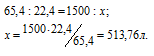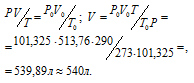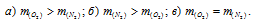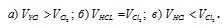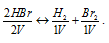Газовая смесь содержит равные массы кислорода и азота чему равно объемное соотношение
Задачи на нахождение парциального давления газов и общего давления смеси
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь). Отсюда Исходя из того, что объём кислорода до смешения был в три раза больше, чем после смешения, рассчитаем давление кислорода до смешения:
Ответ: Робщ. = 100,8кПа.
Задача 42.
Газовая смесь приготовлена из 2л Н2 (Р = 93,3 кПа) и 5л CH4 (Р = 112 кПа). Объем смеси равен 7л. Найти парциальные давления газов и общее давление смеси.
Решение:
По условию задачи объём водорода увеличился в 3,5 раза (7/2 = 3,5), а объём метана – в 1,4 раза (7/5 = 1,4). Во столько же раз уменьшились парциальные давления газов.
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь).
Ответ:
Задача 43.
Газовая смесь состоит из NO и СО2. Вычислить объемное содержание газов в смеси (в %), если их парциальные давления равны соответственно 36,3 и 70,4 кПа (272 и 528мм. рт. ст.).
Решение:
Согласно закону Дальтона парциальное давление данного газа прямо пропорционально его мольной доли на общее давление смеси газов:
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь).
Ответ: 34,02%NO; 65,98%CO.
Задача 44.
В закрытом сосуде вместимостью 0,6м 3 находится при 0 °С смесь, состоящая из 0,2кг СО2, 0,4кг 02 и 0,15кг СН4. Вычислить: а) общее давление смеси; б) парциальное давление каждого из газов; в) процентный состав смеси по объему.
Решение:
Вычислим общее количество газов в смеси по уравнению:
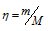

а) Общее давление смеси газов определяем по уравнению:
Отношение парциальных (приведённых) объёмов отдельных газов к общему объёму смеси называется объёмной долей и определяется по формуле:
Ответ:
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь).
Ответ:
Задача 46.
В газометре над водой находятся 7,4л кислорода при 23 °С и давлении 104,1 кПа (781 мм. рт. ст.). Давление насыщенного водяного пара при 23 °С равно 2,8 кПа (21мм. рт. ст.). Какой объем займет находящийся в газометре кислород при нормальных условиях?
Решение:
Парциальное давление кислорода равно разности общего давления и парциального давления паров воды:
Обозначив искомый объём через и, используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака, находим:
Ответ: V0 =6,825л.
Решение задач по химии на газовые смеси
Задача 10.
Вычислите среднюю молярную массу воздуха, следующего состава: 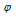
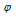
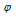
Решение:
Средняя молярная масса газовой смеси вычисляется по соотношению:
В этом соотношении:
М1; М2; М3; Мn — молярные массы газов, составляющих смесь;
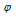
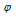
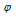
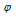
В случае, когда объемные доли газов выражены в долях от единицы, в соотношении делить на 100% не нужно.
Для контроля правильности вычислений необходимо всегда помнить, что средняя молярная масса газовой смеси должна иметь промежуточное значение между молярными массами самого тяжелого и самого легкого газа из данной смеси.
Рассчитаем среднюю молярную массу воздуха, получим:
Получилось промежуточное значение между молярными массами самого легкого газа в смеси (N2) и самого тяжелого (СО2).
Ответ: Мсредн. возд. = 29 г/моль.
Ответ: Мсредн. = 3,76 г/моль.
Подставим все известные величины:
Получили одно уравнение с одним неизвестным. При его решении получаем 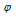
О т в е т : 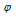
Относительная плотность газовой смеси показывает, во сколько раз масса некоторого объема данной газовой смеси отличается от массы такого же объема (при тех же условиях) какого-либо газа. При определении относительной плотности газовой смеси используют понятие средней молярной массы.
Например, относительная плотность газовой смеси азота, гелия и метана по водороду равна 9. Это значит, что любой объем данной газовой смеси (при тех же условиях) в 9 раз тяжелее такого же объема водорода.
Комментарии:
1 Для газов, находящихся при одинаковых условиях, эти две величины численно совпадают (по закону Авогадро).
Газовая смесь содержит равные массы кислорода и азота чему равно объемное соотношение
Репетитор по химии и биологии
100 баллов ЕГЭ по химии!
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
РГМУ по химии 2010
РНИМУ им. Н.И. Пирогова
выпускница репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускник репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускница репетитора В. Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ им. А.И. Евдокимова
выпускница репетитора В.Богуновой
РНИМУ им. Н.И. Пирогова
выпускник репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ им. А.И. Евдокимова
выпускница репетитора В. Богуновой
РНИМУ им. Н.И. Пирогова
выпускник репетитора В.Богуновой
МГМСУ им. А.И. Евдокимова
выпускник репетитора В.Богуновой
Секретная шпаргалка по химии
4.2 Состав смеси газов
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
И.Ю. Белавин, 2005, задача 229
Два из трех газов (сероводород, водород и кислород) смешали и получили газовую смесь, плотность которой оказалась равной плотности оставшегося газа. Полученную газовую смесь вместе с равным ей объемом третьего газа под давлением поместили в замкнутый сосуд емкостью 4 л, содержавший азот при н.у. и нагревали при 600 С до окончания химических реакций, затем постепенно охладили. Определите массы веществ, содержавшихся в сосуде после охлаждения, если плотность газовой смеси в сосуде перед нагреванием равнялась 9,25г/л. (Ответ: m(S) = 7,5 г, m(SO2) = 15 г, m(Н2О) = 9 г)
Ну как, решили? Нет?! А ваши репетиторы?! Извините, это был риторический вопрос. Кстати, мои ученики, абитуриенты 2003-2008 гг. такие задачи щелкали, как семечки, на экзаменах во 2-й медицинский (теперь РНИМУ им. Н.И. Пирогова). Надеюсь, вам понятно, что 34-м задачам ЕГЭ еще есть куда усложняться, perfectio interminatus est (нет предела совершенству), с газами нужно работать, работать и работать. Поэтому команду «Газы!» отменять рано. Итак, поехали!
Сегодня мы поговорим о газовых смесях, затронем понятие плотности газа (абсолютной и относительной), средней молярной массы, решим задачи: определение средней молярной массы и плотности газа по компонентам смеси и наоборот.
Обязательно посетите страницу моего сайта «Изучаем Х-ОбХ-04. Закон Авогадро. Следствия из закона Авогадро. Нормальные условия. Молярный объем газа. Абсолютная и относительная плотность газа. Закон объемных отношений » и сделайте конспекты по теории. Затем возьмите бумагу и ручку и решайте задачи вместе со мной. Чует мое сердце, что ЕГЭ по химии устроит нам газовую атаку, а противогазы не выдаст!
Определить плотность по азоту газовой смеси, состоящей из 30% кислорода, 20% азота и 50% углекислого газа.
Вычислите плотность по водороду газовой смеси, содержащей 0,4 моль СО2, 0,2 моль азота и 1,4 моль кислорода.
5 л смеси азота и водорода имеют относительную плотность по водороду 12. Определить объем каждого газа в смеси.
Плотность по водороду пропан-бутановой смеси равна 23,5. Определите объемные доли пропана и бутана
Газообразный алкан объемом 8 л (н.у.) имеет массу 14,28 г. Чему равна его плотность по воздуху
Плотность паров альдегида по метану равна 2,75. Определите альдегид
И.Ю. Белавин, 2005, задача 202
Сосуд емкостью 5,6 л при н.у. заполнили метаном, затем нагрели до высокой температуры, в результате чего про-изошло частичное разложение метана. Определите массу образовавшейся сажи, если известно, что после приведения к нормальным условиям объем полученной газовой смеси оказался в 1,6 раза больше объема исходного метана, эта газовая смесь обесцвечивает бромную воду и имеет плотность по воздуху 0,2931. (Ответ: m(C) = 0,6 г)
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами.
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
Подписывайтесь на видео-канал Репетитор по химии и биологии. Ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения заданий ЕГЭ.
Решение задач на газовые смеси | Закон Авогадро
Задача 71.
При прохождении смеси равных объемов SO2 и О2 через контактный аппарат 90% молекул SO2 превращается в SO3. Определить состав (в процентах по объему) газовой смеси, выходящей из контактного аппарата.
Решение:
Уравнение реакции горения сернистого газа имеет вид:
Из уравнения реакции вытекает, что из двух молекул SO2 и одной молекулы O2 образуются две молекулы SO3. Известно, что из каждого литра SO2 превратилось в SO3 0,9л, при этом образовалось тоже 0,9л SO3. Кислорода на каждый литр прореагировало соответственно 0,45л О2 (0,9/2 = 0,45).
Таким образом, выходящая смесь газов из контактного аппарата, на каждый литр смеси состояла из 0,1л SO2 (1 – 0,9 = 0,1) и 0,55л О2 (1 – 0,45 = 0,55). Общий объём смеси, выходящей из контактного аппарата, составляет 1,55л (0,1 + 0,55 + 0,9 = 1,55).
Задача 72.
Смесь, состоящая из трех объемов Сl2 и одного объема H2, оставлена в закрытом сосуде на рассеянном свету при постоянной температуре. Через некоторое время содержание Сl2 в смеси уменьшилось на 20%. Изменилось ли давление в сосуде? Каков процентный состав смеси по объему?
Решение:
Уравнение реакции взаимодействия хлора с водородом имеет вид:
При взаимодействии одного моля хлора с одним моль водорода образуется два объёма хлороводорода, т. е. реакция идёт без изменения объёма. При нормальных условиях из трёх литров хлора в реакцию вступило 0,6л (3 . 0,2 = 0,6). Точно такое же количество водорода тоже вступило в реакцию. Таким образом, при взаимодействии 0,6л хлора и 0,6л водорода образовалось 1,2л хлороводорода (2 . 3 = 0,6). Так как реакция идёт без изменения объёма, то давление в системе тоже не изменится.
Находим процентный состав газовой смеси по формуле:
Ответ: не изменилось;

Задача 73.
При взаимодействии NН3 с Сl2 образуются хлороводород и азот. В каких объемных соотношениях взаимодействуют NH3 и С12 и каково отношение объемов получающихся газов?
Решение:
Уравнение реакции взаимодействия аммиака с хлором имеет вид:
При взаимодействии аммиака с хлором из каждых двух объёмов аммиака и трёх объёмов хлора образуются шесть объёмов хлороводорода и один объём азота. Таким образом, аммиак и хлор взаимодействуют в объёмных отношениях 2 : 3 (2VNH3 : 3VCl), а отношение объёмов получающихся газов – 1 : 6 V(N2 : V(HCl).
Ответ: V(NH3) : V(Cl2) = 2 : 3; V(HCl) : V(N2) = 6 : 1.
Задача 74. Какой объем Н2 (при 17 °С и давлении 102,4кПа) выделится при растворении 1,5кг цинка в соляной кислоте?
Решение:
Уравнение реакции имеет вид:
Зная мольную массу цинка (65,4г/моль) и мольный объём газа (22,4л), находим объём водорода, который выделится при растворении 1,5кг цинка из пропорции:
Затем приводим полученный объём к указанным условиям используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака, находим V0:
Ответ: 540л.
Задача 75.
После взрыва смеси, состоящей из одного объема исследуемого газа и одного объема Н2, получился один объем водяного пара и один объем азота. Все измерения производились при одинаковых условиях. Найти формулу исследуемого газа.
Решение:
Молекулярная формула воды H2O, а азота – N2. Так как продукты реакции и исходные вещества состоят из одинаковых объёмов, то, учитывая, что образуются по одной молекуле воды и азота из одной молекулы водорода и одной молекулы исследуемого газа, можно предположить, что молекула исследуемого газа состоит из двух атомов азота и одного атома кислорода. Следовательно, формула исследуемого газа имеет вид N2O.
Ответ: N2O.
Задача 76
При одинаковых условиях взяты равные объемы N2 и O2. Каково соотношение масс обоих газов:
Решение:
Согласно закону Авогадро, в равных объёмах любых газов, взятых при одинаковых условиях (одной и той же температуре и одинаковом давлении) содержится одинаковое число молекул (6,02 . 10 23 ). Поскольку M(O2) равен 32 г/моль, а M(N2) – 28г/моль, то m(O2) > m(N2)
Ответ: а).
Задача 77.
Смешали равные объемы Н2 и С12. Как изменится объем смеси после протекания реакции: а) не изменится;
б) увеличится в два раза; в) уменьшится в два раза?
Решение:
Уравнение реакции взаимодействия хлора с водородом имеет вид:
При взаимодействии одного моля хлора с одним моль водорода образуется два объёма хлороводорода, т.е. реакция идёт без изменения объёма. Поэтому объём смеси после протекания реакции не изменится.
Ответ: а).
Задача 78.
Каково соотношение объемов, занимаемых 1 моль НСI и 1 моль Сl2 (Т и Р одинаковы):
Решение:
Согласно закону Авогадро одно и тоже число молекул любого газа занимает при одинаковых условиях (температура и давление одинаковы) один и тот же объём. Вместе с тем 1 моль любого газа содержит одинаковое число молекул. Следовательно, при одинаковых условиях 1 моль любого газа занимает один и тот же объём. Этот объём называется мольным объёмом газа и при нормальных условиях (Т = 0 °С и Р = 101,325 кПа) равен 22,4л. Поэтому соотношение объёмов одного моля HCl и одного моля Cl2 (T и Р одинаковы):
Ответ: б).
Задача 79.
При нагревании НВг полностью разлагается. При этом объём газа не изменяется. Каковы продукты реакции разложения: а) атомы Н и Вг; б) молекулы Н2 и Вг2 в) молекулы Н2 и атомы Br?
Решение:
Уравнение реакции термического разложения бромоводорода имеет вид:
Таким образом, из двух молекул НВг образуются одна молекула Н2 и одна молекула Вг2, т.е. объём системы после реакции не изменяется. Следовательно, продуктами реакции термического разложения HBr являются газообразные Н2 и Вг2.
Алгоритм решения задач на определение состава газовых смесей
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Определение состава газовых смесей
ЗАДАЧА: Плотность газовой смеси, состоящей из водорода и гелия, по воздуху составляет 0,1. Определите объемную долю этих газов в исходной смеси.
1. Находим среднюю молярную массу смеси газов: М (смеси) = D возд (смеси)×М(возд) = 0,1×29 = 2,9(г/моль) 2. Составляем схему «правила креста» и находим объем газовой смеси:
3.Определяем объемную долю водорода и гелия в смеси:
φ (He)= =0,9/2=0,45 или 45%
Смесь азота и оксида углерода ( IV ) объемом 14л (н.у.) имеет массу 25,5г. Определите объемную, мольную и массовую доли азота в смеси.
1.Находим количество вещества газовой смеси: υ (смеси) = =14/22,4=0,625(моль ) 2.Вычисляем среднюю молярную массу смеси: М (смеси) = = 25,5:0,625= 40,8(г/моль)
(1- x )—объемная доля оксида углерода( IV ) в смеси, φ ( CO 2 )= 1- x по формуле М (смеси) = φ( N 2 ) × М( N 2 ) + φ ( CO 2 ) × М( CO 2 )
40,8= x ×28 + (1- x ) × 44 откуда x =0,2 или x =20% φ( N 2 )=20% φ ( CO 2 )=1-0,2=0,8 или 80%
4. Определяем мольную долю азота в смеси. По закону Авогадро объемная доля газа в смеси равна его мольной доле, поэтому φ( N 2 )= χ( N 2 )=0,2 или 20%
5. Вычисляем массовую долю азота в смеси, на основе формулы χ( N 2 )= υ( N 2 )/ υ (смеси) находим количество вещества азота
υ( N 2 ) = χ( N 2 ) × υ (смеси) =0,2×0,625=0,125 (моль), тогда m ( N 2 )= υ( N 2 ) × M ( N 2 )= 0,125×28=3,5(г) ω( N 2 )= = 3,5/25,5=0,137 или 13,7%
Все эти действия можно объединить одной формулой ω( N 2 )= = 0,2 × 0,625 × 28/25,5=0,137
или ω( N 2 )= = 0,2 × 28/40,8 = 0,137 или 13,7%
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-054163
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
В МГПУ сформулировали новые принципы повышения квалификации
Время чтения: 4 минуты
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
ВПР для школьников в 2022 году пройдут весной
Время чтения: 1 минута
Минпросвещения намерено расширить программу ускоренного обучения рабочим профессиям
Время чтения: 2 минуты
Международный конгресс-выставка «Молодые профессионалы» пройдет с 12 по 14 декабря в Москве
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
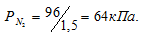
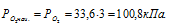
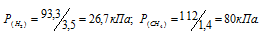
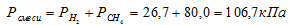
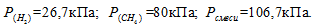
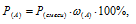
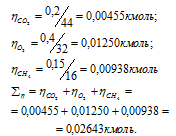
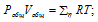
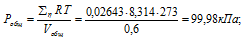
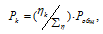
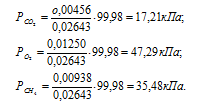
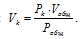
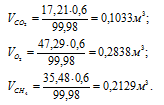
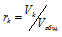
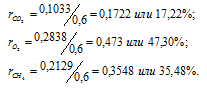
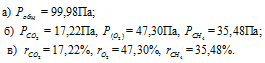
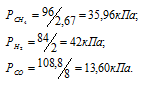
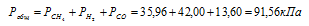
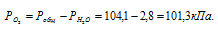
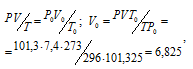
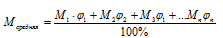
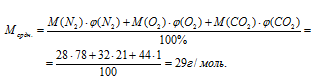
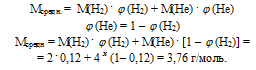
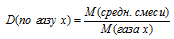





m.jpg)
m.jpg)
m.jpg)

m.jpg)
m.jpg)
m(2).jpg)
_m.jpg)


m.jpg)
_m.jpg)


_01.jpg)
_02.jpg)
_03.jpg)
_04.jpg)
_1.jpg)
_2.jpg)
_3.jpg)
_4.jpg)
_5.jpg)
_6.jpg)