Гематоксилин эозин что это
Особенности внутрикишечной опухолевой инвазии в проксимальном направлении при раке прямой кишки
И.А. Нечай, Г.И. Суханкина
Городская больница № 40
СПбГУ, медицинский факультет, кафедра хирургии
Аннотация. Представлены результаты гистологических исследований распространения «ракового поля» в проксимальном направлении при раке прямой кишки. Необходимость таких исследований обусловлена важностью сохранения дистальных отделов сигмовидной кишки, при выполнении передней резекции прямой кишки, с целью улучшения резервуарной и эвакуаторной функций. В результате определено минимальное расстояние от верхнего края опухоли, которое необходимо отступить при пересечении кишки, не нарушая онкологических принципов оперирования.
Клинические наблюдения о несомненной важности бережного отношения к дистальной части сигмовидной кишки при передних резекциях прямой кишки (ПК), побудили нас изучить распространенность ракового поля в проксимальном направлении от верхнего края раковой опухоли. Знания эти должны лечь в основу рекомендаций, насколько минимально допустимо отступать от верхнего края опухоли при резекции сигмовидной кишки, не нарушая онкологических принципов оперирования. Такая озабоченность связана с тем, что у больных, у которых при резекции ПК для анастомоза использовалась самая дистальная часть низводимой сигмовидной кишки, резервуарно-накопительная и эвакуаторная функции оказывались заметно лучше. Вместе с тем, заботясь об улучшении функциональных результатов операций, мы постоянно имели в виду важность соблюдения онкологических принципов оперирования, поскольку главным при лечении онкологических больных является, конечно, улучшение пятилетней выживаемости.
Распространение ракового процесса внутристеночно от края видимой опухоли ПК в дистальном направлении привлекало внимание ряда авторов. Такие исследования имеют чрезвычайно важное значение при оперативном лечении больных с низкой раковой опухолью ПК. При этой локализации злокачественной опухоли, с позиций функциональных результатов, важен каждый сантиметр сохраненной дистальной части кишки. Использование сшивающих аппаратов при резекции ПК позволяет в техническом плане проводить максимально низкие резекции кишки.
Распространенность инвазии в дистальном направлении при раке прямой кишки.
Распространенность раковой инвазии в дистальном направлении изучалась целенаправленными и тщательными морфологическими исследованиями. R.Willis приводит концепцию «опухолевого поля», в соответствии с которой новообразование развивается мультицентрически с формированием затем единого опухолевого узла. В.Ю.Клур с соавт. проводил серийные гистологические срезы не только в дистальном направлении, но и радиарно. Они установили, что контуры «опухолевого поля» имеют эксцентрическое распространение от основного узла с внутристеночной инвазией, которая в дистальном направлении составляет не менее 3,5-4,0 см при экзофитных опухолях, а при эндофитном росте увеличивается еще на 1,0-1,5 см. Г.И. Воробьев с соавт. исследовал 71 препарат прямой кишки, удаленный при брюшно-промежностной экстирпации. Они установили, что глубина опухолевой инвазии прогрессивно уменьшается в направлении от центра к периферии опухоли. Дистальный внутристеночный рост по подслизистому слою был зарегистрирован лишь в 2,2 % случаев и не превышал 15 мм. Глубина инвазии колоректального рака изучалась также с помощью компьютерного исследования, эндоректоэхографии. В результате была установлена незначительная по протяженности от опухолевого узла внутрикишечная инвазия опухолевого процесса в дистальном направлении. Практически это было претворено в жизнь, и на смену «правила 5 см» пришло «правило 2 см», т. е. достаточно отступить от нижнего края опухоли 2 см с тем, чтобы не нарушить основной онкологический принцип оперирования.
Распространенность опухолевой инвазии в проксимальном направлении в меньшей мере привлекала внимание специалистов. При пересечении кишки выше опухоли не возникает необходимости в строгой экономичности сохранения кишки, примыкающей к опухоли, так как всегда имеется достаточная часть остающегося участка левого фланга ободочной кишки. Вместе с тем наши специальные исследования с анализом длины сигмовидной кишки по дооперационным ирригограммам и размера резецированной части ее после передней резекции ПК показали несомненную важность максимально возможного сохранения для анастомоза дистальной части сигмовидной кишки. К подобному заключению нас подвело изучение функциональных результатов сфинктеросохраняющих резекций ПК. Все это побудило специально изучить распространенность ракового поля в проксимальном направлении от верхнего края видимой опухоли. Результаты таких исследований были нужны для определения минимального расстояния, которое необходимо отступать от верхнего края раковой опухоли при пересечении кишки для соблюдения онкологических принципов оперирования.
После фиксации препарата в проксимальном направлении от видимого верхнего края опухоли последовательно проводились пересечения кишечной стенки с интервалом 5мм (рис. 1).
Результаты исследования. Представляем наблюдение, характеризующее отсутствие опухолевой инвазии по кишечной стенке.
Мужчина 54 года, рак анального канала и ПК, выполнена брюшнопромежностная экстирпация ПК. Гистологическое исследование 31261−31272.
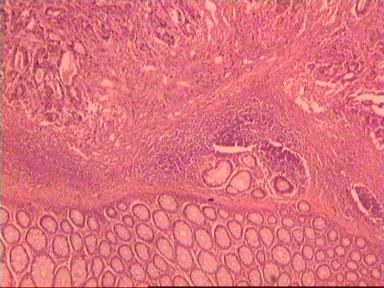
Макропрепарат: блюдцеобразно возвышающееся над поверхностью кишки новообразование диаметром 6 см, прорастает все стенки кишки. От края опухоли в проксимальном направлении макроскопически определяется инфильтрация стенки на протяжении 3,5 см.
Микроскопическое исследование: высокодифференцированная слизеобразующая аденокарцинома ПК, прорастание всей толщи стенки кишки, врастание опухоли в жировую ткань. В опухоли очаги некроза, выраженная мононуклеарная реакция. От проксимального края видимой инвазии уже в 1 мм внутристеночного роста опухоли нет. (Рис. 2). Метастазов аденокарциномы в лимфатических узлах и жировой ткани не выявлено.
Рис. 2. Микропрепарат слизеобразующей аденокарциномы ПК
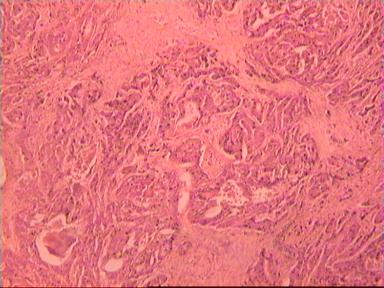
Такие данные были получены и при аденокарциноме, и при плоскоклеточном раке ПК. Приведем наблюдение, свидетельствующее о распространении опухолевого роста по кишке в проксимальном направлении. Мужчина 73 года, рак ПК, выполнена передняя резекция ПК. Гистологическое исследование № 869−870; 871−882. Макропрепарат: опухоль 5 см с кратером, циркулярно охватывающая просвет кишки, прорастание всех слоев кишки и прилежащей жировой ткани, участки абсцедирования.
Микроскопическое исследование: аденокарцинома разной степени дифференцировки. В 5 мм вне видимой опухоли − аденокарцинома в подслизистом, мышечных слоях, в клетчатке, с абсцедированием (рис 3). На срезах через 10 мм от видимого края новообразования опухолевого роста нет.
 |  |
| А | Б |
Рис. 3. Микропрепарат аденокарциномы ПК разной степени дифференцировки
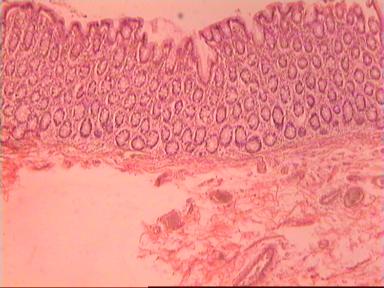
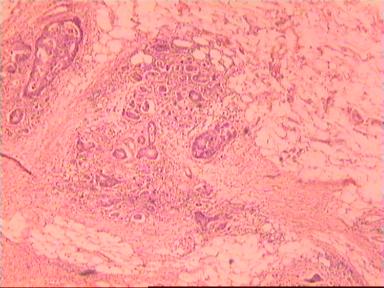
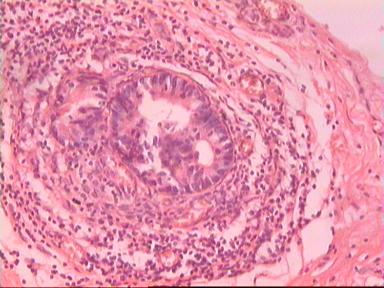
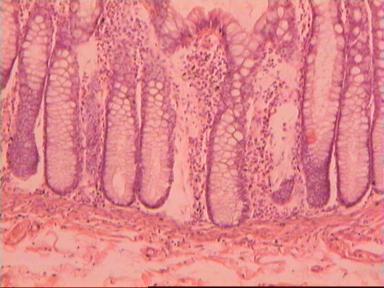
Приведем еще одно наблюдение, свидетельствующее о несомненном распространении опухолевого роста по кишке в проксимальном направлении. Женщина 73 года, рак ПК, выполнена резекция ПК по Гартману. Макропрепарат: экзофитная опухоль 5 х 5 см, прорастание всех слоев кишки, регионарные лимфоузлы не определяются.
 |  |  |
| А | Б | В |
Рис. 4. Микропрепарат аденокарциномы ПК разной степени дифференцировки
Рак прямой кишки. Инвазия опухоли. Обсуждение результатов исследования.
Данные исследования убедительно свидетельствуют, что раковая инвазия в проксимальном направлении от верхнего видимого края раковой опухоли ПК не имеет тенденции к значительному распространению, а в основном ограничена контурами макроскопического «ракового узла» или инвазией по кишечной стенке не более чем на 5мм от него. Лишь в 23,5 % случаев было установлено распространение ракового поля в проксимальном направлении, причем максимально зарегистрированная инвазия была в 20мм от видимого края опухоли ПК.
Вопреки ожиданиям не выявилось повышенной тенденции к внутристеночному росту при низкодифференцированной аденокарциноме, слизистых и плоскоклеточных формах рака ПК. Следовательно, отступление от верхнего края опухоли на 4−5 см в проксимальном направлении с онкологических позиций вполне оправдано и нет необходимости удалять здоровую и функционально полноценную часть кишки. Однако нужно учитывать, что уровень пересечения кишки выше опухоли во многом определяется высотой перевязки основного кровеносного сосуда, которым для этой зоны является нижняя брыжеечная артерия, особенностями кровоснабжения конкретного участка кишки и вовлеченностью в онкопроцесс лимфатического аппарата. Намечая линию пересечения сигмовидной или нисходящей части ободочной кишки, нужно учитывать эти обстоятельства и по возможности бережно, экономно относиться к удалению этого отдела толстой кишки, помня, что инвазия опухоли по стенке кишки незначительна.
Таким образом, внутрикишечная инвазия злокачественного роста в проксимальном направлении от видимого края опухоли ПК наблюдается в 23,5 % случаев и не превышает по протяженности 20 мм. В остальных случаях «раковое поле» ограничивается контурами основного видимого новообразования или распространяется не более чем на 5 мм от него.
Уровень пересечения кишки на 4−5 см выше проксимального края видимой раковой опухоли ПК онкологически оправдан, если учесть распространение «ракового поля» по кишечной стенке. Однако объем операции, конечно, зависит от особенностей кровоснабжения конкретного участка кишки, вовлеченностью в онкопроцесс лимфатических узлов и некоторых других факторов.
Окраска гематоксилином и эозином
Окраска гематоксилином и эозином (окраска гематоксилин-эозином) — один из самых распространённых методов окраски в гистологии. Широко используется в медицинской диагностике, в частности в онкологии для окраски ткани, полученной при биопсии.
Окраска включает использование основного красителя гематоксилина, окрашивающего базофильные клеточные структуры ярко-синим цветом, и спиртового кислого красителя эозина Y, окрашивающего эозинофильные структуры клетки красно-розовым цветом. Базофильные структуры, как правило, это те, которые содержат нуклеиновые кислоты (ДНК и РНК): клеточное ядро, рибосомы и РНК-богатые участки цитоплазмы. Эозинофильные структуры содержат внутри- и внеклеточные белки, например, тельца Леви. Цитоплазма является эозинофильной средой. Эритроциты всегда прокрашиваются ярко-красным цветом.
Техника окраски гематоксилин-эозином
Некоторые структуры плохо прокрашиваются гематоксилином и эозином (как правило гидрофобные) и требуют иных методов окраски. Например, участки клеток, богатые липидами и миелином, остаются неокрашенными: адипоциты, миелиновая оболочка аксонов нейронов, мембрана аппарата Гольджи и др.
См. также
Ссылки
Полезное
Смотреть что такое «Окраска гематоксилином и эозином» в других словарях:
Окраска гематоксилин—эозин — Гистологический образец лёгочной ткани человека, окрашенный гематоксилин эозином. Окраска гематоксилин эозин (окраска гематоксилином и эозином) является одним из самых распространённых методов гистологии. Широко используется в медицинской… … Википедия
Туберкулёз о́рганов дыха́ния — Туберкулез органов дыхания. Органы дыхания при туберкулезе (Туберкулёз органов дыхания) поражаются наиболее часто. В соответствии с принятой в нашей стране клинической классификацией туберкулеза различают следующие формы Т. о. д.: первичный… … Медицинская энциклопедия
Сердце — I Сердце Сердце (лат. соr, греч. cardia) полый фиброзно мышечный орган, который, функционируя как насос, обеспечивает движение крови а системе кровообращения. Анатомия Сердце находится в переднем средостении (Средостение) в Перикарде между… … Медицинская энциклопедия
Лейко́зы — (leucoscs; греч. leukos белый + ōsis; синоним лейкемия) заболевания опухолевой природы, протекающие с вытеснением нормальных ростков кроветворения: опухоль возникает из кроветворных клеток костного мозга. Заболеваемость Л. неодинакова в различных … Медицинская энциклопедия
Пневмония — I Пневмония (pneumonia; греч. pneumon легкое) инфекционное воспаление легочной ткани, поражающее все структуры легких с обязательным вовлечением альвеол. Неинфекционные воспалительные процессы в легочной ткани, возникающие под влиянием вредных… … Медицинская энциклопедия
Туберкулёз внелёгочный — Туберкулез внелегочный условное понятие, объединяющее формы туберкулеза любой локализации, кроме легких и других органов дыхания. В соответствии с клинической классификацией туберкулеза (Туберкулёз), принятой в нашей стране, к Т. в. относят… … Медицинская энциклопедия
Плацента — I Плацента (лат. placenta лепешка; синоним детское место) развивающийся в полости матки во время беременности орган, осуществляющий связь между организмом матери и плодом. В плаценте происходят сложные биологические процессы, обеспечивающие… … Медицинская энциклопедия
Забрюшинное пространство — I Забрюшинное пространство (spatium retroperitoneale; синоним ретроперитонеальное пространство) клетчаточное пространство, расположенное между задней частью париетальной брюшины и внутрибрюшной фасцией; простирается от диафрагмы до малого таза. В … Медицинская энциклопедия
Матка — I Матка Матка (uterus, metra) непарный мышечный полый орган, в котором происходят имплантация и развитие зародыша; расположен в полости малого таза женщины. Органогенез Развитие М. во внутриутробном периоде начинается при длине плода около 65 мм … Медицинская энциклопедия
Мокрота — I Мокрота (sputum) выделяемый при отхаркивании патологически измененный трахеобронхиальный секрет с примесью слюны и секрета слизистой оболочки носа и придаточных (околоносовых) пазух. В норме трахеобронхиальный секрет состоит из слизи,… … Медицинская энциклопедия
Замечания по технике окрашивания
код для вставки на форум:
При окраске водными красителями срезы переносят в краситель из дистиллированной воды, а при окраске спиртовыми — из соответствующего раствора спирта. После того как препарат приобретает интенсивную окраску, его промывают в воде или спирте для удаления избытка красителя (дифференцировка), контролируя этот процесс под микроскопом.
Срезы тканей после целлоидиновой и парафиновой заливки, а также полученные на замораживающем микротоме окрашивают в широкогорлых бюксах или на часовых стеклах. Одновременно окрашивают несколько срезов, промывают, дифференцируют и т.д. каждый срез отдельно.
Препараты можно помещать в красящий раствор в специальных контейнерах, предназначенных для одновременного окрашивания большого количества стекол. Если препаратов немного, то рациональнее краситель наносить непосредственно на срез по каплям с помощью пипетки. Остатки красителя можно слить в склянку и использовать повторно. Д. Кисели (1962) предлагал накрывать при этом срезы стеклянным колпаком, а для увлажнения среды оставлять под колпаком смоченную водой вату.
1. ЯДЕРНЫЕ КРАСИТЕЛИ И ИХ ПРИГОТОВЛЕНИЕ
Окрашивание ядер клеток обусловлено двумя механизмами химического взаимодействия: 1) основные красители, например анилиновые, образуют соли в присутствии ДНК и РНК; 2) образуются комплексы с ионами металлов при применении протравы. В практической работе чаще используют протравные красители. К ним относятся гематоксилин, кармин, сафранин, галлоцианин, ализарин. Хорошо окрашивают ядра такие красители, как янус зеленый, основной коричневый, оксазиновые красители (крезиловый фиолетовый, нильский голубой), тионин, азуры, метиленовый синий, основной фуксин, метиловый зеленый и др. Следует упомянуть о хороших результатах окраски ядер соком черники, которая предложена М.Д. Лавдовским еще в 1887 г.
Гематоксилин и способы его приготовления
Гематоксилин имеет растительное происхождение: его получают из эфирного экстракта кампешевого дерева. Гематоксилин хорошо растворяется в спирте и плохо в воде. Красящими свойствами обладает продукт окисления гематоксилина — гематеин, поэтому краситель становится пригодным только после созревания — окисления, на которое требуется от 10 дней до 2—3 нед. Созревание можно ускорить с помощью солей алюминия, хрома, железа и др.
Гематоксилин Эрлиха
1. Гематоксилин кристаллический 2г
3. Дистиллированная вода 100 мл
5. Алюмокалиевые или алюмоаммонийные квасцы 3г
6. Ледяная уксусная кислота 10 мл
Гематоксилин растворяют в спирте, а квасцы — в дистиллированной воде, смешивают оба раствора и затем добавляют остальные компоненты. Раствор периодически перемешивают. Через 10—14 дней он приобретает темно-вишневый цвет, что свидетельствует о готовности красителя. Продолжительность окрашивания гематоксилином Эрлиха 4—6 мин. Затем следуют промывание в дистиллированной, потом в водопроводной воде, дифференцировка в 1 % солянокислом спирте, восстановление в аммиачной воде и окончательное промывание в дистиллированной воде. Для приготовления солянокислого спирта к 100мл-70% спирта добавляют 1мл концентрированной соляной кислоты. Для приготовления аммиачной воды к 50мл дистиллированной воды добавляют 2 капли крепкого аммиака.
Гематоксилин Делафильда
1. Гематоксилин кристаллический 4гр
3. Алюмокалиевые или алюмоаммониевые квасцы 40гр
4. Дистиллированная вода 400мл
Приготовление: спирт+гематоксилин+квасцы=3-4дня на свету, перемешывая,фильтруют+100мл глицерина+100мл метилового спирта=3-4 дня на свету, фильтруют. Перед применением разбавляют в 2 раза дистиллированной водой или 2% раствором алюмокалиевых квасцов.Окрашывание 4-6 минут, промывание в дистиллированной воде, дифференцировка в солянокислом спирте, восстановление в амиачной воде, промывание в ДВ.В результате хроматин и кариолемма ярко-синие.
Гематоксилин Гарриса
1. Кристалическый гематоксилин 5 гр + спирт 50мл-96%
2. Алюмоамонийные квасцы 100гр+ ДВ 1литр
3. Смешывают + 60мл глицерина + 2,5 оксида ртути. Нагревают до 100С, остужают, фильтруют. Перед использованием до 100мл раствора добавляют 2 мл ледяной уксусной кислоты. Окраска 3-4 минуты, дает чёткие ярко-синие ядра.
Гематоксилин Гарриса в модификации Кисели
1. Кристалическый гематоксилин 1 гр + спирт 10мл-96%
2. Кристалический гематоксилин 20гр + ДВ 200мл
3. Смешивают, доводят до кипения, + 500мг желтого оксида ртути. Остужают, фильтруют, готов к использованию. Окраска 4-6 минут, дает ярко-синие ядра.
Гематоксилин Ганзена
4. Кристалическый гематоксилин 1 гр + спирт 10мл-100%
5. Алюмокалиевые квасцы 20гр+ ДВ 100мл
6. Смешывают + 3мл насыщеного раствора перманганата калия. Нагревают до 100С, остужают, фильтруют. Окраска 3-4 минуты, дает красно-фиолетовые ядра.
Гематоксилин Маллори(водный)
Кристалическый гематоксилин 2,5 гр + алюмоамонийные квасцы 50гр+ ДВ 1литр
Выдержывают 10 суток при 25С, +440мг перманганата калия и 2,5гр тимола, перемешивают,
фильтруют. Синие ядра.
Кислый гемалаун Майера(водный)
1. Кристалический гематоксилин 1 гр
2. Алюмоамонийные квасцы 50гр
4. Йодат натрия 200мг
5. Хлоралгидрат 50гр
6. Лимонная кислота 1 гр
Продолжительность окрашивания 4—6 мин.
Результат: ядра красно-фиолетовые.
Гематоксилин Кораци (водный)
1. Гематоксилин кристаллический 0,1 г
2. Йодат калия 2—3 кристал
3. Алюмокалиевые квасцы 5 г
4. Дистиллированная вода (теплая) 100 мл
Смесь перемешивают до полного растворения и добавляют 25 мл глицерина. Раствор перед использованием фильтруют. Продолжительность окрашивания 1—2 мин. Результат: ядра ярко-синие.
Железный гематоксилин Гейденгайна
1. Гематоксилин кристаллический 1 г
3. Дистиллированная вода 90 мл
Краситель созревает 4 нед. Добавление 100 мг йодата натрия ускоряет «созревание» — он готов к использованию уже через 1 ч после приготовления. Окрашивание проводят разведенным в 2 раза раствором.
Продолжительность окрашивания 1 —36 ч.
1. Препарат помещают в 2,5 % раствор железоаммонийных квасцов на 2—12 ч.
2. Ополаскивают в дистиллированной воде.
3. Окрашивают гематоксилином Гейденгайна 1—36 ч.
4. Промывают в водопроводной воде — 3 смены по 10 мин, затем обезвоживают, просветляют, заключают.
Результат: ядра и цитоплазматические структуры черные и синевато-черные.
Железный гематоксилин Брусси
1. Гематоксилин кристаллический 1 г I
2. Дистиллированная вода при 40 «С 100 мл I
3. Железоаммонийные квасцы 8 г II
4. Дистиллированная вода при 40 «С 100 мл II
Растворы I и II смешивают, фильтруют. Продолжительность окрашивания 30 с—1 мин. Затем промывают в водопроводной воде, обезвоживают, просветляют заключают.
Результат: ядра синевато-черные.
Железный гематоксилин Вейгерта
1. Гематоксилин кристаллический 1 г А
2. Спирт 96 % 100мл А
3. Раствор трихлорида железа гексагидрата 50%-4 мл В
4. Дистиллированная вода 95 мл В
5. Концентрированная соляная кислота 1 мл В
Растворы хранят в отдельных склянках с притертыми пробками. Перед использованием нужное для окрашивания количество краски получают путем смешивания растворов А и Б в пропорции 1:1.
Продолжительность окрашивания 1—2 мин, затем промывают в водопроводной воде.
Результат: ядра черно-синие.
Другие ядерные красители
Кармин
Продолжительность окрашивания 30 мин—24 ч. Затем следует промывание в дистиллированной воде, дифференцировать в солянокислом спирте, обезвоживание, просветление и заключение.
Результат: ядра ярко-красные.
Сафранин
Обеспечивает получение хороших результатов после фиксации ткани в тетраоксиде осмия и особенно после применении фиксаторов, содержащих хром.
Продолжительность окрашивания 24 ч. Затем следуют промывание дистиллированной водой, дифференцировка в солянокислом спирте, дистиллированная вода, обезвоживание, просветление и заключение.
Результат: хроматин ядер и кариолемма ярко-красные.
Галлоцианин
Рекомендуется для окрашивания тканей, залитых в желатин.
Сначала растворяют квасцы, затем добавляют Галлоцианин, раствор кипятят при постоянном помешивании, охлаждают, фильтруют. Срок годности красителя 1 мес.
Продолжительность окрашивания 24—48 ч. Затем следуют промывание в 2 сменах дистиллированной воды, обезвоживание, просветление и заключение.
Результат: хроматин и тигроидное вещество синевато-черные.
Сок черники
Свежие чистые ягоды черники разминают в фарфоровой ступке, смешивают с равным объемом 96 % спирта, настаивают 1— 2 сут и фильтруют. Перед окрашиванием часть раствора разводят равным количеством 2 % водного раствора алюмокалиевых квасцов и добавляют 2—3 кристаллика тимола.
Продолжительность окрашивания 5—7 мин. Затем следуют промывание в дистиллированной воде, дифференцировка в солянокислом спирте, промывание в дистиллированной воде, обезвоживание, просветление и заключение.
Результат: ядра темно-фиолетовые.
2. ЦИТОПЛАЗМАТИЧЕСКИЕ КРАСИТЕЛИ
Окрашивание цитоплазмы клеток происходит в результате связывания оснований и белков кислотными красителями. В группу диффузных (кислых) красителей входят карбоновые и сульфоновые кислоты, нитро-, азокрасители и др. В гистологической практике постоянно применяют эозины, пикриновую кислоту, оранжевый Г, кислый фуксин, конго красный (конгорот), азокармин, эритрозин. Чаще используют 1 % водные растворы этих красителей, но можно применять и 1 % спиртовой раствор.
Продолжительность окрашивания колеблется от 5 с до 3—5 мин в зависимости от сорта и серии красителя. Если препарат перекрашивается, то излишек краски легко удаляется при ополаскивании в дистиллированной воде и последующем обезвоживании препарата или среза в спиртах.
Смесь кислого фуксина и пикриновой кислоты (пикрофуксин) готовят из насыщенного водного раствора пикриновой кислоты и 1 % водного раствора кислого фуксина (см. главу 22).
3. Методика окраски гематоксилином и эозином
Процедура окрашивания срезов, полученных на замораживающем микротоме, после парафиновой или целлоидиновой заливки различается лишь по техническим приемам, а порядок проведения окраски одинаков.
Результат: ядра синие, цитоплазма и межклеточное вещество розовые.
похожие статьи
Классификация медико-криминалистических ситуационных экспертиз / Нагорнов М.Н., Леонова Е.Н., Ломакин Ю.В., Светлаков А.В., Емелин В.В., Кочоян А.Л. // Судебно-медицинская экспертиза. — М., 2019. — №3. — С. 4-8.
Практическое применение источника экспертного света «Светоч-Х» в работе медико-криминалистического отделения / Девятериков А.А., Куличкова Д.В., Шаповалова Е.С. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2019. — №18. — С. 70-73.
Апробация модификации метода цветных отпечатков с использованием тонкого целлофана вместо фотобумаги / Девятериков А.А., Нестеров А.В. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2017. — №16. — С. 18-24.