Гемохроматоз что это такое симптомы
Гемохроматоз
Что такое гемохроматоз?
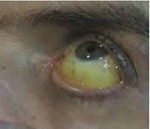
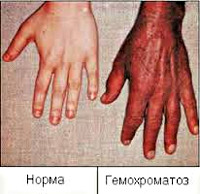
Гемохроматоз — это преимущественно наследственное заболевание с накоплением железа и отложением его в тканях. Болезнь еще называется бронзовым диабетом из-за отложения в коже железосодержащего пигмента гемосидерина.
Также железо накапливается в печени, сердце, поджелудочной железе, селезенке, железах эндокринной системы, что вызывает их постепенное разрушение. Чаще всего гемохроматоз врожденный, но иногда встречается вторичный гемохроматоз — у пациентов с болезнями печени, крови, нарушениями обмена веществ или при передозировке препаратов железа.
Симптомы гемохроматоза
При врожденном гемохроматозе признаки болезни появляются у взрослых людей, когда в организме уже накоплено более 20-40 г железа. Первые симптомы — это сильная утомляемость, ослабление полового влечения, потеря веса. Затем присоединяются:
В развернутой стадии болезни обнаруживают поражение внутренних органов с развитием:
Гемохроматоз может привести к смерти больного из-за развития осложнений: кровотечения из расширенных вен пищевода (при циррозе печени), диабетической комы, острого мозгового нарушения кровообращения, сепсиса, рака печени.
Причины появления гемохроматоза
Наследственное генетическое нарушение обмена железа возникает при мутации гена HFE короткого плеча 6-ой хромосомы. Этот ген отвечает за формирование сигнала о недостатке железа в организме. Если ген поврежден, то возникает ложный сигнал и начинает активно вырабатываться железосвязывающий белок, усиливается всасывание железа из пищи.
При этой болезни за год накапливается от 0,5 до 1 г железа. Вначале оно откладывается в виде белковых ферритиновых комплексов, но затем ферритина уже не хватает и железо (сильный окислитель) начинает разрушать органы. На месте такого разрушения образуется соединительная ткань вместо работающей (фиброз и цирроз).
При приобретенном гемохроматозе возникает избыток железа из-за его передозировки (переливание крови, препараты), нарушения обмена в печени.
Первичный и вторичный гемохроматоз
Первичный гемохроматоз — это самостоятельное врожденное заболевание из-за генетического дефекта. Он бывает 4 видов:
Вторичный гемохроматоз всегда возникает на фоне другой болезни:
Спровоцировать усиленное накопление железа может и низкобелковая диета, бесконтрольное применение железа в препаратах или/и добавках, частые переливания крови, неправильное лечение препаратами железа.
Факторы риска при гемохроматозе
Вероятность развития гемохроматоза выше у людей:
Диагностика
Диагноз гемохроматоза ставят на основании типичной клиники и при обнаружении отклонений в анализах крови:
Для подтверждения наследственного происхождения гемохроматоза проводится молекулярно-генетическая диагностика методом ПЦР в реальном времени. Дополнительно исследуют состояние печени (печеночные пробы, УЗИ, биопсия, МРТ), уровень глюкозы и гликированного гемоглобина, изменения миокарда (ЭКГ, ЭхоКГ).
Лечение гемохроматоза
Основные принципы терапии:
Одновременно проводится лечение пораженных органов. У пациентов с распространенным циррозом печени решается вопрос о пересадке органа.
Перегрузка железом
Общая информация
Краткое описание
НАЦИОНАЛЬНОЕ ГЕМАТОЛОГИЧЕСКОЕ ОБЩЕСТВО
Рекомендации утверждены на IV Конгрессе гематологов России (апрель 2018г)
ПЕРЕГРУЗКА ЖЕЛЕЗОМ: ДИАГНОСТИКА И ЛЕЧЕНИЕ
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Наследственный гемохроматоз (НГ) – полисистемное заболевание, в основе которого лежат генетически обусловленные нарушения метаболизма железа, приводящие к его избыточному накоплению в организме и токсическому повреждению органов и тканей [4,10].
IV тип – генетическую основу составляют мутации гена SLC40A1, кодирующего синтез транспортного белка ферропортина [4,13].
Этиология и патогенез
Эпидемиология
Клиническая картина
Cимптомы, течение
Диагностика
Рекомендуется проводить осмотр, включающий измерение роста и массы тела, оценку состояния кожных покровов и костно-суставной системы; выявление гепатоспленомегалии, признаков дисфункции сердца, легких, печени, органов эндокринной системы.
Лечение
В Российской Федерации в настоящее время зарегистрирован 1 лекарственный препарат – хелатор железа: деферозирокс (Эксиджад). Деферазирокс является пероральным хелатором железа, период полувыведения которого составляет 8-16 часов, что позволяет принимать данный препарат 1 раз в день. Клинические исследования показали, что деферазирокс способен контролировать токсичный пул лабильного железа плазмы и удалять отложения железа из ткани печени и сердца.
Информация
Источники и литература
Информация
Рекомендации обсуждены на заседании Проблемной комиссии по гематологии (март 2018г).
Гемохроматоз
Гемохроматоз характеризуется патологичным накоплением железа, которое избыточно поглощается из пищи и напитков. Избыток железа накапливается в тканях и крупных органах, вызывая их повреждение. Характерным признаком заболевания является изменение цвета кожи, которая приобретает бронзовый оттенок.
Гемохроматоз может быть первичным и вторичным. Как первичное заболевание он возникает в результате генетических изменений, вторично проявляется на фоне другого заболевания.
Избыток железа депонируется в печени, сердце, поджелудочной железе, а также и других органах. Поражение печени является общим и ранним признаком наследственного гемохроматоза. Накопление железа в поджелудочной железе, сопровождается снижением экзо- и эндокринной функций и развитием сахарного диабета. Наследственный гемохроматоз может привести к развитию сахарного диабета, преждевременному старению и раку.
У людей с гемохроматозом повышена абсорбция железа до 30% в кишечнике при нормальном его содержании в пище. При такой скорости всасывания, организм не успевает отработать излишнее железо, поэтому оно накапливается в тканях. Первоначально железо откладывается в клетках печени в форме легко мобилизуемого водорастворимого белка ферритина, содержащего 23% железа, позднее — в форме окруженных однослойной мембраной гранул белка гемосидерина, содержащих 35% железа. Избыточное железо токсично для организма. Оно представляет мощный проксидант, поэтому запускает свободно-радикальные реакции, приводящие к повреждению клеточных структур. Образуется «ржавчина».
Наследственный гемохроматоз: генетические причины
HFE — это ген, который контролирует количество поглощаемого железа. Существует две мутации в гене, ответственные за развитие заболевания: C282Y и H63D. Заболевание передается по аутосомно-рецессивной схеме наследования. Большинство людей с наследственным гемохроматозом унаследовали две копии C282Y, одну от матери и другую от отца. Около 31% людей с двумя копиями C282Y развивают симптомы к 50 годам.
Человек, который наследует только один ген с мутацией C282Y, не обязательно будет страдать синдромом перегрузки железом. Однако, всасывание железа в его организме будет происходить активнее, он будет носителем.
Если оба родителя являются носителями, существует вероятность 25% унаследовать два мутированных гена, по одному от каждого родителя. Только некоторый процент людей с двумя копиями мутации C282Y никогда не испытывают симптомов.
Некоторые люди могут наследовать одну C282Y и одну мутацию H63D. У небольшой части этих людей будут проявлены симптомы гемохроматоза.
Наследование двух копий H63D происходит редко. Наличие двух копий мутации H63D может увеличить риск развития гемохроматоза, но эти данные не подтверждены.
Гемохроматоз. Пигментный цирроз. Бронзовый диабет.
Врачи, лечащие заболевание
У этого заболевания множество названий, но за этой многоликостью прячется опасный враг. Заболевание относительно редкое и требующее исключительного опыта и особого подхода в терапии.
Развитие заболевания связано с избыточным накоплением железа в организме, что проявляется поражением печени, поджелудочной железы, сердца, кожи, суставов, гипофиза.
В развернутой стадии заболевания наблюдаются такие симптомы, как: серые кожные покровы и коричневая пигментация (в области конечностей, лица, шеи и половых органов), сахарный диабет, цирроз печени, хроничечная почечная недостаточность артропатии, импотенция.
Диагноз гемохроматоза устанавливается на основании характерной клинической симптоматики, оценки параметров метаболизма железа (повышение уровней железа и ферритина сыворотки крови; снижение показателей общей железосвязывающей способности сыворотки и трансферрина); результатах генетического тестирования, данных биопсии печени.
Лечение гемохроматоза направлено на удаление из организма избыточного количества железа (с помощью кровопусканий, при применении дефероксамина) и на профилактику возникновения осложнений заболевания.
Выделяют первичный и вторичный гемохроматоз:
В настоящее время известно 5 мутаций, детерминирующих появление этого заболевания.
Типы наследственного гемохроматоза:
Самая распространенная форма наследственного гемохроматоза (более 95% всех случаев) опосредована двумя мутациями в гене HFE, локализованном в 6-й хромосоме (локус 6p21.3): C282Y (замена цистеина в положении 282 на тирозин) и H63D (замена гистидина в положении 63 на аспарагин). Ген детерминирует синтез HFE-белка, который представляет собой гликопротеин (ММ= 37 235 дальтон), сходный по структуре с белками главного комплекса гистосовместимости 1 класса.
Мутации гена HFE приводят к усилению всасывания железа в ЖКТ и его накоплению в тканях организма, что приводит к нарушению функций печени, поджелудочной железы, сердца, гипофиза. Однако клинические проявления заболевания возникают только у половины гомозигот с мутацией C282Y.
Ювенильный гемохроматоз встречается редко. Заболевание манифестирует в возрасте 10-30 лет.
Генетическую основу заболевания составляют мутации гена HJV(локус 7q22), кодирующего синтез рецептора трансферрина-2 (TfR2). Клинические проявления у пациентов с гемохроматозами 2-го и 3-го типов идентичны. Было установлено, что рецептор трансферрина-2 является модулятором продукции гепсидина в ответ на избыток железа в организме. Поэтому у большинства гомозиготных пациентов с мутациями гена, кодирующего синтез рецептора трансферрина-2, уровни гепсидина крайне низкие.
Клиническая симптоматика аутосомно-доминантного гемохроматоза сходна с той, которая наблюдается при гемохроматозе 1-го типа: перегрузка организма железом, сопровождающаяся развитием цирроза печени, сахарного диабета, импотенцией (у мужчин) и аритмиями.
Болезнь быстро прогрессирует, приводя к смертельному исходу вскоре после рождения.
Вторичный гемохроматоз возникает при избыточном поступлении в организм железа (при длительном неконтролируемом лечении препаратами железа, при повторных частых переливаниях крови).
Существует несколько видов вторичного гемохроматоза:
Развивается у людей, которые переносят неоднократные массивные гемотрансфузии по поводу хронических анемий.
К этой группе относятся пациенты с алкогольным циррозом печени, гемохроматозом африканского племени банту. Последний ранее назывался гемосидероз Банту. Его причиной является длительное и избыточное поступление в организм железа с алкогольными напитками, изготавливаемыми в специальных железных сосудах.
Развивается вследствие нарушений метаболизма железа при промежуточной талассемии, у больных циррозом печени после операции портокавального шунтирования, при хронических вирусных гепатитах В и С, при неалкогольном стеатогепатите, при закупорке протока поджелудочной железы, кожной порфирии, при злокачественных новообразованиях.
Возникает при большой талассемии и некоторых видах дизэритропоэтической анемии.
Профилактика
Меры первичной профилактики гемохроматоза не существуют.
Важно как можно раньше установить диагноз, так как лечение гемохроматоза методом кровопусканий позволяет отсрочить или предотвратить появление цирроза печени и увеличить продолжительность жизни пациентов.
С этой целью проводится семейный и популяционный скрининг. В ходе проведения скрининга было установлено, что 78% мужчин (средний возраст 42 года) и 36% женщин (средний возраст 39 лет), являющихся родственниками пациентов с гемохроматозом, являются гомозиготными носителями мутации C282Y и имеют признаки перегрузки железом.
Первичное обследование всех родственников первой степени родства больного гемохроматозом проводится до достижения ими возраста 20 лет путем определения сывороточных показателей метаболизма железа (уровней железа, ферритина, трансферрина, общей железосвязывающей способности сыворотки, коэффициента насыщения ферритина железом).
При наличии лабораторных признаков нарушения метаболизма железа проводится генетическое тестирование с целью выявления мутаций C282Y и H63D.
Если пациент с гемохроматозом или его родственник в возрасте до 40 лет являются гомозиготными носителями мутации C282Y и у них выявлены лабораторные признаки нарушения метаболизма железа, то им рекомендуется проведение кровопусканий.
Если возраст пациента с гемохроматозом или его родственников больше 40 лет, и они являются гомозиготными носителями мутации C282Y, то им производится биопсия печени с целью установления степени ее перегрузки железом.
Биопсия печени проводится также при необходимости подтверждения диагноза и определения стадии заболевания.
Даже при отсутствии в биоптате данных за гемохроматоз родственники пациентов нуждаются в наблюдении с определением железосвязывающей способности сыворотки крови каждые 6-12 месяцев.
При первых признаках заболевания (коэффициент насыщения ферритина железом более 40%), показано проведение кровопусканий.
Симптомы гемохроматоза
Типичные симптомы гемохроматоза проявляются, когда уровень железа в организме достигает критической отметки в 20-40 грамм. Поскольку заболевание развивается очень медленно, то первые тревожные звоночки могут появиться, как правило, к 40-60 годам. На начальных этапах у больных наблюдаются:
Симптомами прогрессирующего гемохроматоза являются:
У женщин в этот период может наблюдаться задержка овуляции или полное прекращение месячных. В запущенных случаях – бесплодие. У мужчин отмечается аномальное увеличение молочных желез, атрофия яичек, а впоследствии – импотенция.
Диагностика гемохроматоза
Диагностика гемохроматоза осуществляется преимущественно лабораторными методами. Основными критериями для подтверждения данного диагноза являются определение уровня железа и железосодержащих белков в плазме крови, а также скорость выведения этого металла с мочой.
Очень часто также применяется биопсия печени и кожи с целью обнаружения специфического пигмента гемосидерина, выделяющегося при распаде гемоглобина.
В отдельных случаях, когда имеет место поражение внутренних органов, врач может назначить ультразвуковое исследование органов брюшной полости, ЭКГ, ЭхоКГ, МРТ печени, рентгенографию суставов и др.
Лечение гемохроматоза
Лечение гемохроматоза – процесс длительный и сложный, осуществляемый в течение всей жизни больного. О полном выздоровлении в данном случае речь не идет, однако при современном уровне развития медицинской науки течение болезни можно существенно замедлить и тем самым облегчить состояние пациента.
При этом заболевании на стадии манифестации с системным накоплением железа (почки, печень, поджелудочная железа, сердце, суставы и другие органы) продолжительность жизни может составлять 4-5 лет. Если же гемохроматоз вовремя диагностировать и помешать его развитию, то течение заболевания в большинстве случаев доброкачественное и может протекать в стадии компенсации десятки лет.
Поначалу у больного сливают по 0,5 литров крови еженедельно, при этом осуществляя контроль за его состоянием. Как только у пациента возникают первые признаки анемии, процедуру выполняют реже, а при необходимости делают перерыв на 3 месяца. Заканчивается курс кровопускания, когда результаты биопсии печени показывают оптимальное содержание железа в тканях этого органа.
Поскольку гемохроматоз является генетически обусловленным заболеванием, стопроцентной защиты от него не существует в принципе. Единственный способ обезопасить себя от его разрушительного влияния – регулярно проходить медицинское обследование и сдавать соответствующие анализы. Особенно это касается тех, у кого есть ближайшие родственники с подобным синдромом.
Гемохроматоз – наследственное полисистемное заболевание, сопровождающееся активным всасыванием железа в ЖКТ и его последующей аккумуляцией во внутренних органах (сердце, поджелудочной железе, печени, суставах, гипофизе). Клиника гемохроматоза характеризуется бронзовой пигментацией кожи и слизистых оболочек, развитием цирроза печени, сахарного диабета, кардиомиопатии, артралгий, нарушения половой функции и т. д. Диагноз гемохроматоза подтверждается при определении повышенной экскреции железа с мочой, высокого содержания железа в сыворотке крови и биоптатах печени, а также с помощью рентгенографии, УЗИ, МРТ внутренних органов. Лечение пациентов с гемохроматозом основано на соблюдении диеты, введении дефероксамина, проведении кровопусканий, плазмафереза, гемосорбции, симптоматической терапии. При необходимости решается вопрос о трансплантации печени и артропластике.
Общие сведения
В этиологическом аспекте выделяют первичный (наследственный) и вторичный гемохроматоз. Первичный гемохроматоз связан с дефектом ферментных систем, приводящим к отложению железа во внутренних органах. В зависимости от генного дефекта и клинической картины выделяют 4 формы наследственного гемохроматоза:
Вторичный гемохроматоз (генерализованный гемосидероз) развивается в результате приобретенной недостаточности ферментных систем, участвующих в обмене железа, и часто ассоциирован с другими заболеваниями, в связи с чем выделяют следующие его варианты: посттрансфузионный, алиментарный, метаболический, смешанный и неонатальный.
Причины гемохроматоза
Первичный наследственный гемохроматоз является заболеванием с аутосомно-рецессивным типом передачи. В его основе лежат мутации гена HFE, расположенного на коротком плече 6-ой хромосомы. Дефект HFE-гена приводит к нарушению трансферрин-опосредованного захвата железа клетками 12-перстной кишки, следствием чего является формирование ложного сигнала о дефиците железа в организме. В свою очередь, это способствует повышенному синтезу железосвязывающего белка DCT-1 энтероцитами и усиленной абсорбции железа в кишечнике (при нормальном поступлении микроэлемента с пищей). В дальнейшем происходит чрезмерное отложение железосодержащего пигмента гемосидерина во многих внутренних органах, гибель их функционально активных элементов с развитием склеротических процессов. При гемохроматозе ежегодно в организме человека накапливается 0,5-1,0 г железа, а проявления заболевания манифестируют при достижении общего уровня железа 20 г (иногда 40-50 г и больше).
Вторичный гемохроматоз развивается в результате избыточного экзогенного поступления железа в организм. Такое состояние может возникать при частых повторных гемотрансфузиях, неконтролируемом приеме препаратов железа, талассемии, некоторых видах анемии, кожной порфирии, алкогольном циррозе печени, хронических вирусных гепатитах В и С, злокачественных новообразованиях, следовании низкобелковой диете.
Симптомы гемохроматоза
Клиническая манифестация наследственного гемохроматоза приходится на зрелый возраст, когда содержание общего железа в организме достигает критических значений (20-40 г). В зависимости от преобладающих синдромов различают гепатопатическую (гемохроматоз печени), кардиопатическую (гемохроматоз сердца), эндокринологическую формы заболевания.
Заболевание развивается постепенно; в начальной стадии преобладают неспецифичные жалобы на повышенную утомляемость, слабость, похудание, снижение либидо. В этой стадии больных могут беспокоить боли в правом подреберье, сухость кожи, артралгии, обусловленные хондрокальцинозом крупных суставов. В развернутой стадии гемохроматоза формируется классический симптомокомплекс, представленный пигментацией кожи (бронзовая кожа), циррозом печени, сахарным диабетом, кардиомиопатией, гипогонадизмом.
Обычно наиболее ранним признаком гемохроматоза выступает появление специфической окраски кожи и слизистых оболочек, выраженной, главным образом, на лице, шее, верхних конечностях, в области подмышек и наружных гениталий, рубцов кожи. Интенсивность пигментации зависит от давности течения заболевания и варьирует от бледно-серого (дымчатого) до бронзово-коричневого цвета. Характерно выпадение волос на голове и туловище, вогнутая (ложкообразная) деформация ногтей. Отмечаются артропатии пястно-фаланговых, иногда коленных, тазобедренных и локтевых суставов с последующим развитием их тугоподвижности.
Практически у всех больных выявляется увеличение печени, спленомегалия, цирроз печени. Нарушение функции поджелудочной железы выражается в развитии инсулинзависимого сахарного диабета. В результате поражения гипофиза при гемохроматозе страдает половая функция: у мужчин развивается атрофия яичек, импотенция, гинекомастия; у женщин – аменорея и бесплодие. Гемохроматоз сердца характеризуется кардиомиопатией и ее осложнениями – аритмией, хронической сердечной недостаточностью, инфарктом миокарда.
В терминальной стадии гемохроматоза развивается портальная гипертензия, асцит, кахексия. Гибель пациентов, как правило, наступает вследствие кровотечения из варикозно расширенных вен пищевода, печеночной недостаточности, острой сердечной недостаточности, диабетической комы, асептического перитонита, сепсиса. Гемохроматоз значительно увеличивает риск развития рака печени (гепатоцеллюлярной карциномы).
Диагностика гемохроматоза
В зависимости от преобладающих симптомов пациенты с гемохроматозом могут обращаться за помощью к различным специалистам: гастроэнтерологу, кардиологу, эндокринологу, гинекологу, урологу, ревматологу, дерматологу. Между тем, диагностика заболевания едина при различных клинических вариантах гемохроматоза. После оценки клинических признаков больным назначается комплекс лабораторно-инструментальных исследований, позволяющих убедиться в правомерности диагноза.
Лабораторными критериями гемохроматоза служат значительное повышение уровня железа, ферритина и трансферрина в сыворотке крови, увеличение выведения железа с мочой, снижение общей железосвязывающей способности сыворотки крови. Диагноз подтверждается с помощью пункционной биопсии печени или кожи, в образцах которых обнаруживается отложение гемосидерина. Наследственная природа гемохроматоза устанавливается в результате проведения молекулярно-генетической диагностики.
С целью оценки тяжести поражения внутренних органов и прогноза заболевания исследуются печеночные пробы, уровень глюкозы крови и мочи, гликозилированный гемоглобин и др. Лабораторная диагностика гемохроматоза дополняется инструментальными исследованиями: рентгенографией суставов, ЭКГ, ЭхоКГ, УЗИ органов брюшной полости, МРТ печени и др.
Лечение гемохроматоза
Основной целью проводимой терапии служит удаление избытка железа из организма и недопущение развития осложнений. Больным с гемохроматозом назначается диета, предусматривающая ограничение пищевых продуктов с высоким содержанием железа (яблок, мяса, печени, гречневой крупы, шпината и пр.), легкоусвояемых углеводов. Запрещается прием мультивитаминов, аскорбиновой кислоты, БАДов, содержащих железо, алкоголя. Для выведения избытков железа из организма прибегают к кровопусканиям под контролем показателей гемоглобина, гематокрита крови, ферритина. С этой же целью могут использоваться экстракорпоральные методы гемокоррекции – плазмаферез, гемосорбция, цитаферез.
Патогенетическая медикаментозная терапия гемохроматоза основана на внутримышечном или внутривенном введении пациенту дефероксамина, связывающего ионы Fe3+. Одновременно проводится симптоматическое лечение цирроза печени, сердечной недостаточности, сахарного диабета, гипогонадизма. При выраженной артропатии определяются показания к проведению артропластики (эндопротезирования пораженных суставов). У пациентов с циррозом решается вопрос о проведении трансплантации печени.
Прогноз и профилактика
Несмотря на прогрессирующее течение заболевания, своевременная терапия позволяет продлить жизнь пациентов с гемохроматозом на несколько десятилетий. При отсутствии лечения средняя продолжительность жизни больных после диагностики патологии не превышает 4-5 лет. Наличие осложнений гемохроматоза (главным образом, цирроза печени и застойной сердечной недостаточности) является прогностически неблагоприятным признаком.
При наследственном гемохроматозе профилактика сводится к проведению семейного скрининга, раннему выявлению и началу лечения заболевания. Избежать развития вторичного гемохроматоза позволяет рациональное питание, контроль за назначением и приемом препаратов железа, проведением переливаний крови, отказ от приема алкоголя, наблюдение за больными с заболеваниями печени и системы крови.