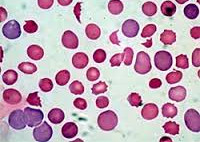
Гемолиз что это простыми словами в медицине
Что такое гемолиз крови
Сегодня мы разберем такое понятие, как гемолиз крови, изучим главные причины его развития, полностью рассмотрим симптоматику, способы медикаментозного лечения. Итак, гемолиз это явление в человеческом организме, обусловленное уничтожением эритроцитов из-за разрешения мембраны, ввиду чего гемоглобин и иные компоненты попадают во внешнюю среду. Мембрана клетки распадается под действием особого вещества, называемого гемолизином, а также под воздействием ядов и токсинов, о которых мы расскажем позже. Не стоит забывать, что такое явление, как гемолиз, постоянно происходит практически в любом живом организме, ведь жизнь эритроцитов имеет свой срок, обычно не превышающий 120-125 дней. Однако при некоторых заболеваниях клетки крови разрушаются быстрее, что, в свою очередь, ведет к различным патологиям крови. Теперь рассмотрим подробнее, что такое гемолиз крови, какие его виды существуют?
Типы гемолиза
Как говорилось выше, эритроцит имеет свой жизненный цикл, которых обычно доходит до 125 дней, после его мембрана разрушается, и клетка погибает. Весь указанный процесс происходит в селезенке человека под воздействием иммунной системы. В зависимости от того, где происходит гемолиз, его подразделяют на несколько типов.
Большинство специалистов в области изучения болезней крови делят гемолиз эритроцитов на следующие подвиды:
Причины
Если диагностируется гемолиз то причины этого могут быть совершенно разные, к основным обычно относят:
Перечисленные выше факторы провоцируют приобретенные гемолитические анемии, при врожденных заболеваниях жизненный цикл красных кровяных телец значительно короче. Чаще всего это происходит ввиду врожденной хрупкости мембраны эритроцита, либо иммунная система человека воспринимает «свои» же клетки крови, как враждебные, и стремится их уничтожить.
Биологический гемолиз происходит в селезенке или печени, причем наблюдается увеличение данных органов и снижение синтеза эритроцитов.
Неотложной помощи требует стадия острого гемолиза, основными причинами указанного процесса служат:
Симптоматика
В зависимости от тяжести заболевания симптомы гемолиза могут различаться, например, при легкой форме пациентов беспокоит слабость, иногда наблюдается озноб, чувство тошноты, нередко отмечается желтушность глазных яблок.
В случае обширного гемолиза, после 8-9 часов от начала развития больных беспокоит:
Стоит отметить, что гемолиз эритроцитов наблюдают не только в организме человека, например, в лабораторных условиях при исследовании анализа крови человека.
В случае распада клеток крови в ходе лабораторных анализ, результаты исследования могут быть недостоверными.
К основным причинам, по которым произошло быстро свертывание крови, относят:
К сожалению, вышеперечисленные причины ведут к повторному забору крови и проведению исследование, что нежелательно, особенно для маленьких детей, поэтому медицинский персонал должен строго следовать инструкциям при проведении процедуры.
Лечение
Стоит отметить, что развитие гемолиза — это крайне опасное состояние, особенно в острой стадии, в данном случае требуется скорейшая медицинская помощь. При остром гемолизе специалисты, во-первых, должны предотвратить наступление гемолитического криза, все мероприятия проводятся исключительно в условиях стационара.
При резком снижении уровня гемоглобина единственным эффективным способом лечения будет переливание эритроцитной массы, в случае наступления криза рекомендован прием анаболических стероидов.
При развитии острой стадии аутоиммунного гемолиза пациенту назначается курс глюкокортикостероидов, например, Преднизолона. В случае отсутствия ремиссии при приеме вышеуказанных средств, то больному назначают операцию по удалению селезенки. Некоторые формы гемолиза предполагают прием не только глюкокортикостероидных препаратов, но и медикаментов иммунодепрессивного характера.
В случае наступление стадии глубокого гемолиза производится процедура переливания эритроцитарной массы, но только после проведения пробы Кумбса.
Также в данной стадии назначают внутривенно Реоглюман, чтобы устранить гемодинамические нарушения.
Если у пациента диагностировано увеличение креатинина и мочевины, ему назначают курс процедур гемодиализа. Для профилактики развития почечной недостаточности показан прием Бикарбоната натрия.
Для лечения острого гемолиза у детей осуществляется единичная процедура замены резус-негативной крови. Переливание крови производят в совокупности с назначением глюкокортикостероидных препаратов. Также показано кормящей матери отказаться от естественного вскармливания младенца.
Еще раз напомним, что острая стадия гемолиза требует незамедлительной медицинской помощи, в случае врожденного заболевания пациенты должны постоянно наблюдаться у врача.
Аутоиммунная гемолитическая анемия у взрослых
Общая информация
Краткое описание
НАЦИОНАЛЬНОЕ ГЕМАТОЛОГИЧЕСКОЕ ОБЩЕСТВО
Рекомендации утверждены на IV Конгрессе гематологов России (апрель 2018г)
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ДИАГНОСТИКЕ И ЛЕЧЕНИЮ АУТОИММУННОЙ ГЕМОЛИТИЧЕСКОЙ АНЕМИИ (АИГА) У ВЗРОСЛЫХ
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
АИГА разделяют на первичные (идиопатические) и более распространенные вторичные, встречающиеся при других заболеваниях. Вторичные АИГА чаще всего сопряжены с лимфоцитарными опухолями, системной красной волчанкой (СКВ), ревматоидным артритом, а также с неспецифическим язвенным колитом, врожденными иммунодефицитами, раком толстой кишки, легких, желудка и яичников, некоторыми инфекциями. В одних случаях АИГА обнаруживают в ходе длительно текущей болезни, а в других гемолиз предшествует проявлению указанных заболеваний, нередко затрудняя своевременную диагностику.
По механизму разрушения эритроцитов выделяют внутриклеточный, внутрисосудистый и смешанный варианты гемолиза.
Cерологические свойства аутоантител легли в основу деления АИГА на четыре формы: 1) с неполными тепловыми агглютининами (80% всех больных); 2) с полными холодовыми агглютининами (12—15% всех случаев); 3) с тепловыми гемолизинами; 4) с двухфазными холодовыми гемолизинами Доната—Ландштейнера (крайне редкая и, как правило, вторичная форма при сифилисе и вирусных инфекциях). Тип антител во многом определяет клинические проявления гемолиза, выбор лечения и прогноз.
Этиология и патогенез
Причина развития АИГА — срыв иммунологической толерантности к собственным антигенам. Механизм этого процесса до сих пор не изучен. Поскольку АИГА — редкое заболевание, не исключено, что готовность к подобным нарушениям в какой-то мере обусловлена теми или иными генетическими дефектами T-лимфоцитов. Показано, что при АИГА, как и при многих других аутоагрессивных заболеваниях, имеет место подавление супрессорной функции T-лимфоцитов, что способствует увеличению популяции B-лимфоцитов, образующих антитела против собственных структур [22]. Срыв толерантности происходит, когда она формируется в присутствии малых количеств антигена. Толерантность, развившаяся после контакта с большим количеством антигена, практически не исчезает. В качестве примера обычно приводят отсутствие аутоагрессии против антигенов системы AB0. Различные формы АИГА могут иметь в своей основе разные ведущие причины. Имеются сведения о выявлении антилимфоцитарных антител и антилимфоцитотоксинов при различных аутоиммунных заболеваниях. При B-клеточных опухолях аутоантитела — продукт опухолевого клона.
Свойства аутоантител определяют особенности различных форм АИГА. Неполные аутоагглютины вызывают агглютинацию эритроцитов только в водно-солевой среде, в то время как действие полных проявляется в любой среде [19, 23]. Неполные тепловые антитела фиксированы на эритроцитах и взаимодействуют через Fc-фрагменты иммуноглобулинов с Fc-рецепторами макрофагов, из-за чего теряется часть мембраны эритроцита, изменяется ее биофизическое состояние и прежде всего — свойства ионных каналов. Это приводит к образованию микросфероцитов и резкому ускорению разрушения (секвестрации) эритроцитов в селезенке, а иногда и в печени [20]. Холодовые агглютинины вызывают транзиторное склеивание эритроцитов на холоде, что приводит к фиксации и активации комплемента на их поверхности с последующим повреждением мембраны. Гемолизины активируют комплемент, повреждающий мембрану внутри сосудистого русла. При этой форме АИГА инфекционный агент может иметь сходство с антигенными структурами эритроцита или на первом этапе несколько видоизменять их, что в дальнейшем приводит к аутосенсибилизации.
В развитии АИГА нередко принимают участие два класса антител: IgG и IgА или IgG и IgM, а также комплемент, что определяет как патофизиологию, так и лечение АИГА. У больных с аутоантителами IgM-класса, фиксирующими комплемент, спленэктомия не приводит к прекращению гемолиза, поскольку в разрушении эритроцитов активно участвуют фагоциты печени [24].
Клиническая картина
Cимптомы, течение
Основные клинические и лабораторные проявления АИГА — нормоцитарная анемия с быстро нарастающей слабостью и плохой адаптацией даже к умеренному снижению уровня гемоглобина, бледность и желтушность кожи и склер. Могут быть темная моча и боли в поясничной области, нередко субфебрильная температура и небольшое увеличение размеров селезенки. Спленомегалия у пациента старше 50—60 лет, как правило, заставляет думать о вторичной АИГА, связанной с лимфопролиферативным заболеванием. При холодовой гемагглютининовой болезни степень анемии колеблется в широком диапазоне, но, как правило, анемия выражена умеренно и сопровождается симптомами, связанными с феноменом склеивания эритроцитов, что затрудняет проведение анализа крови. При длительном охлаждении возможно развитие синдрома Рейно, некрозов и бронхоспазма.
Лабораторное обследование выявляет снижение уровня гемоглобина, от умеренного до 26—36 г/л, и соответствующее уменьшение количества эритроцитов при высоком ретикулоцитозе. Число лейкоцитов и тромбоцитов обычно не изменено, но при интенсивном гемолизе возможны лейкоцитоз с омоложением лейкоцитарной формулы, а также тромбоцитоз или тромбоцитопения. В мазке периферической крови, как правило, — сочетание микросфероцитов с крупными ортохромными эритроцитами, но в зависимости от свойств антител могут наблюдаться холодовая агглютинация и, иногда, шистоциты. Ключевые изменения биохимических показателей крови: гипербилирубинемия (преобладает непрямая, неконъюгированная фракция), повышение активности ЛДГ в сыворотке в 2—8 раз (в зависимости от интенсивности гемолиза).
Прямая проба Кумбса в большинстве случаев положительна, но при массивном гемолизе, а также при холодовых и гемолизиновых формах АИГА, вызванных IgА- или IgM-аутоантителами, может быть отрицательной [24]. При гемолизиновых формах АИГА и тяжелом гемолитическом кризе с активацией комплемента обнаруживают повышение уровня свободного гемоглобина плазмы (гемоглобинемия), темный, бурый или вишневый цвет мочи (гемоглобинурия). При первичном обследовании в стационаре с ограниченными возможностями лабораторной диагностики инкубация в плазме и/или сыворотке больного (при 37C в течение 24—48 ч) как его собственных, так и донорских эритроцитов помогает заподозрить гемолиз (скрининг-тесты Кросби и Хегглина—Майера). В таких случаях с помощью проточной цитометрии необходимо исключить наличие ПНГ-клона среди эритроцитов, нейтрофилов и моноцитов (приобретенный дефект клеточной мембраны, лишающий ее защиты от мембранатакующего комплекса комплемента, — определяется по отсутствию экспрессии рецепторов CD59, CD24, CD14, CD66 и CD16, а также по отсутствию фиксирующего их якорного белка в реакции с флюоресцентным аэролизином [FLAER]). В некоторых случаях АИГА транзиторное снижение экспрессии CD55, реже CD59 на части эритроцитов при отсутствии дефекта мембраны нейтрофилов и моноцитов не является свидетельством появления ПНГ-клона.
Имеет значение «снижение» уровня гаптоглобина сыворотки при всех видах гемолиза. Этот феномен обусловлен тем, что гаптоглобин, уже перенасыщенный гемоглобином из разрушенных эритроцитов, перестает связывать добавленный в пробирку меченый гемоглобин. Изменены биофизические свойства эритроцитов, их деформируемость (пластичность), распределение по плотности. К сожалению, эти простые тесты, информативные для диагностики разных анемий и контроля эффективности лечения, не входят в стандарт клинических лабораторий.
Диагностика
Лечение
Тактика лечения АИГА зависит в первую очередь от ее серологической разновидности и остроты гемолитического криза. При лечении криза первичной и вторичной АИГА принципиальных различий нет. Наибольшие успехи достигнуты в лечении самой распространенной формы АИГА — с положительной прямой пробой Кумбса, вызванной неполными тепловыми агглютининами. Основное содержание данного раздела касается именно этой формы. Сведения о лечении других, более редких, серологических форм АИГА разрозненны и противоречивы (эту информацию мы не стали выделять в отдельный раздел).
На протяжении полувека независимо от формы АИГА первой линией терапии остаются глюкокортикоиды (преднизолон и эквивалентные дозы дексаметазона, триамцинолона, метилпреднизолона). При этом начальная доза преднизолона зависела, как правило, от остроты процесса. Общепринятая начальная доза — 1 мг/кг в сутки (50—80 мг/сут). Увеличение дозы преднизолона до 2 мг/кг/сут (90—160 мг/сут) не улучшает результаты лечения, приводя к быстрому развитию характерных тяжелых осложнений. Первый гемолитический криз, как правило, удается купировать. В течение двух недель прекращается падение гемоглобина, исчезает гипертермия. Через 3—4 недели уровень гемоглобина может достигнуть нормы. Стремление к быстрому уменьшению дозы с момента нормализации гемоглобина из-за побочного действия глюкокортикоидов (кушингоид, стероидные язвы, артериальная гипертония, угревая сыпь с формированием гнойничков на коже, бактериальные инфекции, сахарный диабет, остеопороз, венозные тромбозы) всегда приводит к рецидиву гемолиза. Снижать дозу преднизолона начинают по 5—10 мг за 2—3 дня и продолжают до тех пор, пока суточная доза не достигнет 25—30 мг. Далее отмена препарата проводится значительно медленнее — по 2,5 мг за 5—7 дней. После достижения дозы ниже 10—15 мг должен сохраняться замедленный темп отмены. Такая тактика предполагает прием преднизолона в течение 3—4 месяцев. При меньшей продолжительности поддерживающей терапии рецидив гемолиза практически неизбежен. Стойкой ремиссии достигают только у 7—22% пациентов [2]. При большей длительности лечения число клинических ремиссий может увеличиться, но нарастают и нежелательные явления. Повторные курсы глюкокортикоиды нередко дают меньший эффект, в то время как осложнения превращаются в терапевтическую проблему, конкурирующую с самой АИГА. Основной причиной смерти таких больных является не гемолиз, а тромбозы, тромбоэмболии, бактериальные и грибковые инфекции (пневмония, уросепсис, септический эндокардит). Диагноз рецидивирующей формы АИГА, а точнее резистентности к первой линии терапии, фактически формируется после первого же рецидива гемолиза. При АИГА с холодовыми агглютининами глюкокортикоиды, как правило, малоэффективны, а необъяснимые колебания уровней эритроцитов и гемоглобина, чаще технические, корректируются при 37С (пример: эритроциты — 0,7 1012/л, после согревания кюветы — 2,9 1012/л, что предотвратило необоснованную трансфузию эритроцитов).
В литературе мало сведений о пульс-терапии метилпреднизолоном (10—30 мг/кг/сут) или дексаметазоном (40 мг/кг/сут) при АИГА [3, 4], но такой подход используют при СКВ и других коллагенозах. Метилпреднизолон обычно вводят по 1000 мг/сут в течение 2—5 дней (как правило, 3 дней). В мировой практике пульс-терапию чаще всего применяют для обрыва гемолиза на первом этапе тяжелой АИГА, а затем возвращаются к обычному приему глюкокортикоидов внутрь, описанному выше. Рандомизированные исследования отсутствуют. Результаты, полученные в НМИЦ гематологии у 28 пациентов (возраст от 18 до 72 лет), показали, что многократные пульсовые трехдневные введения метилпреднизолона значительно увеличивают частоту ремиссий и уменьшают риск осложнений по сравнению со стандартным режимом гормонотерапии. Кроме того, собственные наблюдения выявили, что мониторинг таких показателей, как нормализация фракции незрелых ретикулоцитов (IRF — Immature Reticulocyte Fraction), среднего уровня креатина в эритроцитах, распределения эритроцитов по плотности наряду с восстановлением уровней гемоглобина, эритроцитов, ретикулоцитов и активности ЛДГ дает более строгие критерии полной ремиссии. Перечисленные дополнительные показатели активности гемолиза достигали нормы только после 6—8 курсов пульс-терапии [4, 12].
Циклоспорин (Сандиммун Неорал) может приводить к развитию ремиссий у ранее резистентных больных [7—9]. Однако число описанных случаев невелико — около десяти. Препарат назначали либо в виде монотерапии, либо в сочетании с преднизолоном или даназолом, при этом начальные дозы существенно различались. При низкой поддерживающей дозе циклоспорина в течение длительного времени выраженные побочные явления отсутствовали. Emilia et al лечили трех пациентов, начиная с 5 мг/кг/сут в 2 приема. Через 6 дней дозу циклоспорина снизили до 3 мг/кг/сут, далее поддерживали в крови концентрацию препарата, равную 200—400 нг/мл. Литературные данные свидетельствуют о возможности длительных ремиссий (1—2 года) у ранее резистентных больных, в том числе при вторичных и гемолизиновых формах АИГА, а также синдроме Фишера—Эванса. Требуется продолжительная поддерживающая терапия. Однако отмечались и неудачи.
Даназол в практике лечения АИГА так и не нашел широкого применения. Этот препарат назначали на длительный период в дозе 200 мг/сут с последующим ее увеличением до 400 мг/сут и более при хорошей переносимости. Часто даназол назначали в составе комплексной терапии. Несмотря на то, что сообщалось о достижении ремиссии продолжительностью до 5 лет у резистентных больных с идиопатической формой АИГА в 77% случаев и с вторичной формой АИГА — в 60% случаев [10], даназол мало используют в лечении АИГА. За последние 10 лет на эту тему были единичные публикации [11]. Тем не менее интерес к препарату пока полностью не утрачен.
Правильная и своевременная диагностика АИГА с неполными тепловыми агглютининами обеспечивает адекватную тактику лечения и восстановление гематологических показателей через 3—5 недель. Признаки улучшения состояния больного, уменьшение «анемических» жалоб наблюдаются в течение первой недели лечения, повышение уровня гемоглобина — только через 7—10 дней. Адекватность терапии можно оценить по нормализации уровней гемоглобина, ретикулоцитов, билирубина, активности ЛДГ. Кроме того, после стабилизации показателей гемограммы желательно выбрать для мониторинга один или несколько дополнительных показателей активности гемолиза: фракцию незрелых ретикулоцитов (IRF) (при наличии клинического анализатора), распределение эритроцитов по плотности. В процессе лечения контрольные исследования гемограммы и биохимических показателей проводят не реже 3 раз в месяц, после достижения ремиссии — каждые 1,5—2 месяца.
Рекомендации по лечению АИГА, опубликованные в последние 5 лет, должны применяться с учетом индивидуальных особенностей каждого пациента и допускать обоснованные альтернативные решения [12].
Метилпреднизолон вводят в дозе 500 мг (редко 1000 мг) в/в капельно (1,5—2 ч) в течение 3 дней, иногда 4—5 дней. В начале лечения проводят два курса пульс-терапии с интервалом 5—10 дней, не допуская усиления гемолиза.
Одно из наиболее распространенных и серьезных осложнений после проведения спленэктомии — аспленический тромбоцитоз. Поэтому в зависимости от степени риска тромбозов проводится профилактика дезагрегантами и/или низкомолекулярными гепаринами, как указано выше. При тромбоцитозе более 1500 10 9 /л возможно назначение гидроксимочевины, 1000—1500 мг/сут, под контролем гемограммы 2 раза в неделю.
Основанием для повторного курса ритуксимаба являются доклинические признаки рецидива гемолиза, определяемые по динамике стандартных лабораторных показателей — уровня гемоглобина, количества эритроцитов и ретикулоцитов, активности ЛДГ, уровня билирубина, а также по результатам принятых в НМИЦ гематологии более чувствительных методов мониторинга — распределению эритроцитов по плотности, их деформируемости, фракции незрелых ретикулоцитов (IRF) и/или среднему уровню креатина эритроцитов, количеству иммуноглобулинов на мембране эритроцитов.
Информация
Источники и литература
Информация
Конфликт интересов: авторы не имеют конфликта интересов.
Гемолитическая анемия
Гемолитическая анемия – патология эритроцитов, отличительным признаком которой является ускоренное разрушение красных кровяных телец с высвобождением повышенного количества непрямого билирубина. Для данной группы заболеваний типично сочетание анемического синдрома, желтухи и увеличения размеров селезенки. В процессе диагностики исследуется общий анализ крови, уровень билирубина, анализ кала и мочи, УЗИ органов брюшной полости; проводится биопсия костного мозга, иммунологические исследования. В качестве методов лечения используется медикаментозная, гемотрансфузионная терапия; при гиперспленизме показана спленэктомия.
МКБ-10
Общие сведения
Причины
Этиопатогенетическую основу наследственных гемолитических синдромов составляют генетические дефекты мембран эритроцитов, их ферментных систем либо структуры гемоглобина. Данные предпосылки обусловливают морфофункциональную неполноценность эритроцитов и их повышенное разрушение. Гемолиз эритроцитов при приобретенных анемиях наступает под влиянием внутренних факторов или факторов окружающей среды, среди которых:
Патогенез
Центральным звеном патогенеза ГА является повышенное разрушение эритроцитов в органах ретикулоэндотелиальной системы (селезенке, печени, костном мозге, лимфатических узлах) или непосредственно в сосудистом русле. При аутоиммунном механизме анемии происходит образование антиэритроцитарных АТ (тепловых, холодовых), которые вызывают ферментативный лизис мембраны эритроцитов. Токсические вещества, являясь сильнейшими окислителями, разрушают эритроцит за счет развития метаболических, функциональных и морфологических изменений оболочки и стромы красных кровяных телец. Механические факторы оказывают прямое воздействие на клеточную мембрану. Под влиянием этих механизмов из эритроцитов выходят ионы калия и фосфора, а внутрь поступают ионы натрия. Клетка разбухает, при критическом увеличении ее объема наступает гемолиз. Распад эритроцитов сопровождаются развитием анемического и желтушного синдромов (так называемой «бледной желтухой»). Возможно интенсивное окрашивание кала и мочи, увеличение селезенки и печени.
Классификация
В гематологии гемолитические анемии подразделяются на две большие группы: врожденные (наследственные) и приобретенные. Наследственные ГА включают следующие формы:
Приобретенные ГА подразделяются на:
Симптомы
Наследственные мембранопатии, ферментопении и гемоглобинопатии
Наиболее распространенной формой данной группы анемий является микросфероцитоз, или болезнь Минковского-Шоффара. Наследуется по аутосомно-доминантному типу; обычно прослеживается у нескольких представителей семьи. Дефектность эритроцитов обусловлена дефицитом в мембране актомиозиноподобного белка и липидов, что приводит к изменению формы и диаметра эритроцитов, их массивному и преждевременному гемолизу в селезенке. Манифестация микросфероцитарной ГА возможна в любом возрасте (в младенчестве, юношестве, старости), однако обычно проявления возникают у детей старшего возраста и подростков. Тяжесть заболевания варьирует от субклинического течения до тяжелых форм, характеризующихся часто повторяющимися гемолитическими кризами. В момент криза нарастает температура тела, головокружение, слабость; возникают боли в животе и рвота.
Приобретенные гемолитические анемии
Среди различных приобретенных вариантов чаще других встречаются аутоиммунные анемии. Для них общим пусковым фактором выступает образование антител к антигенам собственных эритроцитов. Гемолиз эритроцитов может носить как внутрисосудистый, так и внутриклеточный характер. Гемолитический криз при аутоиммунной анемии развивается остро и внезапно. Он протекает с лихорадкой, резкой слабостью, головокружением, сердцебиением, одышкой, болями в эпигастрии и пояснице. Иногда острым проявлениям предшествуют предвестники в виде субфебрилитета и артралгий. В период криза стремительно нарастает желтуха, не сопровождающаяся кожным зудом, увеличивается печень и селезенка. При некоторых формах аутоиммунных анемий больные плохо переносят холод; в условиях низких температур у них может развиваться синдром Рейно, крапивница, гемоглобинурия. Вследствие недостаточности кровообращения в мелких сосудах возможны осложнения в виде гангрены пальцев ног и рук.
Токсические анемии протекают с прогрессирующей слабостью, болями в правом подреберье и поясничной области, рвотой, гемоглобинурией, высокой температурой тела. Со 2-3 суток присоединяется желтуха и билирубинемия; на 3-5 сутки возникает печеночная и почечная недостаточность, признаками которых служат гепатомегалия, ферментемия, азотемия, анурия. Отдельные виды приобретенных гемолитических анемий рассмотрены в соответствующих статьях: «Гемоглобинурия» и «Тромбоцитопеническая пурпура», «Гемолитическая болезнь плода».
Осложнения
Каждый вид ГА имеет свои специфические осложнения: например, ЖКБ – при микросфероцитозе, печеночная недостаточность – при токсических формах и т.д. К числу общих осложнений относятся гемолитические кризы, которые могут провоцироваться инфекциями, стрессами, родами у женщин. При остром массивном гемолизе возможно развитие гемолитической комы, характеризующейся коллапсом, спутанным сознанием, олигурией, усилением желтухи. Угрозу жизни больного несут ДВС-синдром, инфаркт селезенки или спонтанный разрыв органа. Неотложной медицинской помощи требуют острая сердечно-сосудистая и почечная недостаточность.
Диагностика
Определение формы ГА на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Сплено- и гепатомегалия подтверждается при проведении УЗИ печени и селезенки. Лабораторный диагностический комплекс включает:
В процессе дифференциальной диагностики исключаются гепатиты, цирроз печени, портальная гипертензия, гепатолиенальный синдром, порфирии, гемобластозы. Пациента консультируют гастроэнтеролог, клинический фармаколог, инфекционист и другие специалисты.
Лечение
Различные формы ГА имеют свои особенности и подходы к лечению. При всех вариантах приобретенной гемолитической анемии необходимо позаботиться об устранении влияния гемолизирующих факторов. Во время гемолитических кризов больным необходимы инфузии растворов, плазмы крови; витаминотерапия, по необходимости – гормоно- и антибиотикотерапия. При микросфероцитозе единственно эффективным методом, приводящим к 100 % прекращению гемолиза, является спленэктомия.
При аутоиммунной анемии показана терапия глюкокортикоидными гормонами (преднизолоном), сокращающая или прекращающая гемолиз. В некоторых случаях требуемый эффект достигается назначением иммунодепрессантов (азатиоприна, 6-меркаптопурина, хлорамбуцила), противомалярийных препаратов (хлорохина). При резистентных к медикаментозной терапии формах аутоиммунной анемии выполняется спленэктомия. Лечение гемоглобинурии предполагает переливание отмытых эритроцитов, плазмозаменителей, назначение антикоагулянтов и антиагрегантов. Развитие токсической гемолитической анемии диктует необходимость проведения интенсивной терапии: дезинтоксикации, форсированного диуреза, гемодиализа, по показаниям – введение антидотов.
Прогноз и профилактика
Течение и исход зависят от вида анемии, тяжести протекания кризов, полноты патогенетической терапии. При многих приобретенных вариантах устранение причин и полноценное лечение приводит к полному выздоровлению. Излечения врожденных анемий добиться нельзя, однако возможно достижение длительной ремиссии. При развитии почечной недостаточности и других фатальных осложнений прогноз неблагоприятен. Предупредить развитие ГА позволяет профилактика острых инфекционных заболеваний, интоксикаций, отравлений. Запрещается бесконтрольное самостоятельное использование лекарственных препаратов. Необходимо тщательная подготовка пациентов к гемотрансфузиям, вакцинации с проведением всего комплекса необходимых обследований.