Генетические маркеры это что
Генетические маркеры
К структурным или генетическим маркерам относят все нарушения, которые изменяют структуру ДНК. В первую очередь это крупные аномалии, такие как делеции целых хромосомных районов, содержащих гены-супрессоры опухолевого роста и дупликации или амплификации районов, содержащих клеточные протоонкогены, факторы роста и др. Частным случаем является микросателлитная нестабильность, происходящая в опухолевых клетках.
К структурным перестройкам относят транслокации и инверсии хромосомного материала, в результате которых могут образовываться химерные гены, имеющие онкогенные функции. Другим результатом структурных перестроек может оказаться ситуация, когда клеточный протоонкоген получает дополнительные активирующие регуляторные элементы и начинает гиперэкспрессироваться. И, наконец, к структурным аномалиям относят различные типы мутаций, которые могут активировать проонкогены или инактивировать гены-супрессоры.
Согласен Данный веб-сайт содержит информацию для специалистов в области медицины. В соответствии с действующим законодательством доступ к такой информации может быть предоставлен только медицинским и фармацевтическим работникам. Нажимая «Согласен», вы подтверждаете, что являетесь медицинским или фармацевтическим работником и берете на себя ответственность за последствия, вызванные возможным нарушением указанного ограничения. Информация на данном сайте не должна использоваться пациентами для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.
Локусы, аллели, генетические маркеры что это?
В этой статье мы поможем разобраться вам во всех этих терминах, знание которых поможет понять механизм ДНК тест на установление родства, в том числе установление отцовства.
Генетика человека. Главные понятия.
В каждом человеке есть уникальный набор генов, который достается нам от родителей.
При слиянии генов наших родителей внутри нас формируется совершенно уникальный и новый генетический код. Гены располагаются в хромосомах и имеют определенное место.
Так вот, благодаря научным исследованиям были определены участки, где находится конкретный ген, именно его и называют локусом или генетическим маркером.
Гены влияют на наш цвет волос, цвет глаз, цвет кожи и т.д. их многочисленные вариации называются аллелями. Нужно понимать, что ребенок получает по одной аллели каждого гена от отца и от матери.
Как правило аллели имеют противоположные свойства: темные и светлые волосы, высокий и низкий рост. Совокупность аллелей в исследуемых локусах и есть ДНК профиль человека.
Благодаря разнообразию эти аллелей в определенных участках (локусах) можно провести ДНК тест на установление родства. Т.к. ребенок получает половину генетического материала от матери и половину от отца.
Подробнее об аллелях и наследственности.
Т.к. аллели имеют противоположные свойства, один аллель, как правило, более сильный. И этот сильный аллель будет называться доминантным. Аллель, который не проявляется называется рецессивным. В целях отличия доминантных и рецессивных аллелей их обозначают разными буквами. Заглавную букву присваивают доминантному аллелю.
Как проходит тест ДНК
Получив образцы, генетическая лаборатория производит выделение ДНК из взятых мазков.
Далее проводится процедура полимеразной цепной реакции. Для этого достаточно иметь небольшой фрагмент ДНК.
После реакции ДНК-секвенатор проводит автономное тестирование и сравнение образцов. Итоговые данные вносятся сотрудником лаборатории в компьютерную программу, производится расчёт вероятности генетической связи и родства.
Программа сравнивает контрольный образец, предоставленный предполагаемым родственником, с испытуемым образцом.
Установление степени родства проводится по методу 25 STR, это минимальное количество генетических маркеров для точного определения родства.
Метод применяется в мировых лабораториях и обладает исключительно высокой достоверностью. Заключение и результаты тестирования подписываются руководителем лаборатории, заверяются печатью. Руководитель должен иметь действующий сертификат судмедэксперта.
Результат считается положительным, если вероятность совпадения выше 99,9999%.
Уникальность строения ДНК присуща каждому человеку, совпадения невозможны. Молекулы способны хранить полную информацию о наследственности. Именно за счёт этого в современной медицине достигается высокая достоверность тестирования.
Мáркеры для клеток: как ученые «раскрашивают» клетки, чтобы отличить одну от другой
Выделить все важное и отличить от других — вот задача клеточных мáркеров.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: В этой статье рассказывается о том, как ученые научились в широком смысле «раскрашивать» клетки — выделять из общей смеси только те, которые им интересны, а остальные отсеивать. Речь пойдет как о естественных поверхностных и внутриклеточных мáркерах и способах их выявления, так и о более изощренных генетических способах маркировать клетки. Читателя ждет открытие, что штрих-коды бывают не только в магазинах, но и в клетках, а вирус иммунодефицита человека превратился в послушный инструмент.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Что первое приходит на ум неискушенному в науке человеку при слове «мáркер»? Бьюсь об заклад, что добрая половина представляет себе желтый широкий фломастер для выделения текста. Другая половина, наверняка, представляет себе черный нестираемый маркер, которым одно время были исписаны все трубы, заборы и веранды. Начертания «Маша + Саша = Любовь» скрепляли чувства подростков навечно, а менее романтичные, но выразительные фразы надолго свидетельствовали о личной неприязни. Встречались даже стихи. Однако предлагаю уважаемым читателям узнать еще одно значение этого слова — очень научное и так нужное всей современной биологии и биомедицине. В научном понимании и конкретно в клеточной биологии, слово «маркер» в широком смысле означает что-то, что отличает одну живую клетку (или группу клеток) от других. Это может быть молекула на поверхности клеточной мембраны, или какой-нибудь внутриклеточный белок, или вещество, которое синтезируется/накапливается только в этом конкретном виде клеток, или генетическая особенность, присущая только данному типу клеток. Условно все маркеры можно разделить на естественные, которые существуют сами по себе, и искусственные — введенные намеренно. Давайте разберемся с ними по порядку.
Естественные клеточные маркеры и способы их рассмотреть
В многоклеточных организмах существует клеточная специализация. Несмотря на то, что клетки содержат одинаковую ДНК, они отличаются друг от друга: клетки мышц умеют сокращаться, нейроны — проводить нервные импульсы, и так далее. Это происходит из-за того, что в каждом виде клеток работает только определенный набор генов из всего их разнообразия, содержащегося в ДНК. Именно поэтому маркером клеток может служить любой ген, который экспрессируется избирательно — только в каком-нибудь конкретном виде клеток. Особенно удобно, когда такой отличительный ген кодирует белок, располагающийся на поверхности клетки.
Раковые маркеры
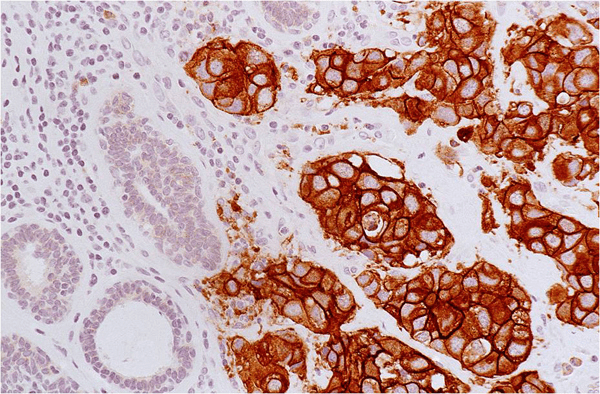
Часто можно слышать слово — «онкомáркер». Это классический пример клеточных маркеров: молекул на поверхности опухолевых клеток, которые или не встречается совсем, или присутствуют в гораздо меньшем количестве на поверхности здоровых клеток. Одним из ярких примеров онкомаркеров является HER2-антиген на поверхности клеток рака груди (рис. 1) [1]. HER2 — рецептор эпидермального ростового фактора. В результате аномального увеличения количества копий гена этого рецептора в опухолевых клетках нарушается регуляция клеточного цикла, и опухоль начинает быстро расти. HER2+-варианты рака груди — очень агрессивны [2].
В этом случае у ученых есть целый набор методов, как можно «увидеть» клетки, несущие такой маркер, отличить их от остальных клеток и даже отсортировать: в одну пробирку — клетки с поверхностным маркером (или с несколькими маркерами), в другую — остальные. Эти методы основаны на использовании антител.
Антитела — специальные белки, которые могут распознавать молекулы за счет пространственного взаимодействия. Именно антитела играют важную роль в нашем иммунитете — они связываются с белками или другими молекулами на поверхности бактерий и вирусов, что и запускает иммунную реакцию. Современная наука научилась делать антитела против практически любых белков — в том числе и против поверхностных клеточных маркеров. Чтобы использовать антитела для определения маркеров, ученые прибегают к еще одной хитрости. Они присоединяют к антителу еще один белок: или фермент, или флуоресцирующий (светящийся) белок. Тогда, если к исследуемым клеткам добавить антитела против поверхностного маркера, связанные с ферментом, потом отмыть лишние антитела и добавить субстрат для фермента, который при расщеплении приобретает какой-нибудь цвет, то клетки, несущие на своей поверхности нужный маркер, окажутся окрашенными, а остальные клетки — останутся бесцветными (рис. 1).
Рисунок 1. Пример выявления онкомаркера HER2 с помощью антител (иммуногистохимия). Коричневые клетки несут на своей поверхности HER2.
Такая модификация выявления маркера называется иммуногистохимией («иммуно» — из-за того, что используют иммунные антитела, «химия» — потому что в методе присутствует химическая реакция расщепления субстрата ферментом, «гисто» — потому что чаще всего такой метод применяют к гистологическим срезам — тонким слайсам исследуемой ткани, которые закреплены на стеклянной подложке).
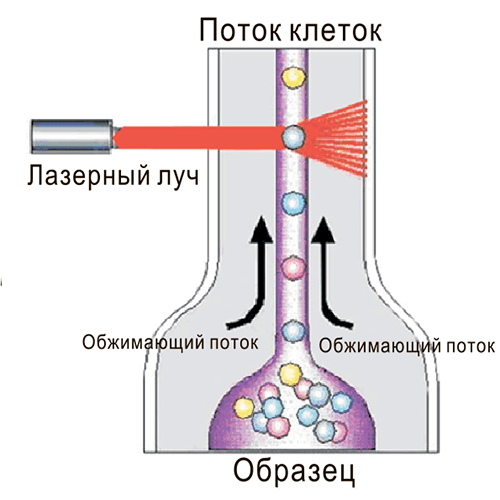
Другой метод, позволяющий выявлять поверхностные маркеры, называется проточной цитофлуориметрией (fluorescence-activated cell sorting, FACS) [3]. Здесь исследуемые клетки (в виде одноклеточной взвеси) смешивают с антителами, к которым присоединены флуоресцирующие белки. Антитела связываются со своими маркерами-мишенями, a не связавшиеся антитела удаляют. Далее клетки загружают в прибор. Он создает тонкую струю из клеточной суспензии, проходящую через свет лазера буквально по одной клетке. Если на поверхности клетки есть искомые маркеры, то вместе с клеткой в луч лазера попадают и антитела, связавшиеся с маркерами. Происходит возбуждение флуорофора на антителе, и он испускает на своей длине волны свет, который и регистрируется детектором (рис. 2).
Рисунок 2. Общий принцип проточной цитофлуориметрии.
После этого прибор может отклонить эту клетку из струи или в одну сторону, или в другую. Таким образом можно разделить клетки на две группы: с маркером и без. Получается, что прибор «знает», есть ли искомые маркеры на каждой из исследуемых клеток, сколько таких клеток, умеет сортировать нужные и ненужные клетки.
Описанные способы позволяют выявлять естественные маркеры — молекулы, которые и до начала исследования присутствовали на поверхности или внутри клеток. Эти методы сильно помогли ученым разобраться в том, чем опухолевые клетки отличаются от нормальных, стволовые клетки — от более зрелых и дифференцированных, и разные ткани — друг от друга.
Искусственные маркеры: внедрить и распознать
У описанных выше методов есть один существенный недостаток: они не позволяют установить родственные связи между клетками. Вот, предположим, у нас есть 100 клеток, и у 12 из них есть маркер А на поверхности. Все эти клетки А для нас будут на одно лицо, как близнецы (рис. 3).
Рисунок 3. Братья-близнецы из фильма «Приключения Электроника».
Мы не сможем сказать, произошли ли все эти 12 клеток от одной материнской и являются ли «близкими родственниками». Или, скажем, можно предположить, что они получились после деления нескольких клеток с исследуемым маркером и являются друг другу двоюродными, троюродными братьями и сестрами, а может быть и вовсе седьмой водой на киселе. Чтобы исследовать родственные связи в клеточной популяции (еще говорят — «исследовать клональный состав популяции» [4]) и следить за тем, как ведет себя потомство отдельных клеток, ученые научились вводить искусственные генетические маркеры в клетки. Делают это несколькими способами. Один из самых продвинутых способов на сегодняшний день — использование специальных вирусов.
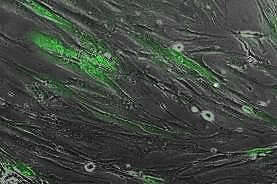
Рисунок 4. Мультипотентные мезенхимальные стромальные клетки (ММСК) человека, маркированные лентивирусом с зеленым флуоресцентным белком GFP.
собственные данные автора статьи, [4]
Современная генная инженерия достигла таких невиданных высот, что специалисты научились конструировать вирусы с заранее известными, тщательно отобранными для целей исследователей свойствами. Например, можно создать вирус, который способен заражать клетку — проникать через ее оболочку в ядро, — встраиваться в ДНК зараженной клетки, и больше ничего не делать: не создавать новые вирусные частицы, не копировать себя в геноме зараженной клетки, не экспрессировать ни один из вирусных генов. Вместо этого ученые смогли заставить вирус, который встроился в ДНК клетки, экспрессировать нужные белки (например, на этом принципе основана генотерапия). В частности, можно сделать так, что с ДНК вируса экспрессируется флуоресцентный белок [5], и зараженная клетка начинает светиться во флуоресцентном микроскопе (рис. 4).
Вирусы, которые способны направленно доставлять гены в ДНК клетки, стали называть вирусными векторами.
Как ВИЧ помогает ученым
На заметку: именно к этому семейству принадлежит вирус иммунодефицита человека (ВИЧ). На его основе придуманы многие генетические векторы. Так что, в руках ученых ВИЧ из возбудителя страшной болезни превратился в послушный инструмент исследования.
Введение вектора в клетки для исследования их клонального состава принято называть маркированием клеток. Вы здесь совершенно справедливо спросите: «Позвольте, а где же здесь маркирование? Ну, ввели мы ДНК вируса в ДНК клетки, но дальше-то что?». А я Вам отвечу, что здесь-то и начинается самое интересное! Введенная ДНК действительно может выступать в роли маркера. Здесь есть два варианта: 1) маркером может служить не сама вирусная ДНК, а то место, куда она встроилась; 2) маркер может содержаться в самой вирусной ДНК.
Про то, каким удивительным образом в одном клеточном ядре величиной в несколько микрометров упаковываются молекулы ДНК, длина которых измеряется в метрах, читайте увлекательную статью на «Биомолекуле»: «Организовать геном: запутанная история гипотез и экспериментов» [6].
Рисунок 5. Модель фрактально-глобулярной структуры ДНК. Цветом здесь условно обозначены разные хромосомы.
Соответственно, у одного маленького вируса много возможностей, куда встроиться. В идеале — их бесконечно много, и поэтому найти две клетки, в которых бы вирусы встроились в абсолютно одинаковом месте, — довольно сложно. Еще один важный момент заключается в том, что если зараженная клетка решит поделиться, то обе ее дочерние клетки будут содержать провирус (так называется вирус, который встроился в геномную ДНК) в одном и том же месте генома! Другими словами, генетический маркер — наследуемый признак. Если научиться определять, в какое же именно место генома попал вирус в разных клетках, то можно было бы отличать потомство одной зараженной клетки от другой! И ученые умеют это! Существует несколько методов, позволяющих это сделать, главные из которых — метод саузерн-блоттинга и полимеразная цепная реакция, опосредованная лигированием [7], [8].
Про принцип гибридизации по Саузерну я отсылаю тебя, дорогой читатель, к другой замечательной статье, посвященной описанию важнейших методов молекулярной биологии: «Важнейшие методы молекулярной биологии и генной инженерии» [9]. А о полимеразной цепной реакции расскажет статья «12 методов в картинках: полимеразная цепная реакция» [10].
Оба метода основаны на том, что вследствие случайного характера интеграции вируса в геномную ДНК расстояние от провируса до ближайшего сайта рестрикции будет разным в двух независимо зараженных клетках. Соответственно, если из зараженных клеток выделить ДНК и разрезать ее одной из рестриктаз, то длина фрагмента, содержащего провирус, будет разной у потомства двух разных зараженных клеток, и будет одинаковой у всех клеток, которые произошли в результате деления одной зараженной клетки. Если после рестрикции разделить фрагменты гель-электрофорезом [11], перенести на нитроцеллюлозную мембрану и гибридизовать с короткой последовательностью дезоксирибонуклотидов, комплементарной провирусу (такие олигонуклеотиды принято называть зондами), то на фотобумаге проявится набор полос, который будет одинаковым для клеточного потомства одной клетки и разным — для клеточного потомства нескольких зараженных клеток (рис. 6).
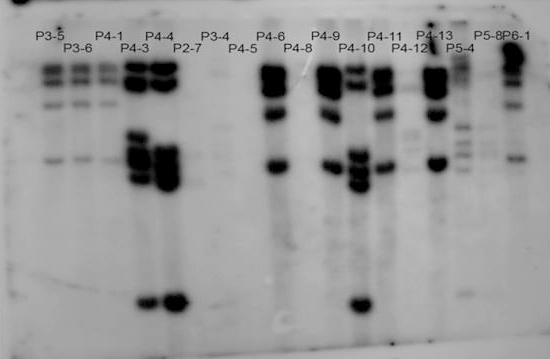
Рисунок 6. Саузерн-блот клеточных клонов, полученных из популяции, зараженной лентивирусным вектором. Каждая дорожка — результат саузерн-блоттинга ДНК из клеточного клона (клеточного потомства одной зараженной клетки). Набор полос в каждой дорожке соответствует продукту гибридизации зонда, комплементарного провирусу, с фрагментами расщепленной ДНК, содержащими провирус. Фрагменты разделены по длине с помощью гель-электрофореза.
собственные данные автора статьи, [4]
Из картинки видно, что на первых трех (и некоторых других дорожках — предлагаю читателю размяться и подсчитать их!) паттерн полос идентичен. Это говорит о том, что ДНК, проанализированная в этих образцах, получена из клеток, произошедших от одной исходно зараженной материнской клетки. Легко также заметить, что дорожка с таинственным названием Р5-4 содержит совершенно другой набор полос. Это означает, что ДНК, использованная здесь, принадлежала другой зараженной клетке. Недостаток такого метода в том, что он не позволяет в явном виде идентифицировать сайт интеграции провируса. Метод позволяет только сравнивать между собой клеточные клоны и судить об их родстве.
Другой метод, который позволяет анализировать сайты интеграции провирусов, — полимеразная цепная реакция, опосредованная лигированием [8]. Это достаточно сложный и многостадийный метод, который включает в себя рестрикцию ДНК, присоединение (лигирование) адаптеров, использование магнитных микрочастиц, ПЦР, электрофорез и секвенирование и заслуживает отдельной статьи. Прошу тебя, мой читатель, поверить мне на слово — этот метод позволяет с точностью до нуклеотида определить место в ДНК, в которое произошла интеграция провируса. С помощью этой методики можно не только различить потомство зараженных клеток между собой, но также судить о том, сколько вирусов проникло в ДНК зараженной клетки, в какие гены произошла интеграция, и не произошло ли изменение их экспрессии в результате внедрения вируса [12], [13].
Ранее я упомянул о том, что в качестве маркера, кроме места интеграции, можно использовать и саму ДНК провируса. Давайте рассмотрим подробнее, как это можно сделать. Здесь нам поможет химический синтез олигонуклеотидов! Дело в том, что в ДНК вируса можно вводить любую информацию: например, ген, кодирующий флуоресцирующий белок или фермент. Правда, тогда все вирусные частицы ничем не будут отличаться одна от другой и приобретут смысл маркеров только тогда, когда попадут в клетку. А почему бы не сделать сами вирусные частицы уникальными? Для этого ученые конструируют лентивирусные векторы, несущие так называемые генетические штрих-коды [14]. Суть заключается в том, что с помощью химического синтеза получают смесь олигонуклеотидов, где в некоторых позициях случайным образом содержится любой из четырех известных дезоксирибонуклеотидов. Дизайн штрих-кода может быть, например, таким:
ATC NNN GGA NNN TAT NNN CGA NNN ATT NNN GTG NNN
Здесь символы N обозначают любой из известных нуклеотидов (А, Т, C или G). Такой штрих-код ничего не кодирует, но он представляет собой смесь нуклеотидов с разными последовательностями. Приведенный штрих-код — на самом деле смесь из 4 18 (или приблизительно 10 11 после несложных, но утомительных математических преобразований) различных олигонуклеотидов! Такая смесь используется для сборки вирусов. На выходе получаются уже не обезличенные вирусы, похожие друг на друга как две капли воды, но целая библиотека вирусов, где каждая вирусная частица несет какой-то из возможных олигонуклеотидов-штрих-кодов. Клетки заражают такой вирусной библиотекой, и каждая зараженная клетка получает в свою ДНК уникальный стабильный наследуемый маркер в виде генетического штрих-кода. Все дочерние клетки будут нести тот же штрих-код (или набор штрих-кодов), который приобрела материнская клетка при заражении. Клеточное потомство двух разных зараженных материнских клеток будет иметь различные штрих-коды. Подобно тому, как штрих-коды на товарах в обычном продуктовом магазине позволяют однозначно идентифицировать и отличить один товар от другого, так генетические штрих-коды позволяют отличить потомство одной зараженной клетки от другой. Если затем из зараженной популяции клеток выделить ДНК и определить все присутствующие в ней штрих-коды с помощью новых методов секвенирования, то можно однозначно установить клональный состав клеточной популяции, проследить за динамикой клонов и выявить те клоны, которые преобладают над другими. После заражения библиотекой лентивирусов со штрих-кодами клеточная популяция становится как будто раскрашенной маркерами с очень-очень-очень разнообразной палитрой [15], примерно вот так (рис. 7):
Рисунок 7. Как выглядела бы клеточная популяция, если бы каждый генетический штрих-код имел свой цвет.
Рисунок 8. Канцелярские принадлежности.
Количество генетических маркеров влияет на результаты исследования по установлению родства
Развитие молекулярно-генетической биологии привело к созданию точных методик, позволяющих установить биологическое родство.
В основе генетического исследования лежит сравнительный анализ материального носителя наследственности – дезоксирибонуклеиновой кислоты (ДНК).
При оплодотворении происходит слияние геномов яйцеклетки и сперматозоида в результате чего образуется генотип нового организма. ДНК отца и матери в равной степени составляет геном ребенка.
Гены – функциональные единицы наследственности – существуют в одной из форм – аллелей.
Аллели отличаются последовательностью расположения нуклеотидов, что передается по наследству.
Тот факт, что все клетки, сформировавшие новый организм, содержат одинаковую ДНК – наполовину матери, наполовину отца – и позволяют определять степень родства тестируемых лиц.
Для этого изучаются короткие участки ДНК – локусы, которые повторяются с определенной очередностью. Они носят название ДНК-маркеров.
Комбинация из ДНК-маркеров составляет генетический профиль человека.
Методика проведения анализа ДНК
Стандартным материалом для генетической экспертизы является защечный эпителий, полученный при помощи мазка. Кроме того, выделить ДНК можно из любого биологического материала человека: крови, слюны, волос, ногтей, спермы, мочи.
Цель исследования – нахождение совпадений каждого фрагмента (локуса) ребенка с таким же фрагментом у предполагаемого отца. Так как такие фрагменты могут встречаться и у других мужчин в популяции, для точности результатов необходимо наличие данных о частоте встречающихся аллелей.
Для установления отцовства проводится математический анализ вероятности совпадения аллелей ребенка и вероятного отца.
Официально в России принято, что при показателе вероятности выше 99,9% отцовство считается доказанным.
Оптимальный набор локусов для достоверного анализа ДНК
Стандартный анализ на установление отцовства осуществляют по 25 генетическим маркерам. При расширении панели тестируемых маркеров повышается и точность производимого анализа.
Генетические маркеры, используемые при анализе ДНК, должны обладать высокой полиморфностью, то есть иметь не 2 аллели (варианта), а значительно больше до 10 и более. На точность результатов генетической экспертизы также влияет количество тестируемых локусов и природа локуса.
Расширенный анализ 25-40 локусов проводят: ·
При установлении родства специалисты при положительном результате указывают, что родство не может быть исключено. При отрицательных результатах заключение носит более категорический характер: родство исключено.
Незначительное отклонение от 100% при определении вероятности отцовства объясняется тем, что не исключается теоретическая возможность существования в мире человека с таким же генетическим профилем, как и у тестируемого мужчины.