Генетический драйв что это
Молекулярные биологи из Калифорнийского университета в Сан-Диего впервые успешно испытали технологию генного драйва на млекопитающих — мышах. До сих пор данный метод, предназначенный для распространения мутантных генов в популяции животных, тестировался только на насекомых. Ожидается, что генный драйв позволит контролировать численность определенных видов или полностью уничтожать их. «Лента.ру» рассказывает, в чем заключается эта технология, зачем она нужна и насколько она опасна для людей.
Разгон генов
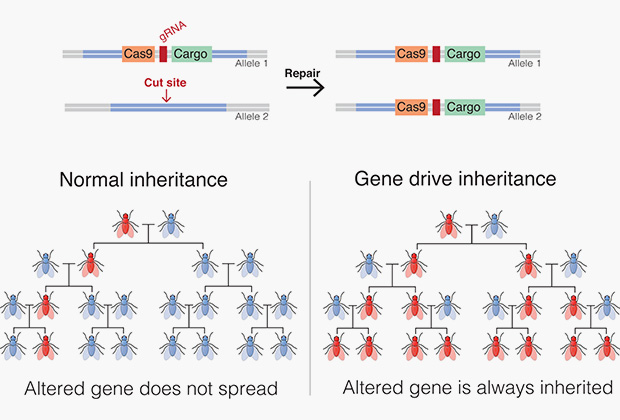
Суть генного драйва заключается в изменении вероятности, с которой потомство может унаследовать определенный ген. В природе эта вероятность составляет 50 процентов. В соматических клетках млекопитающих находится двойной набор хромосом, которые унаследованы от матери и от отца (такие пары хромосом называются гомологичными), но в половые клетки — яйцеклетки и сперматозоиды — попадает только материнская или только отцовская хромосома (с одинаковой вероятностью). Можно внедрить мутантный ген в организм, но есть только один шанс из двух, что он передастся потомству. Естественный отбор может помочь мутации распространиться в большой популяции, но для этого она должна быть полезной для организма, увеличивая его шансы на выживание. К тому же ее распространение займет очень много времени.
Однако генный драйв позволяет увеличить шансы на наследование мутации почти до ста процентов. Происходит генная конверсия, то есть модифицированный ген просто копируется из одной гомологичной хромосомы в другую, в результате намного больше половых клеток готовы передать потомству мутацию. С течением времени почти вся популяция может нести в себе измененную ДНК. Успех этого метода зависит от ряда факторов, включая степень панмиксии (насколько особи скрещиваются между собой) и частоты генной конверсии, которая должна составлять около 90 процентов. В этом случае генный драйв может способствовать распространению даже вредных мутаций, если они не слишком сильно снижают репродуктивный успех особи.
Система генного драйва была успешно испытана на насекомых. Предполагается, что ее используют в борьбе с распространением малярии. В комаров и москитов внедрят гены, которые лишат их способности переносить малярийный плазмодий, и выпустят модифицированных насекомых в окружающую среду, где они будут свободно скрещиваться со своими сородичами. Ожидается, что, если генному драйву подвергнуть один процент популяции диких насекомых, то опасная инфекция будет уничтожена в течение года.
Против кого воюем
До сих пор генный драйв не испытывался на млекопитающих, хотя предлагалось использовать эту технологию для борьбы с инвазивными видами, то есть видами животных, которые были случайно или намеренно занесены в новые для них места обитания, где они угрожают местным видам.
Речь идет о вирусе миксомы, вызывающем миксоматоз, и кальцивирусе — возбудителе геморрагической болезни кроликов. Миксома способствовала значительному сокращению популяции кроликов, поскольку приводила к гибели почти всех зараженных особей. К сожалению, чрезмерная агрессия вируса, полезная для борьбы с животными, постепенно сошла на нет. Инфекционному агенту не выгодно быстро убивать своего хозяина, так как он не успевает заразить другого и распространиться более широко. Поэтому вирусы эволюционируют в сторону смягчения своих патогенных свойств. В свою очередь у кроликов также повысилась невосприимчивость к болезни.
У кальцивируса тоже оказались свои недостатки. Он хорошо убивал кроликов в условиях сильной жары, а вот в более мягком климате оказался менее эффективным и способствовал иммунизации животных против своей агрессивной формы.
Тут генный драйв и приходит на выручку. Его можно использовать для распространения восприимчивости инвазивного вида к вирусам и пестицидам, лишения его устойчивости к различным заболеваниям, — и таким образом не дать популяции неконтролируемо разрастаться, или в конечном итоге полностью уничтожить ее.
Все сложно
Однако генный драйв в млекопитающих оказалось сложнее осуществить, чем в насекомых. В новой работе исследователи использовали систему CRISPR/Cas9, которая позволяет разрезать ДНК в нужном месте, а клетка сама копирует в место разреза необходимый участок генома, чтобы восстановить поврежденную цепочку. Этот участок генома должен быть гомологичен утерянному, поэтому исследователи получают возможность получить две копии одного гена.
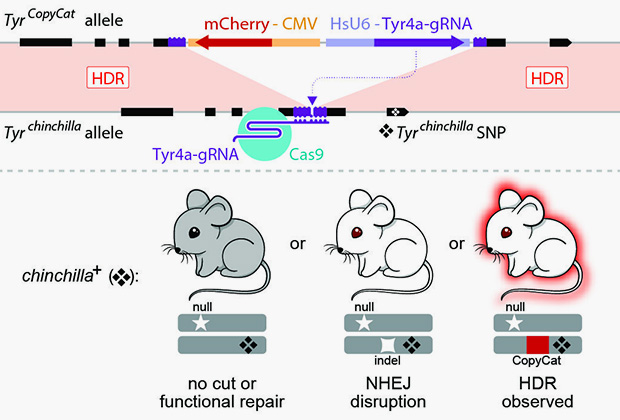
Ученые создали генетически модифицированных мышей, внедрив в ген Tyr кодирующий фермент тирозиназу, ДНК-элемент, названный CopyCat. В результате Tyr перестает кодировать правильную аминокислотную последовательность тирозиназы, участвующей в синтезе меланина, и мыши становятся альбиносами. Кроме того, CopyCat содержит гидовую РНК, которая указывает ферменту Cas (являющемуся «ножницами») на неповрежденный ген Tyr, находящийся на гомологичной хромосоме, и способствует его разрезанию.
Изображение: Cooper Lab, UC San Diego
Однако вместо того чтобы «восстановить» разрезанный ген Tyr с помощью копии CopyCat, клетка может попросту еще сильнее обрезать и «сшить» концы ДНК, вызывая нежелательную мутацию. Чтобы выяснить, какой механизм осуществляется, ученые пошли на хитрость. Они скрестили черную мышь, имеющую одну копию гена Tyr с CopyCat, с мышью, которая несет другую двойную мутацию, вызывающую альбинизм. В этом случае должно получится три типа потомства: черные мыши с геном альбинизма и нетронутым Tyr, белые мыши с геном альбинизма и обрезанным Tyr и белые мыши с геном альбинизма и CopyCat. Однако ученые варьировали время активации Cas9 в эмбрионе. Оказалось, что добиться копирования CopyCat в 86 процентах случаев можно только в определенный этап развития плода женского пола.
Генный драйв и CRISPR: история, потенциал и стартапы
Скоро изменится сама природа человеческой расы. Эти изменения будут радикальными и быстрыми – таких в истории нашего вида еще не было. Только что закончилась одна глава нашей истории и начинается следующая.
Революция существования людей станет возможной благодаря новой генетической технологии с безобидным названием CRISPR (произносится как «криспр»). Многие читатели уже могли встречать это название в новостях, и скоро его подхватят другие мейнстримные медиа. CRISPR – аббревиатура от Clustered Regularly Interspaced Short Palindromic Repeats (короткие палиндромные повторы, регулярно расположенные группами). CRISPR для геномики – то же самое, что и vi (визуальный текстовый редактор в Unix) для ПО. CRISPR – это технология редактирования генома, которая дает генным инженерам беспрецедентные возможности: она превращает их в генных хакеров. До появления CRISPR генная инженерия была медленной, дорогой и неточной. Теперь же редактирование генома можно будет выполнять дешево, точно и воспроизводить результаты.
Этот текст – очень не-технический пересказ истории развития CRISPR. Также мы поговорим о Gene Drive [1], биологическом методе, который при использовании вместе с CRISPR дает генным инженерам еще больше возможностей. Ниже я добавил несколько ссылок для тех, кому интересно углубиться в эту тему – по ним можно почитать о технических подробностях. В конце я кратко расскажу о последствиях и перспективах этих технологий.
Кратко рассмотрим вводную информацию. Генетический код, описанный в ДНК, можно рассматривать как ПО, которое порождает всевозможные формы жизни, существующие на нашей планете. Генетики изучают методы расшифровки генома, но все затрудняет тот факт, что у них очень мало возможностей для изменения этого кода. Для сравнения – представьте, если бы у разработчиков ПО был доступ к огромному количеству чрезвычайно мощных программ, которые они едва понимают, и код которых не могут изменять. Но если возможность редактировать код появится, и ученые смогут модифицировать «генетическое ПО», то исследованиями можно будет заняться всерьез. У инженеров появится возможность не только изменять код, но и исправлять и улучшать его. Снова появятся хакеры.
Понять эту удивительную технологию будет проще, если узнать где она появилась. В 1980-х ученые из университета Осаки секвенировали ДНК бактерии E Coli и заметили нечто странное. ДНК состояла из длинных цепочек нуклеотидов, а внутри нее были повторяющиеся кластеры странных последовательностей нуклеотидов, которые находились не на своих местах. Они выглядели так, будто они прерывались случайными цепочками ДНК. Со временем подобные кластеры были обнаружены у нескольких других бактерий и получили название CRISPR (это название вполне емко описывает то, что обнаружили ученые). Впрочем, тогда никто не знал что это и каковы функции этой находки.
Существует несколько открытий, которые давали ученым ответы на эти вопросы, но стоит выделить два самых важных. Во-первых, три разные команды недавно использовали свежие базы данных генетического материала и заметили, что эти цепоки CRISPR похожи на необычную вирусную ДНК. Во-вторых, гениальный биолог-эволюционист из Национального центра биотехнологической информации Евгений Кунин пришел к ключевому выводу, что это бактериологический механизм защиты от вирусов. В итоге эта идея привела к формулированию предназначения CRISPR.
Позвольте мне прояснить один момент во избежание путаницы. Ранее мы говорили о том, что CRISPR – это описание определенных необычных цепочек ДНК. Чтобы использовать эти цепочки в качестве защитного механизма или для редактирования генома (об этом поговорим дальше), необходим инструмент, который называется Cas. Если будете читать о Cas-белках, вы можете также встретить упоминания Cas9 (или Cas3 и т.д.). Полный набор этих инструментов иногда называют CRISPR/Cas, но обычно говорят просто CRISPR, и я придерживаюсь именно этого термина.
Обсудим как все это работает. Когда бактериям, обладающим CRISPR, удается отбиться от атак вирусов, они используют белки Cas для захвата фрагментов вирусной ДНК и вставляют эти фрагменты в свою ДНК. Если вирусу не повезет напасть на столь хорошо подготовленную бактерию, то эта самая бактерия использует цепочку CRISPR как паттерн для распознавания вируса и использует Cas для того, чтобы раздробить вирус на безобидные частицы.
Это очень крутой механизм. Белки Cas копируют вирусные гены CRISPR из собственной ДНК в молекулы РНК (как и ДНК, РНК очень важна для записи структуры генома), за счет чего формируется структура, состоящая из Cas-белка и РНК. После своего создания эта структура начинает блуждать по клетке. Когда эта структура сталкивается с другой молекулой, она проверяет есть ли в ней ДНК и при обнаружении считывает нуклеотидную последовательность. Если эта последовательность соответствует хранимой цепочке CRISPR, то произошла встреча с известным вирусом. Затем РНК захватывается и ферменты CAS расщепляют вирусную ДНК подобно гильотине (или убивают ее, если вам хочется считать вирусы живыми). Если для вас все это звучит как некий иммунологический алгоритм, реализованный сущностями из биологии, то вы в целом правы:
Круто, не правда ли? Расшифровка этой загадки могла бы принести ее автору докторскую степень или сделать доцента профессором, но теперь за нее можно получить даже Нобелевскую премию – ведь мы говорим об открытии, которое может изменить судьбу человечества. Все дело в том, что над ним независимо работали несколько разных команд (и теперь они соревнуются между собой [2]), и на каждую из этих команд снизошло невероятное озарение. Они поняли, что иммунная система, появившаяся в результата в результате миллионов лет эволюции может совершить революцию в генной инженерии. Если у ученых появится возможность использовать механизм CRISPR, то они смогут точно выделять и вырезать отдельные фрагменты ДНК. Более того, с помощью CRISPR и двух разных белков Cas9, они смогут точно вырезать целые сегменты из произвольных структур. Конечно, это лишь половина задачи редактирования генома. После удаления нежелательной последовательности на ее место нужно будет вставить те гены, которые нам нужны. Как оказалось, это очень просто. Достаточно просто ввести ген(ы), которыми вы хотите заменить удаленные фрагменты, и уже существующие ферменты восстановления сами все соберут.
Одна из самых классных особенностей CRISPR заключается в том, что эта технология универсальна (в отличие от большинства уже существующих методов редактирования генома — они работают с ограниченным множеством организмов). Теоретически, CRISPR может работать с любыми (земными) формами жизни.
Давайте минутку подумаем над тем, сколько всего хорошего может сделать CRISPR для будущего человечества. Мы сможем нейтрализовать своих врагов в животном мире. Мы сможем лечить генетические заболевания. Возможно, мы сможем разработать терапию против любых вирусных или бактериологических болезней, причем эта терапия будет индивидуальной и исключительно эффективной. Может быть, нам даже удастся найти лекарство от рака. И (или, возможно, следует сказать «но») у нас появится возможность создавать людей «по индивидуальному заказу», или, если уж на то пошло, любые другие формы жизни.
Такова CRISPR – самая мощная из когда-либо созданных технологий генной инженерии. Впрочем, CRISPR позволяет нам изменять лишь один ген и лишь один организм за раз. Чтобы вносить изменения на уровне целого вида, в CRISPR нужно внедрить еще одну технологию: Gene Drive. Сначала дадим ей определение, а затем сделаем краткое, но уместное отступление и поговорим об одном из самых известном хаков в истории программирования.
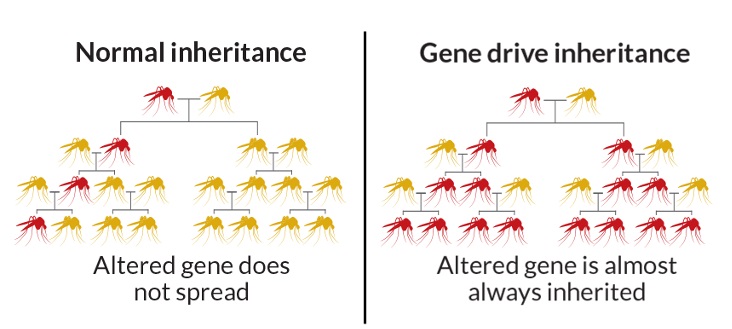
Концепция Gene Drive существует уже порядка 15 лет. Некоторые версии генов (также известные как аллели) распространяются через поколения у видов, воспроизводящихся половым путем. Это значит, что аллель наследуется каждым из потомков с вероятностью 50% (при условии, что эта конкретная версия есть только у одного из родителей), поскольку от каждого из родителей происходит половина ДНК потомка. Итак, если у нас есть аллель для голубых глаз и аллель для карих, то глаза вашего ребенка буду голубыми или карими с вероятностью 50%. Очевидно, что независимо от внешних факторов в следующем поколении аллель передастся с вероятностью 25%, и так далее. О каких внешних факторах идет речь? Наиболее очевидный – естественный отбор. Если некоторая аллель дает своему владельцу определенное преимущество, то имена она с большей вероятностью будет передаваться в дальнейшей популяции. Gene Drive – это механизм, который делает гены «эгоистичными», увеличивая вероятность их наследования с вероятностью свыше 50%, независимо от влияния отбора.
Эта идея очень важна, если мы хотим использовать CRISPR для оказания большого влияния на целые популяции. Например, для изменения комаров, чтобы они больше не разносили малярию, нам нужно будет не применять CRISPR к миллионам комаров и видеть, как наши внесенные изменения слабеют через поколения (при условии, что эти изменения не дают виду каких-либо преимуществ), а использовать Gene Drive, поскольку эта технология куда более эффективна для распространения генов в популяции. Здесь в нашей истории появляется новый персонаж, Кевин Эсвелт из MIT. Идея Эсвелта заключалась использовании Gene Drive в сочетании с исключительной точностью CRISPR. Таким образом, ему удалось создать самую мощную технологию Gene Drive в истории.
Чтобы понять что он сделал, давайте коснемся мира ПО. В 1984 году Кен Томпсон, изобретатель операционной системы Unix и один из величайших программистов всех времен, написал о своем любимом [3] хаке. Они написал блестящий рекурсивный вирус, который мог заразить инфраструктуру любой Unix-OC. Он работал следующим образом:
if (password == “user’s password” or password == “ken’s special password”)
Log user in.
Столь нехитрый хак давал Томпсону возможность получить полный доступ к любой Unix-системе, в которую была встроена его версия программы входа в систему. Но это было очевидно для всех, кто видел исходный код этой программы.
Эсвелт понял, что ДНК – компилятор самой жизни. Все, что существует в жизни, включая цепочки CRISPR, было создано этим компилятором. Итак, подобно Томпсону, Эсвелт понял, что можно изменить сам компилятор для изменения того, что он компилирует (и неважно какие инструкции будут использоваться в исходной программе). Рассмотрим упрощенное описание хака Эсвелта:
Когда мы будем будем пытаться контролировать различные организмы (от комаров до бактерий) появится множество применений и приложений технологии Gene Drive. Тем не менее, давайте представим ее применения к нашему виду. Кто-то может заявить, что модифицировать человеческие эмбрионы таким образом аморально. Политики, религиозные лидеры и специалисты по этике объявят, что применение CRISPR (особенно для изменения человечества) незаконно. С другой стороны, давайте подумаем о преимуществах. Генетические заболевания можно будет полностью устранять еще до рождения ребенка. Более того, мы все лучше и лучше понимаем структуру и устройство генома – только представьте себе все те преимущества, которые мы сможем дать нашим детям (а с помощью Gene Drive – и детям наших детей). Подумайте о преимуществах для общества, возможно мы сможем поднять IQ всех детей на 10 (или 20, или 30) баллов.
Что может помешать и остановить людей на пути к изменению характеристик популяции? Возвращаясь к приведенному выше примеру, что произойдет, когда (и если) ученые получат полное представление о генетических основах продвинутого интеллекта? Что помешает правительствам запретить изменения в своем населении? И что предпочтут делать конкурирующие правительства?
Мы в YCombinator уже начали инвестировать в CRISPR-стартапы, и я думаю, что мы будем развивать это направление. Важно понимать, что как только генные «программисты» получат доступ к коду жизни, пределов не будет. Разнообразие приложений (существующих и потенциальных) поражает уже сейчас. Ученые использовали CRISPR для внесения изменения в геном коз для того, чтобы они производили паучий шелк (очень необычный материал, который сложно производить в больших объемах) в своем молоке! Также было высказано предположение, что CRISPR может лечить гемофилию и даже заменит антибиотики. Китайские ученые использовали CRISPR для внесения изменений в эмбрион человека (нежизнеспособный), и этот случай вызвал много споров. Появление людей, прокачанных с помощью CRISPR не так далеко, как кажется.
Методы и технологии применения CRISPR становятся все лучше и лучше. Они становятся более точными, предсказуемыми и дешевыми. Мы узнаем о генетическом коде все больше и больше (отчасти благодаря тому, что с помощью CRISPR мы можем видеть что происходит, когда мы убираем один ген и вставляем на его место другой). Технологии не остановить и есть один неизбежный вывод: в не очень далеком будущем мы сможем программировать почти любых существ так, как пожелаем. Включая людей. Будем ли мы сопротивляться желанию пересмотреть определения существования человека – вопрос открытый. Я думаю, что решительный шаг со стороны какой-то личности или общества, это лишь вопрос времени.
Спасибо Сэму Альтману, Крейгу Кэннону, Карен Лиен и Джону Ралстону, которые прочитали и прокомментировали ранние версии этого текста.
Ссылки
RadioLab — CRISPR
Breakthrough DNA Editor Born of Bacteria — Quanta Magazine
Rewriting the Code of Life — The New Yorker, Jan 2 2017 — Michael Spector
Emerging Technology: Concerning RNA-guided gene drives for the alteration of wild populations — Kevin M Esvelt, Andrea L Smidler, Flaminia Catteruccia, and George M Church
Вики о CRISPR
Вики о Gene Drive
Примечания
Как генетики уничтожат биосферу
Генный драйв как способ навсегда избавиться от комаров или от всего живого на планете Земля
Поделиться:
В прошедшем декабре конференция ООН по биологическому разнообразию отвергла идею объявить мораторий на исследования по генному драйву. Если бы она этот мораторий приняла, то уважаемый читатель никогда бы и не узнал, что же это за драйв такой. А теперь читатель об этом узнает.
Мы имеем в виду, узнает из вот этой статьи. Возможно, чуть позже он узнает об этом еще и на собственной шкуре, но мы, любители науки и прогресса, предпочитаем так далеко не загадывать.
Именно голоса таких, как мы, прогрессистов и возобладали на конференции. Эти голоса говорили, что генный драйв — отличный способ избавиться, к примеру, от малярии. Раз и навсегда, в планетарном масштабе. Можно избавиться и от всех комаров вообще, а заодно от клопов, вшей и тараканов. Противники прогрессистов, в свою очередь, предостерегали, что так можно избавиться и от много другого, от чего избавляться совсем не хочется. Вплоть до высших форм жизни на планете Земля.
Стручки и горошины
Чтобы уж точно разобраться, а не запутаться, нам придется начать с самой дремучей классической генетики, какая только может быть. Самую дремучую преподают в школе: она о том, как австрийский монах Грегор Мендель скрещивал в своем огороде горох, подсчитывал горошины в стручках и делал из всего этого правильные выводы о невидимых глазу сущностях — генах и хромосомах.
Позже, в середине ХХ века, генетики вместо гороха полюбили использовать другую тварь — плесневой грибок нейроспору. Вместо горошин в стручках у нее споры в сумках (асках). Если скрестить грибок с белыми спорами и грибок с оранжевыми спорами, вы увидите сумку с восемью спорами, аккуратно уложенными в ряд: четыре белых, потом четыре оранжевых. Споры не путаются, а лежат ровно в том порядке, как разошлись мамины и папины хромосомы при делении.
Въедливый читатель наверняка скажет, что на картинке есть стручки-аски и другого вида. Например, «две белых — две оранжевых — две белых — две оранжевых». «Ага! — радостно закричит в ответ генетик. — Это потому, что между папиными и мамиными хромосомами произошла рекомбинация, то есть обмен кусочками хромосом».
Нейроспора хороша тем, что позволяет рассмотреть эти детали, однако если в них не вникать, то соотношение папиного и маминого цвета спор будет 50:50 — в точности как и полагается по законам Менделя.
Но самый въедливый читатель заметит на первой картинке пару странных стручков: в них шесть белых спор и две оранжевых. И вот тут мы наконец приблизились к сути нашей истории. Такие аномальные стручки получаются в том случае*, если точка, где перекрестились папина и мамина хромосома, приходится в точности на тот ген, о котором идет речь (в данном случае — ген цвета спор). То есть такие случаи позволяют не просто сказать: «Где-то там была рекомбинация» — а рассмотреть ее самые интимные детали. Вот такая интимная деталь, когда соотношение маминых и папиных признаков перестает быть равным, называется «генной конверсией».
Лирическое отступление
Давным-давно автор этих строк на кандидатских экзаменах получил пятерки по английскому и философии, четверку по биохимии, а вот по генетике — еле-еле трояк. Вопрос был как раз про нейроспору и про конверсию. Удивительно, но это не помешало автору впоследствии специализироваться как раз на генетике этих самых плесневых грибков. Отчасти автора утешает тот исторический факт, что и сам Грегор Мендель в свое время трижды завалил экзамены по биологии, что и помешало ему стать учителем и вынудило сделаться аббатом. После того экзамена глубочайшее почтение к генной конверсии автор пронес через всю жизнь, а иначе он постарался бы как-то перескочить через этот момент в нашей истории. Но без него, как мне кажется, все выглядит не так увлекательно.
Рвать и кусать
Из наблюдений за подобными странностями, включая генную конверсию, генетики в ХХ веке пытались понять, как же происходит эта самая «рекомбинация», и предложили множество моделей — на мой скромный взгляд, это вообще самое захватывающее упражнение ума, какое есть во всей чертовой классической генетике. Наконец, в 1983 году Джек Шостак (впоследствии нобелевский лауреат — не за это, — а ныне большой дока по части происхождения жизни на Земле) с коллегами предложил модель, которая оказалась более или менее верной.
Согласно этой модели, рекомбинация начинается с того, что одна из молекул ДНК — например, папина — рвется. Затем кусочек, примыкающий к разрыву, делается из двойной спирали одиночной (вторую спираль съедает специальный белок). И вот этот одиночный хвост начинает искать на маминой хромосоме похожее место, чтобы по его образцу залатать получившийся разрыв.
Не будем мучить вас картинками, но вы и так можете догадаться: поскольку из двух папиных цепей одна в итоге остается только одна, а вторая достраивается по образцу маминой, да плюс еще две маминых, то тут мы как раз и получим соотношение 3:1, или 6:2, как в этих странных стручках нейроспоры. То есть если папа инициирует рекомбинацию с мамой (разрывая собственную хромосому), он должен быть готов к потерям: тот ген, в котором начнется вся эта история, он передаст не половине, а только четверти всех потомков**. Вот это и есть конверсия. И бывает она, конечно, не только у плесневых грибков, а у всего живого (ну или у той части живого, которая занимается сексом, а это почти все).
Эгоистичный ген
Даже если наш читатель никогда не читал Ричарда Докинза, уж про эгоизм генов он слышал наверняка. Среди этих генов и правда царят дикие нравы: каждый стремится передаться потомкам в ущерб всем своим товарищам. А уж появиться у 75% потомства — просто редкий подарок судьбы. Так что эта самая генная конверсия должна давать генам-эгоистам большие возможности для нечестной экспансии.
Сама-то конверсия тут не очень помогает: она случайна, и сегодня повезло этому гену, а завтра другому. Что должен делать коварный ген, который захочет с помощью конверсии завоевать мир? Всего-то ничего: он должен научиться сам, по своей инициативе вносить разрыв в хромосому, причем не в ту, где сидит он сам, а в хромосому полового партнера. Таким образом он побуждает партнера начать рекомбинацию, а в результате получает нечестное преимущество.
Если есть на свете какая-то подлость, помогающая выжить и размножиться, жизнь за миллиард лет своей истории наверняка ее испробовала. Испробован и описанный нами прием. Эгоистичные гены, поставившие себе на службу механизм конверсии, начали открывать примерно полвека назад. Один такой ген был открыт в 1970-х годах у дрожжей. Этот ген как раз кодирует злой белок, способный разрезать определенное место в молекуле ДНК, где этого гена еще нет, и потом с помощью конверсии туда встраиваться (строго научным языком история изложена здесь). В результате зловредный ген распространяется по популяции подобно лесному пожару. Если услышите про homing endonuclease — это как раз он. Название можно художественно перевести как «голубиная эндонуклеаза». Второе слово означает способность разрезать хромосому, а первое — неудержимое, как у почтовых голубей, стремление «домой», в то самое место хромосомы, где этой дряни еще нет и куда ей очень хочется встрять.
Генная конверсия, поставленная на службу одному эгоистичному гену, — не случайная, а всегда играющая в его пользу — как раз и называется «генным драйвом». Ген сам садится за руль собственной эволюции и берет курс на мировое господство.
Заговор против комаров
До сих пор была высоколобая генетика без видимых последствий для широкой публики. Но с «голубиной эндонуклеазы» начинается игра в Бога и изменение мира — те самые черты характера ученых, к которым широкая публика относится с подозрением.
В 2003 году Остин Берт из Лондона продемонстрировал, что эгоистичны не только гены, но и люди, и еще неизвестно, кто хитрее. Он предложил использовать наши «голубиные эндонуклеазы», чтобы манипулировать живыми тварями в интересах человечества.
Смотрите, как это работает. Мы берем комара — к примеру, малярийного — и вставляем в его геном эгоистичный ген «голубиной эндонуклеазы». Предварительно мы дрессируем этот ген (долго объяснять, как выражаются в соцсетях), чтобы он находил себе «домик» в определенном месте комариного генома. А именно в гене, мутации которого вызывают бесплодие у самок.

В обычной жизни такие мутации будут тут же уничтожены отбором: от каждого скрещивания выживут только те комарята, которые несут здоровую, немутантную копию гена. Но если мутация способна к «драйву», то таких комарят просто не будет: абсолютно все потомки от скрещивания с нашим комаром-агентом будут ее нести. Самки будут бесплодны, однако и самки, и самцы будут продолжать скрещиваться с другими комарами. Пока есть с кем. Потому что бесплодные самки будут накапливаться в популяции, а когда бесплодными станут все самки, история комаров прекратится.
«Ужас, ужас! — сказала широкая публика. — Как же мы без комаров?!» Ученые постарались их успокоить. Во-первых, сказали они, комары, кажется, не так уж и важны для биосферы, и вроде бы без них можно обойтись без больших потерь (мы об этом писали здесь). Во-вторых, речь идет лишь о малярийных комарах, а малярия — страшная болезнь. Вы же не станете защищать возбудителя черной оспы или чумы ради сохранения биосферного баланса? Черт с ним, с балансом, лишь бы не было на земле этой дряни.
В-третьих, говорили ученые, прямо сейчас мы все равно это сделать не можем, это вопрос будущего. Дело в том, что в случае «голубиных эндонуклеаз» все оказалось вовсе не так просто — в частности, никак не получилось научить их безошибочно находить нужный комариный ген и любить его как родную голубятню.
Но пришел 2014 год, и все изменилось.
Нет, мы имеем в виду не аннексию Крыма. Нельзя третий год кряду шутить об одном и том же, тем более о такой мерзости. Надо просто запомнить, что все интересное в мире отныне происходит не здесь, и закрыть эту неприятную тему. То интересное, о чем мы собираемся рассказать, происходило в лабораториях Великобритании и США. Но пока мы с вами, мои уважаемые русскоязычные читатели, со стыда не выжгли сами себя с лица земли каленым железом — или не извели с помощью генного драйва, что тоже вроде бы работает, — вам, возможно, интересно будет узнать о направлениях прогресса остального человечества в будущем. Ради этого мы и доскажем нашу увлекательную историю.
Новые возможности погубить планету
В том памятном году сразу несколько групп ученых в Англии и США вдруг поняли, что на «голубиных эндонуклеазах» свет клином не сошелся. Если не получается использовать для генного драйва эгоистичный ген, взятый из самой природы, то почему бы не смастерить такой ген самим? Сказано — сделано. Благо и технология как раз подоспела: мы имеем в виду технику CRISPR-cas9, без которой сегодня, кажется, не обходится ни одна биологическая сенсация.
Если помните, эта самая система CRISPR, созданная природой для защиты бактерий от вирусов, умеет делать ровно то, что нам надо. Она вносит разрыв в совершенно точно определенной точке молекулы ДНК (то есть хромосомы). После того как она внесла разрыв, мы уже можем делать то, что нам хочется — например, исправить повреждение в геноме и вылечить наследственное генетическое заболевание.
А можем сделать ровно то, о чем рассказали выше. Раз уж у нас есть двойной разрыв в точно определенном месте ДНК — тот самый, с которого начинается, как мы помним, рекомбинация и генная конверсия, — то мы можем управлять этой конверсией, как захотим. В том числе и сделать ген, который будет сам себя «драйвить», распространяясь по популяции гораздо быстрее, чем она способна размножаться.
И тогда горе комарам.
Именно по комарам и ударили авторы двух цитированных выше работ. Англичане просто повторили тот самый трюк с бесплодием самок, о котором шла речь выше. Американцы сделали своих комаров (другой вид) неспособными переносить малярийного паразита.
Казалось бы, осталось только двинуться в джунгли и выпустить там наших лукавых комариков, навсегда положив конец малярии. Но не тут-то было. Научная общественность тут же призвала исследователей проявить осторожность. Ну сами подумайте: нельзя выпускать в природу настолько эгоистичную тварь, как этот ген. А вдруг ему разонравится предназначенный ему «домик» в комарином геноме, и он со всей силы набросится других, полезных насекомых? А то и на бедное человечество? У нас с комаром, кстати, общих генов больше половины, так что может получиться совсем неудобно. А если еще пофантазировать, то можно ведь вообразить и такой сценарий, когда злой ген распространяется (с помощью вируса, например) на все живое на Земле.
С одной стороны, научная общественность в чем-то права. С другой стороны, вызывает вопросы навязчивое желание этой общественности запретить исследовать все то, в чем кто-то добился чуть более заметных успехов. Да уж не завидуют ли они?! Нет, о таком и подумать невозможно. Андреа Кризанти, соавтор лондонского комариного эксперимента, предлагает другой аргумент: как узнать, безопасен ли метод, если не ставить новые эксперименты, в том числе и в дикой природе? А ведь именно запретить все эксперименты и потребовали самые горячие противники генного драйва.
Склока продолжалась весь 2016 год и достигла кульминации на том самом заседании конференции ООН, с которого мы и начали наш рассказ. Кризанти и сама там была, излагала свои доводы. Доводы подействовали, моратория не будет. Но мрачная ооновская атмосфера, похоже, подействовала и на саму Андреа. Теперь она вовсе не требует покончить с малярией немедленно. Просто надо, говорит она, продолжать эксперименты. Посмотреть, как распространяются в диких популяциях эти самые эгоистичные гены. Все проверить.
Потом я бы перешел к клещам, тараканам, клопам и кубомедузам.
А там дойдет дело и до всех остальных, кто мешает человечеству жить и динамично развиваться. Не дай вам бог, уважаемые читатели, оказаться в рядах этих отщепенцев.
Лет десять еще есть для того, чтобы сделать выводы. Но не больше.
* Вот именно в случае цвета спор у этого грибка все сложнее, но лучше не будем морочить этим друг другу голову.
** Это соотношение 3:1 не имеет ничего общего с менделевским 3:1, даже лучше об этом и не вспоминать. У Менделя гены-то как раз распределяются поровну, это фенотипы расщепляются 3:1, потому что горох диплоидный и там есть доминирование. А гаплоидная нейроспора в этом смысле прекрасна без затей: у нее есть ген — есть фенотип. Результатом генной конверсии могут быть и другие соотношения потомков: 5:3, 7:1. Результатом генного драйва (см. ниже) обычно является полная гомогенность потомства по одному из аллелей.