Генномодифицированные люди что это
ГМО-люди – будущее биотехнологий уже здесь

Интересно, чем закончатся наши исследования
Кажется, прошлая тема про ГМО-лосося весьма неплохо зашла Хабрачитателям. Пока мы готовим материал по модификации растений, я предлагаю посмотреть не менее интересную тему — генная модификация Homo Sapiens. Это очень спорная и холиварная тема, игнорировать которую бесполезно.
Сразу дам несколько тезисов, которые могут показаться спорными, но которые так или иначе надо решать в научном сообществе:
Что такое генотерапия
Давайте для начала определимся с терминологией. Генотерапия — это вмешательство в геном человека с целью лечения тех или иных заболеваний. Причем, вмешательство идет только в соматические клетки. Это те клетки, которые не участвуют в размножении. Нам явно не надо какие-то мутации и багфиксы закреплять в новых поколениях. Пока, по крайней мере.
Реальные эксперименты на животных начались примерно в 1980-х годах, но тогда это были только робкие шаги. Всякого рода красоты вроде ДНК-принтеров, экспрессирующихся векторов для эукариотов у нас не было.
Куда мы реально можем вмешаться?
Плазмиды
Для начала можно не трогать ядро клетки, которое содержит основную генетическую информацию. Можно воспользоваться плазмидами. 
1) Хромосомная ДНК бактерии 2) Плазмиды
Плазмиды — это почти исключительно бактериальная штука. Иногда встречаются у примитивных грибов и некоторых растений. По сути, это ДНК, но свернутая в кольцо и плавающая отдельно в цитоплазме. То есть такой отдельный механизм для хранения генетического материала. Для бактерий они очень важны для передачи положительных мутаций, например, чтобы «рассказать соседям» о вариантах защиты от антибиотика. Фишка плазмид при использовании у людей в том, что они разваливаются сами по себе через какое-то время после введения в клетку. А еще они не затрагивают основной генетический аппарат клетки. То есть основную прошивку не затронет.
Патчим kernel
Далее, у нас есть возможность непосредственно отредактировать фрагмент кода в ядре. Это более инвазивная процедура и она уже сопряжена с рисками неточной вставки или вырезания кусочка ДНК. Но это практически единственный вариант радикально починить какой-то тяжелый генетический дефект, так как соматические клетки будут делиться и передавать пропатченную версию ДНК своим потомкам.
Митохондрии
Митохондрии — это что-то вроде атомных реакторов в клетке. Потребляют жирные кислоты и глюкозу, а на выходе штампуют макроэрги — вещества с высокой энергией связи. Например, АТФ. Это универсальное «топливо» для всех активных реакций, например для работы осмотических мембранных насосов против градиента концентрации.
У них есть особенность — свой собственный генетический аппарат. Собственно, они на полуавтономных симбионтов похожи именно поэтому. Их генетический аппарат имеет смысл править при врожденных мутациях в митохондриальной ДНК. Обычно это тоже очень тяжелые врожденные синдромы.
Вирусный вектор — это как шприц
Первый ключевой момент — разработка инструментария доставки — вирусных векторов. Первый такой вирус для млекопитающих был разработан в 1984 году. В качестве молекулярного шприца использовали мышиный ретровирус. Он сам по себе являлся весьма неприятным инструментом, так как с высокой вероятностью провоцировал онкологические заболевания. Собственно, его второе название murine leukemia virus (MLVs). В дальнейшем разработки перешли на более безопасные варианты.
Что вообще такое вирусный вектор? Это такой специально модифицированный вирус, который срабатывает только один раз. Как шприц. Для этого он должен отвечать нескольким критериям:
Безопасность
Вирусный вектор не должен иметь возможность самопроизвольно размножаться. Для этого у них есть встроенный kill-switch. Их геном изначально так поврежден, что автономно размножаться они не могут. В лабораторной среде они размножаются на культуре клеток только в присутствии незаменимых компонентов и дополнительных вспомогательных вирусов, которые производят часть нужных для сборки белков. То есть в культуральном флаконе лаборатории размножается, а в организме срабатывает один раз, выходит из клетки в полусобранном виде и умирает.
Низкая цитотоксичность
Многие вирусы очень жестоко обращаются с клетками носителя. После фазы инкубации клетка дохнет от истощения и из ее бренных останков во все стороны разлетаются новые вирионы. При этом есть и вирусы, которые особо не влияют на нормальную физиологию клеток, на которых паразитируют. Например, аденовирусы.
Стабильность
Вирусы должны быть генетически стабильны. Например, грипп не подойдет. Он вообще не имеет внятных механизмов «контроля четности» и ему все равно, что хеш после копирования не сошелся. Это его эволюционная стратегия. Те же коронавирусы, напротив имеют механизмы контроля и репарации, что дает большую стабильность генетического материала. Хотя их не используют как вектор по другим причинам. Таким образом, задача состоит в том, чтобы вирус в процессе своего размножения в биореакторах сохранил тот самый payload — полезную нагрузку без изменений.
Специфичность типа клеток
Вирус должен доставить свою нагрузку не абы куда, а точно в конкретный тип клеток. Это значит, что если нам надо вылечить заболевание, связанное с дефектными эритроцитами, то вирус должен очень точно поражать именно мультипотентные стволовые клетки-предшественники клеток крови. И при этом не зацепить, например, мышечную ткань.
Что уже реально делают в плане генотерапии
Первая генетическая коррекция человека была проведена в 1990 году.Четырёхлетняя Ашанти ДеСильва получила лечение от тяжелого генетического дефекта сложного комбинированного иммунодефицита, связанного с недостатком фермента ADA. Надо отметить, что редактировали не геном стволовых клеток, которые производят Т-лимфоциты, а уже взрослые Т-клетки из ее же собственной донорской крови. То есть она нуждалась в повторении этих процедур в дальнейшем. Далее была серия успешных экспериментальных протоколов для лечения SCID (Severe combined immunodeficiency) по схожей методике.
В 1999 году произошел инцидент, который ощутимо затормозил исследования в этой области. Джесси Гелсинджер, страдал от генетического заболевания печени, из-за которого она была неспособна обезвреживать аммиак. Через 4 суток после введения аденовирусного вектора со здоровой копией гена он умер в результате гипериммунного ответа и полиорганной недостаточности. В дальнейшем FDA пришли к выводу о многочисленных нарушениях в протоколе исследования.
В 2006 появились первые сообщения об удачных протоколах индивидуальной генотерапии для лечения онкологии. Т-киллеры программируются на конкретный вид опухоли и затем выпускаются в организм пациента.
В 2011 году признали терапию ВИЧ у пациента Геро Хюттера в 2008 году. Метод не особо применим для широкой аудитории, так как требует полного удаления своего костного мозга, а затем имплантация скорректированных клеток с двойной дельта-32 мутацией, которая отключает рецептор CCR5.
К 2013 году в мире было разрешено всего пять генных препаратов. Три от онкологии, глибера для лечения наследственного дефицита липопротеинлипазы и неоваскулген. Последний, кстати, разработали полностью у нас.
Неоваскулген
Результаты лечения Неоваскулгеном.
Этот препарат относится к плазмидным, то есть он не редактирует свой геном клетки, а только доставляет в нее плазмиды, которые работают ограниченное время.
Препарат представляет собой кольцевую ДНК (плазмиду), несущую человеческий ген VEGF 165, кодирующий синтез фактора роста эндотелия сосудов (VEGF — Vascular Endothelial Growth Factor). Стимулируя образование и рост коллатеральных сосудов, Неоваскулген призван оказать длительный лечебный эффект и улучшить качество жизни пациентов. Развитие микроциркуляторного русла в ишемизированной ткани нижней конечности способствует насыщению тканей кислородом, заживлению язв, увеличивает дистанцию безболевой ходьбы.
Механизм действия интересный. Клетки в месте инъекции начинают синтезировать VEGF — это фактор роста сосудов. В результате, в этом участке начинает нарастать новая разветвленная капиллярная сеть. Это критично для пациентов с хронической ишемией нижних конечностей из-за диабета и атеросклероза, например. До этого препарата ампутаций было больше. Сейчас его протестировали еще и для использования в стоматологии для приживления имплантов.
Генопрепарат смешивают с костным материалом и ушивают. В итоге сосуды быстро прорастают и формируется нужная ткань без отторжения. На кроликах уже точно моделировали при трансплантации фрагментов черепа. Люди на очереди, насколько мне известно.
Zolgensma
Спинальная мышечная атрофия — заболевание очень мрачное, по клинике отчасти похожее на боковой амиотрофический склероз, которым страдал Хокинг, но имеет другие причины. В результате развития заболевания прогрессирует паралич, который заканчивается смертью из-за невозможности дышать.
Zolgensma — это первый лекарственный препарат для генной терапии спинальной мышечной атрофии. Выпускается компанией AveXis (Novartis). Рабочая копия гена SMN вводится с помощью аденоассоциированного вируса (AAV) серотипа 9, AAV9, который способен преодолевать гематоэнцефалический барьер и проникать в клетки пациента. Одна проблема — стоит совершенно чудовищных денег. Одна инъекция стоит больше 2,1 миллиона долларов (около 152 миллионов рублей). Но результаты тоже потрясающие. У людей восстанавливается моторная функция и в дальнейшем заболевание не прогрессирует. По идее, такие дорогостоящие манипуляции должно оплачивать государство. Для отдельных людей стоимость лечения редких заболеваний просто неподъемная.
Что дальше?
Вот тут вопрос очень сложный. Мы действительно накапливаем дефектные гены в популяции. Раньше ребенок с пороком сердца бы просто умер — сейчас его спасут и он даст потомство с этим дефектом. Раньше много беременностей не сохранялось — сейчас беременных вытягивают с минимальным процентом выкидышей и завершают успешными родами. По сути, мы ломаем механизмы естественной выбраковки популяции. Это правильно и гуманно, но что-то надо делать с накапливающимися мутациями генофонда.
Либо мы придем к зеленым карточкам и разрешениям на размножение, либо научимся надежно и безопасно исправлять генетические аномалии. Было бы круто выкинуть близорукость, системную дисплазию соединительной ткани и кучу других врожденных дефектов. А еще наконец починить этот дурацкий сломанный ген, отвечающий за синтез витамина С из глюкозы, как у всех нормальных млекопитающих.
Вот только дальше нас ждет неизвестное будущее. Больше всего настораживает потенциальное расслоение общества, когда самые богатые слои населения будут модифицировать своих детей на отсутствие сахарного диабета, атеросклероза, а заодно еще и задавить немного миостатин, чтобы выглядели атлетичными без особых усилий. Круто же. Но пугает.
Человек генно-модифицированный / Homo genere mutatio
Человек генно-модифицированный / Homo genere mutatio
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Когда Олдос Хаксли писал «Дивный новый мир», думал ли он, что на самом деле может наступить эра детей, созданных по заказу? «Дети здесь не рождаются. Их выращивают в специальных инкубаторах и делят на альфы, беты, гаммы, дельты и эпсилоны в зависимости от умственных способностей». На сегодняшний день вряд ли найдется более рьяно обсуждаемая в СМИ тема биомедицины, чем CRISPR/Cas. СМИ готовят общество к появлению в будущем фабрик по производству детей на заказ, ученые — к возможности создания генетической панацеи. Исследования на человеческих эмбрионах с применением генетических модификаций лишь подливают масла в огонь. Общественность строит догадки, какие перспективы дает этот инструмент генного редактирования в руках ученых. Ждет ли мир появление «отредактированных» людей? Станет ли Homo genere mutatio в эволюционный ряд после Homo sapiens sapiens? К чему бы ни привела технология CRISPR/Cas, несомненно, что это шаг в бездну новых возможностей.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Биомедицина сегодня и завтра» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Что такое CRISPR/Cas9 и с чем его едят
Хотя система CRISPR известна с 1980-х, активно о ней заговорили лишь несколько лет назад [1]. Повышенное внимание к технологии генной модификации связано с перспективами, которые она открывает. В частности, лечение генетических заболеваний. Это может изменить медицину. Освоение CRISPR/Cas9 в рамках человеческого тела подобно первым шагам в космосе.
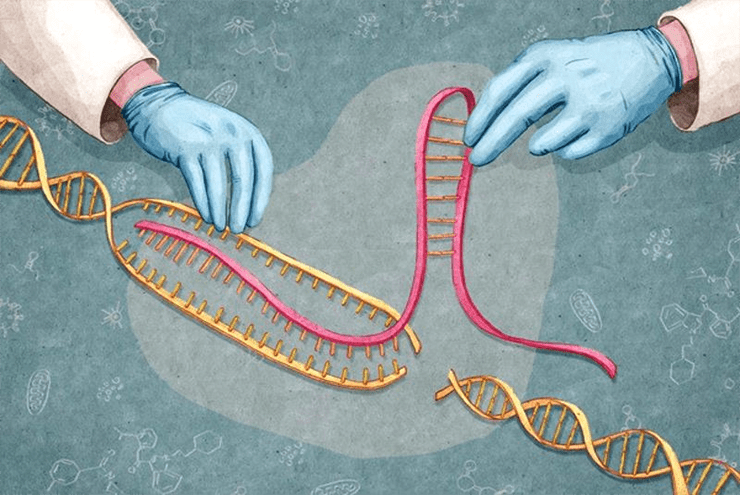
Технология CRISPR (от англ. Clustered Regularly Interspaced Short Palindromic Repeats — короткие палиндромные повторы, регулярно расположенные группами) основана на направленном редактировании генома с помощью эндонуклеазы Cas9. Словно умные ножницы, фермент Cas9 совершает двунитевые разрезы в нужных участках гена, удаляя дефекты генетической информации (рис. 1). После того как разрыв внесен, включаются системы восстановления ДНК, и нужная неповрежденная последовательность встает на место удаленной дефектной [2].
Рисунок 1. Схема работы CRISPR/Cas9.
Это уже не совсем так. В начале ноября 2017 года появилось сообщение о том, что мальчику, больному буллезным эпидермолизом, заменили 80% площади кожи на трансплантаты из его собственных клеток, в которых дефектный ген, вызывающий болезнь, заменили нормальным. — Ред.
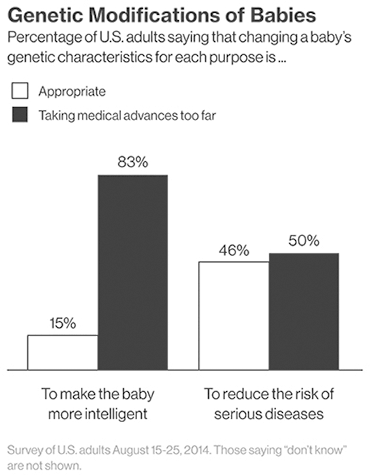
Рисунок 2. Общественное мнение относительно технологии CRISPR/Cas9.
Другой стороной медали может стать использование технологии не по задуманному назначению. Общество страшится появления «дизайнерских» детей, сделанных на заказ родителями. Проведенный опрос среди американцев говорит о том, что люди еще не готовы принять возможности генной терапии. Так, 83% респондентов не хотят использовать технологию для совершенствования детей (рис 2).
Еще один шаг к совершенству
Однако технология генного «ремонтирования» не без изъянов. Она не доведена до совершенства. CRISPR/Cas9 — это не волшебная палочка, призванная исправлять любой генетический дефект. Генетический скальпель не отличается высоким уровнем точности. Эндонуклеаза может совершить разрезы и в нецелевых участках. При этом система CRISPR/Cas9 может не исправлять мутации, как задумывалось, а создавать новые.
Отсутствие стопроцентной точности в работе эндонуклеазы Cas9 делает технологию небезопасной и ненадежной. Пока система не станет более точной, она не получит широкое распространение в практической медицине. Однако маленькие шаги в сторону реальности метода совершаются. Работа ученых из Массачусетского технологического института выводит технологию CRISPR на новый уровень посредством создания улучшенной версии фермента — eSpCas9.
eSpCas9 имеет повышенную специфичность, что снижает вероятность побочных эффектов при редактировании генома. Разрезы этого фермента более точные. Это позволило снизить риск вероятных ошибок примерно в 10 раз. Несомненно, такое открытие — настоящий прорыв для генного редактирования. Оно стало более специфичным и точным, а значит, стало ближе к практической медицине, чем когда-либо [3].
Первый блин комом
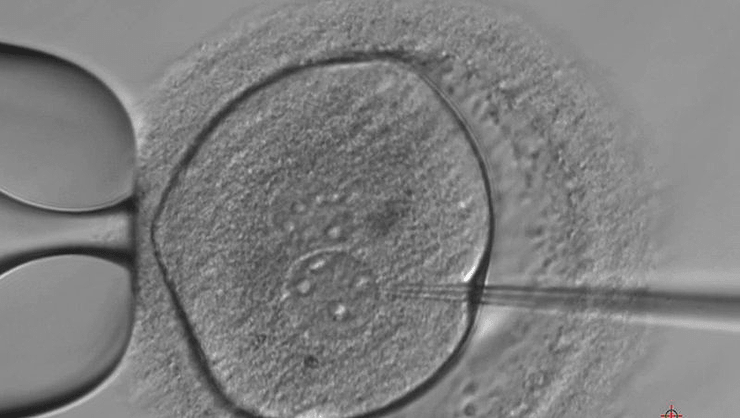
В апреле 2015 года мир должен был ахнуть от удивления: впервые ученым удалось не просто прочитать, а еще и отредактировать геном человека (рис. 3). Удивительно, но это событие не привлекло к себе много внимания. Такие авторитетные издания, как Nature и Science, не пожелали публиковать данные об исследовании ввиду его неэтичности. Связано это с тем, что впервые методику генного редактирования CRISPR/Cas9 проверили на человеческих эмбрионах [4].
Рисунок 3. Человеческие эмбрионы с отредактированным геномом.
Китайские ученые из университета Гуанчжоу использовали нежизнеспособные эмбрионы. Их получили посредством ЭКО. На этапе их образования произошел сбой, который привел к формированию трипронуклеарных эмбрионов, которые содержат не два пронуклеуса — материнский и отцовский, — а три. Такие зародыши обычно погибают еще до имплантации и нежизнеспособны: они содержат аномальный тройной набор хромосом (69 шт.), тогда как в норме кариотип составляют 46 [5]. Лишние 23 хромосомы не дают плоду развиваться нормально, что приводит к его гибели [6].
Перед учеными не стояла задача продлить время жизни трипронуклеарных эмбрионов. Их целью было осуществить генный нокаут бета-талассемии, которой страдали эмбрионы. Задумку не вполне удалось реализовать. Из 86-и лишь полсотни эмбрионов удалось протестировать. Генная модификация произошла в 28 зародышах, но почти во всех случаях — не такая, как надо, или в неправильном месте. Дефектный ген бета-талассемии был успешно удален из клеток лишь четырех эмбрионов.
Эксперимент не только не принес ожидаемого эффекта, но и создал новые непредвиденные мутации в геноме множества клеток. По словам лидера научной группы, использованная технология пока слишком «сырая». Она не может быть использована на нормальных эмбрионах. Чтобы приступить к ее клиническому использованию, процент успеха должен приближаться к 100.
Модификация людей одобрена законом
Официальное разрешение от вневедомственного органа Министерства здравоохранения Соединенного Королевства — HFEA (Human fertilisation and embryology authority) — на редактирование человеческих эмбрионов с помощью технологии CRISPR/Cas9 в 2016 году получила исследовательская группа из Института Фрэнсиса Крика в Великобритании под руководством биолога Кэти Ниакан. В качестве объекта исследования будут использоваться лишние эмбрионы, которые получают при ЭКО, — те, что оказались не нужны семьям ввиду свершившегося успешного подсаживания других зародышей. Раньше такой материал просто утилизировали за ненадобностью.
Это первое разрешение на подобную деятельность в Великобритании, и ученых не ждет полная свобода действий. Эмбрионы могут быть использованы лишь для определенных целей, которые будут оценены экспертной комиссией (рис. 4). Применять можно семидневные эмбрионы. Срок жизни объектов исследования после начала эксперимента — 14 дней. После этого они должны быть утилизированы. Подсаживание их к суррогатной матери исключено. Пролонгировать беременность генномодифицированными эмбрионами запрещено [7].
Рисунок 4. Человеческому эмбриону вводят отредактированную ДНК в лондонской лаборатории Института Фрэнсиса Крика.
Успех CRISPR/Cas9
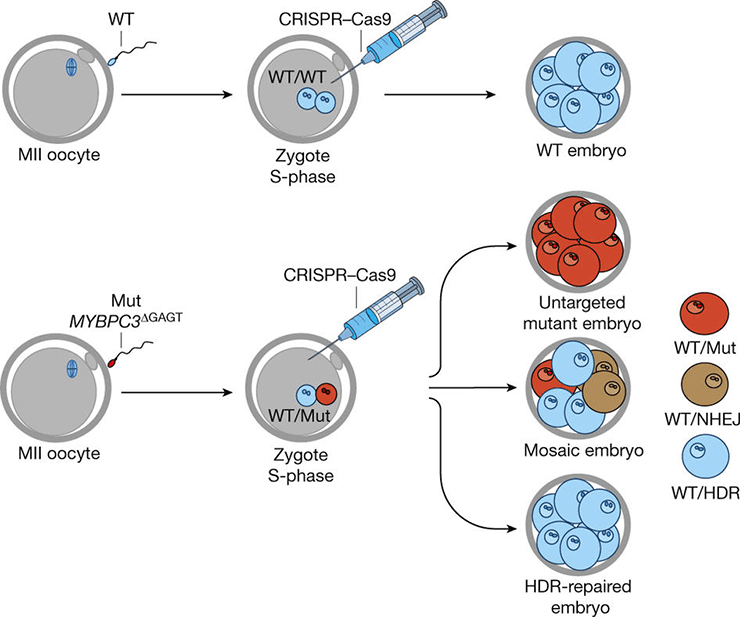
Первые полосы научных журналов в августе 2017 года вновь украшала аббревиатура CRISPR/Cas9. На этот раз новостями об успешном эксперименте спешили поделиться ученые из Орегонского университета здоровья и науки (OHSU). Группа ученых во главе с уроженцем Казахстана Шухратом Миталиповым применили технологии редактирования генов CRISPR/Cas9, чтобы изменить ДНК больных человеческих эмбрионов [8].
Среди безумного моря наследственных патологий выбор объекта исследования пал на гипертрофическую кардиомиопатию. Это серьезное генетическое заболевание сердца с аутосомно-доминантным типом наследования. Это значит, что патология проявится при наличии хотя бы одной дефектной копии гена. При этом данный ген не сцеплен с половой хромосомой, поэтому встречается как у мужчин, так и у женщин.
Особенно часто заболевание поражает молодых спортсменов [9]. Технология CRISPR/Cas9 позволила группе ученых отредактировать дефектный ген. В исследовании использовали 12 здоровых яйцеклеток и сперму, несущую мутантный ген MYBPC3. С помощью CRISPR/Cas9 из ДНК сперматозоидов удалось вырезать дефект, словно ножницами (рис. 5) [10].
Рисунок 5. Схема воздействия CRISPR/Cas9 на ген MYBPC3.
В результате получили 42 здоровых эмбриона из 58-и. Это составило 72,4% потомства без патологии. Такие результаты оказались довольно успешными по сравнению с полученными ранее при других исследованиях с CRISPR/Cas9 на эмбрионах с генетическими заболеваниями. Улучшение показателей, их приближение к ста процентам, дает надежду на лечение наследственных болезней в ближайшем будущем.
«Мы продемонстрировали возможность исправлять мутации в человеческом эмбрионе безопасным способом и с заметной степенью эффективности», — говорит один из руководителей проекта, Хуан Карлос Бельмонте.
Что может предложить миру CRISPR/Cas9
Каждое крупное открытие в истории человечества встречало сопротивление. С этим столкнулись и Галилео Галилей, и Джордано Бруно, и Парацельс, и Игнац Земмельвейс, осмеянный за свое предложение мыть врачам руки перед осмотром больных. Мир с трудом принимает новые открытия. Сотни известных имен стали признанными лишь после смерти и были гонимы за свои убеждения при жизни.
Инквизиция и научное невежество остались далеко позади. Сегодня медицина развивается очень быстро — в сравнении с минувшими столетиями она движется семимильными шагами. Несомненно, CRISPR/Cas9 станет одним из важнейших биотехнологических открытий XXI века. Что же может предложить миру эта технология?
Рисунок 6. Руками врача буквально лечится геном.
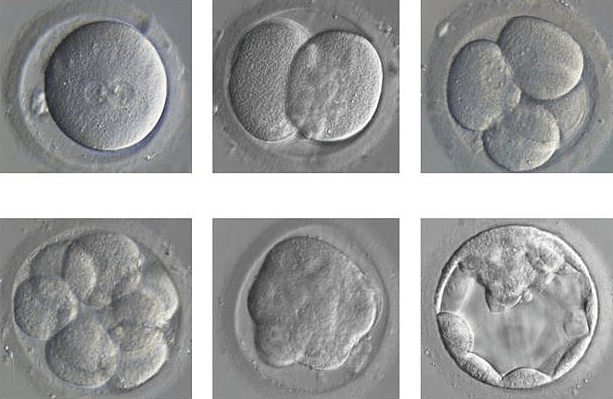
Рисунок 7. Развитие эмбриона из одного оплодотворенного яйца до бластоцисты.
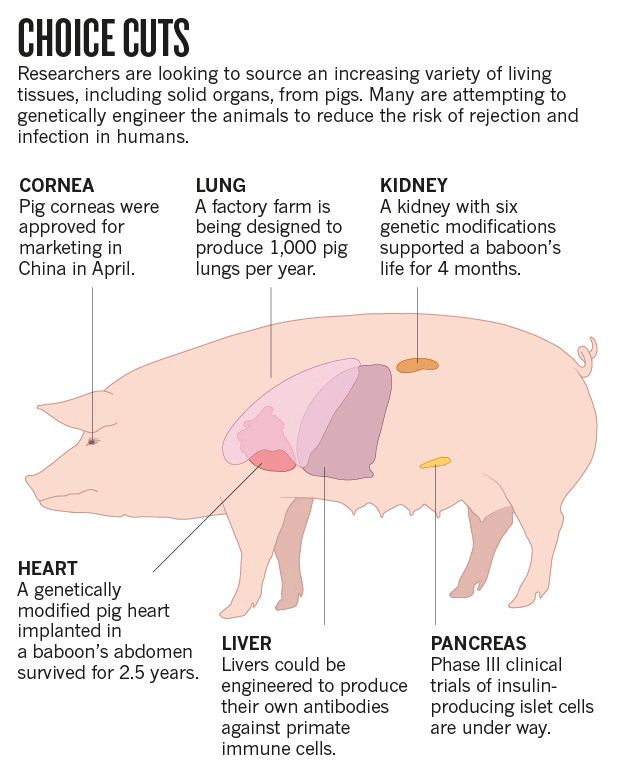
Рисунок 8. Схема возможного использования органов свиней.
Рисунок 9. ГМ-пища.
Рисунок 10. Схематичное изображение «дизайнерского» ребенка.
Тем не менее случайные мутации, которые ненароком могут появиться при редактировании генома, потенциально могут быть еще опаснее, чем имеющиеся (рис. 11).
Рисунок 11. Схематичное изображение гена с опасной мутацией.
Этично ли редактировать людей?
CRISPR/Cas9 предстоит преодолеть не только технические трудности, которые требуют приближенного к ста процентам результата для внедрения в практическую медицину, но и этические (рис. 12). Насколько нравственно редактировать геном человека, данный ему при рождении? Можем ли мы вмешиваться в работу природы и модифицировать ее по своему усмотрению?
Рисунок 12. Обложка книги профессора Калифорнийского университета Пола Кнопфлера — GMO sapiens.
Международный мораторий на опыты над людьми говорит сам за себя. А проведенные на данный момент исследования имели четкие рамки, закрепленные законодательно. Вынашивание и рождение «редактированного ребенка» в таких условиях невозможно.
По мнению биоэтика из Университета Висконсина в Мэдисоне Альты Чаро, «дизайнерские дети» — сомнительная перспектива для CRISPR/Cas9. Исследовав положение дел с технологией генной модификации, она сделала заявление: «Озабоченность по поводу проведенных экспериментов раздута. Это увлекательный, важный и достаточно внушительный шаг к изучению правильного редактирования эмбрионов. Независимо от беспокойных предположений, это не начало эпохи „дизайнерских детей“. Наследование таких признаков, как интеллект или атлетизм, определено множеством генов. Разгадать каждый из них и спроектировать ребенка не представляется возможным» [19].
Что же принесет миру технология генного редактирования CRISPR/Cas9 — пользу или вред? Однозначного ответа на этот вопрос не даст никто. Хотя практической пользы от технологии пока получено не было, то будущее, которое рисует CRISPR/Cas9 в рамках биомедицины, рано или поздно наступит. И нам откроется возможность узреть и понять этот новый и смелый отредактированный мир (рис. 13).
Рисунок 13. Безграничные возможности CRISPR/Cas9.