Генномодифицированный человек что это
ГМО-люди – будущее биотехнологий уже здесь

Интересно, чем закончатся наши исследования
Кажется, прошлая тема про ГМО-лосося весьма неплохо зашла Хабрачитателям. Пока мы готовим материал по модификации растений, я предлагаю посмотреть не менее интересную тему — генная модификация Homo Sapiens. Это очень спорная и холиварная тема, игнорировать которую бесполезно.
Сразу дам несколько тезисов, которые могут показаться спорными, но которые так или иначе надо решать в научном сообществе:
Что такое генотерапия
Давайте для начала определимся с терминологией. Генотерапия — это вмешательство в геном человека с целью лечения тех или иных заболеваний. Причем, вмешательство идет только в соматические клетки. Это те клетки, которые не участвуют в размножении. Нам явно не надо какие-то мутации и багфиксы закреплять в новых поколениях. Пока, по крайней мере.
Реальные эксперименты на животных начались примерно в 1980-х годах, но тогда это были только робкие шаги. Всякого рода красоты вроде ДНК-принтеров, экспрессирующихся векторов для эукариотов у нас не было.
Куда мы реально можем вмешаться?
Плазмиды
Для начала можно не трогать ядро клетки, которое содержит основную генетическую информацию. Можно воспользоваться плазмидами. 
1) Хромосомная ДНК бактерии 2) Плазмиды
Плазмиды — это почти исключительно бактериальная штука. Иногда встречаются у примитивных грибов и некоторых растений. По сути, это ДНК, но свернутая в кольцо и плавающая отдельно в цитоплазме. То есть такой отдельный механизм для хранения генетического материала. Для бактерий они очень важны для передачи положительных мутаций, например, чтобы «рассказать соседям» о вариантах защиты от антибиотика. Фишка плазмид при использовании у людей в том, что они разваливаются сами по себе через какое-то время после введения в клетку. А еще они не затрагивают основной генетический аппарат клетки. То есть основную прошивку не затронет.
Патчим kernel
Далее, у нас есть возможность непосредственно отредактировать фрагмент кода в ядре. Это более инвазивная процедура и она уже сопряжена с рисками неточной вставки или вырезания кусочка ДНК. Но это практически единственный вариант радикально починить какой-то тяжелый генетический дефект, так как соматические клетки будут делиться и передавать пропатченную версию ДНК своим потомкам.
Митохондрии
Митохондрии — это что-то вроде атомных реакторов в клетке. Потребляют жирные кислоты и глюкозу, а на выходе штампуют макроэрги — вещества с высокой энергией связи. Например, АТФ. Это универсальное «топливо» для всех активных реакций, например для работы осмотических мембранных насосов против градиента концентрации.
У них есть особенность — свой собственный генетический аппарат. Собственно, они на полуавтономных симбионтов похожи именно поэтому. Их генетический аппарат имеет смысл править при врожденных мутациях в митохондриальной ДНК. Обычно это тоже очень тяжелые врожденные синдромы.
Вирусный вектор — это как шприц
Первый ключевой момент — разработка инструментария доставки — вирусных векторов. Первый такой вирус для млекопитающих был разработан в 1984 году. В качестве молекулярного шприца использовали мышиный ретровирус. Он сам по себе являлся весьма неприятным инструментом, так как с высокой вероятностью провоцировал онкологические заболевания. Собственно, его второе название murine leukemia virus (MLVs). В дальнейшем разработки перешли на более безопасные варианты.
Что вообще такое вирусный вектор? Это такой специально модифицированный вирус, который срабатывает только один раз. Как шприц. Для этого он должен отвечать нескольким критериям:
Безопасность
Вирусный вектор не должен иметь возможность самопроизвольно размножаться. Для этого у них есть встроенный kill-switch. Их геном изначально так поврежден, что автономно размножаться они не могут. В лабораторной среде они размножаются на культуре клеток только в присутствии незаменимых компонентов и дополнительных вспомогательных вирусов, которые производят часть нужных для сборки белков. То есть в культуральном флаконе лаборатории размножается, а в организме срабатывает один раз, выходит из клетки в полусобранном виде и умирает.
Низкая цитотоксичность
Многие вирусы очень жестоко обращаются с клетками носителя. После фазы инкубации клетка дохнет от истощения и из ее бренных останков во все стороны разлетаются новые вирионы. При этом есть и вирусы, которые особо не влияют на нормальную физиологию клеток, на которых паразитируют. Например, аденовирусы.
Стабильность
Вирусы должны быть генетически стабильны. Например, грипп не подойдет. Он вообще не имеет внятных механизмов «контроля четности» и ему все равно, что хеш после копирования не сошелся. Это его эволюционная стратегия. Те же коронавирусы, напротив имеют механизмы контроля и репарации, что дает большую стабильность генетического материала. Хотя их не используют как вектор по другим причинам. Таким образом, задача состоит в том, чтобы вирус в процессе своего размножения в биореакторах сохранил тот самый payload — полезную нагрузку без изменений.
Специфичность типа клеток
Вирус должен доставить свою нагрузку не абы куда, а точно в конкретный тип клеток. Это значит, что если нам надо вылечить заболевание, связанное с дефектными эритроцитами, то вирус должен очень точно поражать именно мультипотентные стволовые клетки-предшественники клеток крови. И при этом не зацепить, например, мышечную ткань.
Что уже реально делают в плане генотерапии
Первая генетическая коррекция человека была проведена в 1990 году.Четырёхлетняя Ашанти ДеСильва получила лечение от тяжелого генетического дефекта сложного комбинированного иммунодефицита, связанного с недостатком фермента ADA. Надо отметить, что редактировали не геном стволовых клеток, которые производят Т-лимфоциты, а уже взрослые Т-клетки из ее же собственной донорской крови. То есть она нуждалась в повторении этих процедур в дальнейшем. Далее была серия успешных экспериментальных протоколов для лечения SCID (Severe combined immunodeficiency) по схожей методике.
В 1999 году произошел инцидент, который ощутимо затормозил исследования в этой области. Джесси Гелсинджер, страдал от генетического заболевания печени, из-за которого она была неспособна обезвреживать аммиак. Через 4 суток после введения аденовирусного вектора со здоровой копией гена он умер в результате гипериммунного ответа и полиорганной недостаточности. В дальнейшем FDA пришли к выводу о многочисленных нарушениях в протоколе исследования.
В 2006 появились первые сообщения об удачных протоколах индивидуальной генотерапии для лечения онкологии. Т-киллеры программируются на конкретный вид опухоли и затем выпускаются в организм пациента.
В 2011 году признали терапию ВИЧ у пациента Геро Хюттера в 2008 году. Метод не особо применим для широкой аудитории, так как требует полного удаления своего костного мозга, а затем имплантация скорректированных клеток с двойной дельта-32 мутацией, которая отключает рецептор CCR5.
К 2013 году в мире было разрешено всего пять генных препаратов. Три от онкологии, глибера для лечения наследственного дефицита липопротеинлипазы и неоваскулген. Последний, кстати, разработали полностью у нас.
Неоваскулген
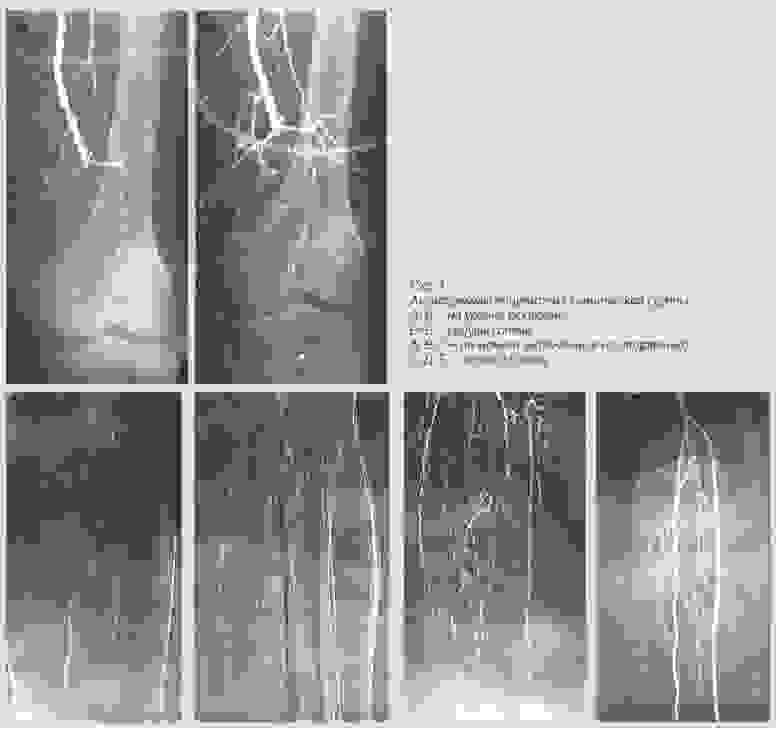
Результаты лечения Неоваскулгеном.
Этот препарат относится к плазмидным, то есть он не редактирует свой геном клетки, а только доставляет в нее плазмиды, которые работают ограниченное время.
Препарат представляет собой кольцевую ДНК (плазмиду), несущую человеческий ген VEGF 165, кодирующий синтез фактора роста эндотелия сосудов (VEGF — Vascular Endothelial Growth Factor). Стимулируя образование и рост коллатеральных сосудов, Неоваскулген призван оказать длительный лечебный эффект и улучшить качество жизни пациентов. Развитие микроциркуляторного русла в ишемизированной ткани нижней конечности способствует насыщению тканей кислородом, заживлению язв, увеличивает дистанцию безболевой ходьбы.
Механизм действия интересный. Клетки в месте инъекции начинают синтезировать VEGF — это фактор роста сосудов. В результате, в этом участке начинает нарастать новая разветвленная капиллярная сеть. Это критично для пациентов с хронической ишемией нижних конечностей из-за диабета и атеросклероза, например. До этого препарата ампутаций было больше. Сейчас его протестировали еще и для использования в стоматологии для приживления имплантов.
Генопрепарат смешивают с костным материалом и ушивают. В итоге сосуды быстро прорастают и формируется нужная ткань без отторжения. На кроликах уже точно моделировали при трансплантации фрагментов черепа. Люди на очереди, насколько мне известно.
Zolgensma
Спинальная мышечная атрофия — заболевание очень мрачное, по клинике отчасти похожее на боковой амиотрофический склероз, которым страдал Хокинг, но имеет другие причины. В результате развития заболевания прогрессирует паралич, который заканчивается смертью из-за невозможности дышать.
Zolgensma — это первый лекарственный препарат для генной терапии спинальной мышечной атрофии. Выпускается компанией AveXis (Novartis). Рабочая копия гена SMN вводится с помощью аденоассоциированного вируса (AAV) серотипа 9, AAV9, который способен преодолевать гематоэнцефалический барьер и проникать в клетки пациента. Одна проблема — стоит совершенно чудовищных денег. Одна инъекция стоит больше 2,1 миллиона долларов (около 152 миллионов рублей). Но результаты тоже потрясающие. У людей восстанавливается моторная функция и в дальнейшем заболевание не прогрессирует. По идее, такие дорогостоящие манипуляции должно оплачивать государство. Для отдельных людей стоимость лечения редких заболеваний просто неподъемная.
Что дальше?
Вот тут вопрос очень сложный. Мы действительно накапливаем дефектные гены в популяции. Раньше ребенок с пороком сердца бы просто умер — сейчас его спасут и он даст потомство с этим дефектом. Раньше много беременностей не сохранялось — сейчас беременных вытягивают с минимальным процентом выкидышей и завершают успешными родами. По сути, мы ломаем механизмы естественной выбраковки популяции. Это правильно и гуманно, но что-то надо делать с накапливающимися мутациями генофонда.
Либо мы придем к зеленым карточкам и разрешениям на размножение, либо научимся надежно и безопасно исправлять генетические аномалии. Было бы круто выкинуть близорукость, системную дисплазию соединительной ткани и кучу других врожденных дефектов. А еще наконец починить этот дурацкий сломанный ген, отвечающий за синтез витамина С из глюкозы, как у всех нормальных млекопитающих.
Вот только дальше нас ждет неизвестное будущее. Больше всего настораживает потенциальное расслоение общества, когда самые богатые слои населения будут модифицировать своих детей на отсутствие сахарного диабета, атеросклероза, а заодно еще и задавить немного миостатин, чтобы выглядели атлетичными без особых усилий. Круто же. Но пугает.
Химера – так называют существо, которое состоит из клеток двух генетически разных организмов. Веками их считали выдумкой, мифом, больным воображением древних народов, но сейчас гибрид человека и животного стал реальностью.
Вот лишь несколько примеров из новейшего времени. В 1997 году американский учёный Чарльз ВакАнси вырастил на спине крысы человеческое ухо. Когда орган достиг нужных размеров, его успешно пересадили пациенту. А Генетики из Калифорнии уже два года используют свиней в качестве доноров.
Сейчас при помощи генной инженерии они создают такую ситуацию, когда в организме свиньи вырастают органы человека. Например, печень или почки. В 2003-м году китаянка Хуичжен Шен соединила клетки человека с яйцеклеткой кролика. В 2004-м исследователи в больнице Майо Клиник в Миннесоте получили свиней, в которых текла человеческая кровь.
В прошлом году китайские генетики провели один из самых скандальных экспериментов в истории. Создали химеру человека и обезьяны. Невероятно, но опыт оказался успешным. ДНК человека прижилась в эмбрионе примата, но появиться на свет человеко-обезьяне не дали.
Группа исследователей намеренно прервала процесс его развития. Дело в том, что существует ещё много, вопросов каким образом такой эмбрион будет развиваться, на сколько проявят себя человеческие клетки с ДНК человека, не проникнут ли они в мозг, и не вызовут ли появление человеческого сознания у такого гибридного организма.
В 2016 году 45-летняя женщина прошла курс генной терапии против старения. Терапия предполагала устранение двух основных эффектов от процесса старения: укорачивание теломер и потеря мышечной массы.
Теломеры — это участки хромосом, которые отвечают за количество делений клетки до ее уничтожения. Хотя длина теломер у каждого человека индивидуальна, рождается человек с длиной теломер 15–20 тысяч пар нуклеотидов, а умирает с длиной 5–7 тысяч. Длина их постепенно уменьшается за счет процесса, называемого пределом Хейфлика, — это количество делений клеток, примерно равное 50. После этого в клетках начинается процесс старения.
В 2015 году перед началом терапии у Элизабет взяли кровь на анализ: длина теломер лейкоцитов составила 6,71 тыс. пар нуклеотидов. В 2016 году после окончания терапии кровь снова взяли на анализ: длина теломер лейкоцитов увеличилась до 7,33 тыс. пар. Теоретически, это означает, что лейкоциты крови «помолодели» примерно на 10 лет. Процедуру Пэрриш проходила в Колумбии, поскольку в США такие эксперименты запрещены.
Результаты исследования были подтверждены двумя организациями — бельгийской некоммерческой организацией HEALES (HEalthy Life Extension Company) и британским Исследовательским фондом биогеронтологии (Biogerontology Research Foundation).
Однако эти результаты пока не подвергались экспертным оценкам. И больше похожи на пробный шар, запущенный в массовое сознание. Официально в большинстве стран сегодня генные эксперименты на человеческих эмбрионах под запретом или строго ограничены регламентом.
В 2019 году китайского учёного Хэ Цзянькуя приговорили к тюремному сроку за проведение незаконного эксперимента с рождением близнецов из генетически модифицированных эмбрионов. Он вставил им ген устойчивости к ВИЧ инфекции без предварительных клинических испытаний.
За незаконные генные опыты над людьми учёный заплатил штраф 3 миллиона юаней, а это более 27 миллионов рублей. Но главное то, что власти Китая подтвердили рождение первых в мире генно-модифицированных людей.
Что именно делал этот Хэ Цзянькуй?
Он и его коллеги выбирали несколько супружеских пар, в которых мужчины были ВИЧ-инфицированными. Затем они изменили ДНК эмбрионов, зачатых с помощью экстракорпорального оплодотворения с использованием нового метода редактирования генов криспр-кас-девять (CRISPR-Cas9). Их целью было создать у детей иммунитет к вирусу ВИЧ, носителями которого были их отцы. Для этого ученые попытались «отключить» у эмбрионов один единственный ген, отвечающий за кодирование белка, который позволяет ВИЧ проникать в клетку.
Согласно материалам уголовного дела, в результате этих экспериментов две женщины забеременели и родили в общей сложности трех девочек с измененной ДНК. По соображениям конфиденциальности суд был закрыт, и судьба этих детей сейчас неизвестна.
И это примеры, прозвучавшие в СМИ. А какие эксперименты проводят в секретных лабораториях, принадлежащих военным или мегакорпорациям типа Байер, простым смертным знать не дано.
Редактирование людей: как и зачем ученые проводят операции с геномом
Каждый из живых организмов на Земле носит в клетках наследственный материал своих предков. Эти данные называются геномами, и они нужны непосредственно для создания и поддержания деятельности организма. Генная инженерия работает над изменениями в наследственной информации. Рассказываем, что происходит с редактированием геномов прямо сейчас.
Читайте «Хайтек» в
Применение генной инженерии в научных исследованиях
Для изучения функции того или иного гена может быть применён нокаут гена. Так называется техника удаления одного или большего количества генов, что позволяет исследовать последствия подобной мутации.
Для нокаута синтезируют такой же ген или его фрагмент, измененный так, чтобы продукт гена потерял свою функцию. Основные методы реализации: цинковый палец, морфолино и TALEN.
Для получения нокаутных мышей полученную генно-инженерную конструкцию вводят в эмбриональные стволовые клетки, где конструкция подвергается соматической рекомбинации и замещает нормальный ген, а измененные клетки имплантируют в бластоцисту суррогатной матери. У плодовой мушки дрозофилы мутации инициируют в большой популяции, в которой затем ищут потомство с нужной мутацией. Сходным способом получают нокаут у растений и микроорганизмов.
Логичным дополнением нокаута является искусственная экспрессия, то есть добавление в организм гена, которого у него ранее не было. Этот способ генной инженерии также можно использовать для исследования функции генов. В сущности процесс введения дополнительных генов таков же, как и при нокауте, но существующие гены не замещаются и не повреждаются.
Используется, когда задачей является изучение локализации продукта гена. Одним из способов мечения является замещение нормального гена на слитый с репортерным элементом, например, с геном зеленого флуоресцентного белка GFP. Этот белок, флуоресцирующий в голубом свете, используется для визуализации продукта генной модификации.
Хотя такая техника удобна и полезна, её побочными следствиями может быть частичная или полная потеря функции исследуемого белка. Более изощрённым, хотя и не столь удобным методом является добавление к изучаемому белку не столь больших олигопептидов, которые могут быть обнаружены с помощью специфических антител.
В таких экспериментах задачей является изучение условий экспрессии гена. Особенности экспрессии зависят прежде всего от небольшого участка ДНК, расположенного перед кодирующей областью, который называется промотор и служит для связывания факторов транскрипции.
Этот участок вводят в организм, поставив после него вместо собственного гена репортерный, например, GFP или фермента, катализирующего легко обнаруживаемую реакцию. Кроме того, что функционирование промотора в тех или иных тканях в тот или иной момент становится хорошо заметным, такие эксперименты позволяют исследовать структуру промотора, убирая или добавляя к нему фрагменты ДНК, а также искусственно усиливать его функции.
Зачем нужна генная инженерия человека
В применении к человеку генная инженерия могла бы применяться для лечения наследственных болезней. Однако, технически, есть существенная разница между лечением самого пациента и изменением генома его потомков.
Задача изменения генома взрослого человека несколько сложнее, чем выведение новых генноинженерных пород животных, поскольку в данном случае требуется изменить геном многочисленных клеток уже сформировавшегося организма, а не одной лишь яйцеклетки-зародыша. Для этого предлагается использовать вирусные частицы в качестве вектора.
Вирусные частицы способны проникать в значительный процент клеток взрослого человека, встраивая в них свою наследственную информацию; возможно контролируемое размножение вирусных частиц в организме. При этом для уменьшения побочных эффектов учёные стараются избегать внедрения генноинженерных ДНК в клетки половых органов, тем самым избегая воздействия на будущих потомков пациента.
Также стоит отметить значительную критику этой технологии в СМИ: разработка генноинженерных вирусов воспринимается многими как угроза для всего человечества.
С помощью генотерапии в будущем возможно изменение генома человека. В настоящее время эффективные методы изменения генома человека находятся на стадии разработки и испытаний на приматах.
Долгое время генетическая инженерия обезьян сталкивалась с серьёзными трудностями, однако в 2009 году эксперименты увенчались успехом: в журнале Nature появилась публикация об успешном применении генноинженерных вирусных векторов для излечения взрослого самца обезьяны от дальтонизма. В этом же году дал потомство первый генетически модифицированный примат (выращенный из модифицированной яйцеклетки) — обыкновенная игрунка ( Callithrix jacchus).
Хотя и в небольшом масштабе, генная инженерия уже используется для того, чтобы дать шанс забеременеть женщинам с некоторыми разновидностями бесплодия. Для этого используют яйцеклетки здоровой женщины. Ребёнок в результате наследует генотип от одного отца и двух матерей.
Однако возможность внесения более значительных изменений в геном человека сталкивается с рядом серьёзных этических проблем. В 2016 в США группа учёных получила одобрение на клинические испытания метода лечения рака с помощью собственных иммунных клеток пациента, подвергаемых генной модификации с применением технологии CRISPR/Cas9.
В конце 2018 года в Китае родились двое детей, геном которых был искусственно изменён (выключен ген CCR5) на стадии эмбриона методом CRISPR/Cas9, в рамках исследований, проводимых с 2016 года по борьбе с ВИЧ. Один из родителей (отец) был ВИЧ-инфицированным, а дети, по заявлению, родились здоровыми.
Поскольку эксперимент был несанкционированным (до этого все подобные эксперименты на человеческом эмбрионе разрешались только на ранних стадиях развития с последующим уничтожением экспериментального материала, то есть без имплантации эмбриона в матку и рождением детей), ответственный за него учёный не предоставил доказательств своим заявлениям, которые были сделаны на международной конференции по редактированию генома.
В конце января 2019 года властями Китая были официально подтверждены факты проведения данного эксперимента. Тем временем учёному было запрещено заниматься научной деятельностью и он был арестован.
Как редактируют человеческий геном?
«Цинковые пальцы» встречаются и в составе человеческих белков. Благодаря этому методу можно сконструировать цепь ZFN так, что она будет узнавать определённый участок ДНК. Это дает возможность точечного воздействия на заданные участки в составе сложных геномов.
Домены «цинковые пальцы» встречаются в составе человеческих факторов транскрипции – белков, регулирующих процесс синтеза РНК с матрицей ДНК. При создании искусственных нуклеаз можно сконструировать цепочку из «цинковых пальцев» так, что она будет узнавать определенный участок ДНК.
Если такая цепочка будет достаточно длинной, она может распознавать относительно протяженные последовательности ДНК, состоящие из ряда тринуклеотидных фрагментов. Это означает реальную возможность точечного воздействия на заданные участки в составе больших сложных геномов.
Однако у метода «цинковых пальцев» обнаружились и серьезные недостатки: во-первых, это не вполне строгое распознавание тринуклеотидных повторов, что приводит к заметному числу расщеплений ДНК в «нецелевых» участках.
Во-вторых, метод оказался весьма трудозатратным и дорогостоящим, поскольку для каждой последовательности ДНК необходимо создать свою оптимизированную белковую структуру zinc-finger нуклеазы. Поэтому система «цинковые пальцы» широкого распространения не получила.
В 2011 году журнал Nature Methods назвал систему TALEN (Transcription Activator-like Effector Nucleases) «методом года» благодаря широкому спектру возможных применений в разных областях фундаментальной и прикладной науки.
TALEN — один из способов направленного внесения разрыва в ДНК с последующим его «залечиванием» — для выключения генов у мышей. Сразу после них эту технологию применили для внесения в мышиный геном мутации, приводящей к развитию одного из наследственных синдромов. Авторам метода моделирования генетически обусловленных болезней удалось не только «испортить» мышиный геном, но и исправить его обратно.
Метод обеспечивает точное воздействие на заданные участки ДНК и может быть использован практически в любой современной молекулярно-биологической лаборатории.
В основе этой системы — особые участки бактериальной ДНК — CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats, или короткие палиндромные кластерные повторы). Разделяют эти повторы спейсеры — короткие фрагменты чужеродной ДНК. Последние встраиваются в геном после того, как ДНК рекомбинирует с её геномом.
Примеры редактирования человека
Заболевание 44-летнего жителя Аризоны Брайана Мадо проявилось еще в раннем детстве. Оно неизлечимо и наследуют его в основном мужчины. Мукополисахаридоз II типа — это метаболическое расстройство: у людей с ним есть мутация в гене, ответственном за производство фермента, который участвует в расщеплении сложных углеводов. В итоге они накапливаются в клетках и вызывают многочисленные патологии органов.
Мужчина решил принять участие в клиническом испытании нового метода — генной терапии. Это лишь первая фаза исследования, а всего до регистрации терапии (то есть до разрешения применять этот метод для всех больных с синдромом Хантера) их должно быть три.
Метод, который использовали в случае Брайана Мадо, позволяет редактировать геном прямо в теле человека — и при этом достаточно точно попадать в конкретный участок ДНК. Редактирование происходит с помощью так называемых «цинковых пальцев».
Китайский исследователь Хэ Цзянькуй отредактировал геномы человеческих эмбрионов перед процедурой искусственного оплодотворения, в результате чего на свет появились двое детей с измененной ДНК.
С помощью системы CRISPR/Cas9 исследователь отредактировал геномы эмбрионов семи пар во время репродуктивного лечения. В результате одной из беременностей от здоровой матери и ВИЧ-инфицированного отца родились две девочки-двойняшки с измененной ДНК. Хэ Цзянькуй пояснил, что удалил у детей ген CCR5, благодаря чему они получили пожизненный иммунитет к ВИЧ.
Для восстановления зрения можно использовать оптогенетические технологии, с помощью которых работой нейронов можно управлять с помощью светочувствительных белков бактерий и вспышек лазера.
Руководствуясь этой идеей, биологи создали вирус, который может проникать в ганглионарные нейроны. Эти нервные клетки отвечают за передачу сигналов из сетчатки в мозг человека. Попавший в ганглионарный нейрос вирус заставляет его производить подобные сигнальные молекулы. Однако эта процедура не возвращает зрение сама по себе, так как белки бактерий реагируют на свет не так, как палочки и колбочки сетчатки.
Чтобы решить эту проблему, профессор Базельского университета Ботонд Роска и профессор Питтсбургского университета Хосе Сахель создали специальные очки, которые преобразуют поступающие в них изображение в понятный мозгу формат и стимулируют ганглионарные клетки вспышками лазера. В результате пациент может видеть силуэты крупных предметов и объектов и совершать другие сложные действия