Гентингтона болезнь что это
Гентингтона болезнь что это
Этиология и встречаемость болезни Гентингтона. Болезнь Гентингтона (MIM № 143100) — панэтническое аутосомно-доминантное прогрессирующее нейродегенеративное заболевание, вызванное мутациями в гене HD. Распространенность болезни Гентингтона колеблется от 3 до 7 на 100 000 среди западных европейцев до 0,1—0,38 на 100 000 среди японцев. Эти изменения распространенности отражают изменения в распределении аллелей болезни Гентингтона и гаплотипов, предрасполагающих к мутации.
Патогенез болезни Гентингтона
Продукт гена HD, белок генгтинтин, экспрессируется повсеместно. Функция генгтинтина остается неизвестной.
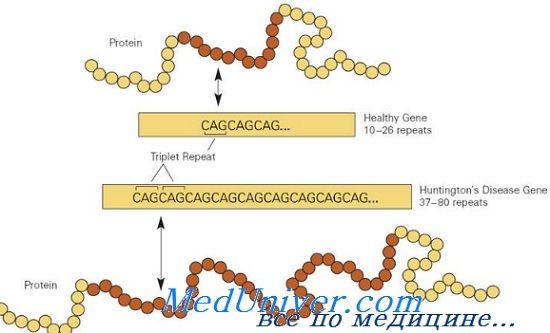
Болезнетворные мутации в гене HD обычно вызваны экспансией последовательности повторов CAG в экзоне 1, кодирующем полиглутаминовую цепочку; в норме аллели HD имеют от 10 до 26 повторов триплета CAG, тогда как мутантные аллели имеют больше 36 повторов. Приблизительно у 3% пациентов болезнь Гентингтона развивается в результате новой экспансии повторов CAG; 97% наследуют мутантный аллель HD от больного родителя.
Новые мутантные гены болезни Гентингтона возникают вследствие перехода премутации (27-35 повторов CAG) в полную мутацию. До настоящего времени все описанные пациенты наследовали новую полную мутацию от отца.
Экспансия полиглутаминового участка генгтинтина приводит к появлению у него нового свойства, и как необходима, так и достаточна для индукции болезни Гентингтона. Кроме выраженной рассеянной атрофии неостриатума, основного признака болезни Гентингтона, экспрессия мутантного генгтинтина вызывает дисфункцию нейронов, общую атрофию мозга, изменения уровней нейромедиаторов и накопление ядерных и цитоплазматических агрегатов в нейронах. В итоге экспрессия мутантного генгтинтина вызывает гибель нейронов; тем не менее похоже, что клинические симптомы и дисфункция нейронов предшествуют развитию внутриклеточных агрегатов и смерти нейронов. Механизм того, как экспрессия увеличенного числа глутаминовых остатков вызывает болезнь Гентингтона, остается неясным.
Фенотип и развитие болезни Гентингтона
Возраст начала болезни обратно пропорционален числу повторов CAG в гене HD. Пациенты с началом болезни во взрослом возрасте обычно имеют 40-55 повторов; в юношеском возрасте — обычно более 60 повторов. Пациенты с 36-41 повторами CAG имеют неполную пенетрантность, т.е. у них болезнь может не развиться в течение всей жизни. За исключением возраста начала, число повторов не влияет на другие проявления болезни Гентингтона.
Нестабильность и экспансия повторов CAG часто приводит к явлению антиципации, т.е. более раннему возрасту начала в последующих поколениях семьи. Достигнув однажды значения 36, число повторов увеличивается в ходе сперматогенеза отца; экспансия при материнской передаче мутации встречается реже. Поскольку число повторов триплета CAG обратно коррелировано с возрастом начала, индивидуумы, унаследовавшие мутацию от отца, имеют повышенный риск развития болезни с ранним началом; приблизительно 80% молодых пациентов наследуют мутантный ген болезни Гентингтона от отца.
Приблизительно треть пациентов имеют психиатрические нарушения; две трети — комбинацию познавательных и двигательных нарушений. Средний возраст пациентов на начало болезни — 35-44 года; приблизительно у четверти пациентов болезнь Гентингтона проявляется после 50 лет и у одной десятой — до 20 лет. Среднее выживание после установления диагноза — 15-18 лет, а средний возраст смерти — 54-55 лет.
Для болезни Гентингтона характерны прогрессирующие двигательные, познавательные и психиатрические расстройства. Двигательные нарушения включают как произвольные, так и непреднамеренные движения. Первоначально эти движения создают незначительные помехи ежедневной деятельности, но обычно приводят больного к нетрудоспособности по мере развития болезни.
Хорея, присутствующая у более чем 90% пациентов, — наиболее частая форма непроизвольного гиперкинеза; характеризуется неповторяющимися непериодическими толчками, которые не могут быть подавлены усилием воли. Познавательные нарушения начинаются в начале болезни и влияют на все аспекты познания; речь обычно затрагивается позднее, чем другие функции.
Поведенческие нарушения, обычно развивающиеся в ходе болезни, включают антиобщественное поведение, агрессию, взрывы гнева, апатию, сексуальные отклонения и повышенный аппетит. Психиатрические проявления, развивающиеся на любой стадии болезни, включают изменения личности, легкие психозы и шизофрению.
В конечных стадиях болезни Гентингтона обычно развиваются настолько выраженные двигательные нарушения, что больные полностью зависят от постороннего ухода. Они также теряют массу тела, у них появляются нарушения сна и мутизм. С течением болезни поведенческие нарушения уменьшаются.
Особенности фенотипических проявлений болезни Гентингтона:
• Возраст начала: от подросткового до старости
• Двигательные нарушения
• Познавательные нарушения
• Психиатрические нарушения
Лечение болезни Гентингтона
К настоящему времени никакого эффективного лечения при болезни Гентингтона нет. Помощь сводится к уходу и фармакологическому лечению поведенческих и неврологических проблем.
Риск наследования болезни Гентингтона
Каждый ребенок родителя с болезнью Гентингтона имеет 50% риск унаследовать мутантный аллель болезни Гентингтона. За исключением аллелей с неполной пенетрантностью (36-41 повтор CAG), у всех детей, унаследовавших мутантный аллель, если они имеют нормальную продолжительность жизни, развивается болезнь Гентингтона.
Дети отцов, несущих премутацию, имеют эмпирический приблизительно 3% риск унаследовать аллель болезни Гентингтона, в котором премутация перешла в полную мутацию. Тем не менее не все мужчины, несущие премутацию, равновероятно передают полную мутацию.
Доклиническое тестирование и пренатальная диагностика доступны благодаря анализу числа повторов CAG в 1 экзоне гена HD. Доклиническое тестирование и пренатальная диагностика — методики прогностические, поэтому лучше интерпретируются в случае подтверждения экспансии CAG у больного члена семьи.
Пример болезни Гентингтона. М.П., 44-летний мужчина, отметил ухудшение памяти и внимания. По мере снижения интеллектуальных функций в течение последующего года у него развились непроизвольные движения пальцев кистей и стоп, а также мимических мышц лица типа гримасничания. Он понимал свое состояние и впал в депрессию. До этого М.П. был здоров, и в его анамнезе не было аналогично больных родственников; его родители погибли в сорокалетнем возрасте в автокатастрофе. У пациента одна здоровая дочь.
После углубленного осмотра невролог диагностировал состояние больного как болезнь Гентингтона. Диагноз болезни Гентингтона подтвержден анализом ДНК, показавшим наличие 43 повторов триплета CAG в одном из аллелей гена HD (в норме не более 26). Последующее пресимптоматическое обследование дочери показало, что она также унаследовала мутантный аллель HD. Оба получили подробную консультацию.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Болезнь Гентингтона: что это?

Диагностика болезни Гентингтона
Диагностируют данное заболевание на основе семейного анамнеза и характерных симптомов. Результаты медицинского осмотра необходимо подтвердить при помощи генетического тестирования. Если у человека выявлена мутация в гене, это дает основания для подтверждения диагноза.
Также для диагностики используют методы нейровизуализации, при помощи которых выявляют атрофию хвостатого ядра и в ряде случаев – коры головного мозга. Исследование проводят при помощи МРТ и КТ.
Симптомы заболевания
Симптомы болезни Гентингтона можно разделить на две основные группы: двигательные и нервно-психические.
К двигательным относятся:
Нервно-психические изменения проявляются:
Лечение хореи Гентингтона
Способов полного излечения от данного заболевания в настоящее время не существует, поэтому терапия направлена в основном на устранение симптомов. Возбуждение и хорею устраняют при помощи нейролептиков либо тетрабеназина, депрессию – с помощью антидепрессантов. Возможно использование препаратов, замедляющих развитие деменции.
Ближайшим родственникам пациента, особенно находящимся в детородном возрасте и планирующим семью, необходимо предложить генетическое тестирование, чтобы оценить вероятность возникновения заболевания у их детей.
Гентингтона болезнь что это
Увеличение числа CAG-триплетных повторов (экспансия) в 1 экзоне гена HTT является причиной развития болезни Гентингтона, аутосомно-доминантного неврологического заболевания.
Хорея Гентингтона, экспансия триплетных повторов, ген HTT, генетическое обследование.
Синонимы английские
Huntington disease, expansion of CAG (cytosine-adenine-guanine) triplet repeats, HTT gene.
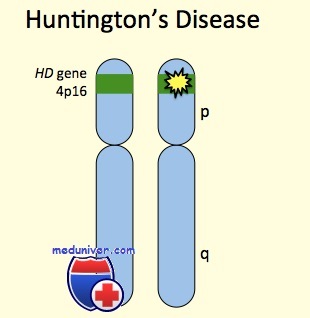
Локализация гена на хромосоме
Фрагментный анализ 1 экзона гена HTT.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Болезнь Гентингтона (БГ) – наследственное прогрессирующее нейродегенеративное заболевание, вызванное экспансией CAG-триплетных повторов в 1 экзоне гена HTT, располагающегося на коротком плече 4 хромосомы и кодирующего белок гентингтин (HTT). Небольшое количество нуклеотидов CAG (цитозин-аденин-гуанин) в гене HTT встречается в норме, однако при увеличении числа повторов (экспансии) более 35 вероятность развития заболевания и передачи гена потомкам значительно увеличивается. Размер экспансии коррелирует с тяжестью симптоматики и временем первых проявлений заболевания.
Встречаемость заболевания среди населения с европейскими корнями составляет 10:100000. Заболевание наследуется по аутосомно-доминантному типу, то есть имеется 50% риска его развития у потомков.
Болезнь Гентингтона проявляется преимущественно неврологической симптоматикой. Клинические проявления и признаки:
Для чего используется исследование?
В соответствии с международными клиническими рекомендациями, генетическое обследование на болезнь Гентингтона проводится при наличии у пациента клинической симптоматики, характерной для данного заболевания, а также родственникам и детям больного.
Когда назначается исследование?
Что означают результаты?
Генетическое обследование является основным методом подтверждения диагноза и основано на подсчете числа тройных CAG-повторов с помощью метода фрагментного анализа в гене НТТ. Диагностическая значимость обнаруженного числа CAG-повторов в гене HTТ представлена в таблице:
Количество CAG-повторов в гене HTT
Диагностический тест
Прогностический тест
Риск развития для детей
6-26 – нормальная аллель
Болезнь Гентингтона исключена
Болезнь Гентингтона не разовьется
Невысокий риск развития болезни Гентингтона
27-35 – умеренное увеличение
Болезнь Гентингтона очень маловероятна
Маловероятно, что болезнь Гентингтона разовьется
Риск развития БГ ( Что может влиять на результат?
Хотя генетический тест является точным методом лабораторной диагностики, время клинических проявлений заболевания (пенетрантность болезни) зависит от внешней среды, индивидуальных генетических факторов. Для оценки характера наследования у детей и родственников, риска прогрессирования заболевания и назначения лечения рекомендуется получить консультацию специалиста.
Кто назначает исследование?
Невролог, психиатр, врач-генетик.
52 Генетическое обследование на гентингтоноподобное заболевание 2 типа в гене JPH3
44 Генетическое обследование на гентингтоноподобное заболевание 4 типа в гене TBP
47 Генетическое обследование на дентаторубро-паллидолюисову атрофию в гене ATN1
49 Комплексное обследование на гентингтоноподобные заболевания (ГПЗ2,ГПЗ4,ДРПЛА)
63 Медь в крови
44 Обследования на частые генетические причины мозжечковой атаксии (СЦА 1,2,3,6,7, АФ)
43 Определение экспансии триплетов при спиноцеребеллярной атаксии 1 типа (в гене ATXN1)
43 Определение экспансии триплетов при спиноцеребеллярной атаксии 2 типа (в гене ATXN2)
44 Определение экспансии триплетов при спиноцеребеллярной атаксии 3 типа (в гене ATXN3)
45 Определение экспансии триплетов при спиноцеребеллярной атаксии 6 типа (в гене CACNA1A)
44 Определение экспансии триплетов при спиноцеребеллярной атаксии 7 типа (в гене ATXN7)
25 Диагностика системной красной волчанки
Болезнь Гентингтона
Симптомы и способы лечения
Болезнь Гентингтона (также болезнь Хантингтона) – это разрушительное аутосомно-доминантное нейродегенеративное заболевание. Шансы, что носитель передаст его кому-либо из своих детей, равны 50%.
Болезнь Гентингтона – одна из самых распространенных неврологических болезней, вызванных мутацией одного гена. Черты этого заболевания – отложения белкового агрегата в нервных клетках – присущи болезни Альцгеймера и болезни Паркинсона.

Изображение процесса болезни – нейрон, пораженный тельцами включения // wikipedia.org
Причины болезни Гентингтона
Болезнь Гентингтона вызвана экспансией тринуклеотинового CAG-повтора в гене, кодирующем белок гентингтин. У здоровых людей меньше 36 CAG-повторов, последовательность выглядит так: CCAGCAGCAGCAGCAGCAGCAGCAGCAGCAG… У людей с болезнью Гентингтона 36 таких повторов или больше. Когда CAG-повторы транслируются в аминокислоту глутамин, мутантный гентингтин получает аномально длинный полиглутаминовый тракт. Этот тип мутации наблюдается в восьми других нейродегенеративных заболеваниях.
Удлиненный полиглутаминовый тракт сообщает гентингтину токсические свойства. Они могут быть связаны со склонностью мутантного белка к агрегации или с тем, что мутантный гентингтин препятствует нормальному функционированию других белков в клетке. Это приводит к нейродегенерации, особенно заметной в хвостатом ядре, скорлупе и коре головного мозга.
Симптомы болезни Гентингтона: хорея
На клиническом уровне пациент демонстрирует ненормальные хаотические движения, снижение когнитивных способностей (форма деменции) и психиатрические отклонения. Самое очевидное двигательное нарушение, наблюдаемое при болезни Гентингтона, называется хорея – ненормальные короткие и иррегулярные неконтролируемые движения. Психиатрические симптомы болезни, такие как депрессия, отчасти связаны с биологией болезни и не всегда являются реакцией больного на ее наличие.
Болезнь Гентингтона обычно проявляется в середине жизни – к 40 годам. Однако в случаях с очень высоким количеством повторов болезнь может проявиться в раннем детстве. В некоторых случаях, когда число CAG-повторов близко к 36, болезнь проявляется ближе к концу жизни. Чем длиннее цепочка повторов тринуклеотида, тем раньше появляются признаки заболевания. Симптомы болезни похожи у всех пациентов, хотя на начальном этапе могут быть некоторые различия. Болезнь продолжается в течение 15–20 лет до смерти больного.
История исследования болезни Гентингтона
Болезнь названа по имени американского врача Джорджа Гентингтона, он детально описал ее в 1872 году. «О хорее» – первая из двух статей Гентингтона, в которой он аккуратно описал признаки болезни, которые наблюдал у семьи, живущей на Лонг-Айленде.
Однако существуют и более ранние описания болезни Гентингтона. Джеймс Гузелла впервые провел связь между геном, вызывающим болезнь, и коротким плечом четвертой хромосомы человека. Это первый классический пример того, как можно обнаружить место гена на определенном участке хромосомы, основываясь на изучении семей. Последующая идентификация Гузеллой и крупным консорциумом мутации и гена, вызывающего болезнь, позволила в дальнейшем проводить точные генетические тестирования и предоставила ключевой ресурс для моделирования болезни в клетках и у животных, что критически важно для разработки лечения.
Лечение болезни Гентингтона
В настоящее время неизвестно лечение, смягчающее нейродегенерацию человека, однако тетрабеназин может уменьшить некоторые двигательные нарушения. Считается, что тетрабеназин не уменьшает уровня нейродегенерации при болезни Гентингтона. Хорея вызвана переизбытком нейромедиатора дофамина, тетрабеназин снижает его активность и уменьшает симптом.
Сейчас разрабатываются многочисленные методы лечения болезни Гентингтона на механистическом уровне. Они включают стратегии снижения экспрессии мутантного белка с помощью антисмысловых методов (в клинических испытаниях) и активацию аутофагии. Антисмысловые стратегии задействуют нуклеиновые кислоты олигонуклеотиды. Они имеют комплементарные гену болезни Гентингтона последовательности и уменьшают количество синтезируемого гентингтина. Эта стратегия вполне рациональна, поскольку основной двигатель болезни – мутантный гентингтин.
Распространенность болезни Гентингтона
Болезнь поражает 1 из 10 000 человек в популяциях европейского происхождения. Чаще всего болезнь Гентингтона встречается в популяционных изолятах (в Венесуэле), реже – в некоторых популяциях (например, у японцев). Различия в распространенности болезни в популяциях связаны с количеством носителей гена в этих группах. Это следствие исторических событий, включая случайные увеличения или уменьшения носителей болезни Гентингтона в популяционных изолятах.
Защитная роль аутофагии
В лаборатории мы сосредоточились на защитных функциях аутофагии при болезни Гентингтона и связанных с ней нейродегенеративных состояниях. Аутофагия – процесс, при котором внутренние компоненты клетки доставляются внутрь ее лизосом или вакуолей и подвергаются в них деградации.
Мы обнаружили, что внутриклеточные белки, склонные к агрегации (подобные мутантному гентингтину), являются субстратами аутофагии. Важно отметить, что мы были первыми, кто показал, что препараты, стимулирующие аутофагию, стимулируют и удаление токсичных белков. Это мутантный гентингтин, мутантный атаксин-3 (вызывающий наиболее распространенную спиноцеребеллярную атаксию), альфа-синуклеин (в болезни Паркинсона) и тау-белки дикого и мутантного типа (связанные с болезнью Альцгеймера и разными видами лобно-височной деменции).
Мы расширили наши исследования от клеточных систем до демонстрации эффективности таких препаратов на болезнях, смоделированных у дрозофил, рыб данио-рерио и мышей. Эта концепция впоследствии была подтверждена многими исследовательскими группами на различных нейродегенеративных заболеваниях.
Наша задача заключается в том, чтобы развить эту стратегию до статуса клинической реальности. Мы провели ряд исследований, чтобы выявить новые препараты, побуждающие аутофагию. Мы с моим коллегой доктором Роджером Баркером завершили тестирование одного из идентифицированных препаратов на пациентах с болезнью Гентингтона.

Белковый агрегат в мозге мыши (отмечен стрелками) // serious-science.org
Изучение функций гентингтина и современная терапия
Есть много текущих исследовательских проектов, работа над которыми способствует изучению болезни. Во-первых, активнее всего разрабатывается вопрос, как мутантный гентингтин вызывает заболевание. Чтобы ответить на него, нужно задействовать методы структурной биологии, биофизики, генетического сканирования, клеточной биологии и животных моделей. Некоторые группы сосредотачиваются на исследовании болезни на биохимическом уровне, пытаясь понять структуру мутантного белка и его рано агрегирующих видов. Другие используют клеточные и нейронные модели, а также модели стволовых клеток, чтобы понять, что нарушает мутантный белок. Они дополняются исследованиями на животных: червях, дрозофилах, данио-рерио, мышах, крысах и даже приматах и овцах. Это нужно для разработки моделей, которые позволят понять болезнь на уровне организма. На таких моделях можно тестировать терапевтические стратегии.
Во-вторых, нужно понять, в чем заключаются функции нормального гентингтина – они плохо изучены. Чтобы пролить свет на эти функции, исследовательские группы применяют разные подходы, основанные на клеточном моделировании. Это может повлиять на терапевтические стратегии и/или наше общее понимание того, как работает клетка.
Третья цель – выявление потенциальных целей терапии для облегчения заболевания, улучшение существующих стратегий лечения. Над этим вопросом работают разные исследовательские группы; они используют методы химического и генетического сканирования, чтобы идентифицировать новые цели и потенциальные препараты.
Четвертая цель – идентифицировать и охарактеризовать биомаркеры прогрессирования болезни, чтобы облегчить клинические испытания. Это даст возможность отследить преимущества любой терапевтической стратегии. Действенно было бы иметь очень чувствительную шкалу прогрессирования болезни с коротким временным интервалом. Это важно для тех, кто является носителем гена болезни, но еще не обладает явными ее признаками и симптомами. В таком случае можно будет протестировать эффекты потенциальных терапевтических средств, которые замедляют развитие болезни.
Об авторе:
Дэвид Рубинштейн – Professor of Molecular Neurogenetics; Deputy Director, Cambridge Institute for Medical Research.
Болезнь Хантингтона
(Болезнь Хантингтона, хорея Хантингтона, хроническая прогрессирующая хорея, наследственная хорея)
, MD, HE UMAE Centro Médico Nacional de Occidente
Болезнью Хантингтона в равной степени страдают представители обоих полов.
Патофизиология болезни Хантингтона
При болезни Хантингтона отмечаются атрофия хвостатого ядра, дегенерация шипиковых нейронов в медиальных отделах полосатого тела, а также снижение уровня таких нейромедиаторов, как гамма-аминомасляная кислота (ГАМК) и субстанция Р.
Болезнь Хантингтона развивается вследствие мутации гена huntingtin ( HTT) (на 4-й хромосоме), вызывающей патологическое увеличение в молекуле ДНК числа CAG-копий, кодирующих аминокислоту глутамин. В результате этого на основе гена синтезируется крупный белок хантингтин, имеющий в своем составе удлиненную цепочку из глутаминовых остатков, накапливающихся внутри нейронов и приводящих к развитию заболевания, патогенез которого окончательно не известен. Чем больше содержится CAG-копий, тем раньше дебютирует заболевание и сильнее выражены его симптомы (фенотип). Количество CAG-повторов может увеличиваться в последующих поколениях, при передаче мутаций отцом, и с течением времени приводить к более тяжелым фенотипам заболевания в семье (так называемая антиципация).
Симптомы и признаки болезни Хантингтона
Симптомы болезни Хантингтона развиваются постепенно, начинаясь, в зависимости от фенотипа, как правило, в возрасте от 35 до 40 лет.
Деменция и психические нарушения (например, депрессия, апатия, раздражительность, ангедония, асоциальное поведение, биполярные или шизофреноподобные расстройства) могут развиваться как до, так и одновременно с двигательными нарушениями. Эти симптомы предрасполагают пациентов к суицидальным идеям и самоубийствам, которые среди пациентов с болезнью Хантингтона гораздо более распространены, чем среди населения в целом.
Типичные проявления: причудливая, «кукольная» походка, гримасничанье, неспособность сознательно быстро двигать глазами, не мигая или не кивая головой (глазодвигательная апраксия), неспособность доводить целенаправленные движения до конца (непостоянство движений), например, при попытке высунуть язык, или сделать хватательное движение.
Диагностика болезни Хантингтона
Клинический осмотр, результаты которого необходимо подтвердить генетическим тестированием
Лечение болезни Хантингтона
Генетическое консультирование родственников
Лечение болезни Хантингтона поддерживающее и симптоматическое. Тем не менее, исследователи продолжают искать способы замедления и остановки прогрессирования заболевания.
Нейролептики могут частично подавить хорею и ажитацию. Нейролептики включают
Хлорпромазин 25–300 мг перорально 3 раза в день
Галоперидол 5–45 мг перорально 2 раза в день
Рисперидон 0,5–3 мг перорально 2 раза в день
Оланзапин 5-10 мг перорально 1 раз в день
Клозапин от 12,5 до 100 мг перорально один или два раза в день
При терапии клозапином необходимо определить лейкоцитоз, поскольку препарат часто вызывает агранулоцитоз. Дозу антипсихотических препаратов увеличивают до развития непереносимых нежелательных эффектов (например, сонливости, паркинсонизма), или до купирования симптомов заболевания.
В качестве альтернативы можно использовать ингибиторы везикулярного транспортера моноаминов 2-го типа (ВМАТ-2) (тетрабеназин, дейтетрабеназин). Такие препараты истощают запасы дофамина и направлены на уменьшение проявления хореи и дискинезий.
Терапию тетрабеназином начинают с дозы 12,5 мг перорально 1 раз в день и повышают до 12,5 мг 2 раза в день на 2-ю неделю, затем 12,5 мг 3 раза в день на 3-ю неделю. Дозу можно увеличить еще на 12,5 мг на 4-й неделе. Дозы > 12,5 мг назначаются перорально 3 раза в день (общая суточная доза 37,5 мг/день); общую дозу увеличивают на 12,5 мг/день еженедельно. Максимальная доза составляет 33,3 мг перорально три раза в день (общая доза примерно 100 мг/день). Дозы увеличивают последовательно по мере необходимости для контроля симптомов или до появления непереносимых побочных эффектов. Нежелательные эффекты могут включать в себя избыточную седацию, акатизию, паркинсонизм, депрессию. При депрессии назначают антидепрессанты.
Дейтретрабеназин в настоящее время доступен для лечения хореи при болезни Хантингтона. Рекомендуемая доза составляет от 6 до 48 мг/день, вводится перорально в 2 приема. Начальная доза составляет 6 мг 1 раз в день, с последующим увеличением на 6 мг/день каждую неделю (например, до 6 мг 2 раза в день) до максимальной дозы 24 мг 2 раза в день (48 мг/день). (Дозы ≥ 12 мг вводятся в 2х разделенных дозах). Побочные эффекты аналогичны тетрабеназину, но препарат переносится лучше. Однако ингибиторы VMAT-2 являются дорогостоящими.
Основные положения, касающиеся болезни Хантингтона
Болезнь Хантингтона, аутосомно-доминантное заболевание, развивающееся независимо от пола, как правило, проявляется в среднем возрасте слабоумием и хореей; большинству пациентов в конечном итоге потребуется помещение в лечебное учреждение.
Если диагноз заподозрен на основании симптомов и семейного анамнеза, проводят генетическое тестирование, с учетом нейровизуализации.
Лечение симптоматическое, как можно скорее следует обсудить организацию ухода за больным в пожилом возрасте.
Родственникам 1-й степени родства, в частности, потенциальным родителям, предлагают консультирование и генетическое тестирование.