Герпетическая инфекция у детей что это
Клинико-лабораторная характеристика персистирующих форм герпес-вирусной инфекции у детей
Герпес-вирусные инфекции (от греч. herpes — ползучий) — группа инфекционных заболеваний, вызываемых представителями семейства герпес-вирусов (Herpesviridae). Антигенных серотипов, выделенных от человека, восемь: вирус простого герпеса 1-го и 2-го типов, вирус ветряной оспы — опоясывающего герпеса или вирус герпеса человека 3-го типа, вирус герпеса человека 4-го типа — вирус Эпштейна–Барр (ВЭБ) — вызывает инфекционный мононуклеоз; вирус герпеса человека 5-го типа — цитомегаловирус (ЦМВ), вирус герпеса человека 6-го, 7-го типов — вызывают внезапную экзантему и синдром хронической усталости, вирус герпеса человека 8-го типа ассоциирован с саркомой Капоши [1]. Все герпес-вирусы являются ДНК-содержащими и сходны по морфологии, типу нуклеиновой кислоты, способу репродукции в ядрах инфицированных клеток.
В РФ сохраняется высокий уровень детской инфекционной заболеваемости [2]. Отмечается возрастание роли инфекций, вызванных вирусами цитомегалии, ВЭБ, герпеса 1-го, 2-го, герпеса 6-го и 8-го типов. Среди детской популяции герпетическая инфекция широко распространена. Так, 70–90% детей 3-летнего возраста имеют достаточно высокий титр вируснейтрализующих антител к вирусу простого герпеса 1-го типа [3]. Эти инфекции у детей часто принимают хроническое течение вследствие персистенции возбудителя и формирования необратимых изменений в органах и системах.
За последние пять лет увеличилось число детей в возрасте до одного года, умерших от генерализованных вирусных инфекций [4]. Велика роль герпес-вирусных инфекций, особенно цитомегаловирусной, в формировании перинатальной патологии и младенческой смертности. Риск развития внутриутробной инфекции зависит от характера взаимоотношений между организмом беременной женщины и микроорганизмом (первичное заражение во время беременности или реактивация ранее приобретенной инфекции).
Проблема врожденной инфекционной патологии является приоритетной для России [5].
Иммуногенез герпес-вирусной инфекции. Длительное нахождение герпес-вируса в организме человека становится возможным благодаря сложной стратегии противоборства и ускользания от иммунной системы хозяина. В достижении этого состояния можно выделить три пути стратегии возбудителя:
Именно стратегия «саботажа», как считают, лежит в основе индуцированной вирусом иммуносупрессии, препятствующей полному удалению патогена и, как следствие, поддерживающей хроническое течение инфекции.
Вирус простого герпеса. В инфицированных клетках вирус простого герпеса образует внутриядерные включения и гигантские клетки, оказывает выраженное цитопатическое действие, проявляющееся округлением и образованием многоядерных клеток. Вирус является слабым индуктором интерферона, в связи с чем инактивация вирусной ДНК внутри клеток не наступает и он сохраняется внутри клеток длительное время, периодически вызывая рецидивы заболевания.
ЦМВ. Сущность проблемы ЦМВ-инфекции в том, что последняя относится к так называемым оппортунистическим инфекциям, клинические проявления которых возможно в условиях первичного или вторичного иммунодефицита.
ЦМВ поражает разнообразные клетки, чаще всего лейкоциты (лимфоциты, моноциты), эпителиальные клетки (дыхательных путей, слюнных желез, почек). С клеток крови ЦМВ с большим постоянством переходит на эндотелий, тропизм к которому у него весьма выражен. Поврежденные эндотелиальные клетки постоянно обнаруживаются в токе крови при активной/реактивированной ЦМВ-инфекции. Повреждение эндотелия сосудов имеет собственное патогенетическое значение в формировании органных поражений, так как вызывает ишемию или кровоизлияния в различные ткани [6].
В раннем неонатальном периоде (0–7 дней) у детей с ЦМВ-инфекцией наблюдались симптомы интоксикации, серый колорит кожи, выраженная мышечная гипотония, большая первоначальная потеря массы тела, синдром рвоты или срыгиваний, признаки угнетения ЦНС. В позднем неонатальном периоде (от 7 дней до одного мессяца) анализ клинических проявлений острой ЦМВ-инфекции выявляет поражение многих органов и систем. Так, у всех детей обнаруживаются гипоксически-ишемическая энцефалопатия с трансформацией синдрома угнетения в синдром гипервозбудимости, проявления анемии, патологическая гипербилирубинемия, увеличение печени и селезенки.
ВЭБ относится к подсемейству бета-герпес-вирусов. Вирусный геном заключен в нуклеокапсид, который покрыт гликопротеидным тегументом gp350, являющимся фактором рецепторного взаимодействия [7]. Проникновение вируса в В-лифоциты осуществляется через рецептор этих клеток CD21-рецептор к C3d-компоненту комплемента. ВЭБ-инфекция широко распространена среди людей, причем первичное инфицирование, как правило, происходит в антенатальном или детском возрасте, но манифестация ВЭБ-инфекции в виде отчетливых клинических проявлений инфекционного мононуклеоза в большинстве случаев происходит в школьном возрасте при различного рода иммунопатологических реакциях. Манифестация инфекции в виде инфекционного мононуклеоза может осложняться поражением печени, слизистой оболочки желудка, ткани почек, лимфоидного аппарата.
Особый характер взаимодействия микро- и макроорганизма при хронических персистирующих инфекциях обусловливают трудности лабораторной диагностики. Обнаружение возбудителя не может быть единственным критерием подтверждения диагноза. Необходима комплексная оценка клинических и лабораторных данных для постановки диагноза.
Цель исследования. Определить клинические особенности течения персистирующих герпес-вирусных инфекций у детей и оценить значимость комплекса лабораторных исследований, в том числе показателей общей иммунологической реактивности у больных при персистирующем у них инфекционном процессе.
Материал и методы исследований. Под наблюдением находилось 63 пациента в возрасте от одного месяца до 7 лет, из них детей до одного года было 25, от одного года до трех лет — 22 и старше трех лет — 15 больных. Среди обследованных детей преобладали пациенты первых двух лет жизни — 47 детей (74,6%) и старше двух лет было 15 больных (25,4%).
В комплекс исследований наблюдаемых детей были включены традиционные методы обследования — клинические анализы крови, мочи, копрограммы, УЗИ мозга, УЗИ внутренних органов, биохимические печеночные и почечные тесты (по показаниям), микробиологический анализ кала на дисбактериоз кишечника, бактериологические посевы на острую патогенную кишечную инфекцию, иммуноферментный анализ (ИФА) на ротавирусы, ИФА на внутриутробные инфекции: герпес-вирусы, цитомегаловирусы, ВЭБ, хламидии, микоплазмы. Определение специфических антител классов IgM и IgG в сыворотке крови к герпес-вирусам проводили непрямым твердофазным иммуноферментным методом с использованием стандартных наборов реактивов фирмы «Вектор-Бест», г. Новосибирск. Использовался молекулярно-биологический метод определения герпес-вирусов — полимеразная цепная реакция (ПЦР) с помощью набора реагентов производства «АмплиСенс» (ЦНИИ эпидемиологии МЗ РФ). В качестве материала использовали биосубстраты: периферическая кровь, моча, секрет из зева, слюна, отделяемое из глаз, вульвы. Оценивались показатели общей иммунологической реактивности: коэффициент фагоцитарной защиты (КФЗ), иммунный лимфомоноцитарный потенциал (ИЛМП) и лейкоцитарный индекс интоксикации (ЛИИ).
Результаты. В клинической диагностике персистирующих инфекций у детей следует отводить первостепенное значение неблагополучию акушерского анамнеза матерей больных детей.
Беременность и роды были осложненными у большинства матерей наблюдаемых детей, чаще всего у них отмечались гестозы и угроза выкидыша, рождение недоношенных, в родах гипоксия плода, преждевременная отслойка плаценты, кесарево сечение и др. У 32 женщин из 63 (50,7%) были различные соматические заболевания (хронический пиелонефрит, кольпит, анемия, аутоиммунный тиреоидит и др.). При обследовании беременных женщин было выявлено как моноинфицирование (у 30 из 63–47,6%), так и сочетания инфекций (у 16 из 63–25,4%). Наиболее часто обнаруживались герпес-вирусы и цитомегаловирусы (суммарно у 27 женщин из 63–43%) и реже другие возбудители — хламидии, микоплазмы (у 11 беременных — 17,4%). Высокая частота вышеуказанных осложнений свидетельствует о несомненной роли инфекции как отягощающего фактора в течение гестационного периода и родов.
Заподозрить внутриутробную или персистирующую инфекцию у детей можно было по высокой степени поражения у детей различных органов и систем: ЦНС (71,4%), органов дыхания (88,8%), желудочно-кишечного тракта (95,2%), поражению глаз (31,7%), лимфатического аппарата (15,9%).
В процессе наблюдения за детьми в недалеком прошлом все дети обследовались на состояние микробиоценоза кишечника.
У всех детей обнаруживались нарушения как в основных компонентах биоценоза, так и в составе условно-патогенной флоры. Следует отметить, что у всех пациентов проводилась коррекция микробиоценоза повторными курсами пре- и пробиотиков, однако восстановления микрофлоры до нормобиоценоза не наблюдалось ни у одного пациента. Следовательно, без выявления и адекватного лечения основного заболевания не удается курировать дисбиотические нарушения в организме ребенка.
Закономерен вопрос о правильности выбора комплекса диагностики внутриутробной и персистирующей инфекции у детей. В зависимости от возраста пользуются разными методами диагностики. Важное значение отводится сбору семейного анамнеза. Диагностика внутриутробных инфекций у детей должна опираться на клинические проявления как общего характера, так и на типоспецифические ее признаки, а также основываться на анализе комплекса лабораторных методов обследования [8].
При оценке клинических анализов крови у наблюдаемых детей обращали на себя внимание значительные отклонения в различных показателях гемограммы: выраженная анемизация (у 31,7% пациентов), нейтропения (у 19%), лимфоцитоз (у 27%), лейкопения с лимфоцитопенией (36,5%), ускорение СОЭ (у 27%), что в совокупности свидетельствовало о наличии воспалительного процесса в организме с выраженным снижением иммунореактивности у детей.
При скрининговом серологическом обследовании методом ИФА на внутриутробные инфекции у детей наиболее часто выявлялись положительные титры типоспецифических антител класса IgM и/или IgG к герпес-вирусам. Диагностические титры антител класса IgM и IgG определялись к ЦМВ (у 9 детей), к HV 1-го, 2-го типа (у 9 детей). Антитела к антигенам ВЭБ обнаруживались у 20 детей, из них у 10 детей были антитела класса IgG к раннему антигену ВЭБ и антитела класса IgM к капсидному антигену ВЭБ, что свидетельствовало об активной фазе ВЭБ-инфекции. Остальные 10 пациентов имели антитела класса IgG к нуклеарному (ядерному) антигену ВЭБ, что расценивалось как поздняя стадия инфекции.
У детей при персистирующем течении с реактивацией инфекции, которое чаще возникало после провоцирующих воздействий (ротавирусные диареи, ОРВИ, профилактические прививки) ПЦР-тесты при исследовании биосубстратов: кровь, осадок мочи, секрет из зева давали положительные результаты с последующим нарастанием титра типоспецифических антител по данным ИФА.
Совокупность проведенных исследований позволила выделить у обследованных больных следующие формы инфекций: моноинфекции были у 21 пациента — 31,8% (ЦМВ — у 5 детей, HV 1-го, 2-го типа — у 6 детей и ВЭБ — у 10), у 42 детей из 63 (68,2%) обнаруживались микст-инфекции. У 23 детей была ассоциация ЦМВ с герпес-вирусами (у 9 детей с HV 1-го, 2-го типа, у 3 детей — с HV 6-го типа и у 11 детей — с C. albicans и хламидиями). Микст-формы герпеса 1-го, 2-го типа были выявлены у 9 больных, у них были ассоциации с микоплазмами и хламидиями. Ассоциации ВЭБ были обнаружены у 10 детей (5 больных имели ассоциацию с ЦМВ, пациента — с HV 6-го типа и 2 больных — с Yersinia pseudotuberculosis).
Из 63 больных у 21 (33,3%) с моноинфекцией течение заболевания расценивалось как латентное (с ЦМВ-инфекцией у 5 и HV 1-го, 2-го типа у 6) и как персистирующее (у 10 детей с ВЭБ-инфекцией). У 14 детей из 42 с микст-инфицированием (у 1/3) было персистирующее течение инфекционного процесса (у 3 детей с ЦМВ-инфекцией в ассоциации с HV 6-го типа и у 11 детей с ЦМВ-инфекцией в ассоциации с C. albicans и хламидиями). У 28 детей из 43 (у 2/3) наблюдалось персистирующее течение с реактивацией инфекции (у 9 детей с ЦМВ-инфекцией в ассоциации с HV 1-го, 2-го типа; у 9 детей с HV 1-го, 2-го типа в ассоциации с хламидиями или микоплазмами и у 10 детей с ВЭБ инфекцией в ассоциации с ЦМВ, HV 6-го типа и ВЭБ в ассоциации с Y. pseudotuberculosis).
Коэффициент фагоцитарной защиты у детей с моноинфицированием и микст-формами герпесвирусной инфекции оказался достоверно сниженным по сравнению со средневозрастной нормой для здоровых детей (0,634 ± 0,05 усл. ед. и 0,540 ± 0,03 усл. ед. соответственно при норме 0,946 ± 0,03, Р1–2 и Р2–3 0,05). Недостаточность защиты клеточно-фагоцитарного звена иммунитета играет важную роль в патогенезе герпес-вирусных инфекций, что должно учитываться в лечении этих заболеваний.
Отклонение величины показателя ИЛМП имело противоположную направленность, она оказывалась достоверно повышенной как при моноинфекции, так и при микст-формах герпес-вирусных инфекций по сравнению с контролем (Р1–3 и Р2–3 0,05. Увеличение показателя ИЛМП у детей с герпес-вирусной инфекцией еще раз подтверждает лимфотропность вирусных антигенов.
ЛИИ оказался достоверно повышенным у больных с микст-формами герпес-вирусной инфекции по сравнению со средневозрастной нормой в контроле (Р2–3 0,05), они имели лишь тенденцию к повышению. Однако при оценке индивидуальных показателей ЛИИ у детей с моноинфицированием герпес-вирусами выявились существенные особенности. У 13 детей из 21 (61,9%) ЛИИ был ниже возрастной нормы, что отражало фазу положительной анергии к совершенно определенному антигену. Это свидетельствует, что организм защищен сейчас только от специфических антигенов, однако он остается уязвимым в отношении других патогенов, то есть низкий индекс интоксикации отнюдь не указывает на полное благополучие организма.
Полученные результаты исследований подтверждают выраженность иммунного дисбаланса как в клеточно-фагоцитарном звене иммунитета, так и в гуморальном, а также свидетельствуют о значимости эндогенной интоксикации у больных с микст-формами герпес-вирусной инфекции и уязвимости иммунной защиты у детей и при моноинфицировании.
Клинический пример. Андрей С., 2 года 5 мес., поступил в стационар с жалобами на высокую температуру — 39 °С, однократную рвоту, сниженный аппетит и жидкий стул 5 раз в сутки. Болен в течение двух недель ОРВИ, получил амбулаторно симптоматическое лечение. К концу второй недели ухудшилось состояние, рецидив лихорадки — 39 °C и дисфункция кишечника. Направлен на госпитализацию.
Анамнез жизни. От первой беременности, протекала с угрозой выкидыша, нефропатией, преэклампсией в родах. Во время беременности перенесла ОPВИ с лимфаденитом. Обследование на пренатальные инфекции, обнаруживались антитела класса IgG к антигенам ЦМВ и вирусу герпеса 1-го, 2-го типа. Лечение не проводилось. Роды в срок, масса при рождении 3500 г, длина 51 см. К груди приложен сразу, сосал активно, грудное вскармливание до года, прикормы вводились в 5 и 6 месяцев. Адаптация к пище нормальная. В массе прибавки достаточные, в 2 г. 5 мес — масса 14 кг 810 г, рост 93 см.
Состояние здоровья в течение первого года жизни неблагополучное. Длительно держалась желтуха, в возрасте 3 недель: общий билирубин — 315,1 мкмоль/л, непрямой — 297,3 мкмоль/л, прямой — 17,8 мкмоль/л. Одновременно с желтухой был неустойчивый стул. В 1-месячном возрасте неврологом установлен диагноз перинатального поражения ЦНС, гипоксическо-ишемического генеза, гипертензионный синдром.
К возрасту 6 мес были обнаружены изменения в гемограмме: гемоглобин — 112 г/л, эритроциты — 4,2 × 10 12 /л, лейкоциты — 7,8 × 10 9 /л, сегментоядерные нейтрофилы — 12%, лимфоциты — 67%, моноциты — 12%, эозинофилы — 8%, базофилы — 1%, СОЭ — 3 мм/час. В повторных анализах крови во 2-м полугодии продолжала выявляться нейтропения. Консультирован гематологом, установлен диагноз доброкачественной нейтропении детского возраста. В 10 мес в анализе крови выявлена анемия (гемоглобин — 107 г/л, эритроциты — 3,81 × 10 12 /л, цветовой показатель — 0,84, тромбоциты — 280 × 10 9 /л, сегментоядерные нейтрофилы — 11%, лимфоциты — 76%, моноциты — 90%, эозинофилы — 3%, базофилы — 1%). Гематологом назначено лечение Сорбифером дурулесом, курс 1 месяц.
Осмотрен ортопедом: отмечено ограниченное отведение бедер. В один год на УЗИ органов брюшной полости определялся перегиб в области шейки желчного пузыря, холестаз. Осмотр генетика: диагностирована недифференцированная дисплазия соединительной ткани с поражением костно-мышечной системы. В 1 г. 5 мес перенес острый энтероколит неуточненной этиологии, госпитализировался в стационар на 10 дней, получал лечение метронидазолом и Энтеролом. В течение 1,5 лет переносит частые ОРВИ с повышением температуры до 38,8 °С в течение 3–4 дней и катаральными явлениями.
Объективные данные. При последней госпитализации отмечались явления назофарингита в течение 5 дней, лихорадка до 39 °С 2 дня, кожные покровы без сыпи. При осмотре — гиперемия зева и увеличение подчелюстных, передних и заднешейных лимфоузлов, стул учащенный до 3 раз в сутки, с 5 дня лечения — оформленный. ЛОР-врачом диагностирован хронический тонзиллит и аденоидит, в фазе обострения.
Обследование. В мазке из зева — высев гемолитического стрептококка. Посевы на патогенную кишечную флору отрицательные. ИФА на ротавирус — отрицательный. Реакция непрямой гемагглютинации (РНГА) с кишечными диагностикумами — отрицательные.
Гемограмма при поступлении: гемоглобин 104 г/л, эритроциты — 3,7 × 10 12 /л, цветовой показатель — 0,85, лейкоциты — 6,4 × 10 9 /л, палочкоядерные нейтрофилы — 4%, сегментоядерные — 72%, лимфоциты — 18%, моноциты — 4%, эозинофилы — 2%, СОЭ — 4 мм/час.
Гемограмма в динамике: гемоглобин — 109 г/л, эритроциты — 3,4 × 10 12 /л, лейкоциты — 7,8 × 10 9 /л, палочкоядерные нейтрофилы — 19%, сегментоядерные — 42%, лимфоциты — 28% (широкоплазменные лимфоциты), моноциты — 8%, плазматические клетки — 1%, эозинофилы — 2%, СОЭ — 13 мм/час. В дальнейшем — красная кровь оставалась без динамики, число лейкоцитов не изменялось, нарастал лимфоцитоз до 43% (широкоплазменные формы), моноцитов до 12%, СОЭ повысилась до 20 мм/час.
Анализ мочи без отклонений от нормы (пятикратно). В биохимическом анализе крови — умеренная гипоальбуминемия, печеночные пробы — в норме. ИФА на специфические антитела к антигенам ЦМВ класса IgM — отрицательный, класса IgG — положительный. Маркеры ДНК-ЦМВ в осадке мочи и в секрете из зева методом ПЦР не найдены. ИФА на специфические антитела к хламидийному антигену (Chlamydia pneumoniae) — положительный в титре 1:80. Маркеры ДНК Ch. pneumoniae в мазке из носоглотки методом ПЦР — положительный. ИФА с микоплазменным антигеном — IgM и IgG — отрицательные, с герпес-вирусами 1-го, 2-го типа — IgM и IgG отрицательные. ИФА на специфические антитела к антигенам ВЭБ: IgM к капсидному антигену — отрицательный, IgG к раннему антигену — положительный и IgG к ядерному антигену (IgGNA) — положительный (> 0,5 ед.). Совокупность данного анализа была индикатором активной фазы мононуклеозной инфекции.
Таким образом, на основе ретроспективной оценки анамнеза ребенка становится ясным, что у пациента, инфицированного с рождения вирусом цитомегалии и хламидиями, в течение первого и второго года жизни инфекция персистировала и, как следствие, — была пролонгированная желтуха, наблюдалось поражение органов дыхания в виде «масок» многократных ОРВИ и эпизодов дисфункций кишечника, формированием дисбактериоза и иммунодефицитного состояния. Поражение ЦНС зарегистрировано неврологом в ранние сроки (в возрасте 1 месяца). В пользу вирусной персистенции свидетельствовал постоянный лимфоцитоз и как следствие — нейтропения, что очень часто недооценивается консультантами-гематологами и не назначается вирусологическое тестирование пациентов. После 2 лет на фоне персистирующей хламидийно-цитомегаловирусной инфекции наслоилась постнатальная инфекция ВЭБ, что в совокупности у ослабленного ребенка в дальнейшем можно ожидать персистирование микст-инфекции (ЦМВ + хламидии + ВЭБ).
После проведенного обследования ребенку была назначена адекватная комплексная терапия (Cумамед, Ликопид с последующим переходом на Виферон, витамины А, Е, Пиридоксин, пробиотики — курс Примадофилуса). Наблюдение за ним продолжается.
Выводы
Литература
Ф. Н. Рябчук, кандидат медицинских наук, доцент
З. И. Пирогова, кандидат медицинских наук, доцент
СПбМАПО, Санкт-Петербург
Что такое герпес простой? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 13 лет.
Определение болезни. Причины заболевания
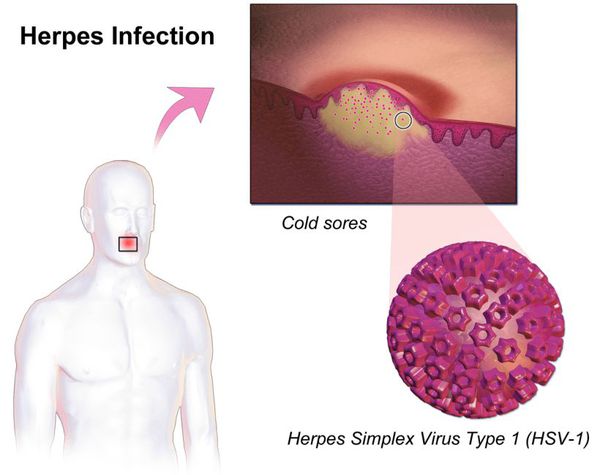
Простой герпес — это высококонтагиозное острое и хроническое инфекционное заболевание, при котором поражается кожа и слизистые оболочки. Его провоцируют вирусы простого герпеса I и II типов, вызывая типичную пузырьковую сыпь и изъязвления, как правило, локализованного характера. У людей с выраженным иммунодефицитом эти вирусы могут вызывать тяжёлые генерализованные формы болезни.
Заболевание входит в TORCH-комплекс, так как влияет на развитие плода: при первичном заражении или реактивации (реже) у беременных оно вызывает врождённую инфекцию.
Этиология
Семейство — Herpesviridae (от греч. herpes — ползучий)
Подсемейство — α-герпесвирусы (Alphaherpesvirinae)
Виды — вирус простого герпеса I, II (Herpes simplex virus I, II)
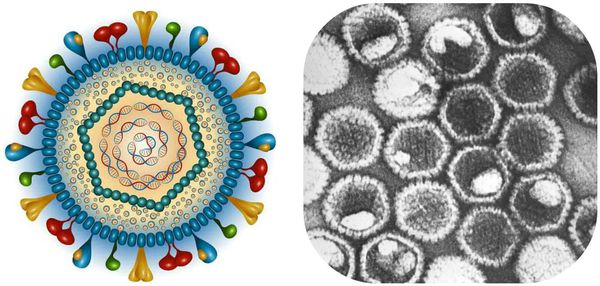
ДНК-содержащие вирусы. В их составе есть нуклеоид — вирусный геном-ДНК, который окружён капсидом сложного строения, покрытым оболочкой белково-липидного характера. Также вирусы содержат гликопротеиды gG1 и gG2, что позволяет провести серотипическое деление вируса герпеса на I и II тип.
Обладают специфической способностью прикрепляться к покровным тканям человека. Это сопровождается постоянной или периодической персистенцией — способностью к размножению в инфицированных клетках без проявлений патологического действия, т. е. простым неактивным носительством.
Эпидемиология
Данным вирусом инфицировано более 90 % населения планеты. После 30-40 лет им заражается почти 100 % людей, причём преимущественно I типом вируса.
Единожды инфицированный человек становится пожизненным носителем вируса одного или обоих типов. Данных об эпизодах самоизлечения нет.
В последнее время появились случаи носительства вируса простого герпеса с отсутствием специфических антител IgG к обоим типам вируса. Клиническое и эпидемиологическое значение этого феномена неизвестно. Возможно, такое явление перекрёстно связано с лицами, которые не поддаются заражению.
Источник инфекции — инфицированный человек. Он заразен в любую фазу болезни или носительства, но преимущественно при обострении.
Вирус может находиться в любой биологической жидкости организма — слюне, сперме, вагинальном секрете, отделяемом пузырьков и других.
Восприимчивость всеобщая. Риск заражения возрастает при травмировании кожи и слизистых оболочек здорового человека и попадании на них инфицированных биологических субстратов. Причём вирус может передаваться даже при отсутствии видимых поражений у инфицированного человека.
Большая часть случаев протекает в виде неактивного носительства. Как правило, первично человек приобретает I тип вируса простого герпеса (с детства), а II тип появляется в период половой зрелости. Однако всё относительно.
Основные способы передачи вируса:
В 20% случаев возможна обратная связь типов вирусов и способов их передачи.
Симптомы простого герпеса
Инкубационный период при приобретённой форме длится 2-14 дней. Чаще всего установить его не удаётся из-за отсутствия манифестации.
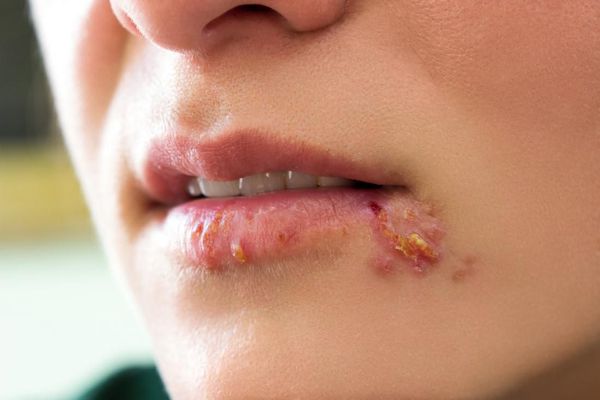
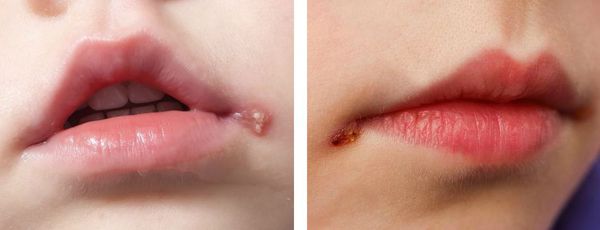
Простой герпес у детей обычно протекать по типу стоматита и гингивита — повышается температура, появляется лихорадка, общая интоксикация, очаговая гиперемия (покраснение) всех слизистых образований ротовой полости, болезненность при жевании, повышенное слюноотделение. Маленькие дети из-за болевых явлений отказываются от еды. В короткий промежуток времени на месте гиперемии появляются мелкие везикулярные высыпания, которые быстро вскрываются, оставляя после себя болезненные эрозии — афты. Увеличиваются и становятся болезненными регионарные лимфоузлы. С течением времени иммунитет укрепляется и симптомы постепенно регрессируют без каких-либо следов поражения. Рецидивы наблюдаются редко.
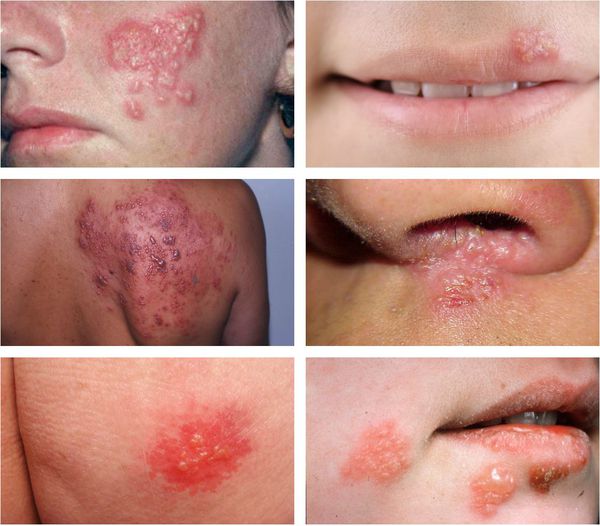
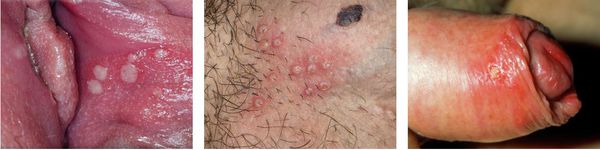
При поражении кожи (преимущественно у взрослых) везикулярные высыпания чаще появляются вокруг рта, крыльев носа, иногда на туловище и ягодицах. Сыпь представляет собой небольшие везикулы с серозным содержимым на слегка гиперемированном фоне кожи. Впоследствии они вскрываются и подсыхают, после чего образуются бесследно отпадающие корки.
Иногда пузырьки сливаются в достаточно большие пузыри. Нередко их содержимое нагнаивается, образуется мокнутий, и присоединяется вторичная стрептококковая или стафилококковая инфекция (стафило- и стрептодермии).
Общее самочувствие, как правило, не изменяется. Иногда может быть несколько увеличен и болезнен регионарный лимфоузел. В основном процесс редко продолжается более недели.
При серьёзных иммунодефицитах инфекция может принять более распространённое (генерализованное) течение. В таком случае возникает синдромом общей инфекционной интоксикации и затрагиваются внутренние органы: увеличивается печень и селезёнка, поражается нервная система (менингоэнцефалиты, энцефалиты и менингиты), а также лёгкие, почки и другие органы. При рецидивах хронической инфекции больные иногда ощущают слабый дискомфорт и пощипывание в области будущих высыпаний.
При генитальном герпесе высыпания появляются на коже и слизистых в области половых органов и промежности. Обычно они сопровождаются болезненностью, гиперемией окружающей ткани, увеличением и болезненностью паховых лимфоузлов. Частота рецидивирования зависит от индивидуальных особенностей иммунной системы.
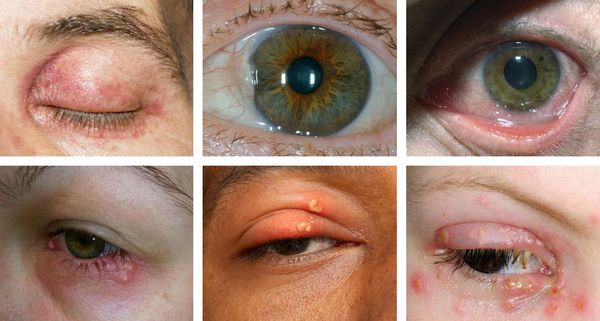
При офтальмогерпесе — герпесе глаз — чаще наблюдаются односторонние поражения из-за перехода первичного процесса на орган зрения, т. е. происходит вторичное поражение. Могут наблюдаться кератиты, блефароконъюнктивиты, иридоциклиты, увеиты, хориоретиниты, невриты зрительного нерва и другие проявления.
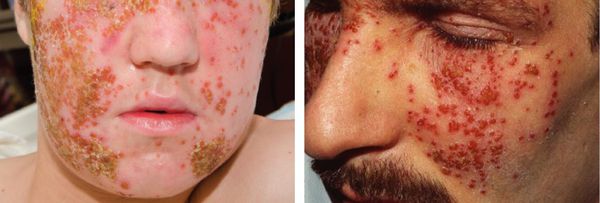
Весьма необычной является форма проявления простого герпеса, известная под названием герпетиформная экзема Капоши — герпетическая экзема. Как правило, она возникает у лиц, имеющих какое-либо кожное заболевание или предрасположенность к нему (дерматоз или «проблемная кожа»). При этом наблюдается интоксикация и высокая температура тела, повсеместно появляются герпетические пузырьки, достаточно обильные и близко расположенные, периодически сливающиеся, иногда с геморрагической пропиткой. В некоторых случаях происходит их нагноение, далее они вскрываются, подсыхают и образуют сплошную корку. При тотальной обработке высыпаний зелёнкой кожа больного приобретает вид кожи крокодила. Заболевание нередко протекает достаточно тяжело, может привести к летальному исходу.
При беременности инфицирование ребёнка происходит:
При первичном инфицировании беременной в первый триместр или при восходящем инфицировании плода зачастую развиваются пороки развития, несовместимые с жизнью, или происходит выкидыш, особенно при заражении II типом вируса герпеса, который является инфицирующим агентом чаще всего — до 80 % случаев.
Патогенез простого герпеса
Ворота инфекции — повреждённая кожа и слизистые оболочки.
Вирус прикрепляется к поверхности клетки эпителия, проникает в неё и начинает размножаться. Это может привести к гибели самой клетки, а при массивном процессе — к явным воспалительным процессам, появлению характерной гиперемии, везикулёзных высыпаний и попаданию вируса в кровь и лимфу. В крови вирус обнаруживается на поверхности эритроцитов, лимфоцитов, тромбоцитов. В этот период вирус может попасть в различные органы и ткани, в т. ч. передаться плоду при первичном заражении матери во время беременности.
Вирус простого герпеса инфицирует чувствительные нервные окончания, паравертебральные нервные ганглии. Оттуда может произойти нейрогенное распространение вируса до кожи, в связи с чем появляются новые высыпания. Они далёки от места первичного внедрения:
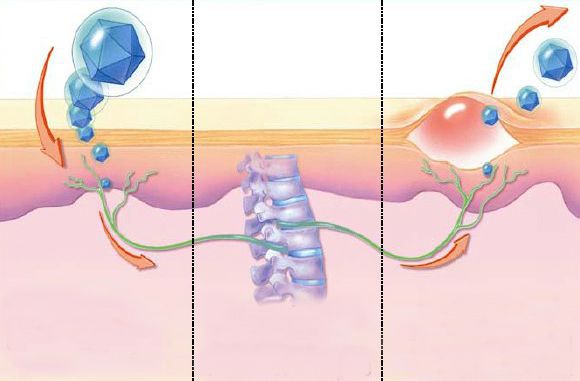
Если иммунная система адекватна, то вирус исчезает из органов и тканей, но при этом пожизненно сохраняется в чувствительных нервных волокнах. Там он может передаваться из клетки в клетку, минуя межклеточное пространство, и в итоге оказывается недоступным для противодействия иммунной системы – т. н. «иммунное ускользание». После этого вирус может более никогда не иметь манифестных проявлений, но при иммунных нарушениях — Т-клеточном иммунодефиците, нарушении продукции интерферона и работы макрофагов — возможна его реактивация, гиперразмножение, выход из нейросенсорных депо и вновь поражение кожи и слизистых оболочек.
Предрасполагающими факторами реактивации вируса могут являться:
Одну из ключевых ролей в появлении симптомов простого герпеса играют макрофаги. Они «позволяют» или «не позволяют» осуществлять размножение вируса внутри себя (т. н. пермиссивность). В первом варианте развивается инфекция с выраженными симптомами, во втором — субклиническая картина заболевания.
Особую роль играет повышение чувствительности организма антигенами вируса. Оно проявляется в развитии местных аллергических реакций замедленного типа в местах высыпаний. При СПИДе данная реактивация приобретает генерализованный вторичный характер с поражением большинства внутренних органов — головного мозга, печени, лёгких, почек и других.
Классификация и стадии развития простого герпеса
В МКБ-10 (Международной классификации болезней) выделяют на две группы, связанных с вирусом простого герпеса:
По степени тяжести простой герпес бывает:
По форме возникновения заболевания различают:
По форме и распространённости инфекции выделяют четыре стадии простого герпеса:
По клинической картине и локализации высыпаний различают две формы простого герпеса:
Осложнения простого герпеса
Диагностика простого герпеса
Лабораторная диагностика:
Дифференциальная диагностика:
Лечение простого герпеса
Больные с осложнёнными формами простого герпеса подлежат госпитализации в инфекционный стационар. Остальные пациенты при отсутствии серьёзных сопутствующих состояний могут лечиться на дому амбулаторно.
Существует две стратегии этиотропного лечения:
Применение средств местного действия в виде мазей и кремов имеет ограниченный малоэффективный результат.
Высокоэффективное этиотропное лечение вполне может быть дополнено средствами повышения иммунной защиты организма (при наличии резервов организма) и витаминотерапией.
Прогноз. Профилактика
При неосложнённых формах болезни прогноз благоприятный, при генерализованных или формах с поражением ЦНС — серьёзный, возможен летальный исход или инвалидизация.
Важное значение в профилактике развития манифестной инфекции имеет ведение здорового образа жизни, правильное питание, предупреждение и лечение сопутствующих заболеваний, избегание переохлаждений и стрессов.
Специальных ограничительных мероприятий при заболевании не проводят. Больного следует обеспечить индивидуальной посудой, не допускать поцелуев с неинфицированными людьми.
При генитальном герпесе высокоэффективным мероприятием является использование презерватива. Определённое снижение риска распространения инфекции даёт регулярный приём противогерпетических средств уже инфицированным людям.
Если у беременной выявлен генитальный герпес при наличии частых рецидивов, высокой вирусной нагрузке области гениталий и родовых путей, то пациентке показан профилактический приём противогерпетических средств, начиная с 36 недели беременности и до родов (если планируются естественные роды). Или же выполняется плановое кесарево сечение.