Гетерогенное заболевание что это
Гетерогенное заболевание что это
Существуют три основные характеристики, присущие опухолевым клеткам. Во-первых, это бесконтрольный рост вне зависимости от клеточного окружения прилегающих тканей. Во-вторых, раковые клетки всегда находятся на той или иной стадии анаплазии, то есть теряют клеточную специализацию. В-третьих, раковые клетки способны метастазировать, то есть распространяться по организму и проникать в ткани далеко за пределы области развития первичной опухоли.
Эти три характеристики присущи клеткам большинства известных видов рака, однако существуют исключения. Действительно, в опухолевой ткани нарушены нормальные регуляторные механизмы контроля роста. Тем не менее обнаруживаются участки опухолевой ткани, где происходит контактное торможение роста неоплазии.
Далее, хотя большинство раковых клеток является «недифференцированными», то есть они как бы произошли от более раннего предшественника процесса тканевой дифференцировки, при некоторых видах рака опухолевые клетки сохраняют те или иные функции зрелой ткани, из которой они произошли. И только метастазирование является уникальным свойством, присущим только раковым клеткам.
Более того, поскольку чаще всего именно метастазы становятся причиной смерти больных раком, изучение биологических механизмов метастазирования является одной из ключевых задач современных исследований в онкологии.
В отдельных статьях на сайте мы рассмотрим события, происходящие вслед за воздействием на организм канцерогена и ведущие к развитию инвазивного метастазирующего злокачественного новообразования.
Большинство человеческих неоплазий по своей природе являются моноклональными. Это означает, что при канцерогенном воздействии на организм обычно первоначально поражается всего одна клетка и вся опухоль представляет собой результат размножения этой единственной клетки. Существуют две основные группы доказательств этой концепции.
Первая группа доказательств. Некоторые женщины бывают гетерозиготны по двум формам фермента глюкозо-6-фосфатдегидрогеназе (Г6ФД). Ген, кодирующий этот фермент, находится в Х-хромосоме, и женские гетерозиготы наследуют этот ген либо по отцовской, либо по материнской линии.
Если у женщины с гетерозиготным набором генов будет повреждена одна из Х-хромосом, каждая клетка ее тела будет содержать только одну из этих двух форм фермента. Обследования больных гематологическими видами рака, возникающими из гетерозиготности по гену Г6ФД, показали, что их раковые клетки всегда содержат только одну форму фермента. Это является сильным доказательством того, что рак развивается из одиночной клетки, несущей ту или иную форму гена.
При хронической гранулоцитарной лейкемии у больных обнаруживается рестрикция экспрессии ферментов в клетках гранулоцитарного ряда и, что особенно важно, в эритроцитах и тромбоцитах. Таким образом, процесс злокачественной трансформации поражает стволовые клетки.
Описанные подходы трудно применимы к раку. По-видимому, рак развивается из некоего «поля вероятности», когда толчок к развитию опухоли из тканевых клеток дают сразу несколько клональных линий, возникающих практически одновременно. Аналитические исследования женщин с раком мочевого пузыря показали, что у них все опухолевые клетки обнаруживают супрессию по одному и тому же локусу Х-хромосомы, тогда как здоровые клетки мочевого пузыря демонстрируют случайные супрессии одной из двух Х-хромосом.
Приведенный факт также подтверждает моноклональную теорию происхождения рака. Кроме того, в исследованиях было показано, что хотя делеция 9q участка хромосомы обязательно присутствует во всех раковых клетках, в некоторых клетках была также обнаружена потеря 17р и 18q участков, что предположительно связано с более поздними этапами развития опухоли. Это также говорит о том, что хотя возникновение и первичное развитие опухоли происходят из одной клетки, в процессе ее роста возможно возникновение и нарастание генетической изменчивости составляющих ее клеток.
Вторая группа доказательств моноклональной природы рака происходит из исследований лимфом и различных лимфоидных форм рака. Было показано, что иммуноглобулины, продуцируемые лимфоидными неоплазиями (и встроенные в мембрану, и выделяемые в кровяное русло, как в случае с миеломой), почти всегда являются моноклональными, принадлежащими к одному классу и обнаруживающими одинаковую рестрикцию экспрессии легких цепей.
Безоговорочное принятие теории моноклональности рака иногда заставляет исследователей приписывать раковым опухолям гораздо более предсказуемое поведение, чем это есть на самом деле. Реальное же положение вещей такое, что, несмотря на моноклональное происхождение, неоплазии в процессе своего развития обнаруживают все большую и большую гетерогенность. Этот факт необходимо всегда учитывать при лечении онкологических заболеваний и в оценке природы опухолевых метастазов.
Как же вообще возникает гетерогенность, если раковая опухоль первично моноклональна? Дело в том, что процесс злокачественной трансформации всегда сопровождается общей генетической нестабильностью, что вызывает многочисленные фенотипические изменения первоначально однородных клеток. Некоторые из мутирующих клеток выживают и дают начало новым линиям развития, некоторые погибают в результате мутации. Выживаемость мутировавших клеток зависит от их гормональной и биохимической стабильности, а также от возможности их распознавания иммунной системой.
Таким образом, зрелую опухоль можно рассматривать как конгломерат клеток моноклинального происхождения, но различающихся по способности к метастазированию, устойчивости к цитотоксическим препаратам и атакам иммунной системы организма.
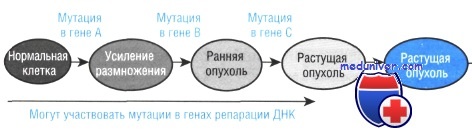
Процесс постепенного накопления хромосомных изменений в ходе прогрессии опухоли показан на рисунке на примере развития рака толстой кишки из полипа толстой кишки. По мере роста опухоли и возрастания генетической нестабильности в ее клетках возникают многочисленные разрывы хромосом, делеции и редупликации генов. Морфологически это сопровождается изменчивостью клеточных ядер и ростом числа плеоморфных цитологических форм.
Опухолевые клетки многих видов рака содержат мутации по гену, кодирующему белок р53. Этот ген кодирует наработку ядерного фосфопротеина, который участвует в контроле клеточного цикла, запрещая вступление клетки в фазу G1, если обнаруживаются повреждения клеточной ДНК. В нормальных клетках под действием ультрафиолетового облучения или цитотоксических препаратов происходит резкое увеличение содержания р53, что связано со стабилизацией белка после трансляции.
Деактивация функций р53 в результате мутации приводит к тому, что клетка вступает в митоз даже с ошибками в своем генетическом коде. Мутации в гене р53 раковых клеток приводят к конформационным изменениям фермента и делают его неактивным. Мутантные формы фермента теряют способность связываться с молекулами ДНК. Таким образом, мутация белка р53 является ключевым моментом опухолевой профессии, когда злокачественные клетки вступают в клеточный цикл без предварительной репарации поврежденных участков ДНК. В дальнейшем происходит процесс все большего накопления мутационных изменений.
Популяция раковых клеток, выросшая как потомство одной единственной клетки, в ходе своего развития обнаруживает значительную изменчивость как по скорости роста отдельных субпопуляций, так и по их цитоплазматической организации, гормонально-рецепторному статусу, чувствительности к радиоактивному облучению и цитотоксическим препаратам. В качестве примера можно привести мелкоклеточный рак легкого.
При этом заболевании клетки первичной опухоли и отдаленных метастазов значительно отличаются друг от друга по уровню цитоплазматического кальцитонина, гистаминазы и L-дофаминовой декарбоксилазы. Обнаруживаются также кариотипические различия клеток первичных и вторичных опухолей.
Гетерогенность опухолей представляет собой громадную проблему для терапии рака. Если опухоль обнаруживает изменчивость клеточных фенотипов и антигенной экспрессии, становится очень трудно оценить, какой вид иммунотерапии может дать положительный лечебный эффект. Аналогично, наличие в единичной опухоли субпопуляций клеток с различной чувствительностью к тем или иным цитостатическим препаратам обусловливает ее резистентность к химиотерапии, которая часто выявляется в ходе проведения лечения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гетерогенное заболевание что это
Существенный компонент медицинской генетики — распознавание и описание генотипов, ответственных за конкретные патологические фенотипы. Важно не придерживаться чрезмерно упрощенческого понимания отношений между моногенными мутациями и фенотипами болезни.
При тщательном анализе генетического заболевания, наследуемого как моногенное, часто оказывается, что оно генетически неоднородно; т.е. включает множество аналогичных фенотипов, в действительности определяемых разными генотипами в различных локусах.
Генетическая гетерогенность может быть результатом других мутаций в том же локусе (аллельная гетерогенность), мутаций в других локусах (локусная гетерогенность) или обеих вместе. Распознавание генетической гетерогенности — важный аспект клинического диагноза и генетического консультирования.
С другой стороны, различные фенотипы, наследуемые в разных семьях, могут быть вызваны другими мутантными аллелями в том же гене. Этот феномен, известный как клиническая или фенотипическая гетерогенность, хорошо известен, и его следует принимать во внимание при согласовании генотипа и фенотипа.
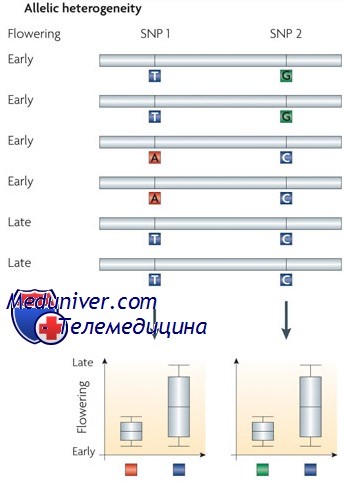
Аллельная гетерогенность
Аллельная гетерогенность — важная причина клинической вариабельности. Множество локусов содержат более одного мутантного аллеля; фактически в любом локусе может быть несколько мутаций. Например, среди пациентов с муковисцидозом по всему миру обнаружено почти 1400 разных мутаций в гене трансмембранного регулятора муковисцидоза (CFTR, англ. cystic fibrosis transmembrane regulator).
Иногда разные мутации вызывают клинически неразличимые заболевания. В других случаях различные мутантные аллели в том же локусе вызывают аналогичный фенотип, но разной степени тяжести; например, некоторые мутации CFTR вызывают классический муковисцидоз с недостаточностью поджелудочной железы, тяжелой прогрессирующей патологией легких и врожденным отсутствием семенного канатика у мужчин, тогда как другие мутантные аллели вызывают патологию легких на фоне нормальной функции поджелудочной железы, а третьи имеют только аномалию мужского репродуктивного тракта.
Если любой конкретный мутантный аллель в целом редко встречается в популяции, большинство людей с редким аутосомно-рецессивным заболеванием скорее сложные (компаундные) гетерозиготы, чем истинные гомозиготы. Поскольку разные аллельные комбинации могут иметь отчасти различающиеся клинические последствия, клиницисты должны принимать во внимание аллельную гетерогенность как одно из возможных объяснений вариабельности среди пациентов с одним и тем же заболеванием.
Тем не менее, существуют некоторые достоверные исключения из наблюдения, что компаундные гетерозиготы более частые, чем истинные гомозиготы. Во-первых, когда больные наследуют один и тот же мутантный аллель от единокровных родителей, несущих одну ту же мутацию, унаследованную от общего предка. Во-вторых, один мутантный аллель может быть ответственным за большую часть случаев аутосомно-рецессивного заболевания в конкретной этнический группе, и тогда многие пациенты из этой группы будут гомозиготными для данного аллеля.
В-третьих, когда заболевание имеет незначительную аллельную гетерогенность, поскольку фенотип болезни, вызываемый конкретной мутацией, характерен для данной мутации (например, серповидноклеточная анемия).
Локусная гетерогенность
Для многих фенотипов один только анализ родословной оказывается достаточным, чтобы продемонстрировать локусную гетерогенность. Например, давно известно, что пигментный ретинит, частая причина снижения зрения из-за перерождения фоторецепторов, передается по аутосомно-доминантному, аутосомно-рецессивному и сцепленному с полом типу.
За последние годы, благодаря анализу родословных и генному картированию, показано, что гетерогенность даже шире, и существуют, по крайней мере, 43 локуса, ответственных за 5 Х-сцепленных, 14 аутосомно-доминантных и 24 аутосомно-рецессивных формы пигментного ретинита, не связанного с другими фенотипическими аномалиями.
А если включать заболевания, при которых пигментный ретинит обнаруживают вместе с другими дефектами, например, умственной отсталостью или глухотой, то описано почти 70 других генетических болезней с пигментным ретинитом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гетерогенное заболевание что это
Вашингтон, 6-10 апреля 2013
Основными темами, обсуждаемыми на конгрессе Американской Ассоциации по Изучению Рака (AACR), стали гетерогенность опухоли и теория клонов.
2 метастаза одной первичной опухоли. Один метастаз сохранил молекулярно-генетические признаки первичной опухоли и развивается из ее клеток (подклон «А»), второй метастаз – в том же органе – в силу генетических мутаций образован подклоном клеток «Б», соответствующих гистологически первичной опухоли, но отличающийся, например, мутацией PIK3CA. Дальнейшее развитие болезни: метастаз, образованный подклоном «А», остается без изменений в развитии и размерах; метастаз, образованный подклоном «Б», начинает метастазировать самостоятельно. В других органах появляются метастазы, отличные по молекулярно-генетическим признакам от первичной опухоли, соответствующие типу «Б», и, как правило, с более агрессивным течением. В определенный момент появляются подклоны «В», «Г» и т.п. – каждый со своим развитием и течением.
В описанном случае речь идет о внутриопухолевой гетерогенности. Внутриопухолевая гетерогенность также встречается в буквальном смысле внутри одной опухоли, т.е. внутри одного опухолевого очага: разные участки опухолевого очага образованы подклонами «А» и «Б».
Второй вариант – это межопухолевая гетерогенность. У каждого пациента с единым гистологическим вариантом, например, с немелкоклеточным раком легкого (НМРЛ), существует свой клон. У пациента 1 – клон «1», у пациента 2 – клон «2». И, конечно, течение болезни разное. Это хорошо изучено на примере НМРЛ, с мутацией EGFR или без нее.
В теории – необходимо подавлять развитие каждого подклона, персонализировать терапию, влиять на каждую «мутацию», обеспечивающую выживание и деление клетки. Ведь уже известно из практики, что резистентность к терапии может быть вызвана устойчивостью определенного подклона (или даже одной клетки-предшественника подклона).
Схема лечения пациента в недалеком будущем может выглядеть так:
Об Американской Ассоциации по Изучению Рака (AACR)
Американская ассоциация, объединяющая специалистов, занимающихся фундаментальной онкологией и трансляционными исследованиями во всем мире. Ассоциация была создана в 1907 году 11 врачами, которых заинтересовал вопрос изучения рака. Сегодня AACR – это крупнейшее ведущее профессиональное сообщество. Например, 20% всех цитируемых в онкологии публикаций приходятся на журналы AACR, а в комитеты входят Нобелевские лауреаты, в том числе действующий директор Национального Института Рака (NCI). Ежегодный Конгресс AACR – «аналог» конгресса ASCO в фундаментальной онкологии.
Современные подходы к диагностике наследственных нарушений соединительной ткани
В статье изложены современные представления о терминологии и номенклатуре наследственных нарушений (дисплазий) соединительной ткани, приведены диагностические критерии отдельных клинических вариантов этой патологии.
Наследственные нарушения соединительной ткани (ННСТ) или, как их еще называют в России, дисплазии соединительной ткани — одна из наиболее дискуссионных проблем клинической медицины. До недавних пор в нашей стране существовала терминологическая путаница и отсутствие единого подхода к оценке этих состояний. Главным образом, это касалось так называемых недифференцированных ННСТ, включавших все варианты врожденной «слабости» соединительной ткани за исключением моногенных синдромов Марфана, Элерса–Данло и ряда других. Отсутствие четких диагностических критериев приводило к тому, что любые случаи выявления каких-либо признаков дизэмбриогенеза произвольно обозначались как ННСТ [1]. Подобная широкая и необоснованная трактовка приводила к гипердиагностике, создавала предпосылки для психогенных ятрогений.
Для преодоления существующих противоречий в дефинициях и критериях диагноза отдельных клинических вариантов ННСТ комитет экспертов Всероссийского научного общества кардиологов (ВНОК) разработал первые национальные рекомендации, принятые на Российском национальном конгрессе кардиологов в 2009 г. и пересмотренные в 2012 г. [2]. Эти усилия позволили существенно сблизить подходы к диагностике ННСТ в нашей стране с международной практикой.
Термин «ННСТ» объединяет генетически и клинически гетерогенную группу заболеваний на основе общности нарушений формирования соединительной ткани в эмбриональном и постнатальном периодах. Генетическая гетерогенность ННСТ подразумевает моногенную и мультифакториальную природу заболевания. Первая реализована в группе относительно редких моногенных синдромов Марфана и Элерса–Данло, сопряженных с мутациями генов белков внеклеточного матрикса. В возникновении наиболее многочисленной группы ННСТ мультифакториальной природы значимы как мутации большого числа различных генов, так и воздействие факторов внешней среды. Клиническая гетерогенность ННСТ связана с повсеместным распространением в организме соединительной ткани и многообразием проявлений врожденной «слабости» ее отдельных компонентов.
Поскольку для большинства ННСТ отсутствуют специфические лабораторные маркеры, а молекулярно-генетические исследования остаются малодоступными и значимыми лишь по отношению к моногенным вариантам патологии, приоритет в диагностике остается за клиническими признаками. В упомянутых выше рекомендациях подобные признаки систематизированы, из них выделены те, которые имеют наибольшее диагностическое значение и включены в опубликованные зарубежные рекомендации по диагностике наиболее изученных ННСТ (Гентские критерии синдрома Марфана [3], Вилльфраншские критерии синдрома Элерса–Данло [4], Брайтонские критерии синдрома гипермобильности суставов [5]). Существенно, что от этих признаков четко отграничены стигмы дисэмбриогенеза (малые аномалии развития), которые хотя и выявляются при ННСТ чаще, чем в общей популяции (что подтверждает роль нарушений эмбриогенеза в формировании ННСТ), но собственно маркерами «слабости» соединительной ткани не являются. Перечень основных внешних и висцеральных маркеров ННСТ приведен в табл. 1. Совокупность выявленных признаков у конкретного пациента позволяет диагностировать тот или иной вариант соединительнотканной патологии.
В настоящее время применительно к ННСТ рекомендовано отказаться от признанных устаревшими терминов «дифференцированные» и «недифференцированные» и предложено говорить о нарушениях классифицируемых (имеющих согласованные рекомендации по диагностике) и неклассифицируемых (или диспластических фенотипах) — табл. 2 [1, 2]. Согласованные рекомендации по диагностике имеют: из моногенных ННСТ — синдромы Марфана и Элерса–Данло, из мультифакториальных — MASS-фенотип, первичный пролапс митрального клапана, синдром гипермобильности суставов.
Синдром Марфана — аутосомно-доминантная патология, в основе которой лежит мутации гена фибриллина-1 (FBN1). Фибриллин составляет основу эластических волокон; его особенно много в межклеточном матриксе сосудистой стенки, сердца, хрящей, хрусталика, роговицы и цинновой связки. Мутации гена FBN1 приводят к неполноценности фибриллина и нарушению структуры и функции перечисленных органов и тканей.
Диагностика синдрома Марфана основана на Гентских критериях (1996, 2010 гг.). В последней версии Гентских критериев [3] было упразднено деление на большие и малые признаки, ряд малых признаков исключен. Одновременно было выделено два наиболее специфичных признака — дилатация и/или расслоение аорты и эктопия хрусталика и предложена балльная оценка остальных признаков для расчета степени системного вовлечения соединительной ткани (СВСТ) — табл. 3. В отсутствие семейного анамнеза диагноз синдрома Марфана может быть установлен при наличии расширения корня аорты и эктопии хрусталика либо при сочетании расширения аорты с мутацией гена FBN1 или с совокупностью признаков СВСТ на 7 и более баллов. При отягощенном семейном анамнезе диагноз правомерен, если выявляется один из специфичных признаков или если СВСТ составляет 7 и более баллов.
Синдром Элерса–Данло — гетерогенная группа коллагенопатий с различными типами наследования и общими клиническими проявлениями в виде гипермобильности суставов и повышенной эластичности кожи. Диагностика синдрома Элерса–Данло основана на Вильфраншских критериях [4]. Вместо ранее признаваемых десяти типов болезни в настоящее время выделены шесть: классический, гипермобильный, сосудистый, кифосколиотический, артрохалазия, дерматоспараксис; для каждого из них определены большие и малые диагностические критерии. Для клинической диагностики необходимо наличие хотя бы одного большого критерия (табл. 4).
MASS-фенотип (или марфаноподобный синдром) — акроним, обозначающий пролапс митрального клапана (Mitral valve prolapse), расширение аорты (Aotic dilatation), изменения кожи (Skin) и костей скелета (Skeleton). MASS-фенотип можно диагностировать при пограничном расширении корня аорты, наличии хотя бы одного скелетного проявления и признаков СВСТ на 5 и более баллов. Как можно заметить, при отсутствии данных молекулярно-генетической диагностики MASS-фенотип трудно (если вообще возможно) отличить от синдрома Марфана с неполным набором признаков.
Пролапс митрального клапана диагностируется при систолическом смещении одной или обеих створок митрального клапана за линию клапанного кольца в парастернальной продольной позиции более чем на 2 мм. Морфологическим субстратом первичного пролапса митрального клапана как одного из вариантов ННСТ выступает миксоматоз створок, отражающий дезорганизацию коллагеновых фибрилл и накопление в них кислых гликозаминогликанов.
При оценке пролапса митрального клапана рекомендуется обращать внимание на глубину пролабирования, толщину створок и степень митральной регургитации — эти параметры существенны для прогнозирования нарушений внутрисердечной и общей гемодинамики. При высокой степени митральной регургитации и толщине створки более 5 мм (признак ее миксоматозной дегенерации) вероятность гемодинамических расстройств достоверно повышается. Придается значение и признакам СВСТ как весомому подтверждению принадлежности пролапса к ННСТ (кроме первичного существуют и вторичные пролапсы митрального клапана, не связанные с врожденной «слабостью» соединительной ткани, а развивающие при поражениях миокарда левого желудочка — миокардитах, миокардиодистрофии, коронарной патологии). Если пролабирование створок митрального клапана составляет не более 2 мм, они не утолщены, а митральная регургитация отсутствует или минимальна, оснований констатировать патологию нет. В этом случае может идти речь о варианте нормы у лиц астенической конституции или преходящем «физиологическом» пролапсе у подростков.
Первичный пролапс митрального клапана следует отличать от митрального пролапса как принадлежности моногенных ННСТ или MASS-фенотипа. Дифференциальными критериями (к сожалению, не абсолютными) являются диаметр аорты и количество признаков СВСТ.
В основе синдрома гипермобильности суставов лежат мутации генов, кодирующих коллаген, эластин, фибриллин и тенасцин Х, приводящие к слабости суставных связок. Синдром характеризуется избыточным диапазоном движений в суставах, сопровождающимся клинической симптоматикой (привычные вывихи, артралгии). При диагностике гипермобильности суставов используется девятибалльная шкала P. Beighton [5], предусматривающая оценку способности выполнения следующих пяти движений: пассивного сгибания V пястно-фалангового сустава более чем на 90°, пассивного приведения I пальца к предплечью, пассивного переразгибания коленных и локтевых суставов более 10°, свободного касания ладонями пола при прямых ногах. Первые четыре движения — парные (присваивается по баллу за возможность выполнить движение на каждой из сторон), последнее — непарное (максимально возможный суставной счет — 9 баллов). Гипермобильность суставов, составляющая не менее 4 баллов, и артралгии не менее чем в четырех суставах продолжительностью от трех месяцев и являются большими диагностическими критериями данной патологии.
Поскольку слабость связочного аппарата является универсальным признаком соединительнотканной недостаточности, синдром гипермобильности суставов исключается при наличии синдромов Марфана, Элерса–Данло и ряда других близких им по клиническим проявлениям ННСТ.
Неклассифицируемые ННСТ, не подходящие под согласованные критерии диагностики, встречаются в повседневной практике гораздо чаще. Многообразие их клинических вариантов систематизировано в следующие варианты: МASS-подобный фенотип, марфаноидная внешность, элерсоподобный фенотип, доброкачественная гипермобильность суставов, неклассифицируемый фенотип. Первые два из них фенотипически напоминают синдром Марфана, два следующие — синдром Элерса–Данло, не отвечая полностью критериям диагноза указанных состояний. В основу диагностики неклассифицируемых ННСТ положены те же принципы (совокупность внешних и висцеральных фенотипических проявлений), что используются при выявлении ННСТ, имеющих согласованные рекомендации, однако диагностический порог при этом менее высокий.
MASS-подобный (марфаноподобный) фенотип характеризуется пограничным значением размера корня аорты в сочетании с миопией и/или пролапсом митрального клапана и наличием признаков СВСТ менее 5 баллов (в отличие от MASS-фенотипа, при котором — 5 баллов и более).
Марфаноидная внешность характеризуется только признаками вовлечения костной системы (обычно у астеников) при отсутствии висцеральных изменений. При этом допускаются менее строгие скелетные изменения, чем те, что необходимы для констатации синдрома Марфана, однако наличие долихостеномелии и арахнодактилии признается обязательным.
Главное условие отнесения пациента к элерсоподобному фенотипу — наличие не менее двух признаков вовлечения кожи, исключая большие критерии синдрома Элерса–Данло.
Доброкачественная гипермобильность суставов констатируется на основе выявления избыточного диапазона движений в суставах, но без клинической симптоматики.
К неклассифицируемому фенотипу предложено относить случаи выявления не менее шести малых внешних и/или висцеральных признаков врожденной «слабости» соединительной ткани, не попадающие под критерии других вышеназванных синдромов и фенотипов.
Неспецифичность внешних и висцеральных маркеров «слабости» соединительной ткани, известная условность диагностических критериев диспластических фенотипов (некоторые из которых отличаются не качественно, а количественно — по числу констатированных признаков) затрудняют распознавание отдельных ННСТ. В процессе диагностики следует руководствоваться своеобразной иерархией ННСТ, составляющей непрерывный фенотипический континуум: от моногенных синдромов через диспластические фенотипы к неклассифицируемому фенотипу и норме. В соответствии с этим подходом наличие признаков синдрома Марфана или Элерса–Данло исключает диагноз неклассифицируемой ННСТ. Наличие критериев MASS-фенотипа (в числе которых фигурируют пролапс митрального клапана и изменения скелета) не дает оснований говорить о первичном пролапсе митрального клапана или марфаноидной внешности. Точно так же диагноз первичного пролапса митрального клапана отвергает заключение о любом из диспластических фенотипов. Наименьший клинический и диагностический вес имеет неклассифицируемый фенотип.
Литература
ГБУЗ НО ГКБ № 30, Нижний Новгород
Abstract. The article is devoted to modern concepts of terminology and nomenclature of hereditary disorders of connective tissues. The authors adduce diagnostic criteria of particular clinical variants of this pathology.
_575.gif)
_575.gif)