Гетероплазмия митохондриальной днк что это
Гетероплазмия митохондриальной днк что это
Некоторые родословные наследственных болезней не могут объясняться типичным менделирующим наследованием ядерных генов. Теперь известно, что они вызваны мутациями митохондриального генома и проявляют материнское наследование. Болезни, вызываемые мутациями в митДНК, демонстрируют множество необычных особенностей, происходящих из уникальных характеристик биологии и функции митохондрий.
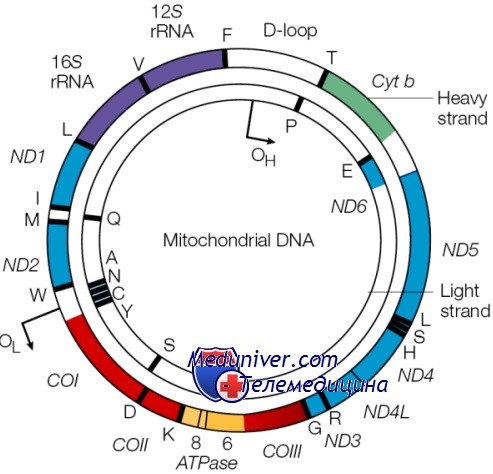
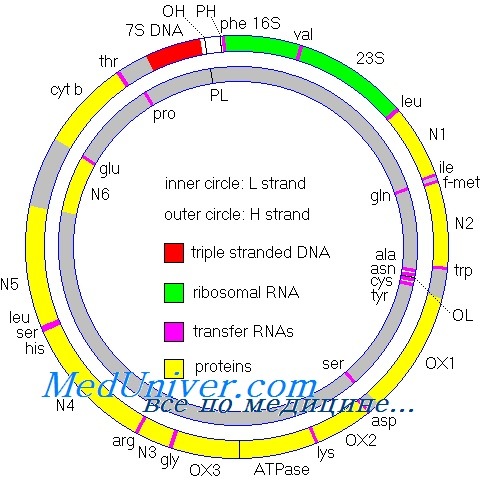
Митохондриальный геном
Не вся РНК и белок, синтезируемые в клетке, кодируются ДНК ядра; небольшая, но важная доля кодируется в генах митохондриального генома. Этот геном состоит из кольцевой хромосомы размером 16,5 килобазы, располагающейся в органеллах митохондриях, а не в ядре. Большинство клеток содержит по крайней мере 1000 молекул митДНК, распределенных по сотням отдельных митохондрий. Важное исключение — зрелый овоцит, имеющий более 100 000 копий митДНК, формирующих до одной трети общего содержания ДНК в этих клетках.
Митохондриальная хромосома содержит 37 генов. Они кодируют 13 полипептидов — компонентов ферментов окислительного фосфорилирования, два типа рРНК и 22 тРНК, необходимых для трансляции транскриптов генов митохондрий. Остальные полипептиды комплекса окислительного фосфорилирования кодируются ядерным геномом.
В митДНК обнаружено более 100 различных перестроек и 100 разных точковых мутаций, вызывающих болезни у человека, часто поражающие ЦНС и мышечно-скелетную систему (например, миоклонус-эпилепсия с «рваными» красными волокнами — MERRF). Болезни, вызванные этими мутациями, имеют отличающийся тип наследования из-за трех необычных характеристик митохондрий: репликативной сегрегации, гомоплазмии и гетероплазмии, а также материнского наследования.
Репликативная сегрегация митохондриальной хромосомы
Первая уникальная характеристика митохондриальной хромосомы — отсутствие управляемой сегрегации, наблюдаемой в митозе и мейозе 46 ядерных хромосом. При делении клетки многочисленные копии митДНК в каждой митохондрии клетки копируются и произвольно расходятся во вновь синтезированные митохондрии. Митохондрии, в свою очередь, случайно распределяются между дочерними клетками. Этот процесс известен как репликативная сегрегация.
Гомоплазмия и гетероплазмия митохондриальной хромосомы
Вторая уникальная характеристика генетики митДНК возникает из-за того, что большинство клеток содержат много копий молекул митДНК. Когда мутация возникает в митДНК, она сначала присутствует только в одной из молекул в митохондрии. В ходе репликативной сегрегации митохондрия, содержащая мутантную митДНК, производит многочисленные копии мутантнои молекулы.
При делении клетка, содержащая смесь нормальных и мутантных митохондриальных ДНК, может передавать в дочерние клетки весьма различающиеся пропорции мутантнои и дикой митДНК. Одна дочерняя клетка может случайно получить митохондрии, содержащие чистую популяцию нормальных или чистую популяцию мутантных митохондриальных ДНК (ситуация, известная как гомоплазмия). Кроме того, дочерняя клетка может получить смесь митохондрий с мутацией и без нее (гетероплазмия).
Поскольку фенотипическая экспрессия мутации в митДНК зависит от относительных пропорций нормальной и мутантнои митДНК в клетках, формирующих различные ткани, неполная пенетрантность, переменная экспрессивность и плейотропия — типичные характеристики митохондриальных болезней.
Материнское наследование митохондриальной ДНК
Результат, определенный характеристиками генетики митДНК, называется материнским наследованием. Митохондрии сперматозоидов обычно отсутствуют в эмбрионе, поэтому митДНК наследуется от матери. Таким образом, все дети женщины, гомоплазмической по мутации митДНК, унаследуют мутацию, тогда как ни один из потомства мужчины, несущего ту же мутацию, не унаследует дефектную ДНК.
Материнское наследование гомоплазмической мутации митДНК, вызывающей наследственную нейропатию зрительного нерва Лебера.
Особенности материнского наследования при гетероплазмии у матери выявляют дополнительные характеристики генетики митДНК, имеющие медицинское значение. Во-первых, небольшое число молекул митДНК в развивающихся овоцитах впоследствии увеличивается до огромного количества, наблюдаемого в зрелых овоцитах. Это ограничение с последующим умножением митДНК в ходе овогенеза характеризуют так называемое «бутылочное горлышко» генетики митохондрий.
Именно поэтому вариабельность процентного содержания мутантных молекул митДНК, обнаруживаемая в потомстве матери с гетероплазмией, возникает, по крайней мере частично, вследствие увеличения только части митохондриальных хромосом в овогенезе. Можно ожидать, что мать с высокой пропорцией мутантных молекул митДНК более вероятно произведет яйцеклетки с высокой пропорцией мутантных молекул митДНК, и, следовательно, более клинически пораженное потомство, чем мать с более низкой пропорцией. Есть одно исключение из материнского наследования, когда у матери имеется гетероплазмия по делеции в митДНК; по неизвестным причинам делеционная молекула митДНК обычно не передается от клинически больных матерей их детям.
Хотя митохондрии почти всегда наследуются исключительно через мать, существует, по крайней мере, один пример отцовского наследования митДНК у пациентов с митохондриальной миопатией. Следовательно, у пациентов с наблюдаемыми спорадическими мутациями митДНК должна учитываться редкая возможность отцовского наследования митДНК.
Точное определение семейной родословной — важная часть работы с каждым пациентом. Родословные могут демонстрировать как типичные менделирующие варианты наследования, так и более редкие, вызванные митохондриальными мутациями и половым мозаицизмом; или сложные варианты семейных случаев, не соответствующие ни одному из типов наследования. Определение типа наследования важно не только для установления диагноза у пробанда, это также идентифицирует других индивидуумов в семье, находящихся в группе риска и нуждающихся в обследовании и консультировании.
Несмотря на сложные цитогенетические и молекулярные анализы, используемые генетиками, точная семейная история, включая родословную семьи, остается фундаментальным средством для всех врачей и генетических консультантов, используемым при планировании индивидуального лечения пациентов.
Характеристика митохондриального наследования:
• Женщины, гомоплазматические по мутации, передают эту мутацию всем детям; мужчины с аналогичной мутацией — нет.
• Женщины, гетероплазматические по точко-вым мутациям и дупликациям, передают их всем детям. Доля мутантных митохондрий у потомков и, следовательно, риск развития и тяжесть болезни могут значительно меняться в зависимости от доли мутантных митохондрий у матери, а также случайно, вследствие небольшого числа митохондрий в «бутылочном горлышке» при созревании овоцитов. Гетероплазматические делеции обычно не наследуются.
• Доля мутантных митохондрий в разных тканях гетероплазматических по мутации пациентов может значительно меняться, вызывая различные проявления болезни в одной семье с гетероплазмией митохондриальной мутации. Часто наблюдаются плейотропизм и вариабельная экспрессивность у разных больных в одной семье.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Митохондриальная патология у детей
Представлены данные о митохондриальных болезнях в детском возрасте. Рассматриваются исторические, этиопатогенетические и генетические аспекты этой группы болезней. Описаны основные виды митохондриальной патологии, подходы к диагностике и современные предс
The article focuses on mitochondrial disorders in infancy and childhood. Authors consider historical, etiopathogenic and genetic aspects of this group of diseases. Main types of mitochondrial pathologies are described, as well as approaches to diagnostics and contemporary ideas of potential treatment methods.
Митохондриальные болезни — это группа наследственной патологии, возникающей в результате нарушений клеточной энергетики, характеризующаяся полиморфизмом клинических проявлений, выражающаяся в преимущественном поражении центральной нервной системы и мышечной системы, а также других органов и систем организма [1].
Альтернативное определение митохондриальной патологии гласит, что это обширная группа патологических состояний, обусловленных генетическими, структурными и биохимическими дефектами митохондрий, нарушением тканевого дыхания и, как следствие, недостаточностью энергетического обмена.
Как указывает A. Munnich, «митохондриальные заболевания могут вызывать любой симптом, в любой ткани, в любом возрасте, при любом типе наследования» [2].
Митохондриальные дыхательные цепи — главный конечный путь аэробного метаболизма. Поэтому митохондриальную патологию нередко называют «болезнями дыхательной цепи митохондрий» (БДЦМ); это сравнительно новый класс болезней.
Исторические аспекты митохондриальной патологии
R. Luft и соавт. (1962) обнаружили взаимосвязь между мышечной слабостью и нарушениями процессов окислительного фосфорилирования в мышечной ткани [3]. S. Nass и M. Nass (1963) открыли существование собственного генетического аппарата митохондрий (обнаружены несколько копий кольцевой хромосомы) [4, 5]. В 1960–1970 гг. появилась концепция митохондриальных болезней, то есть патологии, этиологически опосредованной митохондриальной дисфункцией. В 1980-е гг. были получены точные молекулярно-генетические доказательства митохондриальной природы ряда заболеваний (болезнь Лебера, синдром Пирсона) [6].
Этиопатогенетические аспекты митохондриальной патологии
В зависимости от наличия основного метаболического дефекта принято рассматривать четыре основных группы митохондриальных болезней: 1) нарушения обмена пирувата; 2) дефекты обмена жирных кислот; 3) нарушения цикла Кребса; 4) дефекты электронного транспорта и окислительного фосфорилирования (OXPHOS) [1, 2].
Причинами возникновения митохондриальной патологии являются мутации в генах, кодирующих белки, задействованные в процессах энергообмена в клетках (включая субъединицы комплекса пируватдегидрогеназы, ферменты цикла Кребса, компоненты цепи транспорта электронов, структурные белки цепи транспорта электронов (ЦТЭ), митохондриальные транспортеры внутренней мембраны, регуляторы митохондриального нуклеотидного пула, а также факторы, взаимодействующие с ДНК митохондрий (мтДНК) [2, 6].
Митохондриальные нарушения связаны с большим числом болезней, не являющихся первичными митохондриальными цитопатиями. Тем не менее, при этих болезнях нарушения функций митохондрий вносят значимый вклад в патогенез и клинические проявления заболеваний. Описываемые болезни могут быть метаболическими, дегенеративными, воспалительными, врожденными/приобретенными мальформациями, а также неоплазмами.
Митохондрия является органеллой, которая присутствует практически в каждой клетке, за исключением зрелых эритроцитов. Именно поэтому митохондриальные болезни могут поражать любые системы и органы человеческого организма [6]. В связи с этим правильнее называть эти состояния «митохондриальными цитопатиями» [1, 2].
Основные особенности митохондриальных цитопатий включают выраженный полиморфизм клинических симптомов, мультисистемный характер поражения, вариабельность течения, прогрессирование и неадекватное реагирование на применяемую терапию.
Конечным результатом окислительного фосфорилирования, происходящего в комплексах 1-γ, является производство энергии (АТФ). Аденозин трифосфат — основной источник энергии для клеток.
Митохондриальная ДНК тесно взаимодействует с ядерной ДНК (яДНК). В каждом из 5 дыхательных комплексов основная часть субъединиц кодируется яДНК, а не мтДНК. Комплекс I состоит из 41 субъединицы, из которых 7 кодируются мтДНК, а остальные — яДНК. Комплекс II имеет всего 4 субъединицы; большая их часть кодируется яДНК. Комплекс III представлен десятью субъединицами; кодирование мтДНК — 1, яДНК — 9. Комплекс IV имеет 13 субъединиц, из которых 3 кодируются мтДНК, а 10 — яДНК. Комплекс V включает 12 субъединиц, кодирование мтДНК — 2, яДНК — 10 [2, 6].
Нарушения клеточной энергетики приводят к полисистемным заболеваниям. В первую очередь, страдают органы и ткани, являющиеся наиболее энергозависимыми: нервная система (энцефалопатии, полинейропатии), мышечная система (миопатии), сердце (кардиомиопатии), почки, печень, эндокринная система и другие органы и системы. До недавнего времени все эти заболевания определялись под многочисленными масками других нозологических форм патологии. К настоящему времени выявлено более 200 заболеваний, причиной которых являются мутации митохондриальной ДНК [1, 2, 6].
Митохондриальные болезни могут быть обусловлены патологией как митохондриального, так и ядерного генома. Как указывают P. F. Chinnery и соавт. (2004) и S. DiMauro (2004), мутации мтДНК были выявлены в 1 случае на 8000 населения, а распространенность митохондриальных заболеваний составляет порядка 11,5 случаев на 100 тысяч населения [7, 8].
В каждой клетке находятся от нескольких сотен до нескольких тысяч органелл — митохондрий, содержащих от 2 до 10 кольцевых молекул митохондриальной ДНК, способных к репликации, транскрипции и трансляции, причем независимо от ядерной ДНК.
Генетические аспекты митохондриальной патологии
Митохондриальная генетика отличается от классической менделевской в трех важнейших аспектах: 1) материнское наследование (всю цитоплазму, вместе с находящимися в ней органеллами, потомки получают вместе с яйцеклеткой); 2) гетероплазмия — одновременное существование в клетке нормального (дикого) и мутантного типов ДНК; 3) митотическая сегрегация (оба типа мтДНК в процессе деления клетки могут распределяться случайным образом между дочерними клетками) [1, 2].
Митохондриальная ДНК накапливает мутации более чем в 10 раз быстрее ядерного генома, так как она лишена защитных гистонов и ее окружение чрезвычайно богато реактивными видами кислорода, являющимися побочным продуктом метаболических процессов, протекающих в митохондриях. Пропорция мутантной мтДНК должна превышать критический пороговый уровень, прежде чем клетки начнут проявлять биохимические аномалии митохондриальных дыхательных цепей (пороговый эффект). Процентный уровень мутантной мтДНК может варьировать у индивидов внутри семей, а также в органах и тканях. В этом заключается одно из объяснений вариабельности клинической картины у больных с митохондриальными дисфункциями. Одни и те же мутации могут вызывать различные клинические синдромы (например, мутация A3243G — энцефалопатию с инсультоподобными пароксизмами — синдром MELAS, а также хроническую прогрессирующую наружную офтальмоплегию, сахарный диабет). Мутации в различных генах могут быть причиной одного и того же синдрома. Классическим примером такой ситуации является синдром MELAS [2].
Разновидности митохондриальной патологии
Если перечислить основные митохондриальные болезни, то в их числе окажутся следующие: митохондриальная нейрогастроинтестинальная энцефалопатия (MNGIE), синдром множественных делеций митохондриальной ДНК, липидная миопатия с нормальными уровнями карнитина, недостаточность карнитин пальмитоилтрансферазы, митохондриальный сахарный диабет, болезнь Альперса–Хуттенлохера, синдром Кернса–Сейра, болезнь Лебера (LHON), синдром Вольфрама, синдром MEMSA, синдром Пирсона, синдром SANDO, синдром MIRAS, синдром MELAS, синдром MERRF, синдром SCAE, синдром NARP, синдром Барта, синдром CPEO, синдром Ли и др. [1].
Наиболее часто в детском возрасте встречаются следующие клинические синдромы митохондриальной патологии: синдром MELAS (митохондриальная энцефаломиопатия, лактат-ацидоз и инсультоподобные пароксизмы), синдром MERRF (миоклонус-эпилепсия с рваными красными волокнами), синдром Кернса–Сейра (характеризуется птозом, офтальмоплегией, пигментным ретинитом, атаксией, нарушением сердечного проведения), синдром NARP (нейропатия, атаксия, пигментный ретинит), синдром Ли (подострая некротизирующая энцефаломиелопатия), болезнь Лебера (наследственная оптическая нейропатия) [1, 2].
Имеется большой пул заболеваний, причиной которых является не мутации митохондриальной ДНК, а мутации ядерной ДНК, кодирующей работу митохондрий. К ним относятся следующие виды патологии: болезнь Барта (миопатия, кардиомиопатия, транзиторные нейтро- и тромбоцитопении), митохондриальная гастроинтестинальная энцефалопатия (аутосомно-рецессивное мультисистемное заболевание): птоз, офтальмоплегия, периферическая нейропатия, гастроинтестинальная дисфункция, приводящая к кахексии, лейкоэнцефалопатия. Возраст дебюта последнего заболевания весьма вариабелен — от периода новорожденности до 43 лет.
Диагностика митохондриальной патологии
Клинические критерии диагностики митохондриальных болезней сравнительно многочисленны: 1) миопатический симптомокомплекс (непереносимость физических нагрузок, мышечная слабость, снижение мышечного тонуса); 2) судороги (миоклонические или мультифокальные); 3) мозжечковый синдром (атаксия, интенционный тремор); 4) поражение глазодвигательных нервов (птоз, наружная офтальмоплегия); 5) полинейропатия; 6) инсультоподобные пароксизмы; 7) мигренеподобные головные боли; 8) черепно-лицевая дисморфия; 9) дисметаболические проявления (рвота, эпизоды летаргии, комы); 10) дыхательные нарушения (апноэ, гипервентиляция, тахипноэ); 11) поражение сердца, печени, почек; 12) прогрессирующее течение заболевания [1, 2].
В диагностике митохондриальных болезней используются следующие клинические критерии: 1) признаки поражения соединительной ткани (гипермобильный синдром, гиперэластичность кожи, нарушения осанки и др.); 2) нейродегенеративные проявления, лейкопатии при проведении магнитно-резонансной томографии (МРТ) головного мозга; 3) повторные эпизоды нарушения сознания или необъяснимые эпизоды рвоты у новорожденных; 4) необъяснимая атаксия; 5) отставание в умственном развитии без определенных причин; 6) отягощенный семейный анамнез; 7) внезапное ухудшение состояния ребенка (судороги, рвота, расстройства дыхания, вялость, слабость, нарушения мышечного тонуса — чаще мышечная гипотония, кома, летаргия; поражение печени и почек, не поддающееся обычной терапии) [1, 2].
Лабораторные (биохимические) исследования нацелены в первую очередь на выявление у пациентов лактат-ацидоза и/или пируват-ацидоза. При этом следует помнить, что нормальные показатели молочной кислоты не исключают наличия митохондриального заболевания. Другие биохимические показатели, исследуемые при подозрении на наличие митохондриальной патологии, включают кетоновые тела в крови и моче, ацилкарнитины плазмы крови, а также содержание органических кислот и аминокислот в крови и моче [9].
M. V. Miles и соавт. (2008) предложили оценивать содержание мышечного коэнзима Q10 у детей с дефектом ферментов дыхательной цепи митохондрий [10].
Цитоморфоденситометрические исследования позволяют оценивать активность митохондрий лимфоцитов (снижение количества, увеличение объема, снижение активности).
Из инструментальных исследований (помимо методов нейровизуализации) используется биопсия скелетных мышц с проведением специфических гистохимических реакций — для выявления феномена «рваных красных волокон» (ragged red fibers — RRF) в полученном биоптате. Синдромами с «рваными красными волокнами» являются следующие: MELAS, MERRF, KSS, PEO (прогрессирующая наружная офтальмоплегия), а также синдром Пирсона. Синдромы без RRF: болезнь Leigh, NARP, LHON (наследственная оптическая нейропатия Лебера) [2].
Генетические методы исследований сводятся к определению наиболее частых мутаций и секвенированию митохондриальной ДНК.
Лечение митохондриальной патологии
Терапия митохондриальных болезней, к сожалению, не разработана. С позиций доказательной медицины считается, что эффективное лечение для этой представительной группы болезней отсутствует. Тем не менее, в различных странах мира используются фармакологические средства и биологически активные вещества, нацеленные на нормализацию метаболизма и обеспечение адекватной энергетики митохондрий.
При синдроме MELAS лечение должно быть направлено на лечение судорог, эндокринных расстройств, устранение последствий инсульта.
P. Каufmann и соавт. (2006) указывают, что поскольку уровень лактата часто коррелирует с тяжестью неврологических проявлений, целесообразно применять дихлорацетат для снижения уровня лактата [11]. В нашей стране с аналогичной целью используется диметилоксобутилфосфонилдиметилат (Димефосфон) [12].
В исследованиях японских авторов Y. Koga и соавт. (2002, 2005, 2006, 2007) с хорошим эффектом использовалось внутривенное введение L-аргинина (предшественника NO) — для стимуляции вазодилатации в остром периоде инсульта, а также пероральное его применение для снижения тяжести последующих эпизодов [13–16].
Среди средств, используемых в терапии митохондриальной патологии, фигурируют следующие: витамин В1 (тиамин) — 400 мг/сут, витамин В2 (рибофлавин) — 100 мг/сут, витамин С (аскорбиновая кислота) — до 1 г/сут, витамин Е (токоферол) — 400 МЕ/сут, никотинамид (ниацин) — до 500 мг/сут, коэнзим Q10 — от 90 до 200 мг/сут, L-карнитин — от 10 мг до 1–2 г/сут, янтарная кислота — от 25 мг до 1,5 г/cут, Димефосфон 15% — 1,0 мл на 5 кг массы тела. Применяются также цитохром С (внутривенно), Реамберин (внутривенно) и Цитофлавин (внутривенно и перорально) [17, 18].
В качестве других средств фармакотерапии выступают кортикостероиды, минералокортикоиды (при развитии надпочечниковой недостаточности), антиконвульсанты — при судорогах/эпилепсии (исключая вальпроевую кислоту и ее производные, ограничивая применение барбитуратов). В наших наблюдениях наиболее эффективной противосудорожной терапией являлось использование препаратов леветирацетам (Кеппра), топирамат (Топамакс) или их сочетаний.
Нейродиетология при митохондриальной патологии
Основным принципом диеты при митохондриальной патологии является ограничение нутриентов, оказывающих негативное влияние на механизмы обмена — до формирования метаболического блока (рацион питания одновременно обогащается другими компонентами на обычном или повышенном уровне). Такая терапевтическая стратегия получила название «обхождения блока» (going around the block). Важным исключением в этом плане является группа митохондриальных нарушений, ассоциированных с метаболизмом пирувата (недостаточность пируватдегидрогеназного комплекса с сопутствующими нарушениями со стороны углеводов/гликогена/аминокислот). При этом рекомендуются кетогенная диета и другие виды высокожировых диет [19].
Широко применяются вещества, являющиеся пищевыми кофакторами (коэнзим Q10, L-карнитин, ацетил-L-карнитин, витамин В2, аскорбиновая кислота, витамин Е, витамин В1, никотинамид, витамин В6, витамин В12, биотин, фолиевая кислота, витамин К, α-липоевая кислота, янтарная кислота, Se) [19]. Рекомендуется избегание индивидуальных алиментарных факторов, индуцирующих обострение митохондриальной болезни (голодание, потребление жиров, белков, сахарозы, крахмала, алкоголя, кофеина, мононатрия глутамата; количественные нарушения приема пищи и неадекватное потребление пищевой энергии). При необходимости осуществляется клиническое питание (энтеральное, парентеральное, гастростомия) [19].
Чрезвычайно важными являются своевременная диагностика митохондриальных болезней, поиск клинических и параклинических критериев этих заболеваний на этапе предварительном, догенетическом. Это необходимо для подбора адекватной метаболической терапии и предотвращения ухудшения состояния или инвалидизации больных с этими редкими заболеваниями.
C. S. Chi (2015) подчеркивает, что подтверждение или исключение митохондриальной патологии остается принципиальным в педиатрической практике, особенно когда клинические признаки болезни не являются специфичными, вследствие чего необходим катамнестический подход к оценке симптомов и биохимических показателей [20].
Литература
* ГОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
** ГОУ ВПО ПМГМУ им. И. М. Сеченова МЗ РФ, Москва
Гетероплазмия митохондриальной днк что это
Окислительное фосфорилирование и болезни митохондриальной ДНК (мтДНК). Митохондриальные мутации обычно поражают ткани, зависящие от окислительного фосфорилирования, удовлетворяющего высокие потребности в энергии. Такая фенотипическая направленность отражает центральную роль комплекса окислительного фосфорилирования в производстве энергии клетки.
Следовательно, для большинства болезней митохондриальной ДНК (мтДНК) характерно снижение синтеза АТФ, которое, вероятно, лежит в основе дисфункции и смерти клеток. Это подтверждается и тем, что другие механизмы, кроме снижения производства энергии, лишь косвенно и слабо содействуют патогенезу болезней митохондриальной ДНК (мтДНК), однако также происходящий синтез активного кислорода как побочного продукта окислительного фосфорилирования может содействовать патологическим процессам при нарушениях митохондриальной ДНК (мтДНК).
Имеется достоверное подтверждение того, что пороговый фенотипический эффект связан с гетероплазмией митохондриальной ДНК (мтДНК); прежде чем болезнь становится клинически очевидной, в клетках пораженной ткани должен быть превышен критический порог доли молекул митохондриальной ДНК (мтДНК), несущих мутацию. Этот порог составляет почти 60% для болезней, вызванных делециями митохондриальной ДНК (мтДНК), и около 90% для болезней из-за других типов мутаций.
Наиболее часто при мутациях в митохондриальной ДНК (мтДНК) поражается нервно-мышечная система; последствия включают энцефалопатию, миопатию, атаксию, дегенерацию сетчатки и снижение функции наружных мышц глаза. Митохондриальная миопатия характеризуется так называемыми «рваными» красными волокнами (мышц) — гистологическим симптомом, вызванным распространением структурно и биохимически аномальных митохондрий в мышечных волокнах.
Спектр митохондриальных болезней широк и может включать дисфункцию печени, костного мозга, островкового аппарата поджелудочной железы с проявлениями сахарного диабета, глухоту и другие нарушения.
Необъяснимые и неожиданные стенотипические изменения при болезнях митохондриальной ДНК (мтДНК)
Гетероплазмия, как правило, встречается почти при всех болезнях митохондриальной ДНК (мтДНК), за исключением обычно гомоплазмической наследственной атрофии зрительного нерва Лебера (LHON). Гетероплазмия, приводящая к непредсказуемой и изменчивой доле мутантной митохондриальной ДНК (мтДНК) в любой конкретной ткани, несомненно, ответственна за плейотропность и переменную экспрессивность большинства мутаций митохондриальной ДНК (мтДНК).
Таким образом, в одной семье одна и та же мутация митохондриальной ДНК (мтДНК) может вызывать сахарный диабет и глухоту у одних и тяжелую энцефалопатию с судорогами у других. Другой пример — самая частая мутация мтДНК, замена 3243A>G в гене тРНК лейцина tRNA [номенклатура указывает позицию и код нормального нуклеотида — аденин в позиции 3243 — в молекуле митохондриальной ДНК (мтДНК), и нуклеотид замены (гуанин)].
Замена 3243A>G — самая частая при фенотипе MELAS, акроним для митохондриальной энцефаломиопатии с молочным ацидозом и инсультоподобными эпизодами. В некоторых семьях эта мутация приводит преимущественно к сахарному диабету и глухоте, а в других вызывает хроническую прогрессирующую наружную офтальмоплегию; и наконец, в-третьих, — кардиомиопатию или миопатию. Кроме того, мутации 3243A>G приписывается небольшая доля (
Мутации в генах тРНК и рРНК митохондриального генома
Мутации в не кодирующих белок генах тРНК и рРНК митохондриальной ДНК (мтДНК) имеют глобальное значение, поскольку они позволили понять, что не все патогенные мутации у человека происходят в генах, кодирующих белки. Более 90 патогенных мутаций обнаружено в 20 из 22 генов тРНК митохондриальной ДНК (мтДНК), и они оказались наиболее частой причиной аномалий окислительного фосфорилирования у человека.
Результирующие фенотипы обычно совпадают со связанными с другими дефектами митохондриальной ДНК (мтДНК). В набор разнообразных мутаций тРНК входит 18 нуклеотидных замен в гене tRNA, некоторые из них вызывают MELAS, подобно мутации 3243A>G, другие преимущественно связаны с миопатией. Аналогично некоторые замены в гене 12S рРНК в гомоплазмическом состоянии приводят к нейросенсорной глухоте после применения антибиотиков группы аминогликозидов.
Выяснение разных эффектов мутаций в гене tRNA, связанных с синдромом MELAS, в сравнении с мутациями, вызывающими только миопатии, привело к одному из первых объяснений соотношения между генотипом и фенотипом при болезнях митохондриальной ДНК (мтДНК). Многие мутации гена tRNA, вызывающие синдром MELAS, неизвестным способом нарушают важную биохимическую модификацию неоднозначно соответствующего азотистого основания урацила (U) в тРНК, тогда как замены, вызывающие только миопатию, не нарушают модификацию этого основания.
Неоднозначно соответствующее основание присутствует в третьей позиции многих кодонов и называется так, поскольку допускает неполное совпадение кода. Неоднозначно соответствующее основание важно для опознавания кодона и связи кодон-антикодон; при отсутствии биохимической модификации нарушается способность антикодона, содержащего немодифицированное неоднозначно соответствующее основание, декодировать некоторые кодоны.
Взаимодействие между митохондриальным и ядерным геномами
Поскольку как ядерный, так и митохондриальный геномы кодируют полипептиды окислительного фосфорилирования, неудивительно, что фенотипы, вызванные мутациями в ядерных генах, часто неотличимы от вызванных мутациями мтДНК. Кроме того, мтДНК называют «служанкой» ядерной ДНК, поскольку мтДНК зависит от множества белков ядерного генома для репликации и работы. Генетические исследования показали прямую зависимость между ядерным и митохондриальным геномами.
Первое указание данного взаимодействия было обнаружено на примере синдрома аутосомно передающихся делений в мтДНК с фенотипом, имеющим сходство с хронической прогрессирующей наружной офтальмоплегией. С этим фенотипом связаны мутации по крайней мере в двух генах. Белок, кодируемый одним из этих генов, так называемый твинкл-белок (от англ. twinkle — мерцание; назван по необычной точке приложения) оказался ДНК-праймазой или хеликазой.
Продукт второго гена — специфическая мтДНК-полимераза у, с потерей функции которой связаны как доминантные, так и рецессивные синдромы множественных делеций.
Второе аутосомное заболевание — синдром уменьшения митохондриальной ДНК (мтДНК), результат мутаций в одном из шести ядерных генов (только у небольшой части больных), ведущих к снижению числа копий мтДНК (как на митохондрию, так и на клетку в целом) в различных тканях. Большинство пораженных генов кодируют белки, необходимые для поддержки пула нуклеотидов или их метаболизма в митохондриях. Например, миопатические и гепатоцеребральные фенотипы вызваны мутациями в генах митохондриальной тимидинкиназы и дезоксигуанозинкиназы.
Другое заболевание, митохондриальная желудочно-кишечная энцефаломиопатия, — результат мутаций в гене тимидинфосфорилазы, хотя и не митохондриального белка, но особенно важной для использования митохондриальных нуклеотидов. Кроме понимания биологии митохондрий, идентификация патологических генов при таких редких нарушениях облегчает генетическое консультирование и пренатальную диагностику в некоторых семьях и способствует поиску путей лечения. Например, при недостаточности тимидинфосфорилазы уровень тимидина крови заметно повышается, что позволяет предположить терапевтическую пользу более низких уровней тимидина.
Ядерные гены могут модифицировать фенотип болезней мтДНК
Хотя основной источник фенотипической изменчивости при болезнях митохондриальной ДНК (мтДНК) — гетероплазмия, играют роль также дополнительные факторы, включая гены ядерных локусов. Надежным подтверждением существования таких факторов оказались семьи, несущие мутации, связанные с леберовской атрофией зрительного нерва; при этом заболевании мутации обычно гомоплазмические (и, следовательно, фенотипические изменения не могут объясняться гетероплазмией).
Атрофия зрительного нерва Лебера фенотипически проявляется как быстрая, безболезненная двусторонняя потеря центрального зрения из-за атрофии зрительного нерва у молодых. В зависимости от мутации часто возможно некоторое восстановление зрения, но патогенетические механизмы поражения зрительного нерва неясны.
Болеть могут как мужчины, так и женщины, но существует поразительное и необъяснимое увеличение пенетрантности болезни у мужчин; примерно у 50% носителей-мужчин и только около 10% женщин развивается симптоматика леберовской атрофии. Изменение пенетрантности и преобладание мужчин в фенотипе определяются гаплотипом в коротком плече Х-хромосомы. Гены-модификаторы в этом ядерном локусе еще не определены, но содержатся в общей популяции в частом и, вероятно, древнем гаплотипе Х-хромосомы. Если этот вариант передается человеку, унаследовавшему мутацию леберовской атрофии зрительного нерва в мтДНК от обычно здоровой матери, фенотип в значительной степени модифицируется.
Например, у мужчин, несущих аллели (кроме связанных с самым тяжелым фенотипом) леберовской атрофии зрительного нерва, нарушения зрения развиваются в 35 раз чаще, если они имеют гаплотип X, сцепленный с высоким риском. Эти наблюдения также показывают, что на самом деле локусы генов-модификаторов при моногенных болезнях возможно идентифицировать, этот Х-сцепленный локус — один из нескольких таких модификаторов, подтвержденных к настоящему времени в геноме человека.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в содержание раздела «генетика» на нашем сайте