Гетеротопический оссификат что это
Гетеротопический оссификат что это
Синоним: оссифицирующий миозит. Гетеротопическая оссификация — доброкачественное оссифицирующее заболевание, поражающее, главным образом, мышечную ткань.
Причиной практически всегда служит травматическое воздействие, пациенты жалуются на боль и повышенную чувствительность пораженной области. При физикальном исследовании можно выявить отечность и ограничение движений в пораженном сегменте.
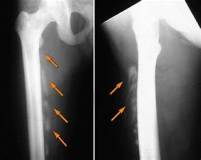
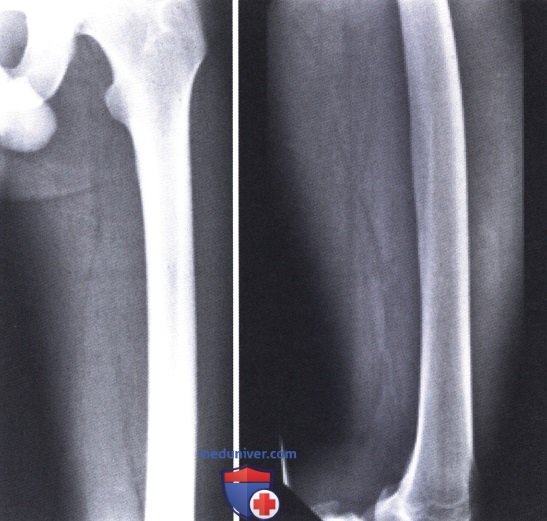
Наиболее частыми локализациями процесса являются четырехглавая мышца бедра, плечевая и ягодичная мышцы. Эти высокоминерализованные образования могут быть ошибочно приняты за злокачественные опухоли (внекостная или параоссальная остеосаркома), однако рентгенологическая картина, характерная для оссификатов, обычно позволяет поставить правильный диагноз, не прибегая к биопсии.
Редактор: Искандер Милевски. Дата публикации: 17.7.2020
Гетеротопическая оссификация
Гетеротопическая оссификация (внескелетное окостенение) — это патологический процесс, который предполагает образование кости внутри мягких тканей, т.е. там, где кость не должна существовать. Этот процесс может наблюдаться в таких структурах, как кожа, подкожная клетчатка и скелетные мышцы. В более редких случаях оссификаты могут формироваться в стенках кровеносных сосудов и брыжейке кишечника. Несмотря на то, что оссификаты могут возникать где угодно, наиболее часто они встречаются вблизи крупных суставов (коленного, тазобедренного, локтевого и плечевого суставов).
Гетеротопическая оссификация была впервые описана Patin в 1692 году во время работы с детьми, которым был поставлен диагноз оссифицирующего прогрессирующего миозита. В 1918 году Dejerine и Ceillier подробно описали гистологические, анатомические и клинические особенности формирования оссификатов у солдат, получивших травму позвоночника во время Первой мировой войны. Следуя работе Dejerine и Ceillier, Marshall Urist описал остеоиндуктивные свойства костного морфогенного белка в таких эктопических структурах, как мышцы. Это считалось и до сих пор считается «эпохальным открытием» среди всех ортопедических исследований.
Этиология/Причины
Точная патофизиология гетеротопической оссификации неизвестна. Трансформация примитивных мезенхимальных клеток соединительной ткани в остеобластную ткань и остеоид включает разнообразные и плохо изученные триггеры. Предполагается, что эти триггеры включают генетические, посттравматические, нейрогенные, послеоперационные и реактивные поражения рук и ног. Генетические формы включают два типа: фибродисплазия и прогрессирующая костная гетероплазия. Эти типы описываются как массивные отложения гетеротопической кости вокруг нескольких суставов в отсутствие провоцирующего события (т. е. травмы). Это наиболее тяжелый вариант оссификации, прогрессивно развивающейся на протяжении всей жизни и серьезно влияющий на здоровье, продолжительность и качество жизни.
Посттравматическая оссификация начинается с пролиферации веретенообразных клеток в течение первой недели после травматического события. В течение 1-2 недель развивается примитивный остеоид. После второй недели можно увидеть примитивные хрящ и кость. Трабекулярная кость образуется через 2-5 недель после травмы. По мере прогрессирования минерализации аморфный фосфат кальция постепенно замещается кристаллами гидроксиапатита. Примерно через 6 месяцев в соединительной ткани появляется настоящая кость.
Нейрогенная гетеротопическая оссификация возникает после серповидноклеточной анемии, гемофилии, столбняка, полиомиелита, рассеянного склероза и токсического эпидермального некролиза. Также нейрогенная оссификация развивается только в местах дистальных (расположенных ниже) уровня повреждения спинного мозга. Области формирования оссификатов почти всегда находятся на пораженной стороне тела (в случае чернею-мозговой травмы или инсульта). Послеоперационные оссификаты чаще всего возникают после процедур, требующих открытой редукции, внутренней фиксации или операций по замене суставов.
Реактивные поражения кистей и стоп обычно связаны с надкостницей или периартикулярной фиброзной тканью, что отличает данную категорию от оссифицирующего миозита. Эти поражения встречаются в трех клинико-рентгенологических условиях: периостальный остеохондроматоз, реактивный периостит, подногтевой экзостоз.
Распространенность
В недавнем исследовании Foruria и соавт. была изучена распространенность оссификации при всех патологиях локтевого сустава, с которыми поступали люди в отделение неотложной помощи в течение 5 лет. Он обнаружил, что наибольшая распространенность гетеротопического окостенения наблюдается при переломах локтевого отростка со смещением и связанных с этим переломах плечевой кости. Место окостенения чаще всего находилось на задней стороне локтевой кости. Факторы риска возникновения оссификатов включают вывих или подвывих в момент травмы, открытую травму и тяжелую травму грудной клетки. При хирургическом лечении патологии у 37% участников формировались оссификаты.
Классификация
Брукерская классификация гетеротопической оссификации
Классификация по МакАфи (после тотальной артропластики межпозвонкового диска)
Стадии развития
Хронология развития гетеротопических оссификатов
Клиническая картина
Клинические признаки и симптомы гетеротопической оссификации могут появиться уже через 3 недели (или до 12 недель) после травмы спинного мозга, опорно-двигательного аппарата или других сопутствующих событий. Первым признаком формирования оссификата обычно является потеря подвижности сустава и нарушение его функции. Другие признаки включают отек, покраснение, повышение температуры в месте поражения, боль и пальпируемое образование. В некоторых случаях может наблюдаться повышение температуры тела.
Диагностика
Ультрасонография
Трехфазная сцинтиграфия
Рентгенография
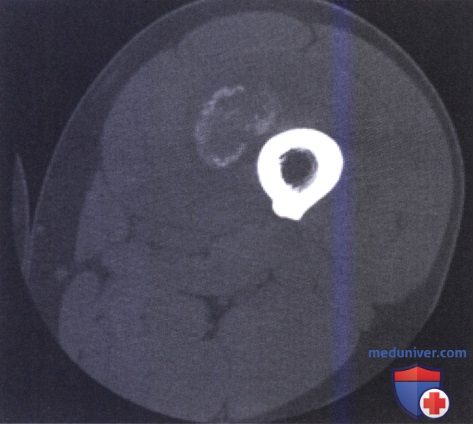
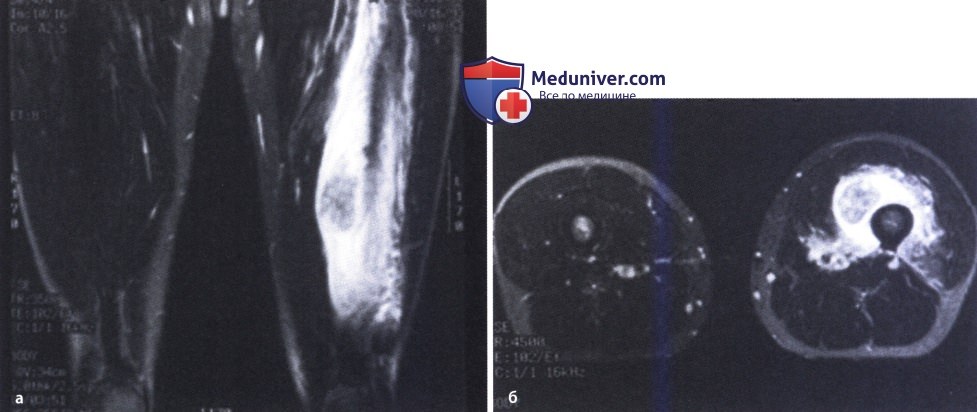
МРТ/КТ
Использование технеция-99 и метилендифосфоната
Простагландин Е2 (PGE2)
Щелочная фосфатаза
Повышенный уровень креатинкиназы
Матриксная металлопротеиназа-9
Примечание: Отсутствие простых объективных мер по выявлению оссификатов приводит к ошибочной диагностике на ранних стадиях и неадекватному лечению.
Дифференциальная диагностика
Начальная воспалительная фаза формирования оссификатов может имитировать другие патологии, такие как целлюлит, тромбофлебит, остеомиелит или опухолевый процесс. Другие дифференциальные диагнозы включают тромбоз глубоких вен, септический артрит, гематому или перелом. Кроме того, есть мнение, что тромбоз глубоких вен и оссификация связаны. Считается, что это обусловлено массовым эффектом и местным воспалением, стимулирующим образование тромба. Образование тромба вызвано венозной компрессией и флебитом.
Сопутствующие заболевания
Наиболее частые заболевания, обнаруженные в сочетании с гетеротопическим окостенением:
Лечение
Лечение оссификатов в значительной степени зависит от количества эктопических костных образований, их локализации и связанных с этим функциональных ограничений пациента.
Первой целью лечебных мероприятий является выявление пациентов, подверженных риску развития оссификатов и их профилактическое лечение. Исследования подтверждают эффективность двух других подходов к лечению оссификатов: 1) хирургическое иссечение и 2) лучевая терапия.
Профилактическое лечение
Необходимо провести дальнейшие исследования в этой области, однако в настоящее время существуют экспериментальные варианты. К ним относятся:
Местная лучевая терапия
Пероральный прием Индометацина
Медикаментозная терапия
Лекарственные препараты назначаются пациентам, подверженным риску развития оссификатов. Существуют два вида препаратов, которые, как было показано, имеют как профилактические, так и лечебные преимущества. К ним относятся нестероидные противовоспалительные препараты (НПВП) и бисфосфонаты.
Примечание: врачи должны быть осведомлены о потенциальных осложнениях (в основном связанных с желудком) у пациентов, принимающих НПВП на регулярной основе.
Хирургическое вмешательство
Хирургическое лечение преследует две цели: изменить положение пораженного сустава и/или улучшить его подвижность. В своей работе Garland предлагает следующие сроки оперативных вмешательств.
Указанные выше сроки были установлены для определения наиболее оптимальных сроков оперативного вмешательства. Клиницисты должны определить, «созрел» ли оссификат для хирургического удаления, это позволяет уменьшить риск интраоперационных осложнений, таких как кровотечение, и последующих рецидивов. Использование сканирования костей для определения метаболической активности очага поражения и уровня щелочной фосфатазы в сыворотке крови часто помогает при принятии решений. Shehab описывает критерии, согласно которым рекомендуется хирургическое удаление гетеротопического окостенения. Эти критерии следующие:
Реабилитация в послеоперационном периоде
Рекомендуется начинать программу реабилитации в течение первых 24 часов после операции. Программа должна длиться в течение 3 недель, чтобы предотвратить адгезию (слипание тканей).
Физическая терапия
Неоднократно было показано, что физиотерапия приносит пользу пациентам, страдающим от гетеротопического окостенения. Предоперационная физиотерапия может быть использована для сохранения структур вокруг очага поражения. Упражнения на поддержание амплитуды движений (пассивные упражнения, активные ассистивные упражнения и активные упражнения) и упражнения для укрепления окружающих мышц позволяют избежать мышечной атрофии и тугоподвижности сустава.
Примечание: Необходимо соблюдать осторожность при работе с пациентами с оссификатами. Слишком активная терапия может усугубить их состояние и привести к воспалению, отеку, кровоизлиянию и усилению боли.
Послеоперационная реабилитация также продемонстрировала свою эффективность в отношении пациентов, перенесших операцию по поводу гетеротопических оссификатов. Послеоперационное лечение оссификатов аналогично предоперационному лечению, но гораздо больше внимания уделяется контролю отека, лечению рубцов и профилактике инфекционных осложнений.
Calandruccio изложил протокол реабилитационного лечения для пациентов, перенесших хирургическое иссечение гетеротопического окостенения локтевого сустава.
Этапы реабилитации и цели для каждого этапа следующие:
Этап I (1 неделя)
Этап II (2-8 недель)
Этап III (9-24 недели)
Примечание: Оба вышеприведенных исследования были в основном направлены на реабилитацию локтевого сустава, пораженного вследствие гетеротопической оссификации. Однако цели и этапы реабилитационного процесса могут быть использованы в качестве руководства при лечении оссификатов в других местах.
Травматический оссифицирующий миозит – это заболевание, при котором после травмы в мышечной ткани формируется зона кальцификации. Провоцируется значительным однократным повреждением или повторной микротравматизацией. Сопровождается появлением быстро растущего, твердого, резко болезненного образования в толще мышцы, ограничением движений. В последующем боли уменьшаются, участок кальцификации рассасывается или окостеневает. При адекватном лечении функция конечности восстанавливается. Диагноз выставляется на основании клинических данных, результатов рентгенографии и других визуализационных методик. Лечение – массаж, физиотерапия. Операции требуются редко.
МКБ-10
Общие сведения
Оссифицирующий миозит травматического генеза (гетеротопическая оссификация, кальцификация и оссификация мышцы, травматическая параоссальная костная формация) – самая распространенная разновидность данной патологии. В отличие от врожденной генерализованной формы миозита протекает с локальным поражением одного мускула, имеет благоприятный исход. Чаще всего формируется в области плеча, второе место по распространенности занимает оссифицирующий миозит области тазобедренного сустава. Страдают преимущественно молодые мужчины спортивного телосложения с хорошо развитой мускулатурой.
Причины
В анамнезе больных имеется четкая связь с травматическим повреждением, но пусковые факторы миозита точно не установлены. Оссифицирующее поражение мускула возникает в следующих случаях:
Многие авторы указывают, что наряду с характером повреждения и значительной мышечной массой пациентов существенную роль играют особенности реабилитации, в частности – преждевременное увеличение объема движений и слишком энергичный массаж.
Патогенез
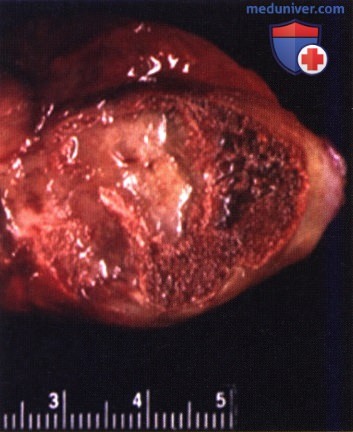
Очаг окостенения появляется на месте гематомы или кровоизлияния, происходит не непосредственно из мышечной ткани, а из соединительнотканных прослоек в толще мускула. Причиной его формирования является метаплазия фиброзной ткани, которая минерализуется и постепенно приобретает структуру губчатой кости. Размеры оссифицирующей формации обычно превышают 5 см.
Иногда вокруг основной зоны поражения выявляются мелкие островки аналогичного строения. Процесс оссификации начинается через 20-30 дней, реже – со второй недели после травмы и завершается спустя 3-6 или более месяцев. К этому моменту на поверхности очага образуется кортикальный слой, участок приобретает полное сходство с обычной костью.
Симптомы оссифицирующего миозита
Общим признаком заболевания является появление растущего опухолевидного образования, сопровождающееся болями и нарушением функции конечности. Образование имеет костную плотность, резко болезненно при пальпации. Болевой синдром усиливается при движениях. Через несколько месяцев боли постепенно стихают, ограничение движений нередко сохраняется. Степень нарушения функций зависит от объема и расположения очага, наличия или отсутствия его связи с надкостницей и других факторов.
Оссифицирующий миозит плеча
Возникает в области плечевой мышцы, чаще всего – после заднего вывиха локтевой кости или обеих костей предплечья. Вероятность развития не зависит от качества и времени вправления. Оссифицирующая формация проявляется формированием твердой припухлости и болями по передней поверхности плеча в нижней трети или ближе к локтевому суставу, ограничением сгибания предплечья.
Оссифицирующий миозит тазобедренного сустава и бедра
Провоцирующим фактором становится эндопротезирование тазобедренного сустава, перелом или вывих бедренной кости, обширные ушибы ягодичной области. В зависимости от вида травмы поражаются различные мышцы – четырехглавая, средняя ягодичная, приводящие. При вовлечении средней ягодичной мышцы участок затвердения обнаруживается в верхней или наружной части ягодицы, снаружи над тазобедренным суставом. Страдает отведение и вращение.
Оссификаты в зоне квадрицепса располагаются на передней поверхности: чуть ниже ТБС при вывихах, в средней или нижней части сегмента – при переломах. Развитие заболевания сопровождается ограничением сгибания голени и разгибания бедра, серьезно нарушается функция ходьбы. При вовлечении приводящих мускулов оссифицирующий миозит поражает передневнутреннюю поверхность тазобедренного сустава или внутреннюю поверхность бедра в верхней половине сегмента. Выявляется ограничение разгибания и приведения, поворота ноги кнаружи.
У футболистов оссифицирующие гетеротопии обычно появляются по наружной поверхности бедра, развиваются в результате столкновений. Страдают латеральная широкая (наружная часть квадрицепса), двуглавая, полусухожильная или полуперепончатая мышцы. Возможны нарушения разгибания, сгибания или вращения голени, разгибания бедра и туловища.
Осложнения
Обширные и гетеротопические очаги сопровождаются развитием контрактуры близлежащего сустава. В тяжелых случаях формируется внесуставной анкилоз. Перечисленные осложнения существенно ограничивают трудоспособность и возможности самообслуживания пациентов с миозитом, становятся причиной инвалидности.
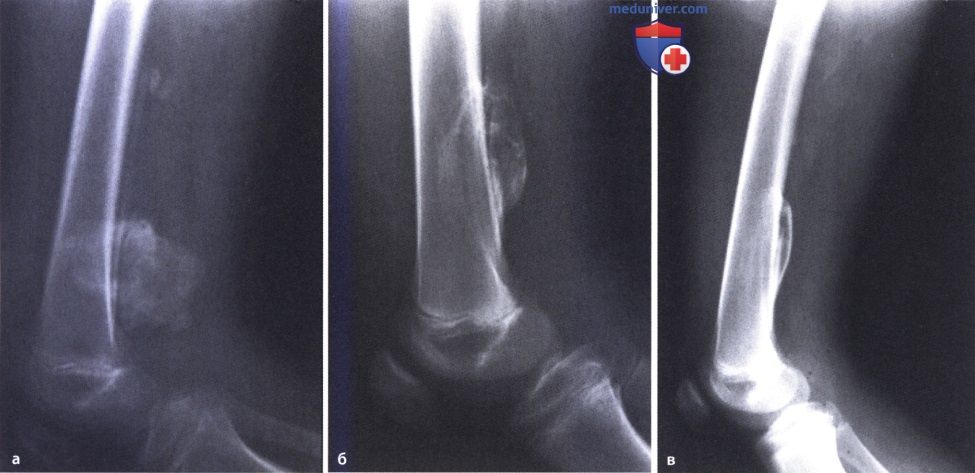
Диагностика
Больным, перенесшим значительную однократную травму, диагноз выставляется курирующими врачами-травматологами, поскольку оссифицирующий процесс развивается в период лечения и реабилитации. При повторной микротравматизации пациенты могут обращаться к ортопедами или онкологам. План обследования включает следующие мероприятия:
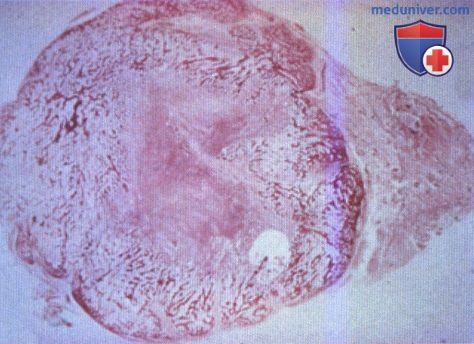
Дифференциальную диагностику проводят с остеосаркомой. Признаками оссифицирующего миозита являются изоляция от кости и отсутствие изменений близлежащей кости по данным визуализационных методик. В сомнительных случаях рекомендовано гистологическое исследование тканей оссификата.
Лечение травматического оссифицирующего миозита
На начальной стадии показаны консервативные мероприятия. При недавних крупных травмах лечение осуществляется в травматологическом отделении, в последующем пациент переводится под амбулаторное наблюдение. После окончательного оформления очага при ограничении функций и отсутствии признаков рассасывания проводятся хирургические вмешательства.
Консервативная терапия
Важнейшими элементами лечения являются специальный режим и тщательный подбор методов реабилитации. При прогнозировании возможного развития оссифицирующего миозита или появлении первых симптомов необходима иммобилизация конечности с последующей постепенной разработкой без форсирования физической активности.
Нагрузка на пораженный сегмент должна быть безболевой. Рекомендуется активная гимнастика. Пассивные форсированные упражнения и массаж на стадии формирования очага противопоказаны, поскольку могут спровоцировать увеличение оссификата. После «созревания» костного включения рекомендованы массаж и физиотерапия. В отдельных случаях, в том числе – при рецидивах после удаления зоны окостенения применяется рентгенотерапия.
Хирургическое лечение
Оперативные вмешательства показаны после появления структурированного участка костной ткани. При планировании операции необходимо учитывать возможность рецидива, поэтому данный метод лечения рекомендован только в случае существенного нарушения функции конечности, ограничения трудоспособности.
Гетеротопический очаг иссекают вместе с капсулой, стараясь минимально травмировать окружающие ткани. Выполняют тщательный гемостаз. Образовавшуюся полость ушивают, устанавливают вакуумный дренаж, чтобы не допустить формирования гематомы, которая может стать источником рецидива.
Прогноз
Прогноз обычно благоприятный. При планомерном комплексном консервативном лечении большинство оссификатов рассасывается или уменьшается в размерах, функции конечности восстанавливаются. При околосуставной локализации, распространении окостенения на всю мышцу или ее значительную часть возможны снижение или утрата трудоспособности.
Профилактика
Превентивные мероприятия включают предупреждение травматизма, ранее начало лечения переломов и вывихов, обязательное вскрытие и адекватное дренирование крупных гематом в мышечных массивах. Большое значение имеет продуманная постепенная реабилитация, исключающая использование форсированных методов восстановления функции конечности.
Гетеротопический оссификат что это
Под гетеротопической оссификацией понимают образование зрелой костной ткани в мягких тканях организма. Среди больных неврологического профиля гетеротопическая оссификация развивается чаще всего у перенесших тяжелую черепно-мозговую травму, позвоночно-спинномозговую травму. Частота развития гетеротопической оссификации при этих состояниях варьирует от 11 до 76%, однако к ограничению движений приводит лишь в 10- 20% из этих случаев [Buschbacher R., 1992]. Причины и патогенез гетеротопической оссификации до конца не ясны. Возможно, определенную роль играют локальные дисметаболические, дисциркуляторные факторы. Существует предположение о нарушении нейрогенного контроля над превращением мезенхимальных клеток в остеобласты [Stover S. и соавт., 1991]. К факторам риска развития гетеротопической оссификации относятся: повышение мышечного тонуса; длительное (более двух недель) пребывание в коме; переломы длинных трубчатых костей; ограничение объема движений в суставах конечностей. К настоящему времени нет достоверных данных о том, что на частоту развития этого осложнения влияет интенсивность пассивных гимнастических упражнений в суставах конечностей.
Эктопическая кость формируется обычно в области крупных суставов (локтевых, плечевых, тазобедренных, коленных) снаружи от суставной капсулы, а также в области переломов длинных трубчатых костей через 1-3 месяца после травмы. Оссификация околосуставных тканей наиболее часто встречается после травм локтевого сустава, возможно, это объясняется хорошим кровоснабжением этой области и частым образованием обширных гематом. Оссификаты локализуются в соединительной ткани между пластами мышц, но не в самих мышцах.
Ранняя диагностика основывается на клинических данных, а также на повышении в крови уровня щелочной фосфатазы. Обычная рентгенография выявляет первые признаки оссификации не раньше чем через 7-10 дней после развития клинических проявлений. Для раннего обнаружения эктопической кости в настоящее время используют метод трехфазного сканирования [Freed J. и соавт., 1982]: в области формирования оссификатов в первую фазу исследования наблюдается локальное усиление кровотока и концентрация в мягких тканях радиоактивных индикаторов.
Гетеротопический оссификат что это
ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России, Уфа, Россия
ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России, Уфа, Россия
ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России, Уфа, Россия
Гетеротопическая оссификация после травм центральной нервной системы: понимание патогенеза
Журнал: Вестник травматологии и ортопедии им Н.Н. Приорова. 2018;(4): 119-124
Гареев И. Ф., Бейлерли О. А., Вахитов А. К. Гетеротопическая оссификация после травм центральной нервной системы: понимание патогенеза. Вестник травматологии и ортопедии им Н.Н. Приорова. 2018;(4):119-124.
Gareev I F, Beylerli O A, Vakhitov A K. Heterotopic ossification after central nervous system injuries: understanding of pathogenesis. N.N. Priorov Journal of Traumatology and Orthopedics. 2018;(4):119-124.
https://doi.org/10.17116/vto201803-041119
ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России, Уфа, Россия
В работе представлены имеющиеся на сегодняшний день сведения о патогенезе, клеточных взаимодействиях, роли воспаления, гуморальных и генетических факторов в формировании гетеротопических оссификатов вследствие травм головного или спинного мозга.
ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России, Уфа, Россия
ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России, Уфа, Россия
ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России, Уфа, Россия
Введение. Гетеротопическая оссификация (ГО) определяется как формирование зрелой пластинчатой кости в мягких тканях, обычно между мышцей и суставной капсулой. Гистологически и рентгенологически гетеротопическая кость напоминает нормальную зрелую кость, но ее можно легко отличить от простых кальцификаций по характеру ее остеобластической дифференцировки [1]. Нейрогенная Г.О. (НГО) вследствие травм нервной системы может быть связана с травматическим повреждением как головного, так и спинного мозга. В частности, после черепно-мозговой травмы (ЧМТ) появление очагов формирования эктопической кости регистрируют в 10–23% случаев, после повреждения спинного мозга — в 40–50%. Это патологическое состояние у мужчин наблюдается в 2,5 раза чаще, чем у женщин [2, 3]. НГО, как правило, развивается у пациентов в возрасте от 20 до 30 лет, что обусловлено более высокой встречаемостью ЧМТ и травм спинного мозга именно в этой возрастной группе [4].
Наиболее частыми клиническими проявлениями НГО являются уменьшение объема движений в суставах, вплоть до развития анкилоза, периартикулярный отек, вызванный интерстициальным отеком окружающих мягких тканей, и болевой синдром в пораженной области. Также может возникать периартикулярная эритема, сопровождающаяся местной гипертермией, которая клинически напоминает септический артрит или тромбофлебит. Выраженность спастичности может нарастать вторично по отношению к развитию НГО. К осложнениям НГО относятся сдавление сосудистых структур и близлежащих нервных стволов, развитие пролежней и тромбофлебита глубоких вен [5].
Формирование ГО обусловлено сложным взаимодействием локальных и системных факторов, которые приводят к повышенной активности остеобластов и преимущественной дифференциации плюрипотентных мезенхимальных клеток в остеобласты, образующие эктопическую кость. Установлено, что сигнал для начала этого процесса может быть травматическим, генетическим или нейрогенным. Для формирования эктопической кости, по теории J. Chalmers и соавт. [6], необходимо наличие трех факторов: остеогенных предшественников, индуцирующего агента и подходящей среды.
Несколько групп исследователей [7–9] выявили четкую связь между гуморальными факторами, выделяемыми поврежденной центральной нервной системой (ЦНС), и такими процессами, как оксидативный стресс, образование свободных радикалов и т. д., которые приводят к формированию гетеротопических оссификатов.
A. Ekelund и соавт. [1] установили связь между высоким уровнем в крови человеческого лейкоцитарного антигена (HLA B27) и развитием НГО вследствие травм спинного мозга. Между тем в настоящее время нет единого мнения относительно того, существует ли явная генетическая предрасположенность к развитию спорадической посттравматической НГО [1, 5].
Патогенез НГО
Точный патогенез НГО до сих пор до конца не ясен. Первоначально Г.О. гистологически определяется в виде локальных микрососудистых изменений, сосудистого застоя с ограниченным отеком. Вслед за этим возникают пролиферация фибробластов и остеобласты, образование остеоидов и, наконец, эктопическое отложение кости [10]. Процесс оссификации в мягких тканях начинается с минеральной фазы с образованием аморфного фосфата кальция, который постепенно замещается кристаллами гидроксиапатита. Центростремительный паттерн созревания эктопической кости, наблюдаемый в последующие недели, лежит в основе феномена разделения на зоны, описанного L. Ackerman [11]. В промежуточной зоне участки незрелой кости выстланы остеобластами, в то время как в зоне внешней границы имеется зрелая кость, формирующая хорошо разграниченный наружный трабекулярный край. Промежуточная зона окружает центральную зону, которая состоит из недифференцированных фибробластов с участками кровоизлияний и некрозом мышечной ткани. По мере созревания оссификата периферический край промежуточной зоны становится видимым при рентгенологическом исследовании вследствие прогрессирующей минерализации [12]. Весь процесс формирования гетеротопической кости обычно завершается в течение 6–18 мес. Зрелый нейрогенный гетеротопический оссификат напоминает нормальную кость как гистологически, так и рентгенологически и является губчатой костью с гаверсовыми каналами, надкостницей, кровеносными сосудами и костным мозгом с небольшими участками кровоизлияния [13].
В работах [14, 15] были представлены убедительные доказательства гипотезы о гуморальном механизме ускоренной регенерации переломов костей нижних конечностей после ЧМТ и травм спинного мозга. O. Gautschi и соавт. [16] предположили остеоиндуктивный эффект цереброспинальной жидкости у пациентов с тяжелой ЧМТ, что было подтверждено рядом исследований [17, 18], в которых изучали скорость пролиферации остеобластической линии клеток человека (hFOB) или первичных остеобластов. Известно, что стимуляция образования эктопической костной ткани является результатом дисбаланса локальных и/или системных факторов в мягких тканях после травматического повреждения. Другими словами, это не только воздействие провоспалительных и остеоиндуктивных биохимических факторов, которые приводят к возникновению НГО, но и нарушение баланса проостеоиндуктивных и антиостеоиндуктивных медиаторов, расположенных в мягких тканях. Кроме того, существующая теория формирования НГО также поддерживает взаимодействие «сигнальных молекул», выделяемых из поврежденной нервной ткани (например, спинного мозга) не только локальными, но и циркулирующими клетками-предшественниками после травмы. Как следствие, инициируется дифференцировка этих клеток в остеобласты, что в результате приводит к образованию эктопической кости [15]. Это подтверждается тем фактом, что мезенхимальные стволовые клетки, полученные экспериментальным путем из миоцитов, являются по своей природе пластичными. Это позволяет им дифференцироваться в нескольких направлениях (остео-, хондро-, фибробласты, адипоциты, клетки гладкой мускулатуры). Однако очень мало известно о связи дифференциации мезенхимальных клеток-предшественников и сигнальных путей, а также об остеоиндуктивных биохимических факторах. Изучение гуморальных факторов (например, щелочной фосфатазы, креатинкиназы, простагландинов) было предметом многочисленных исследований, в ходе которых, однако, не получили убедительных доказательств наличия прямой связи этими факторами и нейрогенным образованием ГО [18, 19]. В настоящей работе дан краткий обзор исследований, посвященных патогенезу ГО после травм ЦНС.
Остеопрогениторные клетки
Имеются доказательства наличия остеопрогениторных клеток, являющихся потенциально остеогенными, в соединительной ткани взрослого человека (например, в мышцах и фасциях) [20, 21]. Было показано, что образование минерализованных узелков, которые служат основой для формирования гетеротопических оссификатов, связано с виментинположительными веретеновидными клетками. Внутриклеточное увеличение экспрессии виментина определяется мезенхимальным фенотипом фибробластов и стволовых клеток скелетной мышечной ткани [22]. Веретеновидные клетки, присутствующие в скелетной мускулатуре, соотносились с мезенхимальными стволовыми клетками, стромальными клетками костного мозга и перицитами вследствие их сходных морфологических, иммуногистохимических и мРНК-профилей, а также способности к многолинейной дифференцировке. Участие интерстиция скелетных мышц в ГО подозревалось в течение десятилетий. Ведущая роль мезенхимальных клеток в образовании ГО после травм ЦНС подтверждена результатами гистологического анализа оссифицирующих отложений [22–24].
Остеоиндуктивные факторы
Локальные микрососудистые изменения и длительно нарастающий отек как начальная фаза гетеротопического формирования кости могут проявляться в вовлеченных тканях как результат активации симпатической нервной системы. A. Da Paz и соавт. [24] предположили, что повреждение нейронных путей вследствие ЧМТ или травмы спинного мозга приводит к хаотической регуляции роста костей. В частности, было высказано предположение, что дисфункция проприоцепции из-за повреждения ЦНС заставляет связки реагировать на прямые стимулы независимым, изолированным и случайным образом, что может стать причиной хаотической дифференциации мезенхимальных прогениторных клеток в гетеротопическую кость. В противоположность этому активное или пассивное осуществление движения в суставе в пределах безболезненного диапазона благоприятно влияет на физическое состояние, уменьшая потребность в дополнительном лечении НГО [25].
Также была установлена роль гипоталамо-гипофизарной системы, дающей сигнал на выработку факторов роста [26]. Было высказано предположение, что гипофиз секретирует системные факторы роста, которые могут способствовать гетеротопическому формированию кости. При этом предполагается, что активность этих системных факторов роста может быть заблокирована связыванием с белками плазмы [27].
По данным клинических исследований [17, 28], у пациентов с тяжелой ЧМТ по сравнению с контрольной группой в сыворотке крови повышается уровень C-реактивного белка, являющегося свидетельством острой фазы воспалительного ответа. Воспаление при повреждении костной ткани индуцирует выработку цитокинов, которые в свою очередь стимулируют ангиогенез и индуцируют остеопрогениторные клетки к высвобождению костных морфогенетических белков (BMP), способствующих остеогенной дифференцировке [29]. Например, интерлейкин-6 (IL-6) может обусловливать дифференцировку мезенхимальных стволовых клеток в остеобласты, способствует снижению апоптоза остеобластов и стимуляции ангиогенеза во время восстановления костной ткани после травм [30]. Кроме того, активация иммунной системы обеспечивает основу для возникновения ГО [31]. Повреждение ЦНС часто связано с активацией ряда иммунологических механизмов, при этом запускается выброс различных воспалительных цитокинов в сыворотку и цереброспинальную жидкость [32]. Так, у пациентов с ЧМТ в кровотоке регистрируют повышение уровня воспалительных цитокинов, таких как С-реактивный белок, IL-6 и фактор некроза опухоли-α (TNF-α) [29, 33].
Установлено, что лептин способствует локальной активации клеток-предшественников костной ткани и остеобластов, но также может снижать активность последних путем связывания с нейронами гипоталамуса. Результаты недавно проведенных исследований [34, 35] показали, что после ЧМТ значительно повышается содержание лептина в сыворотке и спинномозговой жидкости. L. Wang и соавт. [36] для выяснения роли лептина в формировании костной ткани провели исследование с участием 64 самцов крыс, выделив три группы животных: с повреждением головного мозга, с переломами бедренной кости, с переломами бедренной кости в сочетании с повреждением головного мозга. Оказалось, что сывороточные уровни лептина были значительно выше у животных с сочетанной ЧМТ по сравнению с крысами двух других групп в первые 4 и 8 нед после операции [36]. Было обнаружено, что OB-Rb, или длинная форма рецептора лептина, присутствует в остеобластах, хондроцитах и мезенхимальных стволовых клетках, свидетельствуя о возможной важности лептина для роста и развития костной ткани [37]. Влияние лептина на гипоталамус выражается в активации симпатической нервной системы и увеличении количества активных β2-адренорецепторов на поверхности остеобластов, что приводит к ингибированию оссификации [38]. Когда лептин действует периферически, он не только способствует минерализации кости и пролиферации остеобластов, но и ингибирует апоптоз последних [36]. В нормальных условиях эти эффекты находятся в сбалансированном состоянии. Однако прямое и вторичное повреждение ЦНС может привести к повреждению или дисфункции гипоталамуса. В этом случае ослабляется эффект ингибирования оссификации, вызванный воздействием лептина на гипоталамус, что ускоряет регенерацию костной ткани, увеличивает образование костной мозоли и повышает риск НГО [36]. J. Gordeladze и соавт. [33] обнаружили низкие уровни лептина в сыворотке крови у пациентов с НГО, но не получили данных о наличии связи между установленными уровнями лептина и НГО [33].
Кроме того, результаты исследований [17, 34] выявили значительное увеличение уровня паратиреоидного гормона (ПТГ) в кровотоке у пациентов с сочетанной ЧМТ уже в течение 6 ч после травмы. ПТГ как регулятор гомеостаза кальция и фосфора играет важную роль в полноценном формировании костной ткани, наблюдаемом у пациентов с сочетанной ЧМТ [34]. В то же время в других исследованиях [13, 22] не обнаружили существенных различий в уровне ПТГ сыворотки крови на различных сроках после травм ЦНС.
Еще одним белком, связанным с НГО, является остеокальцин — маркер ремоделирования кости. Cbfa1, член семейства транскрипционных факторов runt/Cbfa, был впервые идентифицирован как активатор экспрессии остеокальцина c действующим механизмом в остеобластах, являющийся остеобластным специфического генома. Cbfa1 регулирует активность всех основных генов, экспрессируемых остеобластами. В экспериментах Cbfa1 был определен как ключевой регулятор дифференцировки остеобластов in vivo. Анализ Cbfa1-дефицитных мышей показал, что дифференцировка остеобластов останавливается в отсутствие Cbfa1, причем ни один параллельный сигнальный путь не может преодолеть этот блок. Наконец, выявили, что Cbfa1 играет роль в развитии и дифференциации остеобластов, регулируя скорость осаждения костной матрицы дифференцированными остеобластами. Таким образом, Cbfa1 важен не только для дифференцировки остеобластов, но и для их функционирования [39, 40]. O. Trentz и соавт. [41] установили, что содержание остеокальцина значительно ниже у пациентов с сочетанной и изолированной ЧМТ по сравнению с группой пациентов с изолированными переломами нижних конечностей, что указывает на возможную прогностическую роль уровня остеокальцина в формировании эктопической кости. Также в сыворотке пациентов с ЧМТ наблюдалась повышенная экспрессия маркерных генов остеобластной дифференцировки RUNX-2, SP-7 и CATK. В свою очередь RUNX-2 и SP-7 являются факторами остеобластной дифференцировки, а CATK — остеобластной активности [17]. T. Tanigushi и соавт. [39] и X. Banse и соавт. [42] подтвердили ранее выдвинутую теорию дисбаланса между проостеоиндуктивными и антиостеоиндуктивными факторами у пациентов с сочетанной ЧМТ, изучив такие маркеры костного метаболизма, как карбоксилтерминальный пропептид коллагена 1-го типа (P1CP) и C-терминальный телопептид коллагена 1-го типа (1CTP). В частности, уровни P1CP были выше нормальных значений у пациентов с ЧМТ, что свидетельствует о повышенной остеобластной активности, тогда как содержание 1CTP было ниже у пациентов с изолированной или сочетанной ЧМТ, что указывает на снижение остеокластической активности [39, 42]. Предполагается, что инсулиноподобный фактор роста-2 (IFG-2) играет роль в образовании ГО, поскольку он стимулирует синтез коллагена 1-го типа и синтез хрящевой матрицы [43].
Костные морфогенетические белки (BMPs), которые принадлежат к семейству трансформирующего фактор роста-β (TGF-β), в частности BMP-9 и BMP-2, обладают остеиндуктивными свойствами и могут быть задействованы в патогенезе НГО [44]. Известно, что они индуцируют не только мезенхимальные и остеопрогениторные клетки, но также синтез остеоиндуцирующих факторов, таких как IFG и фактор роста эндотелия сосудов (VEGF), контролируя дифференцировку остеобластов и формирование костной ткани [45, 46]. Однако результаты исследования O. Gautschi и соавт. [8] показали, что содержание BMPs в цереброспинальной жидкости у пациентов с ЧМТ не достигает таких концентраций, при которых реакция остеогенной клетки становится достаточной для формирования ГО.
Основной фактор роста фибробластов (FGF) — еще один член семейства TGF-β, средний уровень которого в сыворотке крови у пострадавших с ЧМТ, по данным исследования [47], был выше в 7 раз по сравнению со средним показателем пациентов контрольной группы с местными повреждениями. Матриксные металлопротеиназы (ММР), участвующие в многочисленных процессах ремоделирования, включая фазу регенерации костной ткани и ангиогенез, были изучены в исследованиях с НГО из-за потенциала использования их в качестве биомаркеров повреждения нервной ткани и для прогноза ЧМТ и спинальной травмы [48]. В частности, у пациентов с ЧМТ в остром периоде регистрировали высокие уровни MMP-9 и IL-6 в крови, что являлось свидетельством важной роли ММР-9 в воспалительном процессе и влиянии на исход травмы [49].
Сигнальный путь Wnt является фактором транскрипции, необходимым для развития нескольких типов тканей, включая костную. Повышенный интерес к генам Wnt обусловлен выявленной ролью их мутаций, обусловливающих избыточное образование костной ткани [35]. Дифференцировка остеобластов предпочтительна, когда экспрессия сигнального пути Wnt повышена. Следовательно, само изменение активности сигнального пути Wnt в первую очередь влияет на формирование костной ткани в физиологических условиях и не может вызывать образование эктопической кости в отсутствие индукторов дифференцировки остеобластов [50]. J. Regard и соавт. [51] определили, что одним из таких индукторов является сигнальный путь Hedgehog (Hh). В проведенной авторами экспериментальной работе с прогрессирующей оссифицирующей гетероплазией in vivo снижение экспрессии сигнального пути Wnt было недостаточным для ингибирования эктопического образования кости, вызванного эктопической передачей сигнального пути Hh. Важно отметить, что сверхэкспрессия сигнального пути Wnt также ингибирует дифференцировку остеобластов [52]. Поскольку оба пути (Wnt и Hh) обладают мощной регуляторной активностью, можно допустить определенное снижение уровня их экспрессии, тогда как эктопическая передача сигналов или сверхэкспрессия может вызвать отрицательные эффекты. Следовательно, фенотипы заболевания на тканевом и клеточном уровнях в первую очередь определяются активируемым сигнальным путем. Поскольку передача сигналов Wnt и Hh необходима для регулирования разнообразных физиологических процессов, предполагается, что их баланс регулируется с помощью GNAS, обеспечивая важную концептуальную основу для понимания молекулярных и клеточных механизмов многих заболеваний, включая НГО [51].
Кроме того, гидроксипролин (протеин, содержащийся в костной и соединительной ткани), обнаруженный в 24-часовом сборе мочи, также наблюдался у пациентов с поврежденным спинным мозгом и с образованием гетеротопических оссификатов [53], однако дальнейшее исследование его клинического значения не проводилось.
В последнее время наблюдается повышенный интерес научного сообщества к простагландинам. Изучается их роль как факторов, влияющих не только на гетеротопическое формирование костной ткани, но также и на костный гомеостаз через индуцирующие факторы (например, BMP-2 и PTH) [54].
Заключение. НГО представляет собой сложный патологический процесс, проявляющийся необычной клиникой, которая вызывает проблемы у пациентов и сопряжена с трудностями в изучении этой патологии у врачей. Определены многочисленные клинические факторы и биохимические маркеры, которые прогнозируют возможность развития НГО и также объясняют различные пути, вовлеченные в патофизиологию заболевания. Однако на сегодняшний день сущность НГО не ясна. Существенным фактором, ограничивающим активное изучение этого патологического процесса, является его редкая встречаемость. Таким образом, будущие исследования должны быть направлены на более детальное изучение генетического и биомолекулярного элементов НГО. Важно подчеркнуть, что лучшее понимание патогенеза развития НГО поможет не только в профилактике и лечении ГО, но также расширит наши знания о другой часто встречающейся патологии, такой как несрастающиеся переломы.
Сведения об авторах
Для контактов: Гареев И.Ф. — тел.: +7(347)255-76-66