Гиалиноз стромы что это
Гиалиноз стромы что это
Кафедра акушерства и гинекологии №1 лечебного факультета Московской медицинской академии им. И.М. Сеченова
Кафедра акушерства и гинекологии №1 Первого Московского государственного медицинского университета им. И.М. Сеченова
Клинико-морфологические особенности простой и пролиферирующей миомы матки
Журнал: Российский вестник акушера-гинеколога. 2013;13(6): 34-38
Сидорова И. С., Агеев М. Б. Клинико-морфологические особенности простой и пролиферирующей миомы матки. Российский вестник акушера-гинеколога. 2013;13(6):34-38.
Sidorova I S, Ageev M B. The clinical and morphological features of simple and proliferating uterine myoma. Russian Bulletin of Obstetrician-Gynecologist. 2013;13(6):34-38.
Кафедра акушерства и гинекологии №1 лечебного факультета Московской медицинской академии им. И.М. Сеченова
Представлен анализ результатов исследований последних лет, посвященных основным клинико-морфологическим вариантам развития миомы матки: простой и пролиферирующей. Проведено сравнение этиологии и патогенеза двух типов миом на основании результатов цитогенетических (потеря гетерозиготности и микросателлитной нестабильности хромосомных районов), молекулярно-генетических, эндокринологических, иммунологических исследований, исследований в области сферы межклеточного взаимодействия. Рассмотрены вопросы дифференциальной диагностики пролиферирующей миомы матки и лейомиосаркомы.
Кафедра акушерства и гинекологии №1 лечебного факультета Московской медицинской академии им. И.М. Сеченова
Кафедра акушерства и гинекологии №1 Первого Московского государственного медицинского университета им. И.М. Сеченова
Концепция пато- и морфогенеза миом матки обсуждается в литературе не одно десятилетие. Однако многие вопросы, посвященные данной проблеме, остаются дискуссионными и мало изученными. В частности, недостаточно исследованы основные клинико-морфологические варианты развития миомы матки: простой и пролиферирующий. Сохраняют свою актуальность вопросы онкологической настороженности у женщин с быстро растущей опухолью, сочетающейся с гиперплазией эндометрия, аденомиозом, генитальным наружным эндометриозом, а также с вовлечением в патологический процесс шейки матки [2, 3, 5, 15, 16].
Морфологически простые миомы характеризовались хорошо очерченными пучками из гладкомышечных клеток. Паренхиматозный компонент (гладкомышечные клетки) опухоли сочетался с преобладающим стромальным (соединительнотканным) компонентом. В процессе роста, «созревания» и «старения» узла миомы данного гистотипа происходило увеличение доли стромального компонента, а миоциты становились компактными, уплощенными, их ядра подвергались сморщиванию.
Особенностями пролиферирующей миомы матки являются множественные быстрорастущие миоматозные узлы чаще в молодом возрасте (до 35 лет). Межмышечное расположение ближе к полости матки вплоть до центрипетального роста и подслизистой локализации. Узлы развиваются также в зонах миометрия, для которых характерны миоциты с выраженной сократительной активностью, способные к быстрой гиперплазии, гипертрофии, пролиферации с относительно невысокой синтетической активностью. Макроскопически узлы этого гистотипа имеют также четкие границы с прилежащим миометрием, их консистенция более мягкая. На разрезе определяется множество сосудов и кровоизлияний.
При микроскопическом исследовании очаги пролиферации опухолевых миоцитов чаще всего локализуются в периваскулярных пространствах вокруг сосудов, которые имеют строение синусоидальных, а также в периферических отделах опухолевых узлов (в зонах их роста, когда миома растет из узла). В отдельных случаях вся миома состоит из пролиферирующих миоцитов с синусоидальными сосудами. Мышечные стенки крупные с «сочными» крупными, гиперхромными ядрами округлой формы. Клеточные элементы располагаются более упорядоченно в виде тяжей и пучков. Строма в зонах пролиферации представлена незначительно выраженной рыхлой соединительной тканью.
Гистологические варианты пролиферирующих миом, в отличие от простых, более разнообразны. Наряду с участками клеточной миомы в опухолевом узле отмечаются очаги с группами эпителиоподобных миоцитов или причудливой формы. По-видимому, можно предполагать наличие переходных миом от пролиферирующих к эпителиоидным.
Миометрий вне узлов имеет признаки гипертрофии, наблюдаются увеличение размеров миоцитов, их ядер, увеличение в них хроматина. В строме отмечаются повышенное количество капилляров на единицу площади и их полнокровие. Характерно наличие множества участков в виде микроскопических активных «зон роста».
У больных миомой матки пролиферирующего типа во все возрастные периоды повышена частота пролиферативных процессов в шейке матки: резервно-клеточная гиперплазия, метаплазия, лейкоплакия, CIN I-II.
Изменение маточных труб наиболее часто характеризуется гиперпластическим типом строения слизистой оболочки во все возрастные периоды. У больных с пролиферирующим вариантом миомы матки во все возрастные периоды по сравнению с больными с простой миомой отмечается повышение частоты истинных доброкачественных опухолей яичников. А в постменопаузе в 2,5 раза чаще обнаружен рак яичников.
Таким образом, в пролиферирующих миоматозных узлах имеются признаки пролиферации опухолевых миоцитов, высокая клеточность, крупные размеры ядер. В миометрии, окружающем простые миоматозные узлы, нет каких-либо специфических изменений.
Простая миома является неактивной, медленно растущей опухолью с преобладанием соединительнотканных компонентов, фенотипической трансформацией миоцитов и снижением кровоснабжения в миоматозных узлах.
Пролиферирующие миомы следует отнести к активной множественной быстрорастущей опухоли матки с повышенной пролиферативной активностью и часто сопровождающейся пролиферативными (гиперпластическими) процессами в эндометрии, опухолевидными и доброкачественными опухолями яичников. Между этими крайними клинико-морфологическими вариантами развития существуют промежуточные варианты.
В многочисленных работах И.С. Сидоровой, Е.А. Коган [7, 11, 12, 15, 16], по данным морфологического и иммуногистохимического исследований, выделена группа основных патологических процессов, наблюдаемых при росте миомы матки: пролиферация, гипертрофия и апоптоз миоцитов, а также стромообразование и вторичные изменения. Из этих работ следует, что рост миомы матки связан не только с пролиферацией, но и с гипертрофией миоцитов, возникающих под действием факторов роста (ИПФР-1, ЭФР, ТцФР), онкопротеинов C-myc, Bcl-2. Простая миома матки отличается преобладанием апоптоза над пролиферацией в миоцитах. Увеличение размеров такой опухоли, вероятно, является результатом не только пролиферации опухолевых клеток, но и их гипертрофии под влиянием ЭФР, ИПФР-1, а также пролиферации элементов стромы и ее вторичных изменений. Пролиферирующая (клеточная) миома матки характеризуется незначительным преобладанием процессов пролиферации опухолевых клеток над апоптозом. Увеличение размеров клеточной миомы матки связано с пролиферацией и гипертрофией миоцитов, а также с их накоплением за счет удлинения сроков их жизни на фоне сниженного апоптоза. В работах также показано, что при митотически активных и клеточных миомах матки обильные кровотечения встречаются чаще, чем при простых, что обусловлено более высоким накоплением в них гепаринсвязывающих факторов роста, вызывающих неоангиогенез и, вероятно, местную гипокоагуляцию. При сочетании миомы матки и гиперплазии эндометрия происходит усиление процессов пролиферации опухолевых клеток различных гистологических типов миом матки [8].
В последние годы считается, что миому матки, патологию эндометрия и шейки матки в различных сочетаниях следует рассматривать как пролиферативный (гиперпластический) синдром, при котором одновременное развитие гиперпластических процессов в разных структурах матки оказывает друг на друга стимулирующее влияние. Поэтому предложена тактика, направленная на раннее выявление миомы матки и нормализацию нейрогуморальных нарушений, лечение бесплодия, сохранение беременности. Выжидательное наблюдение за пациентками с миомой матки, особенно одновременно с патологией эндометрия, может привести к трансформации миоцитов и клеток эндометрия [15].
Хотя саркома матки наблюдается редко (0,5-0,8%), у каждой 4-5-й пациентки при гистологическом исследовании удаленного препарата матки возникают сомнительные гистологические заключения, поскольку иногда отсутствуют объективные различия между пролиферирующей (митотически активной) миомой и начальной стадией саркоматозного перерождения. Мнение, что аденокарцинома при наличии быстрорастущей миомы матки встречается чаще, чем без нее, является общепризнанным (Я.В. Бохман) [3].
Критерием для постановки диагноза лейомиосаркомы является наличие коагуляционного некроза опухолевых клеток. В его отсутствие диагноз может быть поставлен при наличии диффузной умеренной или выраженной клеточной атипии и количества митозов ≥10 на 10 полей зрения большого увеличения микроскопа. При количестве митозов менее 10 возможность появления рецидива небольшая (менее 2-3%) и развитие его медленное. Эта группа обозначается как «атипическая лейомиома с низким риском развития рецидива». Примерно в 25% опухолей выявляется инвазия сосудов. В редких случаях в типичных лейомиосаркомах присутствуют гигантские клетки, напоминающие остеокласты, и выраженным компонентом могут быть ксантомные клетки. Диагноз лейомиосаркомы должен устанавливаться с большой осторожностью у женщин моложе 30 лет и только после исключения возможного приема льюпролида, который иногда бывает причиной развития некроза, идентичного коагуляционному некрозу в опухоли.
Эпителиоидный вариант лейомиосаркомы сочетает «эпителиоидный» фенотип с обычными чертами злокачественности, т.е. большой клеточностью, цитологической атипией, некрозом опухолевых клеток и высокой митотической активностью.
Внимание исследователей направлено на выявление полигеномных нарушений, накопления мутаций и потери гетерозиготности и микросателлитной нестабильности хромосомных районов 10q22, 10q26, 10p13, 9p21, 3p14 в дифференциальной диагностике лейомиосарком и пролиферирующих лейомиом матки. В ходе исследования [19] обнаружена высокая (в среднем 40%) частота потери гетерозиготности и/или микросателлитной нестабильности в группе больных с гистологическим диагнозом лейомиосаркома матки. В группе больных с пролиферирующей миомой матки генетические изменения не выявлены. В результате сравнительного анализа групп больных с лейомиосаркомой и пролиферирующей миомой матки показано, что анализ потери гетерозиготности и микросателлитной нестабильности позволяет дифференцировать эти заболевания со специфичностью и чувствительностью в 92 и 95% случаев соответственно. Выявлена статистически достоверная корреляция между потерей гетерозиготности и/или микросателлитной нестабильностью локуса D10S218 и возрастом пациенток. Выявлено, что у женщин моложе 40 лет частота потери гетерозиготности и/или микросателлитной нестабильности по этому локусу достоверно выше, чем у женщин старше 40 лет. Вероятнее всего, это свидетельствует о том, что онкологические процессы у больных молодого возраста идут значительно агрессивнее, чем у больных старшего возраста. Авторы предлагают начать разработку молекулярно-генетической тест-системы, основанную на молекулярно-генетических нарушениях, для дифференциальной диагностики лейомиосаркомы и пролиферирующей миомы матки [19].
Фактором риска быстрого и множественного роста миомы матки является также наличие в генотипе женщины делеционного варианта гена GSTM1 (ген глутатион-S-трансферазы M1). Связи между особенностями полиморфизма гена семейства глутатион-S-трансфераз и развитием миомы матки стабильно малых размеров не выявлено. Кроме того, фактором риска развития быстрорастущей миомы матки является наличие в генотипе женщины низкофункционального аллеля MTRR 66G. Автор предлагает использовать выявленные ассоциации в качестве генетических маркеров предрасположенности к неблагоприятному клиническому течению миомы матки [6].
Пролиферирующая миома матки наиболее часто встречается у пациенток с поздним (старше 15 лет) менархе, длительными и обильными менструациями и их сочетанием. Она значимо чаще возникает у женщин с редкими нарушениями репродуктивной функции и невынашиванием беременности, при длительном применении внутриматочной контрацепции. Пролиферирующие миомы матки в 48,7% случаев имеют множественный характер роста с интерстициосубсерозной (60%) и субмукозной (14,7%) локализацией миоматозных узлов. Основными гистохимическими особенностями пролиферирующей миомы явились увеличение метаболической активности с преобладанием аэробного гликолиза по данным определения сукцинатдегидрогеназы и уменьшением анаэробного пути. Увеличение количества сосудов в них влечет за собой усиление окислительно-восстановительных процессов и пролиферативной активности. Автором разработана шкала оценки риска развития пролиферирующей миомы матки со 100% специфичностью. Количество баллов от 6 до 9 по данной шкале факторов риска свидетельствует о вероятном развитии пролиферирующей миомы матки в 50% случаев и предполагает назначение противорецидивной гормональной терапии после применения органосохраняющих методов лечения [13].
Изучение биохимических и морфоструктурных особенностей биологических жидкостей у больных с быстрорастущей миомой матки показало, что, по мере увеличения числа и объема узлов миомы матки, а соответственно и объема матки, нарастают уровни малонового альдегида и карбонильной группы белков в эндометриальном секрете [18].
Таким образом, современные представления об этиологии и патогенезе миомы матки основаны на научных фактах из области цитогенетики, молекулярной генетики, эндокринологии, иммунологии, сферы межклеточного взаимодействия. Дальнейшие исследования иммунной системы позволят выявить патогенетическую и прогностическую значимость состояния гуморального и клеточного иммунитета у пациенток, страдающих миомой матки. Поскольку развитие и прогрессирование миомы матки определяется дисбалансом ангиогенных и ангиостатических факторов, необходимо дальнейшее изучение роли хемокиновых рецепторов в иммунных реакциях, связанных с осложнениями миомы матки. Необходимы дальнейшие исследования по вопросам дифференциальной диагностики пролиферирующей миомы матки и лейомиосаркомы, поиск специфических маркеров диагностики и прогноза лейомиосаркомы.
Гиалиноз стромы что это
Фибробласты (гладкая мускулатура)
Кровеносные сосу- ды, ретикулярные волокна в различ- ных тканях
Эндотелиальные и эпителиальные клетки
Базальная мемб- рана, почечные клубочки
Фибробласты (гладкая мускулатура)
Базальная мемб- рана, кровеносные сосуды
Термин ретикулин используется для обозначения отдельных фибрилл коллагена, которые участвуют в образовании трехмерных сетчатых структур (или ретикулума). Ретикулин определяется при световой микроскопии только при импрегнации серебром.
Эластин. Эластические волокна составлены из неупорядоченных сплетений фибрилл эластина вокруг микрофибриллярной сердцевины, состоящей из кислого гликопротеина (фибриллина). Такая структура обеспечивает уникальную эластичность этих волокон, которые широко распространены в соединительной ткани, особенно в коже, легких и кровеносных сосудах. Эластические волокна окрашиваются в черный цвет специальными красителями (например, орсеином).
Унаследованный (аутосомно-доминантный) дефект формирования фибриллина приводит к нарушению структуры эластических волокон, что лежит в основе синдрома Marfan, который характеризуется патологической дистрофией соединительной ткани, при этом наиболее часто поражаются магистральные кровеносные сосуды (аорта) и суставы. При синдроме Ehlers-Danlos (группа унаследованных нарушений, большинство из которых передаются аутосомно-доминантно ), имеется дефект во взаимном соединении нитей коллагена, что ведет к общей непрочности соединительной ткани и к повышению подвижности суставов.
Клетки соединительной ткани. В соединительной ткани, помимо фибробластов, синтезирующих коллаген и гликозаминогликаны и лаброцитов (тучные клетки, тканевые базофилы), вырабатывающих биологически активные вещества, находятся клетки гематогенного происхождения, осуществляющие фагоцитоз (полиморфно-ядерные лейкоциты, гистиоциты, макрофаги), а также обеспечивающие иммунные реакции (плазмобласты, плазмоциты, лимфоциты, макрофаги). Они активно участвуют в метаболизме волокон и межуточного вещества.
К стромально-сосудистым диспротеинозам относят:
— мукоидное набухание;
— фибриноидное набухание;
— гиалиноз;
— амилоидоз.
Мукоидное набухание, фибриноидное набухание и гиалиноз очень часто являются последовательными стадиями дезорганизации соединительной ткани.
Для выявления гликозаминогликанов используются специальные окраски (например, альциановый синий, коллоидное железо). При окраске гематоксилин-эозином они имеют слабобазофильную окраску, так как при ослабевании связи с белком высвобождаются их кислотные радикалы. Чаще всего в практике используют метахроматические катионные красители, которые окрашивают гликозаминогликаны в цвет, отличный от собственного цвета красителя. Толуидиновый синий, например, придает гликозаминогликанам сиреневый или пурпурный цвет. Микроскопически коллагеновые волокна обычно сохраняют пучковое строение, но набухают и разволокняются. Набухание и увеличение в объеме основного вещества приводит к тому, что клетки соединительной ткани удаляются друг от друга. Макроскопически органы практически не изменены.
Локализация. Мукоидное набухание развивается чаще всего в стенках артерий, сердечных клапанах, эндо- и эпикарде, в капсулах суставов.
— ревматические болезни (ревматизм, системная красная
волчанка, системная склеродермия, ревматоидный артрит,
узелковый периартериит и др.);
— атеросклероз;
— гипертоническая болезнь;
— гипоксия.
Значение. Функция органа в гистионе, где развивается мукоидное набухание, нарушается незначительно.
Микроскопически пучки коллагеновых волокон становятся гомогенными, эозинофильными (вследствие блокирования кислотных радикалов ГАГ плазменными белками и смещения рН среды в щелочную сторону), резко ШИК-позитивными, что свидетельствует о значительном увеличении в них количества гликопротеидов. Окраска на фибрин всегда положительная, однако интенсивность ее колеблется. Метахромазия при окрашивании толуидиновым синим отсутствует. Это связано с практически полной деструкцией гликозаминогликанов.
Макроскопически органы и ткани, в которых развивается фибриноидное набухание, мало изменены.
Фибриноидное набухание носит либо системный (распространенный), либо локальный (местный) характер.
Системное поражение отмечено при:
— инфекционно-аллергических заболеваниях (фибриноид
сосудов при туберкулезе с гиперергическими реакциями);
— аллергических и аутоиммунных болезнях (ревматические
болезни, гломерулонефрит);
— ангионевротических реакциях (фибриноид артериол при
гипертонической болезни и артериальных гипертензиях).
Локально фибриноид выявляется при хроническом воспалении. Например, в дне хронической язвы желудка, трофических язв кожи.
Значение фибриноидного набухания. Фибриноидное набухание ведет к нарушению, а нередко и прекращению функции органа (например, острая почечная недостаточность при злокачественной гипертонии, характеризующейся фибриноидными изменениями и некрозом артериол и капилляров клубочков. Развивающиеся в исходе фибриноидного некроза склероз или гиалиноз ведут к нарушению функции клапанов сердца (формированию пороков сердца), неподвижности суставов, сужению просвета и уменьшению эластичности стенок сосудов и др.
Гиалиноз может развиваться в исходе разных процессов:
— плазматического пропитывания;
— фибриноидного набухания (фибриноида);
— склероза.
Классификация. Различают:
— гиалиноз сосудов;
— гиалиноз собственно соединительной ткани.
Каждый из двух видов гиалиноза может носить системный и местный характер.
Гиалиноз сосудов. Гиалинозу подвергаются преимущественно мелкие артерии и артериолы. Ему предшествуют повреждение эндотелия, базальной мембраны и гладкомышечных клеток стенки сосуда и пропитывание ее белками плазмы крови.
Причины системного гиалиноза сосудов:
— гипертоническая болезнь;
— гипертонические состояния, гипертензии (болезни почек,
опухоли эндокринных и половых желез);
— диабет (диабетический артериологиалиноз);
— ревматические заболевания;
— атеросклероз.
Ведущими механизмами в его развитии являются:
— деструкция волокнистых структур;
— повышение сосудисто-тканевой проницаемости
(плазморрагия).
Гиалиноз мелких артерий и артериол носит системный характер, но наиболее выражен в почках, головном мозге, сетчатке глаза, поджелудочной железе, коже.
Микроскопически при гиалинозе артериолы превращаются в утолщенные стекловидные трубочки с резко суженным или полностью закрытым просветом.
Руководствуясь особенностями патогенеза гиалиноза сосудов, выделяют 3 вида сосудистого гиалина:
1) простой, возникающий из малоизмененных компонентов плазмы крови (встречается чаще при гипертонической болезни доброкачественного течения, атеросклерозе и у здоровых людей);
2) липогиалин, содержащий липиды и бета-липопротеиды (обнаруживается чаще всего при сахарном диабете);
3) сложный гиалин, строящийся из иммунных комплексов, фибрина и разрушающихся структур сосудистой стенки (характерен для болезней с иммунопатологическими нарушениями, например, для ревматических заболеваний).
Местный гиалиноз артерий как физиологическое явление наблюдается в селезенке взрослых и пожилых людей, отражая функционально-морфологические особенности селезенки как органа депонирования крови.
Значение. Различно в зависимости от локализации, степени и распространенности гиалиноза. Распространенный гиалиноз артериол может вести к функциональной недостаточности органа (почечная недостаточность при артериолосклеротическом нефроциррозе). Ломкость сосудов ведет к развитию кровоизлияний (например, геморрагический инсульт при гипертонической болезни).
Гиалиноз собственно соединительной ткани
Системный гиалиноз соединительной ткани и сосудов развивается обычно в исходе фибриноидного набухания, ведущего к деструкции коллагена и пропитыванию ткани белками плазмы и полисахаридами. Этот механизм развития системного гиалиноза соединительной ткани особенно часто встречается при заболеваниях с иммунными нарушениями (ревматические болезни).
Местный гиалиноз как исход склероза развивается в рубцах, фиброзных спайках серозных полостей, сосудистой стенке при атеросклерозе, инволюционном склерозе артерий, при организации тромба, инфаркта, заживлении язв, ран, в капсулах, строме опухоли и т.д. В основе гиалиноза в этих случаях лежат нарушения обмена соединительной ткани. Подобный механизм имеет гиалиноз некротизированных тканей и фибринозных наложений в плевре, перикарде и т.д. Гиалиноз может завершать фибриноидные изменения в дне хронической язвы желудка, в червеобразном отростке при аппендиците.
Микроскопическое исследование. Пучки коллагеновых волокон теряют фибриллярность и сливаются в однородную плотную хрящеподобную массу; клеточные элементы сдавливаются и подвергаются атрофии.
Макроскопическая картина. При выраженном гиалинозе волокнистая соединительная ткань становится плотной, хрящевидной, белесоватой, полупрозрачной.
Значение. Различно в зависимости от локализации, степени и распространенности гиалиноза. Местный гиалиноз может быть причиной функциональной недостаточности органа. В рубцах он может не причинять особых расстройств, за исключением косметического дефекта.
Корреляция результатов эхографии, магнитно-резонансной томографии и морфологии при саркомоподобной лейомиоме матки
1) Кафедра рентгенологии и радиологии Военно-медицинской академии им. С.М. Кирова, кафедра радиологии и рентгенологии с курсом УЗ-диагностики, Санкт-Петербург, Россия;
2) Городская больница № 40, отделение лучевой диагностики, Сестрорецк, Россия;
3) Дорожная клиническая больница на ст. Новосибирск-главный ОАО «РЖД», рентгеновское отделение №1,
4) Новосибирский областной онкологический диспансер, патоморфологическое отделение,
5) Новосибирский областной онкологический диспансер, отделение лучевой диагностики,
6) Новосибирский областной онкологический диспансер, отделение гинекологии, Новосибирск, Россия
Приводится клиническое наблюдение пациентки Х., на примере которого рассматривается дифференциальная диагностика саркомы и миомы матки со сложными формами дегенерации методами ультразвуковой диагностики и магнитно-резонансной томографии.
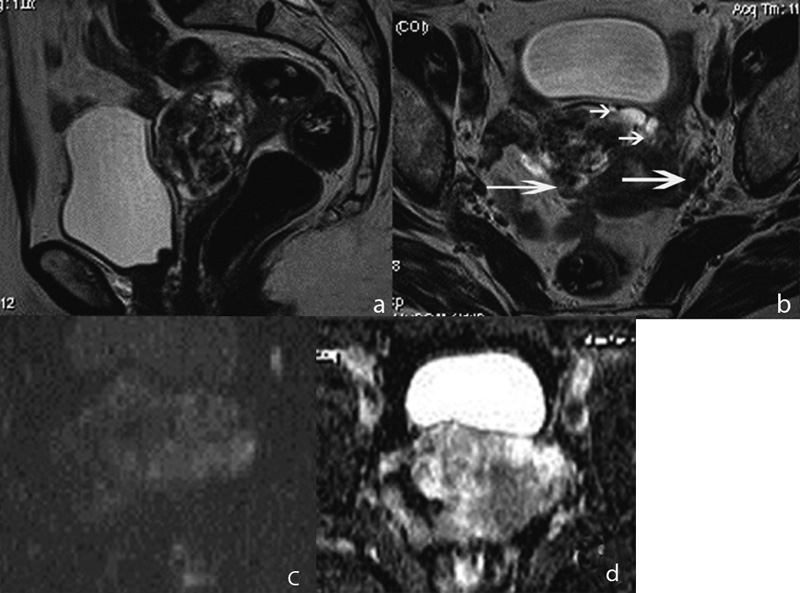
Обсуждение. При затруднении интерпретации сонографической картины в дифференциальной диагностике саркомы и миомы матки рекомендуется проведение МРТ малого таза. При магнитно-резонансной томографии с применением только лишь морфологических последовательностей дифференцировать доброкачественные и злокачественные опухоли миометрия возможно, только опираясь на вторичные признаки (инвазия в прилежащие структуры, регионарная лимфаденопатия, наличие метастазов). Контрастное усиление также не позволяет убедительно различить эти образования, так как и саркомы, и лейомиомы неоднородно накапливают контрастный препарат. Наибольшие затруднения вызывает дифференциальная диагностика крупных узлов, а также сарком и лейомиом клеточного типа или с миксоматозной дегенерацией.
Ключевые слова: саркомы матки, миома матки, ультразвуковая диагностика, магнитно-резонансная томография, МРТ, диффузно-взвешенное изображение.
Лейомиома представляет собой наиболее распространенное из объемных образований матки, составляя 12-25% от всех гинекологических заболеваний [1]. Пик встречаемости лейомиом приходится на поздний репродуктивный и пременопаузальный возраст, когда опухоли этого типа присутствуют у 77% женщин [1, 2].
До 65% лейомиом матки со временем претерпевают так называемые вторичные или дегенеративные изменения, что делает эту группу доброкачественных опухолей чрезвычайно разнородной с точки зрения морфологии и, соответственно, ультразвуковой и магнитно-резонансной семиотики. К таким изменениям относится гиалиновая дегенерация, составляющая до 63% вторичных изменений лейомиом, мукоидная или миксоматозная дегенерация (19%), кальциноз (8%), кистозная дегенерация с предшествующей фазой отека стромы опухоли (4%), красная или геморрагическая дегенерация (3%), а также жировое перерождение (3%) [3]. Для гиалиновой дегенерации лейомиом при МРТ характерен типичный сигнал стромы узла на Т2-ВИ, более низкий, чем для миометрия, и изоинтенсивный поперечно-полосатым мышцам [3]. При УЗИ участки гиалиноза обычно эхонегативны и могут напоминать мелкодисперсную несмещаемую взвесь. Контуры таких лейомиом четкие, но часто неровные, фиброзные изменения стромы узла сопровождаются повышением его эхогенности [4].
Кальциноз лейомиом сопровождается появлением в их строме гипоинтенсивных включений во всех типах взвешенности при МРТ; при УЗИ кальцинаты демонстрируют характерную гипоэхогенность с эффектом дистального затенения, часто участки обызвествления создают своеобразную картину гиперэхогенного ободка узла [3, 4].
Кистозная форма дегенерации лейомиом при УЗИ проявляется наличием в строме узла гипо- или анэхогенных полостей, лишенных кровотока; при МРТ кистозные включения характеризуются гиперинтенсивным сигналом на Т2-ВИ и гипоинтенсивным на Т1-ВИ с высокими показателями измеряемого коэффициента диффузии [3, 5]. При геморрагической дегенерации строма лейомиомы на МР-изображениях характеризуется повышенным сигналом в Т1-взвешенности [3].
Наиболее сложными по структуре, МР- и эхо-характеристикам являются лейомиомы с миксоматозной дегенерацией. При сонографии лейомиомы такого типа характеризуются анэхогенными включениями вне клиники нарушения питания узла, появлением зон сниженной эхогенности в узле без признаков акустического усиления, а также участками повышенной эхогенности в узле 5. При МРТ лейомиомы данного типа демонстрируют негомогенную структуру, вариабельную интенсивность сигнала на Т1-ВИ, при этом они гипер- или изоинтенсивны миометрию на Т2-ВИ [3, 6].
Такое разнообразие семиотики определяет сложности дифференциальной диагностики дегенеративно измененных лейомиом с другими узловыми образованиями тела матки, в частности, с саркомами.
Саркоматозные опухоли тела матки встречаются достаточно редко, на долю лейомиосарком приходится лишь 1% злокачественных опухолей данного органа [1]. Саркомы обычно проявляются болевым синдромом и метроррагиями, однако могут протекать бессимптомно. Они склонны к быстрому росту, 5-летняя выживаемость составляет 50-65% [6]. Наиболее распространенными подтипами сарком тела матки являются лейомиосаркомы и эндометриальные стромальные саркомы [1].
Пациентка Х., 66 лет, обратилась к гинекологу по поводу периодических болей внизу живота тянущего характера, появившихся около полугода назад. Из анамнеза: менопауза в течение 18 лет, 4 беременности, 2 родов; помимо аппендэктомии около 30 лет назад оперативных вмешательств не было, из соматической патологии – артериальная гипертензия II ст., степень риска III.
При гинекологическом обследовании отмечается увеличение размеров тела матки до 6-7 недель беременности за счет плотного узлового образования, безболезненного при пальпации, с ограниченной подвижностью; шейка матки и придатки без особенностей. По результатам морфологического исследования материалов раздельного диагностического выскабливания полости матки и цервикального канала атипических клеток выявлено не было.
УЗИ на аппарате HITACHI Preirus из транасабдоминального и трансвагинального доступов с использованием датчиков различной частоты: конвексного датчика с постоянной частотой 5 МГц, объемного 3D датчика с частотой 2-7 МГц, внутриполостного датчика с постоянной частотой 3-10 МГц (для визуализации образований малого таза размерами до 50 мм) и линейного датчика с постоянной частотой 3-9 МГц для исследования поверхностных структур. Исследование проводили в режиме серошкального сканирования (В-режим) и цветового допплеровского картирования (ЦДК).
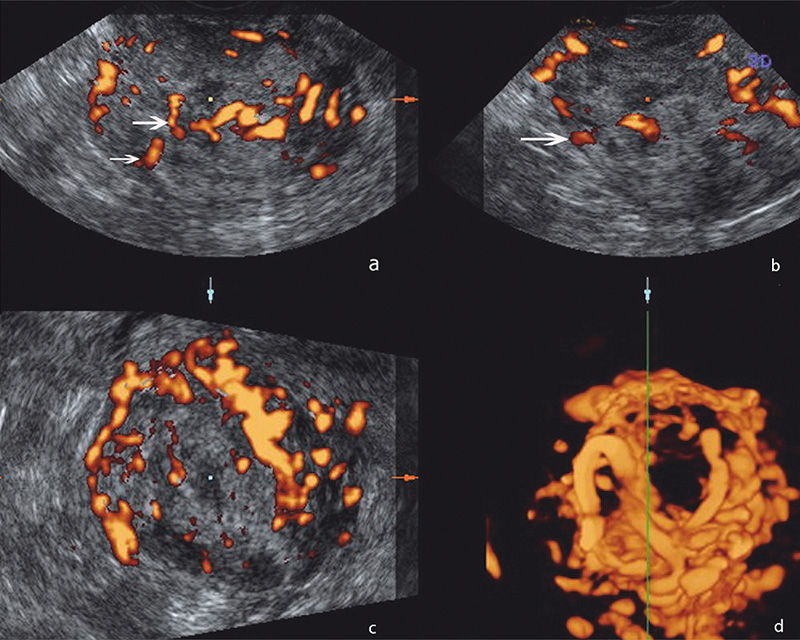
Сонографическая картина образования характеризовалась бугристым контуром, в структуре были анэхогенные аваскулярные участки, кровоток определялся хаотично по всех поверхности, в т.ч. в центральных отделах узла, показатель индекса резистентности (IR) был в пределах 0,5-0,45 мм/сек (рис. 1), на основании чего был предложен диагноз саркома матки.
Рисунок 1. Эхограммы с энергетической допплерографией органов малого таза у больной Х.: а, б, в) образование миометрия с бугристым нечетким контуром, неоднородной структуры за счет гипоэхогенных участков в структуре, хаотичным кровотоком по всей поверхности (стрелки), показатель индекса резистентности (IR) 0,5-0,45 мм/сек; г) 3D-реконструкция, извитой ход сосудов, васкуляризация по типу клубка.
Выполнена МРТ малого таза на системе с напряженностью поля 1,5Т с применением поверхностной 6-канальной катушки. Протокол исследования включал 3 серии Т2-ВИ spin echo в сагиттальной плоскости, по короткой и длинной оси тела матки, Т1-ВИ в аксиальной плоскости с подавлением сигнала от жировой ткани и без такового, ДВИ с b-факторами 50, 500, 800 с/мм 2 в аксиальной плоскости с автоматическим построением карт измеряемого коэффициента диффузии (ИКД). Толщина среза составила 3-4 мм. От контрастного усиления пациентка отказалась.
Рисунок 3. Макропрепарат: удаленная матка с придатками. Полость матки вскрыта, в просвете −
экзофитная крупнодольчатая опухоль на широком основании с признаками нарушения питания, кровоизлияниями, отеком.
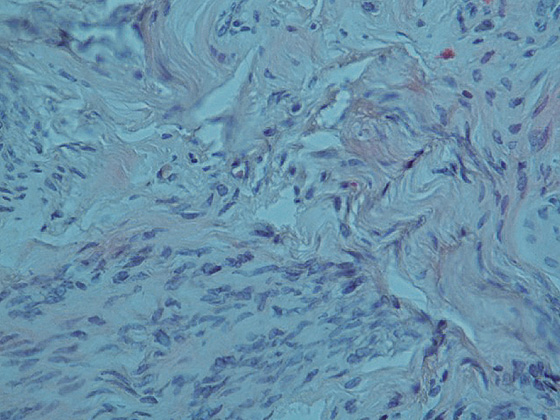
Рисунок 4. Микропрепарат миомы тела матки с дистрофическими изменениями (увеличение 10×40, окраска гематоксилином и эозином).
Опухоль состоит из веретеновидных, с центрально расположенными ядрами клеток, собранных в переплетающиеся пучки,
строма опухоли отечна, сосуды щелевидные, присутствуют эозинофилы и лимфоциты.
При сонографическом исследовании основными признаками, позволяющими дифференцировать саркоматозные опухоли от лейомиом со сложной дегенерацией узла, являются показатели кровотока [5, 7]. В частности, для злокачественных опухолей более характерен центральный тип васкуляризации, тогда как доброкачественные образования миометрия чаще демонстрируют периферический тип кровоснабжения. Большое значение имеют и количественные показатели кровотока: злокачественные опухоли характеризуются более низкими значениями индекса резистентности и более высокими значениями скоростных показателей кровотока [7]. По данным А. Kurjak и соавт., использование порогового значения индекса резистентности (IR) 0,40 позволяет дифференцировать миому и саркому матки с чувствительностью 90,91%, специфичностью 99,82% и прогностической ценностью отрицательного результата 99,96% [8]. Однако не все исследователи разделяют эту точку зрения, считая, что низкие значения IR часто наблюдаются при допплерографии доброкачественных лейомиом [5]. Другим важным дифференциально-диагностическим критерием является максимальная артериальная скорость (МАС). Разные авторы предлагают значения пороговых критериев МАС от 41 до 45 см/с [7]. Но следует отметить, что в пролиферирующих лейомиомах размером более 5 см нередко наблюдаются очень высокие значения МАС, что не позволяет использовать данный критерий как патогномоничный в дифференциации лейомиом и сарком миометрия [4, 9].
Вероятной причиной затруднений в интерпретации сонографической картины в представленном наблюдении послужило наличие сложной дегенерации миоматозного узла и, как следствие, регистрация кровотока в центральных участках образования. УЗ-интерпретацию затрудняло также расширение интрамуральных сосудов в миометрии, окружающем образование, что, вероятно, оказывало влияние на скоростные показатели кровотока и снижение индекса резистентности.
Представленное клиническое наблюдение иллюстрирует, насколько сложным может быть дифференциальная диагностика лейомиом с вторичными дегенеративными изменениями и сарком тела матки. Опухоли сложной структуры в сочетании с сопутствующими сосудистыми изменениями миометрия могут затруднять УЗ-диагностику, имитируя злокачественный рост. В таких случаях для установления диагноза и, соответственно, адекватного выбора тактики лечения рекомендуется проведение МРТ.
Согласен Данный веб-сайт содержит информацию для специалистов в области медицины. В соответствии с действующим законодательством доступ к такой информации может быть предоставлен только медицинским и фармацевтическим работникам. Нажимая «Согласен», вы подтверждаете, что являетесь медицинским или фармацевтическим работником и берете на себя ответственность за последствия, вызванные возможным нарушением указанного ограничения. Информация на данном сайте не должна использоваться пациентами для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.