Гибернация что это в медицине
Искусственная гибернация человека: от гипотермии до фармакологического гипобиоза. Часть I. История гипотермии
Данная статья является литературным обзором развития гибернации человека и освещает исторические аспекты становления гипотермии как метода управления метаболизма человека и нейропротекции головного мозга при критических состояниях.
Artificial human hibernation: from hypothermia to pharmacological hypobiosis. Part I. History of hypothermia
This article is review of literature on the development of human hibernation, it highlights historical aspects of the formation of hypothermia as a method for controlling human metabolism and neuroprotection of the brain in critical conditions.
Гибернация — это поведенческая, физиологическая и молекулярная адаптация, проявляемая различными видами млекопитающих, что позволяет пойкилотермным млекопитающим переносить ограниченную доступность ресурсов, встречающуюся в экстремальных условиях [11]. В период зимней спячки животные испытывают многочисленные периоды оцепенения, которые прерываются короткими периодами эутермии до 35–36°С. Оцепенение можно разделить на три фазы: начало, поддержание и возбуждение, за которыми следует период между приступами эутермии. Во время наступления и поддержания оцепенения у животных наблюдается общее замедление метаболизма, снижение температуры тела, снижение частоты сердечных сокращений, снижение церебрального кровотока до 10%, снижение потребления кислорода, снижение частоты дыхания и подавление иммунных реакций [11, 6]. В то же время длительность гибернации животного зависит от уровня метаболизма головного мозга [9]. Во время пробуждения или во время коротких периодов эутермии происходит быстрая реперфузия крови, которая сопровождается огромным потреблением кислорода и повышением температуры тела. Воспалительные и иммунные реакции возобновляются, и способность выводить свободные радикалы увеличивается [15, 22]. Межэтапная эутермия характеризуется метаболизмом, кровотоком и температурой тела, характерными для гомотермического млекопитающего аналогичного размера [10].
У человека в результате развития шокового состояния происходят ответные реакции в виде централизации кровообращения, повышения энергетической потребности головного мозга и других тканей. Впоследствии при невозможности на раннем этапе оказать адекватную высокоспециализированную медицинскую помощь головной мозг человека через гиперметаболическое состояние переходит в катаболизм. Во время катаболизма при дефиците кислорода отмечается анаэробный тип дыхания, который впоследствии приводит к гибели нейронов. На макроскопическом уровне данные механизмы проявляются в виде диффузного отека головного мозга и постепенной гибели серого вещества головного мозга, как наименее приспособленной к гипоксии структуры. Поэтому многие специалисты неотложной и интенсивной помощи пытаются достичь у пациента состояния гибернации для возможности оказания более эффективной помощи.
Гибернация что это в медицине
Сохраняющегося кровотока хватает только на жизнь клеток, но не для интенсивных сокращений миокарда (ведь сокращение мышцы сердца — самый энергоемкий вид активности). При этом достигается равновесие (снижение сократимости миокарда прямо пропорционально падению кровотока), чем предупреждается появление ишемически поврежденных клеток Затраты энергии в условиях снабжения миокарда ее меньшим ко личеством снижаются Иногда ведущим клиническим признаком ишемии миокарда у таких больных может быть не Ст, а одышка, возникающая вторично вследствие повышения наполнения ЛЖ «Гибернация» миокарда отмечается у больных ИБС с выраженной дисфункцией миокарда ЛЖ
«Гибернирующий» миокард находится во временном (обратимом) состоянии снижения сократимости («спячке»), но он жив, так как внутрь его клеток постоянно идут калий и глюкоза. В «гибернирующих» участках кровоток нарушен надолго (дни, месяцы). «Гибернация» значительной зоны миокарда может привести к развитию сердечной недостаточности
Характерные синдромы при «гибернации» миокарда стабильная и нестабильная Ст, ИМ, ХСН и дисфункция ЛЖ (она потенциально тоже обратима) Разничают 3 формы «гибернации» миокарда острую (он восстанавливается немедленно или в ближайшие сроки после его васкуляризации), подострую (функция миокарда восстанавливается уже через несколько месяцев после реваскуляризации) и хроническую (функция миокарда восстанавливается в течение целого года)
Восстановить функцию левого желудочка (почти половины акинетичных сегментов) можно активным консервативным или хирургическим лечением (АКШ или ангиопластикой) Так, если устраняется стеноз коронарной артерии (ангиопластика) или проводится реваскуляризация (АКШ), то сократительная способность сердца (функция ЛЖ) восстанавливается в значительной степени Часто после АКШ функция ЛЖ у больных со стабильной Ст повышается на треть
ГИБЕРНАЦИЯ ИСКУССТВЕННАЯ
Гибернация искусственная (лат. hibernatio зимняя спячка) — метод фармакологического воздействия на организм, направленный на защиту и сохранение его жизнедеятельности в условиях действия чрезвычайных повреждающих факторов окружающей среды (хирургическое вмешательство, травма, ожоги, инфекционные заболевания и др.). Может быть использована как один из компонентов комбинированной анестезии, а также в комплексе мероприятий интенсивной терапии по лечению тяжелых состояний, обусловленных шоком, интоксикацией, инфекционным заболеванием и т. д.
Основоположник метода Гибернации искусственной — французский патофизиолог А. Лабори. Согласно его взглядам, шок возникает вследствие срыва физиологических реакций, направленных на поддержание гомеостаза (см.).
Вначале симптомы шока завуалированы нейро-эндокринной реакцией, наиболее важным моментом к-рой является усиленное выделение адреналина, способствующего поддержанию кровообращения в жизненно важных органах и в первую очередь в ц. н. с. (период компенсированного, или латентного, шока). Если действие повреждающего фактора продолжается, то после безуспешных попыток восстановить гомеостатическое равновесие во время скрытой фазы шока организм внезапно отказывается от борьбы. Возникает и нарастает атония сосудов, и наступает следующий период — фаза декомпенсированного шока, нередко завершающаяся смертью.
Все проявления реакции организма на повреждающее воздействие, по А. Лабори, можно подразделить на три группы:
1) первичный синдром повреждения (lesional syndrome) — расстройства, нарушения функции и повреждения, которые являются непосредственным результатом воздействия внешнего агента;
2) синдром реакции (reactional syndrome) — комплекс рефлекторных нейро-вегетативных и эндокринных реакций, возникающих как ответ организма на воздействие внешнего фактора и вызванные им повреждения;
3) вторичный синдром повреждения — нарушения и расстройства, возникающие вторично в связи с длительным существованием синдрома реакции, являющегося чисто функциональным.
Основу синдрома реакции составляет рефлекторная деятельность вегетативной нервной системы с выделением медиаторов и других биологически активных веществ (адреналина, ацетилхолина, гистамина, серотонина) и деятельность эндокринной системы, гл. обр. гипофиза и надпочечников. При вторичном синдроме повреждения органические изменения связаны с беспорядочностью (дисгармоничностью) некогда защитных реакций, утративших поэтому свое приспособительное значение.
Помощь организму в борьбе с грозными нарушениями физиологического равновесия может осуществляться либо за счет увеличения силы и длительности защитных реакций организма, либо достижением такого состояния, при к-ром интенсивность реакции будет значительно снижена, что поможет организму пережить период наибольшего внешнего воздействия и в последующем восстановить нарушенное равновесие.
Ослабление реакции организма может быть достигнуто с помощью снижения обмена веществ и торможения нейро-эндокринной системы, что Лабори считает одной из важнейших задач анестезии во время операции и терапевтических мер при лечении таких тяжелых состояний, как шок (см.). По мнению А. Лабори, уровень основного обмена зависит от нейрогормональных медиаторов (адреналин, ацетилхолин и др.). Адреналин повышает основной обмен, а ацетилхолин его снижает. Следовательно, всякий препарат, который тормозит освобождение адреналина и способствует действию ацетилхолина, уменьшает обмен и наоборот. Этому же может способствовать гипотермия (см. Гипотермия искусственная).
Методика проведения искусственной гибернации включает применение фармакол. средств в виде смесей, так наз. литических коктейлей, которые вводят больному по определенным правилам: 1) поскольку не существует одного идеального средства, способного вызвать необходимую нейроэндокринную блокаду, целесообразно использовать несколько препаратов с известным фармакол, действием; 2) препараты следует вводить в малых дозах, что оправдано их взаимно потенцирующим эффектом; 3) необходимо дробное, постепенное введение препаратов (это особенно важно при шоке), чтобы избежать резких сдвигов неустойчивого равновесия физиол, функций больного; 4) применение лекарственных средств должно быть непрерывным, т. к. синдром реакции длится дольше воздействия, его вызвавшего; 5) состав коктейля меняют при длительной гибернации ежедневно, чтобы избежать привыкания.
Основной литический коктейль, известный как смесь М1, включает: аминазин — 50 мг (2 мл 2,5% р-ра), дипразин — 50 мг (2 мл 2,5% р-ра), долозал — 100 мг (2 мл 5% р-ра) — всего 6 мл.
В СССР вместо долозала используют близкий ему по свойствам промедол в дозе 40 мг (2 мл 2% р-ра). Эту смесь вводят внутривенно небольшими (0,5—1 мл) дробными дозами.
В последующем переходят к введению коктейля № 1, содержащего в суточной дозе: аминазин — 50— 150 мг (2—6 мл 2,5% р-ра), дипразин — 50—150 мг (2—6 мл 2,5% р-ра), долозал — 100—200 мг (2—4 мл 5% р-ра) или промедол — 40—80 мг (2—4 мл 2% р-ра), перфузионную жидкость — 1000 мл.
Состав перфузионной жидкости по мере совершенствования метода менялся (физиол, р-р, гидролизат белка с глюкозой или фруктозой, р-р рутина). А. Лабори (1970) рекомендует смесь: глюкоза — 5 г, фруктоза — 5 г, хлористый калий — 0,12 г, хлористый кальций — 0,04 г, хлористый магний — 0,08 г, дист, вода — 100 мл. К смеси добавляют инсулин из расчета 1 ед. на 4 г глюкозы. При отсутствии фруктозы в этой смеси вполне можно использовать 10 г глюкозы. Суточная доза смеси составляет примерно 2500 мл.
Если Г. и. применяют как компонент анестезии, после введения больному смеси М1 производят интубацию трахеи и проводят искусственную вентиляцию легких смесью закиси азота с кислородом (1:1) на фоне релаксации, вызываемой тубокурарином. По окончании операции (в первые сутки) переходят на коктейль № 1. При реанимации гибернацию сочетают с искусственной вентиляцией легких и введением оксибутирата натрия, а в некоторых специальных случаях — гемитиамина или виадрила.
Гибернация искусственная сопровождается характерными сдвигами в состоянии больного. Больной спит, но может быть разбужен. Глаза закрыты. Зрачки сужены, реагируют на свет. Роговичный рефлекс сохранен. Кожные покровы сухие, теплые, бледно-розового цвета. Губы и ногтевые ложа бледно-розовые, цианоза нет. После первоначальной тахикардии пульс обычно в пределах 90—100 ударов в 1 мин., ритмичный, хорошего наполнения. Систолическое давление понижено на 15—25 мм рт. ст., диастолическое — на 10—20 мм. Дыхание в пределах 12—20 в 1 мин., ритмичное, глубокое. Если не применена гипотермия, температура незначительно снижена (35,5—36°).
Неудачи при применении Г. и. связаны с нарушением методики ее проведения. Недостатки Г. и.: 1) при применении больших доз препаратов возможно глубокое и трудно обратимое угнетение компенсаторных реакций, связанное с выраженной нейро-эндокринной блокадой, что препятствует проведению корригирующей терапии; 2) слишком широкий диапазон и длительность действия производных фенотиазина затрудняют управление Г. и.; 3) громоздкость и сложность метода. Помимо этого, при Г. и. может возникнуть и ряд других осложнений. К ним относятся ортостатический коллапс, угнетение дыхания. Основная мера их профилактики —строгое соблюдение методики Г. и.
Все эти обстоятельства привели к тому, что показания к применению Г. и. резко сузились. К их числу можно отнести использование метода при лечении психических заболеваний (см. ниже), в терапии инфаркта миокарда и шока и некоторых тяжелых состояний у детей.
В качестве метода анестезии Г. и. полностью утратила свое значение. Однако многие положения, вызвавшие ее к жизни, побудили продолжить поиски более безопасных и избирательно действующих средств, которые завершились внедрением в клин, практику нейролептаналгезии (см.), обладающей определенными преимуществами, присущими Г. и., и лишенной многих ее недостатков.
Искусственная гибернация при психических расстройствах. Г. и. применяют для лечения психически больных, гл. обр. с состояниями возбуждения и возможной гипертермией (белая горячка, острые травматические психозы, маниакальное возбуждение и т. д.). Существует несколько методик, включающих в различных сочетаниях барбитураты (фенобарбитал, этаминал-натрий) и нейролептические средства, применение которых иногда сочетают с охлаждением. Наиболее известны методы Дешана (A. Dechamps), Эя (Н. Ey) и Берара (E. Berard). Гибернация искусственная в психиатрии рассматривается как одна из разновидностей терапии сном (см. Сон, лечение сном).
Библиография: Блажа К. и Кривда С. Теория и практика оживления в хирургии, пер. с румын., Бухарест, 1967; Дарбинян Т. М. Современный наркоз и гипотермия в хирургии врожденных пороков сердца, М., 1964; Зайцев Г. П. и Гологорский В. А. Потенцированный наркоз в хирургической клинике, М., 1963; Лабори А. Регуляция обменных процессов, пер. с франц., М., 1970; Маневич А. 3. Педиатрическая анестезиология с элементами реанимации и интенсивной терапии, с. 251, М., 1970; Eу H., Bernard P. et Brisset С. Mamiel de psychiatrie, P., 1970; Neveu P. e. a. Catatonie maligne, traitement par hibernation, Ann. m M. Psychol., t. 1, p. 267, 1973, bibliogr.
В. А. Гологорский; М. В. Коркина (психиат.).
Гибернация миокарда: молекулярные механизмы, клиническая значимость и методы диагностики
Полный текст:
Аннотация
Гибернация миокарда – стойкое угнетение сократимости жизнеспособного миокарда левого желудочка, возникающее вследствие его гипоперфузии. Важнейшим проявлением гибернации является сохранение жизнеспособности миокарда на тканевом уровне. В основе этого явления лежат три основных механизма: 1) метаболическая адаптация миокарда, проявляющаяся усиленным захватом глюкозы; 2) активация генетической программы выживания кардиомиоцитов; 3) программируемая клеточная гибель, т. е. аутофагия и апоптоз кардиомиоцитов. Методы диагностики жизнеспособного миокарда включают стресс-эхокардиографию с добутамином, однофотонную эмиссионную компьютерную томографию миокарда, позитронно-эмиссионную томографию, магнитно-резонансную томографию и электромеханическое картирование. В клиническом аспекте наличие и объем жизнеспособного миокарда учитываются при решении вопроса о реваскуляризации у пациентов с одно- и двухсосудистым поражением коронарных артерий без вовлечения передней нисходящей артерии, а также у больных со значительным снижением глобальной сократительной функции миокарда, когда оперативное вмешательство может привести к увеличению фракции выброса левого желудочка.
Ключевые слова
Об авторах
Список литературы
1. Diamond GA, Forrester JS, deLuz PL et al. Post-extrasystolic potentiation of ischemic myocardium by atrial stimulation. Am Heart J. 1978;95(2):204–209.
2. Rahimtoola SH. A perspective on the three large multicenter randomized clinical trials of coronary bypass surgery for chronic stable angina. Circulation. 1985;72(6 Pt 2):V123– V135.
3. Heusch G. Hibernating myocardium. Physiol Rev. 1998;78(4):1055–1085.
4. Шляхто Е. В., Петрищев Н. Н., Галагудза М. М. и др. Кардиопротекция: фундаментальные и клинические аспекты. – CПб.: НП-Принт, 2013. – 399 с.
5. Heusch G. Myocardial ischemia: lack of coronary blood flow, myocardial oxygen supply-demand imbalance, or what? Am J Physiol Heart Circ Physiol. 2019;316(6):H1439–H1446. Doi: 10.1152/ajpheart.00139.2019.
6. Maes A, Flameng W, Nuyts J et al. Histological alterations in chronically hypoperfused myocardium. Correlation with PET findings. Circulation. 1994;90(2):735–745.
7. Schwarz ER, Schaper J, Dahl vom J et al. Myocyte degeneration and cell death in hibernating human myocardium. J Am Coll Cardiol. 1996;27(7):1577–1585.
8. Elsässer A, Schlepper M, Klövekorn WP et al. Hibernating myocardium: an incomplete adaptation to ischemia. Circulation. 1997;96(9):2920–2931.
9. Thomas SA, Fallavollita JA, Suzuki G et al. Dissociation of regional adaptations to ischemia and global myolysis in an accelerated Swine model of chronic hibernating myocardium. Circ Res. 2002;91(10):970–977.
10. Berry GJ, Masek M. The pathology of hibernating myocardium. Nucl Med Commun. 2002;23(4):303–309.
11. Ausma J, Eys van GJ, Broers JL et al. Nuclear lamin expression in chronic hibernating myocardium in man. J Mol Cell Cardiol. 1996;28(6):1297–1305.
12. Ausma J, Furst D, Thone F et al. Molecular changes of titin in left ventricular dysfunction as a result of chronic hibernation. J Mol Cell Cardiol. 1995;27(5):1203–1212.
13. Shvedova M, Anfinogenova Y, Popov SV, Atochin DN. Connexins and Nitric Oxide Inside and Outside Mitochondria: Significance for Cardiac Protection and Adaptation. Front Physiol. 2018;9:479. Doi: 10.3389/fphys.2018.00479.
14. Ausma J, Cleutjens J, Thone F et al. Chronic hibernating myocardium: interstitial changes. Mol Cell Biochem. 1995;147(1–2):35–42.
15. Frangogiannis NG, Shimoni S, Chang SM et al. Active interstitial remodeling: an important process in the hibernating human myocardium. J Am Coll Cardiol. 2002;39(9):1468–1474.
16. Frangogiannis NG, Shimoni S, Chang SM et al. Evidence for an active inflammatory process in the hibernating human myocardium. Am J Pathol. 2002;160(4):1425–1433.
17. Maki M, Luotolahti M, Nuutila P et al. Glucose uptake in the chronically dysfunctional but viable myocardium. Circulation. 1996;93(9):1658–1666.
18. Depre C, Vatner SF. Mechanisms of cell survival in myocardial hibernation. Trends Cardiovasc Med. 2005;15(3):101–110.
19. Depre C, Taegtmeyer H. Metabolic aspects of programmed cell survival and cell death in the heart. Cardiovasc Res. 2000;45(3):538–548.
20. Yuan Y, Huang B, Miao H et al. A «Hibernating-Like» Viable State Induced by Lentiviral Vector-Mediated Pigment Epithelium-Derived Factor Overexpression in Rat Acute Ischemic Myocardium. Hum Gene Ther. 2019;30(6):762–776. Doi: 10.1089/hum.2018.186.
21. May D, Gilon D, Djonov V et al. Transgenic system for conditional induction and rescue of chronic myocardial hibernation provides insights into genomic programs of hibernation. Proc Natl Acad Sci U S A. 2008;105(1):282–287.
22. Mayr M, May D, Gordon O et al. Metabolic homeostasis is maintained in myocardial hibernation by adaptive changes in the transcriptome and proteome. J Mol Cell Cardiol. 2011;50(6):982–990. Doi: 10.1016/j.yjmcc.2011.02.010.
23. Yan L, Sadoshima J, Vatner DE, Vatner SF. Autophagy in ischemic preconditioning and hibernating myocardium. Autophagy. 2009;5(5):709–712.
24. Elsasser A, Vogt AM, Nef H et al. Human hibernating myocardium is jeopardized by apoptotic and autophagic cell death. J Am Coll Cardiol. 2004;43(12):2191–2199.
25. Angelini A, Maiolino G, La Canna G et al. Relevance of apoptosis in influencing recovery of hibernating myocardium. Eur J Heart Fail. 2007;9(4):377–383.
26. Canty JM Jr, Suzuki G, Banas MD et al. Hibernating myocardium: chronically adapted to ischemia but vulnerable to sudden death. Circ Res. 2004;94(8):1142–1149.
27. Luisi AJ Jr, Fallavollita JA, Suzuki G, Canty JM Jr. Spatial inhomogeneity of sympathetic nerve function in hibernating myocardium. Circulation. 2002;106(7):779–781.
28. Ovchinnikov V, Suzuki G, Canty JM Jr, Fallavollita JA. Blunted functional responses to pre- and postjunctional sympathetic stimulation in hibernating myocardium. Am J Physiol Heart Circ Physiol. 2005;289(4):H1719–H1728.
29. Fallavollita JA, Banas MD, Suzuki G et al. 11C-metahydroxyephedrine defects persist despite functional improvement in hibernating myocardium. J Nucl Cardiol. 2010; 17(1):85–96. Doi: 10.1007/s12350-009-9164-z.
30. Camici PG, Rimoldi O. Myocardial hibernation vs repetitive stunning in patients. Cardiol Rev. 1999;7(1):39–43.
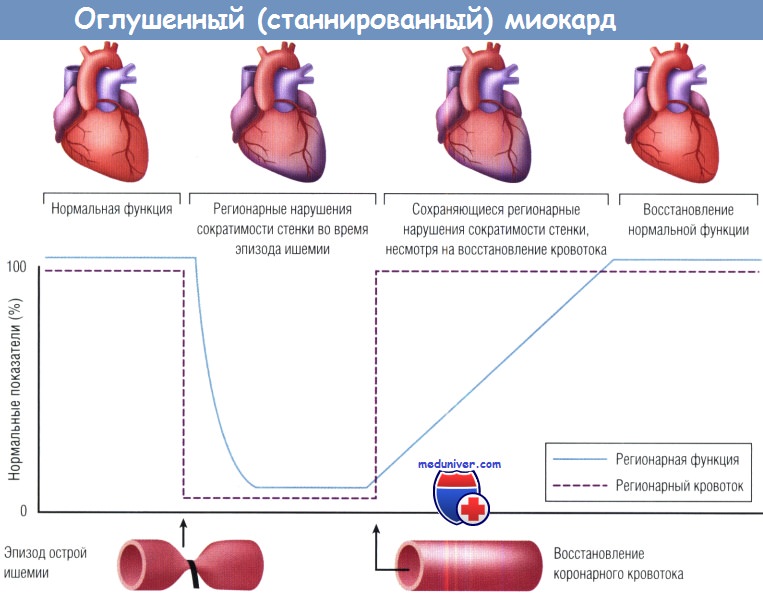
31. Галагудза М. М. Оглушенный (станнированный) миокард: механизмы и клиническая значимость // Бюл. ФЦСКЭ им. В. А. Алмазова. – 2011. – № 2. – С. 5–11.
32. Redwood SR, Ferrari R, Marber MS. Myocardial hibernation and stunning: from physiological principles to clinical practice. Heart. 1998;80(3):218–222.
33. Rahimtoola SH. The hibernating myocardium. Am Heart J. 1989;117(1):211–221.
34. Montalescot G, Faraggi M, Drobinski G et al. Myocardial viability in patients with Q wave myocardial infarction and no residual ischemia. Circulation. 1992;86(1):47–55.
35. Dutka DP, Camici PG. Hibernation and congestive heart failure. Heart Fail Rev. 2003;8(2):167–173.
36. Shivalkar B, Borgers M, Daenen W et al. ALCAPA syndrome: an example of chronic myocardial hypoperfusion? J Am Coll Cardiol. 1994;23(3):772–778.
37. Westaby S. Coronary revascularization in ischemic cardiomyopathy. Surg Clin North Am. 2004;84(1):179–199.
38. Alderman EL, Fisher LD, Litwin P et al. Results of coronary artery surgery in patients with poor left ventricular function (CASS). Circulation. 1983;68(4):785–795.
39. Auerbach MA, Schoder H, Hoh C et al. Prevalence of myocardial viability as detected by positron emission tomography in patients with ischemic cardiomyopathy. Circulation. 1999;99(22):2921–2926.
40. Schinkel AF, Bax JJ, Sozzi FB et al. Prevalence of myocardial viability assessed by single photon emission computed tomography in patients with chronic ischaemic left ventricular dysfunction. Heart. 2002;88(2):125–130.
41. Cleland JG, Pennell DJ, Ray SG et al. Myocardial viability as a determinant of the ejection fraction response to carvedilol in patients with heart failure (CHRISTMAS trial): randomised controlled trial. Lancet. 2003;362(9377):14–21.
42. Löffler AI, Kramer CM. Myocardial Viability Testing to Guide Coronary Revascularization. Interv Cardiol Clin. 2018;7(3):355–365. Doi: 10.1016/j.iccl.2018.03.005.
43. Ker WDS, Nunes THP, Nacif MS, Mesquita CT. Practical Implications of Myocardial Viability Studies. Arq Bras Cardiol. 2018;110(3):278–288. Doi: 10.5935/abc.20180051.
44. Cullen MW, Pellikka PA. Recent advances in stress echocardiography. Curr Opin Cardiol. 2011;26(5):379–384. Doi: 10.1097/HCO.0b013e328349035b.
45. Нифонтов Е. М., Казарин В. В., Рыжкова Д. В. и др. Прогностическое значение жизнеспособности дисфункционирующего миокарда, выявляемой при проведении стрессэхокардиографических тестов // Артер. гипертензия. – 2001. – Т. 7, № 1. – С. 28–31.
46. Schinkel AF, Valkema R, Geleijnse ML et al. Single-photon emission computed tomography for assessment of myocardial viability. EuroIntervention. 2010;6(Suppl G):G115–G122.
47. Petrasinovic Z, Ostojic M, Beleslin B et al. Prognostic value of myocardial viability determined by a 201Tl SPECT study in patients with previous myocardial infarction and mild-to-moderate myocardial dysfunction. Nucl Med Com-mun. 2003;24(2):175–181.
48. Рыжкова Д. В., Нифонтов Е. М., Тютин Л. А. Позитронная эмиссионная томография как метод неинвазивной оценки миокардиального кровотока и коронарного резерва у пациентов с сердечно-сосудистой патологией // Артер. гипертензия. – 2006. – Т. 12, № 3. – C. 200–211.
49. Bengel FM, Higuchi T, Javadi MS, Lautamäki R. Cardiac positron emission tomography. J Am Coll Cardiol. 2009;54(1):1–15. Doi: 10.1016/j.jacc.2009.02.065.
50. Schwaiger M, Schelbert HR, Ellison D et al. Sustained regional abnormalities in cardiac metabolism after transient ischemia in the chronic dog model. J Am Coll Cardiol. 1985; 6(2):336–347.
51. Mpanya D, Tsabedze N, Libhaber C et al. Fluorine-18 fluorodeoxyglucose positron emission tomography in assessing myocardial viability in a tertiary academic centre in Johannesburg, South Africa: a pilot study. Cardiovasc J Afr. 2019;30:1–5. Doi: 10.5830/CVJA-2019-029.
52. Camici PG, Rimoldi OE. Myocardial blood flow in patients with hibernating myocardium. Cardiovasc Res. 2003; 57(2):302–311.
53. Blankstein R, Di Carli MF. Integration of coronary anatomy and myocardial perfusion imaging. Nat Rev Cardiol. 2010;7(4):226–236. Doi: 10.1038/nrcardio.2010.15.
54. Gaemperli O, Bengel FM, Kaufmann PA. Cardiac hybrid imaging. Eur Heart J. 2011;32(17):2100–2108. Doi: 10.1093/eurheartj/ehr057.
55. Ryan MJ, Perera D. Identifying and Managing Hibernating Myocardium: What’s New and What Remains Unknown? Curr Heart Fail Rep. 2018;15(4):214–223. Doi: 10.1007/s11897-018-0396-6.
56. Siebelink HM, Lamb HJ. Magnetic resonance imaging for myocardial viability. EuroIntervention. 2010;6(Suppl G): G107–G114.
57. Elhendy A, Porter TR. Assessment of myocardial perfusion with real-time myocardial contrast echocardiography: methodology and clinical applications. J Nucl Cardiol. 2005; 12(5):582–590.
58. Hayat SA, Senior R. Contrast echocardiography for the assessment of myocardial viability. Curr Opin Cardiol. 2006;21(5):473–478.
59. Fernandes DR, Tsutsui JM, Bocchi EA et al. Qualitative and quantitative real time myocardial contrast echocardiography for detecting hibernating myocardium. Echocardiography. 2011;28(3):342–349. Doi: 10.1111/j.1540-8175.2010.01317.x.
60. Chelliah RK, Hickman M, Kinsey C et al. Myocardial contrast echocardiography versus single photon emission computed tomography for assessment of hibernating myocardium in ischemic cardiomyopathy: preliminary qualitative and quantitative results. J Am Soc Echocardiogr. 2010;23(8):840–847. Doi: 10.1016/j.echo.2010.06.004.
61. Gyöngyösi M, Dib N. Diagnostic and prognostic value of 3D NOGA mapping in ischemic heart disease. Nat Rev Cardiol. 2011;8(7):393–404. Doi: 10.1038/nrcardio. 2011.64.
62. Zelt JGE, Liu PP, Erthal F et al. N-Terminal Pro B-Type Natriuretic Peptide and High-Sensitivity Cardiac Troponin T Levels Are Related to the Extent of Hibernating Myocardium in Patients with Ischemic Heart Failure. Can J Cardiol. 2017;33(11):1478–1488. Doi: 10.1016/j. cjca.2017.06.012.
Для цитирования:
Галагудза М.М., Сонин Д.Л., Александров И.В. Гибернация миокарда: молекулярные механизмы, клиническая значимость и методы диагностики. Регионарное кровообращение и микроциркуляция. 2019;18(3):9-15. https://doi.org/10.24884/1682-6655-2019-18-3-9-15
For citation:
Galagudza M.M., Sonin D.L., Aleksandrov I.V. Myocardial hibernation: molecular mechanisms, clinical significance and diagnostic methods. Regional blood circulation and microcirculation. 2019;18(3):9-15. (In Russ.) https://doi.org/10.24884/1682-6655-2019-18-3-9-15