Гигантоклеточная опухоль мягких тканей что это такое
Гигантоклеточная опухоль мягких тканей что это такое
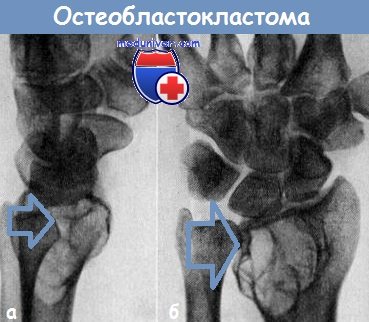
Гигантоклеточная опухоль (остеобластокластома) развивается в возрасте 20-40 лет и обычно поражает эпифизы длинных костей. При этом происходит распад клеток, приводящий к эрозии тела кости и дальнейшему распространению опухоли на мягкие ткани.
Обычно больные обращаются с жалобами на боли и припухлость в области коленного сустава. Одинаково часто опухоль развивается в нижней части бедренной кости или в верхней части большеберцовой.
На рентгенограмме видно литическое разрушение кости. Похожие повреждения образуются при аневризматической кисте кости и при фиброзно-кистозной дистрофии (первичном гиперпаратиреоидизме).
Морфологически опухоль состоит из гигантских и веретеноподобных клеток. В отдельных случаях клетки опухоли характеризуются ярковыраженной малигнизацией, и в этом случае опухоль проявляет повышенную способность к локальной инвазии и к образованию метастазов.
В зависимости от морфологии стромальных клеток, различают несколько типов опухоли (I-III). Возможно, хотя не доказано, что облучение гигантоклеточной опухоли вызывает ее злокачественную трансформацию. Это довольно странно, поскольку обыкновенно облучают наиболее агрессивные опухоли (тип III), так что утверждение остается спорным.
Лечение, как правило, состоит в тщательном выскабливании всей пораженной полости, которая затем может быть заполнена костными фрагментами. При более обширных повреждениях проводят резекцию пораженного участка с последующим эндопротезированием.
В некоторых случаях, например при опухоли позвонков, нельзя использовать хирургический метод. Тогда применяют лучевую терапию. Обычно назначают дозу 40-50 Гр, и фракционированное облучение продолжается в течение 4-5 недель. Эффективных химиотерапевтических средств не существует, хотя использовались препараты для лечения остеосаркомы.
Одиночные легочные метастазы можно удалять хирургическим путем, и иногда это не сопровождается рецидивами.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гигантоклеточная опухоль мягких тканей что это такое
Гигантоклеточная опухоль (ГКО) кости – относительно распространенное, локально агрессивное доброкачественное новообразование, которое связано с широким биологическим спектром – от латентного доброкачественного до высокорецидивирующего и иногда метастатического злокачественного новообразования [1].
ГКО состоит из мононуклеарных клеток и многоядерных гигантских клеток, подобных остеокластам, и представляет собой локально агрессивное поражение с непредсказуемым поведением [2]. ГКО возникает в метаэпифизарной области длинных костей, преимущественно в дистальном отделе бедренной кости и проксимальном отделе большеберцовой кости, но она может встречаться во всем скелете[3]. Гигантоклеточная опухоль кости обычно доброкачественная, но может быть агрессивной на местном уровне. Разрушение костей может быть особенно проблематичным в области суставов, нарушая функцию и подвижность суставов.Местный доброкачественный рецидив ГКО встречается примерно у 25% пациентов, из которых зарегистрированы самые высокие показатели (до 50%) после выскабливания без дополнительной обработки полости.
Также всегда надо помнить, что при лечении рецидивов можно столкнуться с проблемой вторичного перерождения ГКО. Злокачественная гигантоклеточная опухоль кости (ЗГКО) – редкая саркома, заболеваемость которой среди пациентов с доброкачественной ГКО возникает в 2–11% случаев [4].Впервые ЗГКО была описана Стюартом, а различие между первичной злокачественной ГКО и вторичной злокачественной ГКО было проведено ранними исследователями, такими как Hutterи Dahlin.Первичная злокачественная ГКО диагностируется, когда саркома определяется одновременно с первоначальным диагнозом ГКО, в то время как вторичная злокачественная ГКО – когда злокачественное новообразование диагностируется на месте ГКО, ранее подвергнутом хирургическому или лучевому лечению [5].
ГКО подвергается саркомной трансформации в злокачественную опухоль, вариантами которой могут быть остеосаркома, фибросаркома или недифференцированная плеоморфная саркома (исторически известная как злокачественная фиброзная гистиоцитома) [6].
Выбор оптимального способа лечения первичных ГКО остается спорным. Вариантами хирургического лечения являются кюретаж (резекция внутри очага поражения) или резекция единым блоком.В идеале всем пациентам следует проводить кюретаж, чтобы сохранить сустав и оптимальную функцию [7]. После выскабливания костная полость обычно заполняется костными аллотрансплантатами или полиметилметакрилатом (ПММА) для обеспечения механической поддержки и предотвращения коллапса суставной поверхности.Кюретаж остается стандартом лечения ГКО, но при этом отмечается высокий риск местного рецидива – в 35–40% случаев.Чтобы снизить риск местного рецидива, применялись различные местные адъюванты, такие как жидкий азот, фенол, ПММА, золедроновая кислота, перекись водорода (H2O2) и лучи аргона, а также системные методы лечения, такие как бисфосфонаты, интерферон альфа (IFN-a), в последнее время отмечаются позитивные результаты использования деносумаба [8, 9]. Были предложены различные классификации на основе гистологии, клинических и рентгенологических проявлений, но они не дают прогностической информации относительно риска местного рецидива [9].
Агрессивные первичные ГКО и рецидивирующие формы требуют выполнения широкого иссечения кости и реконструкции с помощью модульного эндопротеза.
Описание клинического случая
Мужчина 37 лет поступил с жалобами на боли в области левого коленного сустава, ограничение движений в левом коленном суставе, нарушение опороспособности левой нижней конечности.
В анамнезе заболевания – лечение гигантоклеточной опухоли дистального эпиметафиза левой бедренной кости в феврале 2019 г. Выполнена операция в объеме кюретажа опухоли с пластикой полиметилметакрилатным цементом. Дальнейшее лечение не проводилось. Пациент реабилитирован. Выписан с полным восстановлением функции нижней конечности.
В августе 2020 г. после незначительной физической нагрузки почувствовал резкую боль в левом коленном суставе, ограничение движений в левом коленном суставе, нарушение опороспособности левой нижней конечности. Обратился в травматологический пункт за первичной помощью. По результатам обследования выставлен диагноз: «Патологический перелом дистального эпиметафиза левой бедренной кости». Наложена гипсовая лонгета. Направлен на консультацию в онкологический диспансер.
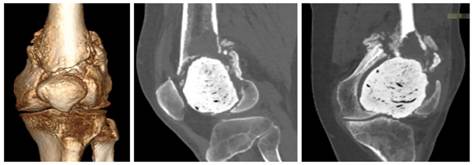
На базе онкологического диспансера проведено дообследование в объеме компьютерной томографии (КТ) левого коленного сустава. По результатам КТ состояние после кюретажа образования дистального эпиметафиза с остеопластикой полиметилметакрилатом, продолженный рост ГКО в дистальном эпиметадиафизе левой бедренной кости, патологический перелом в области дистального метадиафиза (рис. 1).
Рис. 1. КТ-граммы пациента до операции
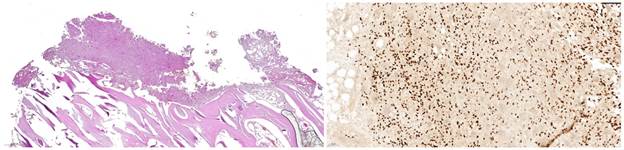
С учетом сроков рецидива и наличия патологического перелома было принято решение пересмотреть первичные препараты с целью исключения первичной злокачественной ГКО (рис. 2).
Рис. 2. Предоперационная гистология, окраска гематоксилин-эозином, ИГХ
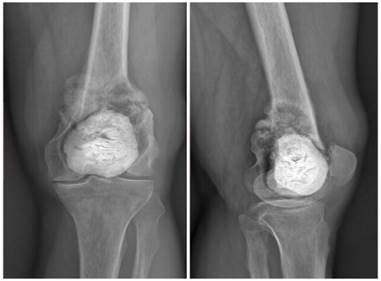
На основе жалоб, данных КТ, пересмотра гистологических препаратов пациенту выставлены показания к оперативному лечению – тотальное онкологическое эндопротезирование левого коленного сустава системой MUTARS® – Implantcast. С учетом планируемого объема оперативного вмешательства от предоперационной контрольной биопсии было принято решение отказаться. С целью предоперационной разметки и подбора протеза выполнены рентгенограммы в стандартных проекциях (рис. 3).
Рис. 3. Рентгенограммы левого коленного сустава, предоперационные
Пациента поместили на операционный стол в положении лежа на спине и поместили силиконовую подушку под ипсилатеральную ягодицу.Хирургический доступ был выполнен традиционным переднемедиальным разрезом в проекции коленного сустава.Выделение и удаление опухоли проводились в строгом соответствии с принципами безопухолевой хирургии.Длина остеотомии определялась на основании предоперационных рентгеновских снимков и тяжести инвазии опухоли.Отступ на 4 см от границы опухоли считается стандартной протезной длиной. Учитывая возраст пациента, были выбраны бесцементные ножки для бедренного и тибиального компонента с дополнительной цементной фиксацией тибиального плато. Во время операции уделялось внимание реконструкции мягких тканей для благоприятного течения реабилитации пациента.
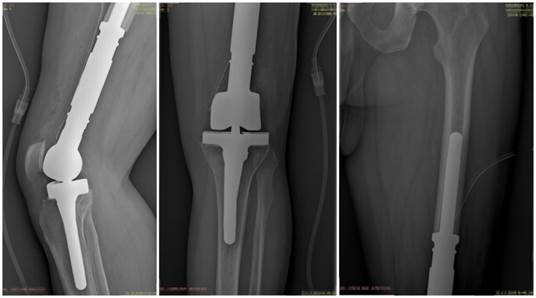
После операции применялись антибиотики широкого спектра в течение 7 дней. Активизация без опоры на оперированную конечность – через сутки после операции. Дренажную трубку удалили через 4 дня после операции. После удаления дренажной трубки разрешена функциональная изометрическая тренировка мышц нижних конечностей. Контрольные рентгенограммы после операции для оценки стояния протеза представлены на рисунке 4.
Рис. 4. Рентгенограммы оперированного коленного сустава
Удаленный сегмент кости с опухолью направлен на патогистологическое исследование. Гистологически был подтвержден рецидив гигантоклеточной опухоли (рис. 5).
Рис. 5. Послеоперационная гистология, окраска гематоксилин-эозином, ИГХ. Подтверждение ГКО
Пациент реабилитируется в ортезе с ограничением угла сгибания 20 градусов. Выписка на амбулаторное лечение на 10-е сутки.
Контрольная явка на 14-е сутки – послеоперационная рана зажила первичным натяжением. Разрешены функциональные упражнения на двойных костылях. Продолжены изометрические нагрузки на нижние конечности. Пациенту разрешена опора на оперированную конечность 25%. Ортез переведен в ограничение угла сгибания 30 градусов.
Контрольная явка через 1 месяц. Разрешена нагрузка на оперированную конечность 50–70%. Ортез переведен в ограничение угла сгибания 90 градусов. Продолжены изометрические нагрузки на нижние конечности. Разрешена тренировка на велотренажере. В области протеза левой бедренной кости появилась отечность. Выполнено УЗИ левой нижней конечности, обнаружена жидкость в перипротезной сумке. Проведена пункция перипротезной сумки в дистальной ее части. Эвакуировано до 150 мл серозной жидкости.
Контрольная явка через 1,5 месяца. Продолжены тренировки на велотренажере. Объем движений в протезе левого коленного сустава доведен до полного. Выполнено УЗИ левой нижней конечности, обнаружена жидкость в перипротезной сумке до 100 мл. Проведена пункция перипротезной сумки в дистальной ее части. Эвакуировано до 150 мл серозной жидкости. Назначены НПВС в терапевтической дозе на 14 дней под прикрытием гастропротекторов.
На второй месяц после операции разрешена ходьба с тростью. Расширен спектр упражнений для восстановления функции нижней конечности. Снят ортез. Отечности в проекции левого бедра не наблюдается. Движения в протезе левого коленного сустава в полном объеме.
Дальнейшие контрольные явки планируются каждые 3 месяца в течение первого года после операции, каждые 6 месяцев со второго по пятый год и каждый год после пятого года. При возникновении болей или нарушения функции требуется незамедлительная явка для оценки состояния.На контрольных явках планируется оценка состояния послеоперационного рубца. На контрольных рентгенограммах планируется оценка наличия рецидива опухоли, расположения протеза, состояния кости, а также изменения длины конечностей.
Обсуждение. Хирургическое лечение гигантоклеточной опухоли кости
Гигантоклеточная опухоль часто возникает вокруг суставов, несущих нагрузку, почти в половине случаев местом локализации являются дистальный отдел бедренной кости и проксимальный отдел голени. Выбор хирургической тактики напрямую влияет на восстановление функции конечности.
При хирургическом лечении оперативные процедуры подразделяются на выскабливание внутри очага поражения и резекцию единым блоком.Кюретаж костных поражений ГКО является основным методом лечения, основным его недостатком служит высокая частота рецидивов. Частота местных рецидивов после простого выскабливания внутри очага поражения в сочетании с костной пластикой составляет от 35% до 40% [4].
Использование химических и физических методов разрушения остаточной костной опухоли в стенке полости позволяет снизить частоту местных рецидивов.Однако при патологическом переломе, рецидиве опухоли, обширном разрушении кортикального слоя кости или недостаточной прочности кости для выдерживания физической нагрузки после удаления опухоли необходимо выполнить резекцию опухоли единым блоком и реконструктивную операцию по замещению костного дефекта. Используемые в настоящее время основные методы реконструкции включают аутогенный трансплантат и протезирование удаленной части кости [4, 9].
В последнее время все шире применяется протезирование после резекции опухоли единым блоком, поскольку обеспечивает восстановление опорности кости и функции сустава, давая возможность пациентам быстрее восстановить функциональность нижней конечности, а также позволяет достичь длительного безрецидивного периода.
Однако основными недостатками этого метода являются высокая частота расшатывания протеза и ограниченная функция сустава, возникающая из-за больших дефектов кости, вызванных резекцией опухоли, короткая длина фиксации в костномозговом канале кости, отсутствие прикрепления или смещение точек крепления важных мышц.
Следствием более частого использования резекции единым блоком с применением протезирования, а также увеличение безрецидивного периода, все больше приходится сталкиваться с поздними осложнениями протезирования.
Оценить эффективность протезирования при длительном сроке наблюдения позволяет работа Maruthainar, которыйпролечил 25 пациентов с ГКО в дистальном отделе бедренной кости методом протезирования, результаты последующего наблюдения в среднем в течение 12 лет (5–18 лет) показали отсутствие рецидива опухоли, необходимость проведения ревизии из-за инфекции.Однако в 6 случаях потребовалась повторная операция из-за асептического расшатывания. Хотя пациенты в проводимом исследовании были молодого возраста, хорошая и долгосрочная функция конечностей все же была достигнута.В этом исследовании 19 пациентов находились под наблюдением в среднем в течение 128,9 месяца, у 18 пациентов наблюдалась функция активного сгибания колена в пределах 30–110 градусов. Эти результаты демонстрируют, что с помощью протезирования бедренной кости и коленного сустава при ГКО может быть достигнута удовлетворительная функция конечностей [9].
Заключение
Лечение рецидивирующей ГКО является сложной задачей в ортопедической онкологии. В идеале лечение должно обеспечивать местный контроль и сохранение функции. В настоящее время при улучшении методов реконструктивной хирургии и появлении высококачественных мегапротезов с биомеханической конструкцией широкая резекция опухоли с заменой дистального отдела бедренной кости рассматривается как вариант лечения обширных поражений с патологическим переломом. Широкая резекция с протезированием предполагает хороший местный контроль с наименьшей частотой рецидивов по данным литературы и благоприятный функциональный результат.
Доброкачественные новообразования мягких тканей
Распространенными доброкачественными опухолями являются липомы, фибромы, ангиолипомы, доброкачественные фиброзные гистиоцитомы, нейрофибромы, шванномы, гемангиомы, опухоли клеток сухожилий, миксомы.
Доброкачественные поражения мягких тканей редко метастазируют, но часто бывают большими и глубокими. Однако, некоторые образования ведут себя весьма агрессивно. Диагностированное вторжение в близлежащие ткани увеличивает шанс неполного удаления и возможность того, что опухоль вернется.
У взрослых наиболее распространенной доброкачественной опухолью мягких тканей является липома. У детей ‒ киста Бейкера. Чаще всего как у взрослых, так и у детей наблюдаются липома и гемангиома.
Симптомы
Доброкачественные опухоли кожи, опухолевидные пролиферации тканей кожи развиваются в большинства случаев безболезненно в виде одиночных или множественных узлов либо разрастаний. Чаще они локализуются в верхних конечностях, на туловище, лице. В большинстве случаев новообразования покрыты кожей с нормальной окраской, реже — розового цвета. Встречаются образования с различной окраской от желтовато – коричневого цвета до черно-синего.
Наиболее частым симптомом является неожиданно прощупываемая опухоль, на втором месте стоят различного рода болевые ощущения, предшествующие появлению опухоли, и на третьем — появление болезненной опухоли.
Характер болевых ощущений, как правило, умеренный и непостоянный, они не имеют такой интевсивности, как при первичных опухолях костей, и чаще всего проявляются при функциональных нагрузках или ощупывании опухоли. При прорастании опухоли в кость боли становятся постоянными, а при локализации в области крупных нервных стволов может развиться картина неврита или плексита.
Виды доброкачественных новообразований
Фиброма
Исходит из волокнистой соединительной ткани и может встречаться везде, где последняя имеется. Различают твердые фибромы, представленные узлом плотной консистенции, и мягкие фибромы, характеризующиеся дряблой консистенцией. Излюбленной локализацией мягких фибром, как правило растущих на ножке, является подкожная клетчатка половых органов и анальной области. Фибромы растут чрезвычайно медленно, четко отграничены от окружающих тканей, подвижны.
Липома
Образуется из жировой ткани. Наиболее часто располагается в подкожной клетчатке, но может находиться в любой части тела, где есть жировая ткань (например, в забрюшинном пространстве). У женщин липомы отмечаются в 3-4 раза чаще, чем у мужчин, возраст при этом значения не имеет. Иногда встречаются множественные липомы (липоматоз). Опухоль часто характеризуется дольчатым строением, мягкой консистенцией. Она не спаяна с кожей и подвижна по отношению к окружающим тканям. Рост липомы медленный. Размеры ее различные, иногда довольно значительные. При наличии в липоме большого количества соединительной ткани опухоль относят к фибролипоме. Однако этот диагноз ставится преимущественно после гистологического исследования.
Миома
Развивается из мышечной ткани и может локализоваться в любом участке тела, где есть мышечная ткань. Опухоль, возникающую из поперечнополосатой мускулатуры, называют рабдомиомой, из гладкой — лейомиомой. В мягких тканях встречаются в основном рабдомиомы, располагающиеся, как правило, на конечностях. Заболевание наблюдается одинаково часто у лиц обоего пола, возникает обычно в молодом возрасте. Опухоли растут медленно, имеют плотноэластичную консистенцию, подвижны, отграничены от окружающих тканей, безболезненны. Так как миомы находятся в толще мышц и не причиняют больным беспокойства, они уже к моменту обращения пациентов к врачу обычно бывает довольно значительных размеров.
Гемангиома
Представляет собой опухоль, исходящую из кровеносных сосудов. Отмечается чаще всего в детском и молодом возрасте. Выделяют в зависимости от локализации следующие группы гемангиом: преимущественно кожных покровов, опорно-двигательного аппарата в целом и паренхиматозных органов. В мягких тканях чаще всего встречаются кавернозные, рацемические и межмышечные гемангиомы. Они образуются в основном в подкожной клетчатке и мышцах нижних конечностей.
Клиническая картина гемангиомы характеризуется двумя основными признаками: болью и наличием припухлости (опухоли). Консистенция ее мягко- или плотноэластичная. Плотная консистенция встречается обычно при относительно малом содержании функционирующих сосудов в опухоли. При большом количестве функционирующих сосудистых полостей консистенция гемангиомы мягкая. Если опухоль связана с крупным артериальным сосудом, то она может пульсировать, и тогда над ней определяется сосудистый шум.
Окраска кожи над опухолью различна и зависит от глубины залегания и роста гемангиомы. Если опухоль располагается в глубине мышечных тканей и даже продолжает расти в сторону костей конечности, цвет кожи над ней может не изменяться. При неглубокой локализации опухоли и ее росте в подкожную клетчатку окраска кожи может переходить от синюшного до ярко-багрового цвета. При сдавливании такая опухоль уменьшается в размерах, а окраска кожи становится менее интенсивной. Боли при гемангиоме, как правило, свидетельствуют о далеко зашедшем патологическом процессе, поражающем глубокие мышечные ткани и нервы конечностей.
Гломусная опухоль (опухоль Барре-Массона)
Встречается чаще всего в детском и среднем возрасте преимущественно у лиц мужского пола. Излюбленной локализацией опухоли являются ногтевые фаланги. В подавляющем большинстве случаев гломусная опухоль бывает одиночной, но иногда их может быть несколько на одном участке. Ведущий симптом — резкая жгучая болезненность при надавливании на ткани, в которых расположена опухоль. Клинически гломусная опухоль становится заметной спустя довольно длительный срок после появления болей. В большинстве случаев она округлая, эластичной консистенции, диаметром от 1 до 3 см. Кожа над опухолью нередко синюшного цвета.
Гигантоклеточная синовиома
Эта опухоль обычно находится в тех местах, где есть синовиальная оболочка. Отмечается в возрасте 30-50 лет, причем несколько чаще у женщин. В подавляющем большинстве случаев гигантоклеточная опухоль располагается на верхних конечностях в области сухожильных влагалищ кисти, реже — на самой кисти, стопе, недалеко от лучезапястного и голеностопного суставов. Растет гигантоклеточная синовиома медленно в виде бугристого округлого или овального узла умеренно плотной консистенции, отграниченного от окружающих тканей. Иногда она состоит из нескольких узлов с единой фиброзной капсулой. Изредка опухоль связана с кожей.
Невринома
Возникает из шванновских клеток оболочки нервов. Локализуется по ходу нервных стволов. Встречается в любом возрасте. Поражаются преимущественно верхние конечности, шея и голова. Опухоль бывает одиночной или множественной, растет медленно в виде четко отграниченного узла. Размеры невриномы — от нескольких миллиметров до 3-4 см в диаметре. Опухоль плотной консистенции. Одним из характерных признаков является болезненность при надавливании.
Нейрофиброма
Развивается из оболочек нервов. Наблюдается у мужчин и женщин любого возраста. Наиболее часто локализуется в области межреберных и седалищных нервов. Нейрофибромы представлены преимущественно одиночными узлами, однако встречается и множественный нейрофиброматоз, известный как болезнь Реклингхаузена. Нейрофибромы растут медленно, имеют округлую форму, гладкую поверхность и плотноэластичную консистенцию. Надавливание на опухоль вызывает боль по ходу нерва. Размеры нейрофибромы могут быть различными, достигая иногда 15-20 см в диаметре.
Диагностика и лечение
Основные методы диагностики: биопсия, физический осмотр, ультразвуковая диагностика. Большинство доброкачественных новообразований подлежит хирургическому лечению и ампутации. Основными показаниями к хирургической операции при доброкачественной опухоли мягкой ткани являются увеличение размеров новообразования, хроническая травматизация, высокий риск озлокачествления.
Основные методы лечения: хирургическое удаление (резекция, иссечение при помощи скальпеля), липосакция (откачка содержимого опухоли шприцом), прием стероидов (ограничивают рост опухоли, но не удаляют её), лазерное удаление, криотерапия (использование жидкого азота). Может использоваться комбинация методов. Заживление занимает около двух недель, в зависимости от места расположения и повреждения других типов тканей.
Саркомы мягких тканей
Вам поставили диагноз: саркома мягких тканей?
Наверняка Вы задаётесь вопросом: что же теперь делать?
Подобный диагноз всегда делит жизнь на «до» и «после». Все эмоциональные ресурсы пациента и его родных брошены на переживания и страх. Но именно в этот момент необходимо изменить вектор «за что» на вектор «что можно сделать».
Филиалы и отделения, где лечат саркомы мягких тканей
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Отдел торакоабдоминальной онкологии
Заведующий отделом д.м.н. Рябов Андрей Борисович
Контакты: (495) 150 11 22
МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Отделение комбинированного лечения опухолей костей, мягких тканей и кожи
Заведующий отделения: Александр Александрович Курильчик
Контакты: 8 (484) 399 31 30
Что такое саркома мягких тканей?
Саркома — это заболевание мягких тканей, характеризующееся высокозлокачественным активным течением.
I. Эпидемиология
Саркомы мягких тканей — это опухоли внескелетной соединительной ткани тела человека, т.е. связок, сухожилий, мышц и жировой ткани, происходящие из примитивной мезодермы. В эту группу также включены опухоли из шванновских клеток примитивной эктодермы и эндотелиальных клеток, выстилающих сосуды и мезотелий. Эта разнородная группа опухолей объединена из-за схожести морфологической картины, механизмов возникновения и клинических проявлений. Саркомы висцеральных органов встречаются крайне редко в молочной железе, почках, предстательной железе, легких и сердце и отличаются большей чувствительностью к режимам лечения, использующимся для лечения сарком, а не опухолей эпителиальной природы тех же органов.
1. Заболеваемость
Саркомы костей и мягких тканей — сравнительно редкая группа опухолей. В России ежегодно регистрируется около 10 000 новых случаев, что составляет 1 % всех злокачественных новообразований. Заболеваемость составляет 30 случаев на 1 000 000 населения, 80% составляют саркомы мягких тканей. В детском возрасте частота выше и составляет 6,5%, занимая 5-е место по заболеваемости и смертности.
2. Этиология
Генетическая предрасположенность играет роль в следующих случаях:
— невоидный базально-клеточный синдром (синдром Горлина) — это аутосомно-доминантное заболевание, характеризующееся кожными проявлениями в виде множественных базально-клеточных карцином, эпидермоидных кист, вдавлениями кожи на ладонях и стопах, а также кистами нижней и верхней челюстей, ребер, позвонков, короткими пястными костями, фибромами яичников и гипертелоризмом. Наиболее часто возникают медуллобластома и фибросаркома челюсти;
— нейрофиброматоз (болезнь фон Реклингхаузена) — аутосомно-доминантное заболевание, характеризующееся наличием множественных нейрофибром, веснушками аксилярной области и гигантскими невусами, а также билатеральными акустическими невромами, менингеомами, фиброзной дисплазией костей. Наиболее часто возникают нейрофибросаркома (10—15%), злокачественная неврилемома (5%), феохромоцитома, астроцитома и глиома;
— туберозный склероз (болезнь Борневилля) — аутосомно-доминантное нарушение с кожными проявлениями в виде гипопигментированных макул, аденом сальных желез, паховых фибром, также характеризуется проявлениями эпилепсии, задержкой умственного развития, гамартомами головного мозга, почек, печени, надпочечников, поджелудочной железы и сердца (у большинства пациентов выявляется рабдомиома сердца), наиболее часто возникают астроцитомы и глиобластомы;
— синдром Гарднера — аутосомно-доминантное заболевание, проявляющееся кожными изменениями в виде дермоидных или эпидермоидных кист, кист сальных желез, липом, фибром и десмоидов, а также полипами толстой кишки, множественными остеомами, включая кости черепа и челюсти. Очень часто встречается аденокарцинома толстой кишки;
— синдром Вернера (прогерия) — аутосомно-рецессивное нарушение, характеризующееся преждевременным старением с изменениями кожи по типу склеродермии, облысением, трофическими язвами конечностей. Наиболее часто возникают саркомы и менингеомы (10%).
У пациенток с наличием вторичного лимфостаза после мастэктомии с лимфодиссекцией значительно повышается риск развития ангиосарком (синдром Стьюарда—Тревеса).
Травма
Этиологическая связь между травмой и саркомами отсутствует. У большинства пациентов травма привлекает внимание к выросшей опухоли и является совпадением.
Канцерогены
Отмечено увеличение количества случаев ангиосарком у пациентов, работавших с винилхлоридом и мышьяком. Исследования не показали зависимость частоты возникновения сарком от таких канцерогенов, как хлорфенолы и феноксиуксусные кислоты.
Радиация
Радиоиндуцированные саркомы встречаются редко и могут возникать в тканях, подверженных ионизирующему излучению. Остеосаркома и злокачественная фиброзная гистиоцитома являются наиболее часто встречающимися гистологическими подтипами. Эти опухоли обычно возникают через 6—30 и более лет после проведенного облучения (медиана 10 лет) и крайне редко встречаются в ранние сроки (2—4 года). Общая доза облучения, режим фракционирования и вид радиации влияют на заболеваемость. Алкилирующие агенты (циклофосфамид и т.п.) в комбинации с лучевой терапией также увеличивают риск возникновения вторичных злокачественных новообразований.
Иммуносупрессия. Наиболее частым примером является саркома Капоши у больных СПИДом, ХЛЛ и аутоиммунной гемолитической анемией, а также больных после трансплантации органов.
Вирусная этиология. Вирус гепреса 8-го типа (HHV8) выявляется у больных СПИДом; ДНК HHV8 выявлялась в кожных образованиях гомосексуальных мужчин, не инфицированных ВИЧ, при классической и эндемической (африканской) формах саркомы Капоши.
II. Локализация сарком мягких тканей
1. Саркомы мягких тканей конечностей составляют 60% от общего числа и возникают на нижних и верхних конечностях в соотношении 3:1. Около 75% сарком (включая саркомы костей) возникают в области коленного сустава (рис.1).
Рис 1. Липосаркома мягких тканей правого бедра.
2. Саркомы головы и шеи возникают редко, с частотой не более 10%.
3. Саркомы туловища и забрюшинного пространства — около 30%, при этом 40% составляют забрюшинные опухоли.
III. Морфология
1. Трансформация и дедифференцировка доброкачественной опухоли мягких тканей в злокачественную встречается редко. Различия в частоте встречаемости различных гистологических подтипов сарком мягких тканей обусловлены разными заключениями патоморфологов, а не вариабельной частотой встречаемости разных подтипов.
2. Биология каждого подтипа опухоли может варьировать от доброкачественной без метастатического потенциала, более агрессивной с местноинвазивным ростом, до злокачественной с высоким метастатическим потенциалом. Для каждого гистологического подтипа сарком тенденция к метастазированию напрямую зависит от размера и степени злокачественности опухоли. Так, высокозлокачественные опухоли размером более 5 см считаются опухолями с очень высоким потенциалом метастазирования и наоборот.
3. Основными характеристиками злокачественности являются: частота митозов, морфологическая характеристика клеточного ядра, клеточность. Клеточная анаплазия, или полиморфизм, и наличие некрозов являются наиболее важными факторами для выставления степени злокачественности. Установление степени злокачественности является субъективной процедурой, поэтому некоторые патоморфологи предпочитают классифицировать саркомы на 2 типа: high grade или low grade. В разных классификациях используют 3-ю или 4-ю степень.
4. Цитогенетика: хромосомные изменения описаны во многих саркомах. В настоящее время их идентификация используется только для более тщательной диагностики того или иного гистологического подтипа. Клинического применения эти данные пока не получили.
IV. Местно-агрессивные опухоли мягких тканей
1. Нодулярный фасциит — псевдосаркоматозный, или пролиферативный, фасциит лечится простым иссечением. Морфологически дифференциальный диагноз проводится с фибросаркомой. Эта опухоль, как правило, не превышает 5 см в диаметре, обычно бессимптомна, с момента появления растет очень быстро до указанного размера, затем рост замедляется, и наступает плато.
2. Атипичная липоматозная опухоль — синоним липосаркомы 1-й степени злокачественности. Не обладает метастатическим потенциалом, но требует широкого иссечения в связи с высоким риском местного рецидивирования. Обычно возникает в брюшной полости или забрюшинном пространстве, может достигать больших размеров и вызывать сложности при удалении из-за близости к внутренним органам. Эта опухоль может дедифференцироваться в злокачественную фиброзную гистиоцитому (дедифферен-цированная липосаркома).
3. Десмоид — опухоль низкой степени злокачественности, характеризующаяся инвазивным ростом. Синонимы: агрессивный фиброматоз или мышечно-апоневротический фиброматоз. Требует широкого иссечения, так как при положительном/пограничном крае резекции высока частота местных рецидивов. Лучевая терапия помогает достичь лучшего локального контроля, применяется в первичном лечении рецидивных опухолей или в качестве адъюванта после хирургического иссечения. В лечении пациентов с рецидивами в облученной зоне или требующим обширных резекций, или с нерезектабельными опухолями возможно проведение системной химиотерапии. Использование тамоксифена дает 15—20% объективных ответов, доксорубицин в комбинации с дакарбазином — более 60%. Имеются данные об эффективности еженедельного введения метотрексата в низких дозах. Ответы, как правило, медленные и отсроченные.
4. Гигантоклеточная опухоль сухожилий и синовиальных оболочек возникает на кисти и требует обычного иссечения. Если вовлечены крупные суставы, то может быть использована тотальная синовиумэктомия. Иногда эти опухоли вызывают эрозию костных структур и рентгенологически могут выглядеть как первичные опухоли костей.
V. Часто встречающиеся саркомы мягких тканей
1. Злокачественная фиброзная гистиоцитома (ЗФГ) является наиболее часто встречающейся саркомой мягких тканей. Возникает в возрастной группе 50—70 лет. Морфологически характеризуется большой клеточностью и плеоморфизмом, имеет очень агрессивное течение. Миксоидный вариант (в настоящее время миксофибросаркома) течет менее агрессивно.
2. Рабдомиосаркома — различают 3 типа: плеоморфная, альвеолярная и эмбриональная. Эмбриональная является наиболее часто встречающимся гистологическим подтипом у детей. Это системное заболевание, и после постановки диагноза лечение начинается с системной химиотерапии, далее — оперативный этап или лучевая терапия для достижения локального контроля с последующей послеоперационной химиотерапией. Плеоморфный вариант обычно возникает во взрослом возрасте, отличается плохим прогнозом и крайне низким процентом излечения.
3. Липосаркома — миксоидная липосаркома является аналогом липосарком 2-й степени злокачественности, характеризуется вялотекущим течением и может метастазировать в мягкие и жировые ткани различных локализаций и брюшную полость. Плеоморфная липосаркома — это опухоль 3-й степени злокачественности (G3), возникает, как правило, на конечностях и метастазирует в легкие.
4. Лейомиосаркома возникает из гладкомышечных клеток, может локализоваться в любой части организма, беря начало из гладкомышечных клеток сосудистой стенки. Наиболее часто возникает в матке или органах ЖКТ. Лейомиосаркомы ЖКТ редко отвечают на химиотерапию, в то время как лейо-миосаркомы матки чувствительны к ифосфамиду с доксорубицином и комбинации гемзара с таксотером. Лейомиосаркомы кожи и подкожно-жировой клетчатки относятся к достаточно доброкачественным опухолям, не метастазируют и лечатся только хирургическим методом.
5. Синовиальная саркома. Гистологически выделяют 2 вида — монофазная и бифазная. Обычно возникает на конечностях, однако может быть также на туловище, брюшной стенке или внутренних органах. Отличается агрессивным ростом и хорошей чувствительностью к химиотерапии. В 1/3 случаев на рентгенограммах обнаруживают кальцинаты.
6. Нейрофибросаркома — злокачественная опухоль оболочек периферических нервов, или злокачественная шваннома. Часто возникает у пациентов с болезнью Реклингаузена. В 50% возникает у больных с нейрофиброматозом.
7. Ангиосаркома — опухоль сосудистого происхождения. Лимфангиосаркомы встречаются редко, часто бывают вторичными после мастэктомии из-за хронического лимфостаза. Гемангиосаркомы могут возникать в любых частях тела, но наиболее часто встречаются в коже и поверхностных мягких тканях головы и шеи.
8. Гемангиоперицитома встречается крайне редко, характеризуется вялотекущим ростом и местным рецидивированием. Гистологически обладает сходством с синовиальной саркомой.
9. Альвеолярная саркома мягких тканей. Клеточная природа происхождения неизвестна. Во взрослом возрасте опухоль наиболее часто выявляется в толще мышц бедра, в детском возрасте, как правило, — в области головы и шеи.
10. Эпителиоидная саркома чаще встречается в виде опухолевого образования дистальных отделов конечностей, исходя из апоневротических структур. Высока частота метастазирования в кожу, ПЖК, жировую ткань, кости и лимфатические узлы. Местные рецидивы обычно возникают выше места предыдущей операции (рис.2).
Рис.2. Эпителиоидная саркома мягких тканей правой голени.
VI. Диагностика
Симптомы и проявление болезни
Симптомы саркомы мягких тканей, которые расположены поверхностно, проявляются:
• растущим отеком в сопровождении сильных болей;
• недостаточностью и нарушением функциональной работы органа из-за растущей опухоли;
• утратой двигательной функции (передвижения) при образовании мягких тканей и/или костей конечностей;
• патологическими костными переломами.
Признаки глазничных онкологических узлов характерны выбуханием кнаружи глазных яблок без ощущения боли. Но при отеке век и местном сдавливании появляется боль, нарушается зрение.
Если саркома мягких тканей выявлена рядом с носом, симптомы проявляются в виде заложенности носа, который не проходит на протяжении длительного периода. Если на фоне болевых ощущений нарушается общее самочувствие, пассаж мочи, появились запоры, у женщин — вагинальные кровотечения, определяется кровь в моче, тогда подозревается мышечная саркома половых органов и путей, выводящих мочу.
Иногда только по снимкам замечают онкологическое образование в органах, при пальпации или при заметном выпирании опухолевой массы, поскольку симптомы отсутствуют. Саркома мышц у основания черепа повреждает черепно-мозговые нервы и их функциональное предназначение. Больные часто жалуются на двоение предметов, паралич лицевого нерва.
При прорастании опухоли в ткани:
• повышается температура тела;
• появляется слабость и беспричинно снижается масса тела;
• нарушается кровообращение, проявляются признаки гангрены или профузных кровотечений за счет сдавливания или прорастания сосудов;
• конечности слабеют и сильно болят в связи с повреждением и сдавливанием нервов;
• появляются трудности с проглатыванием пищи и дыханием за счет сдавливания мускулатуры шеи и органов средостения;
• рядом с опухолью увеличиваются лимфатические узлы.
Диагностика сарком мягких тканей должна проводиться без промедлений. При осмотре кожи обнаруживают бугристый округлый желтоватый или серый узел. Он может иметь разную плотность и консистенцию. Мягкие узлы бывают при липосаркомах, плотные – при фибросаркомах, желеобразные образования – при миксомах.
На ранних этапах развития, на образованиях отсутствует капсула, но при росте они раздвигают вокруг себя ткани. При их сдавливании образуется ложная капсула, которую можно пропальпировать. Если опухоль развивается глубоко в мышцах, то визуально она незаметна, и обнаружить ее трудно. В этих случаях проводят цитологическое исследование проб, полученных при биопсии, а также смывов жидкостей.
Позитронной эмиссионной томографией (ПЭТ) с использованием радиоактивной глюкозы уточняется распространение онкопроцесса по организму. Также проводят:
• рентгенографическое исследование ткани костей, суставов, чтобы обнаружить метастазы или исключить их;
• УЗИ мягких тканей или органов внутри грудины и брюшины;
• КТ костных онкоузлов;
• МРТ/КТ мягкотканевых опухолей (рис.3 и 4);
• ультразвук или томографию;
• ангиографию с применением контрастного вещества, определяющего скопление сосудов в эпицентре опухоли, нарушение кровообращения ниже опухоли;
• анализ крови на онкомаркер на саркому мягких тканей.
Рис. 3. МРТ картина саркомы мягких тканей правого бедра
Рис. 4. КТ картина саркомы мягких тканей правого бедра
Иммуногистохимический анализ выполняют при использовании таких маркеров, как: цитоспецифические (актин саркомерный и гладкомышечный), тканеспецифические (белок промежуточного филамента, коллаген, ламинин), маркеры пролиферации (ядерный белок клеток — PCNA, Ki67).
Также используются маркеры гормонов, ферментов, вирусных агентов.
Радиоизотопные методы диагностики эффективны для глубоко расположенных сарком в клеточном пространстве или полостях. Опухолевыми клетками активно поглощается радиоактивная глюкоза и тогда ее легко определить. Биопсия позволяет исследовать образец пораженной ткани под микроскопом, уточнить вид и низкую, промежуточную или высокую степень злокачественности
До проведения терапии проверяют работу сердца (ЭКГ и ЭхоКГ), состояние головного мозга — (ЭЭГ), слуха – аудиометрий, состояние почек
VII. Лечение
1. Хирургическое лечение:
Саркомы мягких тканей развиваются в капсуле, которая раздвигает окружающие ткани в процессе роста опухоли. Эта оболочка не является истинной, так как инфильтрирована опухолевыми клетками и носит название псевдокапсулы. В ходе оперативного вмешательства необходимо выполнить удаление опухоли согласно онкологическим принципам вместе с псевдокапсулой, не вскрывая ее, в противном случае резко возрастает риск развития рецидива. Тщательный гемостаз также крайне важен, распространение опухолевых клеток в пределах границ послеоперационной гематомы происходит быстро, и вероятность рецидива очень велика. В таких случаях обязательно проведение послеоперационной лучевой терапии. Удаление опухоли должно быть выполнено единым блоком с отрицательными краями резекции. Для обеспечения лучшего локального контроля при саркомах высокой степени злокачественности в послеоперационном периоде может быть проведена лучевая терапия при расположении опухолей на конечностях и туловище. Абсолютно отрицательных краев резекции трудно достичь при выполнении оперативных вмешательств при забрюшинных саркомах. В большой зоне ложа удаленной опухоли потенциально могут находиться опухолевые клетки, однако использование послеоперационной лучевой терапии в цитотоксической дозе может быть невозможно в связи с низкой толерантностью внутренних органов, таких как печень, почки и ЖКТ. Рутинное использование послеоперационной лучевой терапии при первичных забрюшинных саркомах не рекомендуется.
2. Лучевая терапия и предоперационная лучевая терапия показала преимущества в виде возможного уменьшения размеров опухоли и улучшения условий оперирования, меньшего поля облучения (опухоль + края резекции по сравнению с ложем удаленной опухоли + края резекции) и меньшей дозы облучения (обычно 50—54 Гр). При этом основным отрицательным моментом является высокий процент послеоперационных осложнений инфекционного характера.
Послеоперационная лучевая терапия показала преимущества в отсутствии послеоперационных осложнений, связанных с заживлением раны; весь образец опухоли доступен для исследования патоморфологом и оценки истинных размеров и распространенности первичной опухоли. Из отрицательных моментов необходимо отметить большую дозу и поле облучения.
Брахитерапия может проводиться периоперационно, занимает меньшее количество времени и по эффективности не превосходит послеоперационную лучевую терапию (за исключением опухолей низкой степени злокачественности).
Интраоперационная лучевая терапия может быть использована в лечении глубоко расположенных и забрюшинных опухолей, когда очень высок риск осложнений от использования обычной лучевой терапии.
3. Химиотерапия
Вопрос о целесообразности до- или послеоперационной химиотерапии остается открытым. Возможно, предпочтительнее предоперационная химиотерапия для определения ее эффективности у конкретного пациента и выработки более рациональной дальнейшей тактики. Химиотерапия сарком мягких тканей в последние годы начинает претерпевать значительные изменения: меняются подходы к выбору лекарственных комбинаций в зависимости от строения сарком, появляются новые лекарства, приобретает клинические перспективы таргетная терапия. Для больных с распространенным процессом системная терапия все еще является паллиативной, однако может продлить выживаемость, улучшить общее состояние и качество жизни. Выбор терапии должен быть индивидуализирован и основан на ряде факторов, в первую очередь морфологическом строении опухоли и ее биологических характеристиках, а также состоянии и предпочтениях пациента. Отдельно рассматриваются вопросы лечения гастроинтестинальных опухолей (ГИСТ) и рабдомиосарком, которые чаще поражают детей. В настоящее время разные морфологические типы сарком мягких тканей требуют разных подходов к терапии.
Филиалы и отделения, в которых лечат саркомы мягких тканей
ФГБУ «НМИЦ радиологии» Минздрава России обладает всеми необходимыми технологиями лучевого, лекарственного и хирургического лечения, включая расширенные и комбинированные операции. Все это позволяет выполнить необходимые этапы лечения в рамках одного Центра, что исключительно удобно для пациентов.
Заведующий отделом д.м.н. Рябов Андрей Борисович
Контакты: (495) 150 11 22
Заведующий отделения: Александр Александрович Курильчик