Гиперплазия бруннеровых желез что это
Гиперплазия бруннеровых желез что это
а) Терминология:
1. Синонимы:
• Гамартома бруннеровой железы, аденома бруннеровой железы (ошибочное название)
2. Определение:
• Гиперплазия подслизистых желез двенадцатиперстной кишки, не носящая неопластический характер:
о Диффузный тип (гиперплазия бруннеровых желез):
— Множественные мелкие подслизистые узлы (меньше 5 мм)
о Солитарный тип (гамартома бруннеровых желез):
— Солитарное образование на широком основании или на ножке, больше 5 мм
1. Общая характеристика:
• Лучший диагностический критерий:
о Изменения проксимальных отделов двенадцатиперстной кишки в виде «булыжной мостовой» или «клубники», обнаруживаемые при исследовании с бариевой взвесью
• Локализация:
о Диффузный тип: чаще всего в первой части двенадцатиперстной кишки (в луковице) проксимальнее ампулы о Гамартома: преимущественно в первой и второй части двенадцатиперстной кишки
• Морфология:
о Диффузный тип: множественные мелкие округлые подслизистые узелки (либо единичный узелок)
о Гамартома: солитарное полиповидное образование, которое может иметь ножку
2. Рекомендации по визуализации:
• Лучший метод диагностики:
о Рентгеноскопия верхних отделов ЖКТ с бариевой взвесью
о Эндоскопическая ультрасонография
3. Рентгеноскопия при гиперплазии бруннеровых желез:
• Диффузный тип:
о Множественные мелкие округлые узелки в проксимальных отделах двенадцатиперстной кишки
о Внешний вид «булыжной мостовой» или «клубники»
• Гамартома бруннеровой железы:
о Полиповидное образование размером один сантиметр и больше
о Может располагаться на широком основании или на ножке
4. УЗИ:
• Подслизистое гипоэхогенное образование неоднородной структуры, обнаруживаемое при эндоскопической ультрасонографии
5. КТ при гиперплазии бруннеровых желез:
• Полиповидное образование неоднородной структуры, слабо накапливающее контраст
в) Дифференциальная диагностика:
1. Дуоденит:
• Диффузные воспалительные изменения
• Эрозии и утолщение складок
2. Псевдоопухоль изгиба двенадцатиперстной кишки:
• Изгиб под острым углом в области верхушки луковицы двенадцатиперстной кишки
• Избыточное количество слизистой оболочки может имитировать объемное образование в просвете кишки
3. Гамартомный полипоз:
• Синдром Пейтца-Егерса
• Группа мелких полипов в подвздошной и тощей кишке (реже в двенадцатиперстной кишке, толстой кишке и желудке)
• Наличие сочетанных изменений (например, пигментации кожи и слизистых оболочек)
4. Семейный полипоз:
• Множественные аденоматозные полипы в ободочной кишке (реже в желудке, тонкой кишке, двенадцатиперстной кишке)
• Сопутствующие внекишечные проявления (эпидермоидная киста, липома, фиброма, десмоидные опухоли и т. д.)
5. Метастазы в стенке двенадцатиперстной кишки и лимфома:
• Метастазы: округлые подслизистые образования с наличием симптома «мишени» или «бычьего глаза», часто с изъязвлениями
• Лимфома: большое гиповаскулярное мягкотканное образование, инфильтрирующее подслизистую оболочку желудка и двенадцатиперстной кишки на КТ с контрастным усилением
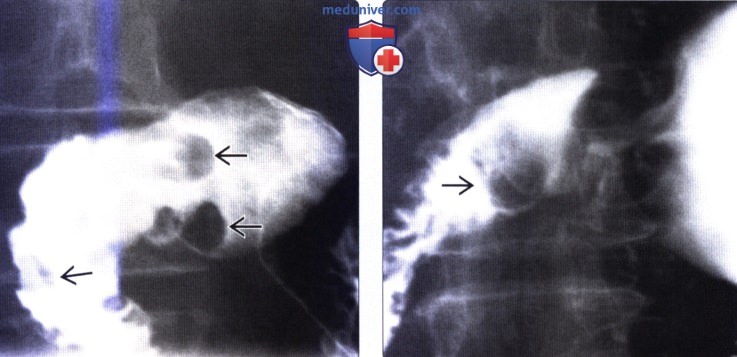
(Справа) На рентгенограмме (кадр из рентгеноскопического исследования) определяется полиповидное объемное образование в луковице двенадцатиперстной кишки. После эндоскопической биопсии и резекции подтвердилась гамартома Бруннеровой железы. Большие, изолированные поражения, как в этом случае, неотличимы от множества других объемных образований дуоденальной луковицы; при их обнаружении требуется биопсия.
1. Общая характеристика:
• Этиология:
о Повышение секреции кислоты (нет доказанной причинно-следственной связи)
о Бруннеровы железы вырабатывают щелочную жидкость, содержащую большое количество бикарбонатов, что приводит к нейтрализации кислоты желудка
2. Микроскопия:
• Диффузный тип: выбухающие бруннеровы железы, разделенные фиброзными перегородками
• Гамартома: сочетание ацинусов, протоков, гладких мышц, жировой и лимфоидной ткани:
о Большинство гистологических данных характерны для того и другого типа
о Морфологические признаки и размер являются более пригодными критериями дифференциальной диагностики
д) Клинические особенности:
1. Проявления гиперплазии бруннеровых желез:
• Наиболее частые признаки/симптомы:
о Боль в эпигастрии
• Другие признаки/симптомы:
о Кровотечение из верхних отделов ЖКТ, высокая обструкция, инвагинация (все возникают редко)
2. Демография:
• Возраст:
о Любой, преимущественно 40-60 лет
• Эпидемиология:
о 5-10% образований двенадцатиперстной кишки обусловлены гиперплазией бруннеровых желез
е) Список использованной литературы:
1. Chen КМ et аI: A duodenal tumor with intermittent obstruction. Brunner’s gland hyperplasia. Gastroenterology. 146(4):e7-8, 2014
2. Kim К et al: Clinicopathologic characteristics and mucin expression in Brunner’s gland proliferating lesions. Dig Dis Sci. 58(1):194-201,2013
3. Kini JR et al: Brunner’s gland hamartoma and hyperplasia. Trap Gastroenterol. 31 (2):121-3, 2010
4. Patel ND et al: Brunner’s gland hyperplasia and hamartoma: imaging features with clinicopathologic correlation. AJR Am J Roentgenol. 187(3):715-22, 2006
Редактор: Искандер Милевски. Дата публикации: 5.2.2020
Бруннеромы. Гиперплазия бруннеровых желез
Иоганн Конрад Бруннер (1653-1727) – швейцарский анатом из Диссенхофена, изучал медицину в Шаффхаузене, Страсбурге и Париже, работал профессором анатомии и физиологии в Гейдельбергском университете. Наиболее известные его работы касаются физиологии поджелудочной железы. Кроме того, он обнаружил подслизистые структуры двенадцатиперстной кишки, известные сегодня как железы Бруннера.
Наибольшая концентрация желез Бруннера находится в проксимальном отделе двенадцатиперстной кишки, но может распространяться и на проксимальный отдел тощей кишки. Эти структуры выделяют вязкую щелочную жидкость, которая содержит гликопротеин, связывающийся со слизистой оболочкой кишечника. Щелочные свойства защищают слизистую оболочку от возможного повреждения желудочным соком. Кроме того, железы Бруннера выделяют энтерогастрон, гормон, который подавляет секрецию желудочной кислоты.
Бруннеромы, вероятно, являются гамартомами, а не истинными неоплазиями.
В литературе встречается мало разрозненных сообщений об аденокарциноме двенадцатиперстной кишки, возникающей из желез Бруннера. Показано, что дисплазия возникает на фоне метаплазии желудка. Постулируется, что гиперплазия железы Бруннера и метаплазия желудка могут возникать вторично по отношению к повреждению слизистой двенадцатиперстной кишки. Недавнее исследование в Японии выявило возникновение дисплазии и инвазионной карциномы в гиперплазии железы Бруннера. Исследователи отметили диспластические изменения в 2,1% случаев гиперплазии железы Бруннера, и только 0,3% из них являются инвазивной карциномой.
Гиперплазия
Оглавление
Под гиперплазией понимают изменение строения тканей, сопровождающееся увеличением в них количества составляющих их клеток. При этом в клеточных элементах растет количество внутренних структур. Такое разрастание тканей связано с тенденцией к ускоренному клеточному делению под действием физиологических (естественных) или патологических причин. Оно может привести к увеличению органа или его части в размере, что напоминает доброкачественную опухоль.
Гиперплазия может быть предраковым состоянием. При дальнейшем увеличении количества клеток в них появляются мутации, характерные для опухолевого роста, меняется форма. Поэтому необходимо своевременное распознавание этого процесса и лечение соответствующих заболеваний.
Классификация гиперплазии
Гиперплазии в первую очередь подвергаются клетки, которые и в норме достаточно быстро делятся. Чаще всего они выстилают слизистые оболочки (эндотелий), образуют железы (железистая гиперплазия) или входят в состав иммунной системы (лимфоидная гиперплазия).
В зависимости от распространенности патологического процесса различается очаговая гиперплазия, диффузная, а также подобные клетки могут образовывать ограниченные образования – узлы и полипы.
Примером физиологического процесса служит гиперплазия молочных желез во время беременности и грудного вскармливания. При этом разрастаются клетки, секретирующие молоко. Этот процесс обратимый, впоследствии железистая ткань постепенно сменяется жировой.
При заболевании в начальной стадии под действием патологических стимулов возникает доброкачественная гиперплазия. Она проявляется лишь увеличением количества клеток в ткани без изменения их свойств. В дальнейшем в таких клетках происходят структурные изменения, и процесс приобретает черты предракового. Так возникает, например, атипическая гиперплазия эндометрия.
Причины и признаки гиперплазии
Основные причины гиперплазии:
Гиперплазия считается естественной реакцией организма на воздействие какого-либо стимула, например, гормона. При устранении провоцирующего фактора постепенно исчезают и симптомы гиперплазии. Этим она отличается от неопластических процессов, лежащих в основе рака и доброкачественных опухолей, которые не реагируют на прекращение действия вредного фактора. Однако патологическая гиперплазия может постепенно трансформироваться в неоплазию.
Симптомы и диагностика гиперплазии
Диагноз этого состояния основан на морфологической характеристике тканей, то есть на обнаружении увеличенного количества клеток при исследовании под микроскопом. Для этого используются разные виды биопсии – мазок, соскоб с поверхности эндотелия, пункция, щипковая, браш-биопсия и так далее. При обнаружении патологических изменений ставится предварительный диагноз заболевания и проводится его дальнейшая диагностика – анализы крови на гормоны, УЗИ органов и другие необходимые исследования.
Наиболее часто встречаются такие клинические формы:
Лечение гиперплазии
Эти морфологические изменения тканей могут привести:
Лечение гиперплазии зависит от того, в каком органе она сформировалась и насколько она выражена. Например, при поражении эндометрия необходима консультация гинеколога, а сама терапия включает назначение лекарственных препаратов, выскабливание при кровотечении или другие хирургические методы.
При гиперплазии щитовидной железы может быть достаточно восстановить поступление йода в организм. Если образовавшийся узел слишком крупный и сдавливает трахею, мешает дыханию и глотанию, его удаляют хирургическим путем.
Гиперплазия простаты лечится с помощью лекарственных средств, а при их неэффективности назначается операция – резекция железы.
Определить, как лечить гиперплазию в каждом индивидуальном случае, может только врач. Народные методы в этом случае будут малоэффективны, а отсутствие своевременной помощи может стать причиной злокачественного перерождения гиперплазированных тканей.
Преимущества клиники для всей семьи «Мама Папа Я»
Сеть семейных клиник «Мама Папа Я» приглашает на обследование и лечение при гиперпластических процессах любой локализации:
Для записи на прием приглашаем позвонить по телефону, указанному на сайте, или заполнить соответствующую заявку.
Рекомендовано к прочтению:
© Сеть семейных клиник
«Мама Папа Я», 2018
Гиперплазия бруннеровых желез что это
В настоящее время возможность поражения ДПК при ХП не вызывает сомнений. Это состояние описывают как «бороздчатый панкреатит», «парадуоденальный панкреатит», «кистозная дистрофия эктопированной ткани поджелудочной железы», «дуоденальная дистрофия» [4]. Мы используем термин «дуоденальная дистрофия» (ДД) как наиболее устоявшийся в отечественной литературе и соответствующий сути заболевания 1. При этом патогенез изменений стенки ДПК до конца неясен. Нет ответа на вопрос, является ли ДД отдельной нозологической формой или осложнением ХП.
Лечебная тактика при ДД также далека от разрешения и варьирует от консервативной терапии и эндоскопического стентирования до панкреатодуоденальной резекции [5, 14, 21].
Одним из основных направлений практической и научной деятельности отделения абдоминальной хирургии Института хирургии им. А.В. Вишневского является лечение больных Х.П. Продолжая традиции клиники, мы задались целью изучить патогенез ДД, оптимизировать диагностику и лечение больных ХП, ассоциированным с ДД.
Материал и методы
ДД диагностирована у 79 (15,3%) больных, которые обследованы в связи с жалобами, характерными для Х.П. Критериями лучевой диагностики ДД были утолщение более 8 мм стенки ДПК за счет воспалительной инфильтрации, а также наличие кист в толще стенки ДПК.
Проявления ДД имелись у 74 мужчин и 5 женщин. Возраст больных колебался от 29 до 73 лет, составляя в среднем 46,8±9,2 года (здесь и далее представлено среднее значение с указанием стандартного отклонения).
Детальному изучению подвергнуты анамнез и клинические проявления заболевания, результаты лучевых методов исследования. Интенсивность болевого синдрома оценивалась по визуально-аналоговой шкале.
УЗИ выполнено всем больным на аппаратах экспертного класса с применением стандартных режимов (В-режим, режим цветового и энергетического допплеровского картирования).
Магнитно-резонансная томография (МРТ) органов брюшной полости выполнена 40 больным на аппарате Philips 3,0 T Achieva с использованием 16-канальной катушки SENSE Torso-XL. В протокол сканирования включали Т1- и Т2-взвешенные последовательности без подавления и с подавлением сигнала от жира, DWI с последующим построением карт ADC. Все программы исполняли при триггерной синхронизации с дыханием, за исключением Т1 с подавлением сигнала от жира (TRIVE), которую осуществляли на задержке дыхания.
Эндоскопическое УЗИ (эндоУЗИ) проведено для уточнения диагноза 52 пациентам электронным эхоэндоскопом с радиальным датчиком во всех доступных режимах. Исследование выполнено к.м.н. Е.Н. Солодининой и к.м.н. Н.А. Курушкиной.
Для определения степени стенозирования просвета ДПК 22 пациентам проведено рентгенологическое исследование пассажа сернокислого бария.
Не оперированы и находятся под наблюдением хирургов нашей клиники 5 больных, которые пока не требуют хирургического лечения.
Гистологическому исследованию подлежал операционный материал, полученный после всех операций, сопряженных с резекцией органов. Во всех случаях использовали окраску гематоксилином и эозином. Исследования выполнены патологоанатомами, имеющими значительный опыт диагностики заболеваний П.Ж. Признаками Х.П. считали атрофию долек, перидуктальный, меж- и внутридольковый фиброз, хроническую воспалительную инфильтрацию, наличие расширенных протоков на фоне сохранной дольковой гистоархитектуры П.Ж. Диагноз Д.Д. устанавливали при выявлении в толще собственного мышечного слоя стенки ДПК протоковых и/или ацинарных структур (гетеротопия ткани ПЖ), кистозных полостей и фокусов некроза, наличии гиперплазии бруннеровых желез и воспалительной инфильтрации в подслизистом слое и мышечной оболочке стенки ДПК и прилежащей ткани ПЖ.
Результаты и обсуждение
Хронология развития заболевания показала, что у 43 (54,4%) пациентов из 79 болезнь началась с острого панкреатита, сопряженного с приемом алкоголя, что потребовало стационарного лечения в 38 наблюдениях. В последующем у этих людей периодически возникала боль в верхних отделах живота различной интенсивности, соответствующая Х.П. Болезнь развивалась постепенно у 33 (41,8%) пациентов, у которых первым симптомом явилась незначительная боль в верхних отделах живота с последующим нарастанием их интенсивности и частоты возникновения. Механическая желтуха без предшествующего болевого синдрома послужила первым клиническим проявлением болезни у 2 (2,5%) больных, умеренная боль в животе у них появилась позже. Нарушение пассажа содержимого по ДПК в качестве первого симптома отмечено лишь у 1 (1,3%) пациента. Длительность заболевания от момента регистрации первых симптомов до установления диагноза ДД колебалась от 2 мес до 14 лет и в среднем составила 32 мес.
Боль в животе явилась основным симптомом болезни, присутствовавшим у 78 (98,7%) больных. Один раз в 2 нед боль в животе возникала у 40 больных. Боль чаще 1 раза в неделю отмечалась у 38 человек, из которых у 24 интенсивность болевого синдрома превышала 6 баллов по визуально-аналоговой шкале. Полностью безболевой вариант болезни был у 1 (1,3%) больного Х.П. Заболевание проявлялось декомпенсированным стенозом ДПК и билиарной гипертензией.
Частым симптомом заболевания явилась потеря в массе тела, зарегистрированная у 46 (58,2%) больных и достигавшая 18,8% за 2 мес.
Билиарная гипертензия обнаружена у 30 (38,0%) больных, из которых у 9 имелась и механическая желтуха. Клинические признаки нарушения проходимости ДПК выявлены у 28 (35,5%) больных, из которых у 13 (16,5%) при рентгенологическом исследовании выявлено нарушение эвакуации контрастного препарата из желудка.
Повышенный уровень онкомаркера СА19−9 констатирован у 15 (19,0%) больных.
При трансабдоминальном УЗИ брюшной полости типичные изменения в виде утолщения стенки нисходящего отдела ДПК с наличием в ее толще анэхогенных структур, имеющих округлые формы и четкие контуры, выявлены у 40 (50,6%) пациентов. В остальных наблюдениях ультразвуковая картина соответствовала ХП (рис. 1).
При МРТ во всех 40 наблюдениях было выявлено утолщение стенки ДПК более 8 мм. Кисты в проекции стенки ДПК обнаружены в 32 наблюдениях (рис. 4).
При эндоУЗИ в 42 из 52 наблюдений обнаружены изменения нисходящего отдела ДПК, расположенные преимущественно в ее медиальной стенке. Типичной эндосонографической картиной являлось утолщение стенки ДПК более 8 мм со сглаживанием слоев и наличием в ее проекции анэхогенных образований (кист) с четкими ровными контурами (рис. 5 и далее).
Паллиативными операциями с формированием обходных анастомозов пришлось ограничиться у 3 больных из-за наличия выраженной воспалительной инфильтрации в области головки железы и подковы ДПК. Субтотальное иссечение стенок кисты ДПК произведено одному пациенту.
Послеоперационные осложнения возникли у 25 (34,7%) больных (табл. 1).
Основная часть осложнений пришлась на больных, которым выполнены дуоденумсохраняющие операции и у которых были минимальные морфологические проявления ХП: из 20 оперированных больных осложнения возникли у 14 (70%), из которых 1 (5,0%) умер. Основной бедой послеоперационного периода у этих больных был острый панкреатит и обусловленная им несостоятельность швов анастомозов. Общая летальность составила 1,3%.
Отдаленные результаты оценены у 47 больных, медиана наблюдения составила 49,9 мес (табл. 2). Эффект оперативного лечения считали полным (66%) при отсутствии жалоб, беспокоивших пациента до операции. Эффект признавали частичным (32%), если жалобы сохранились, но выраженность их значительно уменьшилась. В 1 (2%) наблюдении, в котором дооперационная симптоматика сохранилась, считали, что эффект достигнут не был. Определить причину отсутствия эффекта хирургического лечения не удалось, поскольку пациент отказался от предложенного обследования.

При макроскопическом исследовании операционного материала стенки ДПК были утолщены, с рубцовыми изменениями и кистозными полостями (рис. 6, 7).

Микроскопическое исследование ткани ДПК, полученной после 56 резекционных операций, показало наличие хронического воспаления и инфильтрации стенок, соответствующих бороздчатому панкреатиту в 39 (69,6%) наблюдениях. Гетеротопированная ткань ПЖ в стенке ДПК обнаружена в 17 (30,4%) наблюдениях (рис. 8), признаки ХП имелись в 61 наблюдении, они практически отсутствовали в 4 (5%) наблюдениях.
Поражение ДПК при ХП встречается относительно редко. При литературном поиске в системе MEDLINE мы обнаружили и проанализировали 4 многоцентровых исследования, охватывающих 5656 больных ХП, у которых были учтены осложнения заболевания, при этом дуоденальная непроходимость не упоминалась ни разу [7, 17, 22, 26]. В исследовании J. Domínguez-Muñoz и соавт. [13], включившем 937 пациентов, указано, что частота стеноза ДПК составила 5,4%. В проспективном мультицентровом исследовании, проведенном в Италии L. Frulloni и соавт. [15], из 893 пациентов с ХП у 55 (6,15%) было диагностировано поражение ДПК, описываемое авторами под терминами «дуоденальная дистрофия» или «бороздчатый панкреатит».
Вместе с тем в группе больных ХП, нуждающихся в хирургическом лечении, частота стенозирования просвета ДПК была выше и составляла 10-30% [11], что согласуется с нашими данными.
В последние годы представления о патогенезе поражения ДПК при ХП пересмотрены. Стало очевидно, что кистозно-воспалительная трансформация стенки ДПК не может быть обусловлена контактным распространением воспаления с ткани ПЖ.
В то же время, по мнению Н. Nagai и соавт. [18, 19], внедрение паренхимы ПЖ вплоть до подслизистого слоя по периметру малого сосочка ДПК является нормальным состоянием, а не гетеротопией.
Причиной развития бороздчатого панкреатита считают нарушение оттока панкреатического секрета через малый сосочек ДПК [24].
На сегодняшний день морфологи не могут дать однозначного ответа на вопрос, являются ли ДД и бороздчатый панкреатит различными заболеваниями, несмотря на то, что их морфологические проявления очень близки. Следствием этого явилось предложение N. Adsay и G. Zamboni [4] использовать собирательный термин «парадуоденальный панкреатит».
Таким образом, исходя из накопленного коллективного опыта, можно утверждать, что у больных ХП может возникать кистозно-воспалительная трансформация стенки ДПК, что усугубляет тяжесть течения заболевания. В то же время существует небольшая группа больных, составляющая около 6-20% популяции, у которых поражение стенки ДПК возникает первично, приводит к панкреатической гипертензии и вторичному развитию ХП.
Лучевые методы диагностики при целенаправленном поиске и наличии настороженности в отношении выявления ДД позволяют с высокой степенью достоверности обнаружить кистозную трансформацию стенки ДПК. По нашим данным, наиболее информативными методами оказались КТ и эндоУЗИ.
Не вызывает сомнений, что хирургическое лечение больных ХП и ДД оправдано только после предварительной настойчивой консервативной терапии. Использование аналогов соматостатина, паллиативных эндоскопических вмешательств, обеспечивающих устранение билиарной и панкреатической гипертензии, позволяет добиться стойкой ремиссии заболевания у 20% пациентов [5, 6, 21].
Отсутствие эффекта от консервативного лечения является показанием к хирургическому лечению. Сочетание Х.П. с преимущественным поражением головки ПЖ и ДД со стенозированием просвета ДПК является показанием к панкреатодуоденальной резекции [12]. Больные Х.П. со стойким болевым синдромом, вирсунголитиазом, постнекротическими кистами и ДД без клинически значимого нарушения проходимости ДПК, по нашему мнению, подлежат органосохраняющему хирургическому лечению в виде резекции головки железы с продольной панкреатоеюностомией. Различные варианты хирургического лечения дают схожие отдаленные результаты. Выполнение операций с резекцией вертикальной части ДПК, реимплантацией большого сосочка ДПК не оправдано из-за значительного риска возникновения тяжелых послеоперационных осложнений.
Таким образом, кистозно-воспалительная трансформация стенки двенадцатиперстной кишки является объективной реальностью. Эти изменения стенки кишки, именуемые дуоденальной дистрофией (ДД), чаще являются осложнением хронического панкреатита (ХП), но возможно и первичное их возникновение с последующим присоединением изменений ткани поджелудочной железы, соответствующих Х.П. Клинические проявления ДД не зависят от причины ее возникновения и сводятся к симптоматике, не отличимой от симптомокомплекса Х.П. Лечение больных, страдающих ХП и ДД, вначале должно быть консервативным, при необходимости следует производить паллиативные эндоскопические вмешательства, направленные на устранение билиарной и панкреатической гипертензии. Хирургическое лечение показано при сохраняющейся боли и наличии осложнений ХП, нарушения проходимости двенадцатиперстной кишки.



