Гиперсегментация нейтрофилов что это
Гиперсегментация нейтрофилов что это
Лейкоцитарная формула (с обязательной микроскопией мазка крови) – подсчет количества общего количества и разных видов лейкоцитов, а также изучение их морфологических особенностей посредством микроскопии мазка периферической крови.
Leukocyte Differential Count, WBC Count Differential, Diff, Blood Differential, Differential Blood Count, White Blood Cell Differential.
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Окраска мазка крови специальными красителями позволяет различать клетки и внутриклеточные структуры, кроме того, разные виды лейкоцитов неодинаково восприимчивы к некоторым красителям и окрашиваются по-разному, что вместе с различиями в их морфологических свойствах (форма ядра, размеры и наличие внутриклеточных гранул) позволяет дифференцировать основные виды лейкоцитов при изучении мазка с помощью микроскопа. Традиционно подсчет проводят на сто клеток и полученные цифры записывают в процентах. Зная общее количество лейкоцитов, проценты можно пересчитать в абсолютные значения, которые гораздо более объективно отражают состояние лейкоцитарной популяции.
Гранулоциты называются так потому, что содержат в своей цитоплазме гранулы, в которых содержатся биологически активные вещества, необходимые для выполнения лейкоцитами своих защитных функций. Выделяют три типа гранулоцитов:
Вышеперечисленные типы лейкоцитов встречаются в мазке периферической крови в норме. При некоторых заболевания в кровь из костного мозга могут выходить клетки, которых в норме в мазке быть не должно: например, бласты – морфологический субстрат острого лейкоза. В заключении к исследованию обязательно указывается количество и по возможности морфологические особенности атипичных клеток.
Помимо подсчета количества клеток, врач лабораторной диагностики при микроскопии мазка крови отмечает изменения морфологии лейкоцитов:
Для чего используется исследование?
Когда назначается исследование?
Повышены нейтрофилы в крови: причины, что значит и о чем говорит
Один из показателей нормальной работы иммунной системы — количество нейтрофилов в крови. Число этих клеток можно определить по общему развернутому анализу крови. Повышение и снижение показателей свидетельствует о наличии серьезных патологических процессов в организме.
Что такое нейтрофилы?
Нейтрофилы — разновидность лейкоцитов, которые поддерживают работоспособность иммунной системы. Синтезируются в красном косном мозге. Эти клетки обнаруживают патогенные микроорганизмы, поглощают и переваривают их, после чего нейтрофилы гибнут. Этот процесс называется фагоцитоз. Отмершие клетки образуют массу, которая называется гной.
По степени созревания выделяют 6 видов нейтрофилов. Незрелые — миелобласты, промиелоциты, миелоциты, палочкоядерные клетки и метамиелоциты. Зрелые — сегментоядерные нейтрофилы, которые содержат ядро, разделенное на несколько сегментов. Эти клетки эффективнее справляются с инфекцией, чем незрелые.
Нормы количества нейтрофилов у мужчин и женщин
Количество нейтрофилов в крови у мужчин и женщин составляет 40-70% от общего числа лейкоцитов. Для оценки состояния здоровья значение имеет уровень палочкоядерных и сегментоядерных клеток.
Нормальные значения (в % от общего числа лейкоцитов):
При тяжелых инфекционных заболеваниях в крови присутствует много незрелых нейтрофилов. Это связано с тем, что для борьбы с большим количеством патогенов организм задействует не до конца созревшие клетки. В крови здоровых людей выявляют преимущественно только зрелые нейтрофилы.
У детей первого года жизни количество палочкоядерных клеток несколько выше, чем у взрослых. Меньше всего сегментоядерных клеток выявляют у детей 4-5 лет — в пределах 35-55%.
Причины повышения показателей
Повышение количества нейтрофилов (нейтрофилез, нейтрофилия) наблюдается при различных травмах и заболеваниях. Основная причина — очаговые и генерализованные очаговые инфекции.
Нейтрофилез диагностируют, если содержание нейтрофилов в крови у взрослого превышает 6500 единиц в 1 мкл крови. При этом выделяют относительную форму патологии, при котором нейтрофилов более 75%, но общее количество лейкоцитов в норме. И абсолютный нейтрофилез — одновременно повышен уровень нейтрофилов и лейкоцитов.
При каких болезнях повышается количество нейтрофилов:
Спровоцировать увеличение количества нейтрофилов может длительный прием гормональных препаратов, употребление в пищу консервированной пищи, стресс, чрезмерные физические нагрузки. Физиологический нейтрофилез может быть вызван воздействием тепла и холода, перееданием, предменструальным синдромом.
Нейтрофилия во время беременности не считается патологией. Иммунная система воспринимает плод как чужеродный организм, что приводит к увеличению количества все видов лейкоцитов. Но значительное превышение показателей может быть признаком эклампсии. Повышение уровня нейтрофилов наблюдается и после родов.
Снижение уровня нейтрофилов чаще всего возникает при аутоиммунных патологиях, заболеваниях крови и лучевой болезни, вирусном гепатите, гриппе. Количество клеток уменьшается при приеме НПВС, антибиотиков, противовирусных средств, лекарств для лечения диабета, болезней щитовидной железы, малярии.
Уровень нейтрофилов определяют по общему анализу крови, в бланке эти клетки обозначают буквами NEUT.
Для анализа берут венозную кровь натощак, ужин должен быть за 8 часов до забора биоматериала. За 48 часов до обследования нужно отказаться от употребления алкоголя, острой, жирной и жаренной пищи, избегать чрезмерных физических нагрузок и стрессов.
Как распознать нейтрофилию?
Нейтофилия не является самостоятельным заболеванием, поэтому характерные симптомы патологии выявить сложно. Признаки зависят от основной болезни, на фоне которой произошел скачок нейтрофилов.
Как нормализовать показатели?
Изменение уровня нейтрофилов — признак воспаления, отравления, серьезных травм и болезней. Чтобы точно установить причину увеличения уровня, проводят полное обследование. Это бакопсев различных биологических жидкостей для выявления типа возбудителя инфекции, УЗИ внутренних органов, рентген грудной клетки, ЭКГ, гистологическое исследование. На основании результатов диагностики врач назначает лечение.
При выраженном нейтрофилезе могут назначить следующие препараты:
При воспалении аппендикса, очагов некроза и гнойников необходимо оперативное вмешательство. Дополнительно назначают диетотерапию — в рационе необходимо уменьшить количество мясных блюд, консервов и копченостей. Основа меню — овощи и фрукты в любом виде.
Специфическое лечение не требуется, если уровень нейтрофилов увеличился на фоне стресса или физического переутомления.
Изменение показателей нейтрофилов свидетельствует о различных патологиях, поэтому не стоит заниматься самодиагностикой, пытаться увеличить или уменьшить значения самостоятельно. Правильно подобрать методы лечения сможет только врач после осмотра и диагностики.
Нейтрофилы в крови
Нейтрофилы представляют собой разновидность лейкоцитов, составляя около половины от их общей массы. Задача этих клеток – поддержание работоспособности нашего иммунитета. При попадании в организм патогенных микроорганизмов нейтрофилы их обнаруживают, после чего поглощают, переваривают и умирают – этот процесс называется фагоцитозом.
Синонимы: нейтрофильные гранулоциты, NEUT, нейтрофильные сегментоядерные гранулоциты, полиморфонуклеарные нейтрофилы
Различают шесть видов нейтрофилов в зависимости от стадии их созревания. К незрелым видам относятся миелобласты, промиелоциты, миелоциты, метамиелоциты и палочкоядерные клетки. Конечный этап развития – сегментоядерные нейтрофилы (зрелые клетки с образовавшимся ядром, разделенным на несколько сегментов).
Даже на стадиях своего начального развития нейтрофилы способны противостоять инфекции, хотя зрелые сегментоядерные клетки справляются с этой задачей значительно эффективнее.
В анализах крови людей, страдающих тяжелыми инфекционными заболеваниями, можно обнаружить незрелые формы нейтрофилов. Это объясняется тем, что в борьбе с патогенными микроорганизмами сегментоядерные клетки гибнут слишком быстро, а потому организм вынужден задействовать не до конца созревшие клетки. А вот в крови здорового человека обнаруживаются преимущественно зрелые нейтрофилы, поскольку они хорошо справляются со своей задачей практически без помощи своих юных собратьев.
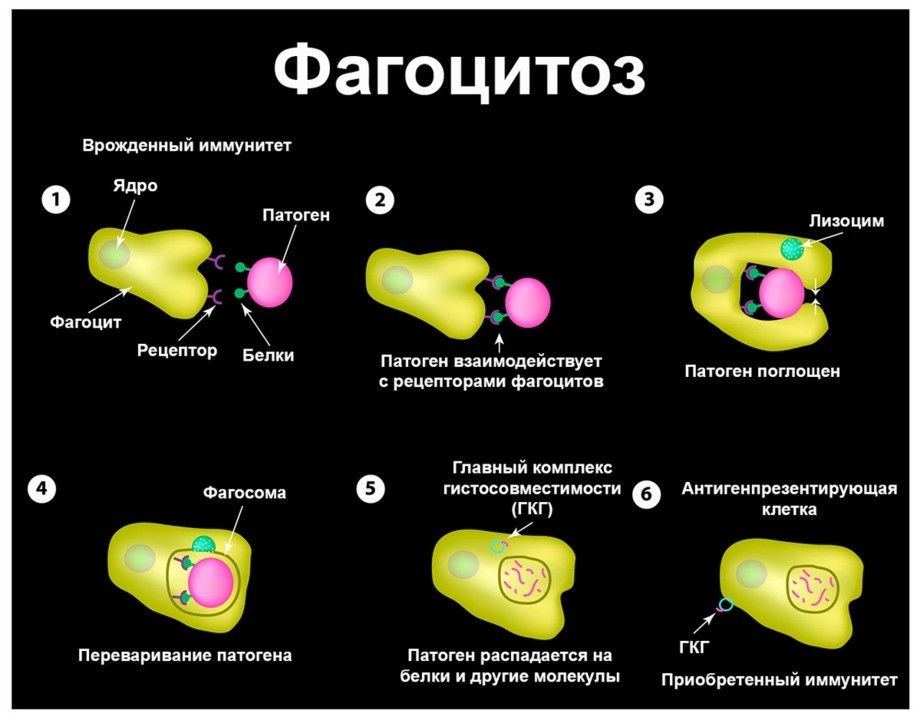
Анализ крови на нейтрофилы
Для определения уровня содержания нейтрофилов используют общий анализ крови. Для обозначения нейтрофилов на бланке анализа используют латинское сокращение NEUT, которое может выражаться как в абсолютном (содержание клеток на литр крови, например 0,04—0,3 × 10 9 ), так и в процентном значении. Для общего анализа, как правило, используется капиллярная кровь. Забор биоматериала осуществляется из пальца после прокола скарификатором. Иногда забор крови проводится из вены – многое зависит от методов, которые использует лаборатория.
Показания к анализу
Общий анализ крови – самое распространенное гематологическое исследование, поэтому спектр показаний для его назначения широк. Нейтрофилы представляют собой разновидность лейкоцитов, основная задача которых – уничтожение патогенных микроорганизмов. Поэтому главная цель анализа на содержание нейтрофилов – выявление потенциально опасных состояний, сопровождающихся инфекционно-воспалительными процессами. Иными словами, анализ крови на нейтрофилы может быть информативен как при простудных заболеваниях, так и при болезнях почек или печени.
Подготовка к анализу
Исследование проводится с утра натощак, поскольку прием пищи вызывает рост числа нейтрофилов в крови. Ужин накануне анализа допускается не позднее восьми часов вечера. За 2 суток до исследования пациенту следует соблюдать следующие правила подготовки:
Утром накануне исследования нельзя курить. Допускается прием чистой негазированной воды.

Нормы содержания нейтрофилов в крови
Количество нейтрофилов в крови составляет примерно 40-70% от всей лейкоцитарной массы как у мужчин, так и у женщин. При исследовании специалисты в первую очередь обращают внимание на содержание нейтрофилов средней и полной стадий созревания, то есть палочкоядерных и сегментоядерных форм. Молодые клетки представляют интерес при подозрении на развитие распространения воспалительных процессов. В таблице приведена лейкоцитарная формула, где отражено в числе прочего и количество нейтрофилов.
У детей первого года жизни количество палочкоядерных нейтрофилов может достигать пяти, затем максимальное значение ограничивается четырьмя, как и у взрослых. Наименьшее количество сегментоядерных нейтрофилов наблюдается у детей 4-5 лет (35-55%). У других возрастных групп оно варьируется в пределах 40-70%.
Причины повышения нейтрофилов в крови
Повышенный уровень нейтрофилов может свидетельствовать о большом количестве заболеваний и травм. Очень часто причиной повышения нейтрофилов в крови становятся инфекционные процессы бактериального происхождения, которые могут быть как очаговыми, так и генерализованными (распространившиеся по всему организму).
Причины повышения уровня нейтрофилов в крови:
Употребление в пищу консервированных продуктов тоже может стать причиной повышения нейтрофилов. Это касается тех продуктов, в которых уже не осталось живых бактерий, однако сохранились токсические продукты их жизнедеятельности.
Причины пониженного уровня нейтрофилов в крови
Снижение уровня нейтрофилов в крови называют нейтропенией. Причиной этого явления могут быть заболевания различной природы, а также прием различных препаратов.
Причины снижения уровня нейтрофилов:
Отдельно следует упомянуть лекарственные препараты: их прием также может стать причиной нейтропении. Это очень обширная группа медикаментов, в которую входят:
Последствия отклонения нейтрофилов от нормы
Изменение уровня нейтрофилов в крови – сигнал организма о наличии воспалительных заболеваний, травм или отравлений. Поэтому необходимо точно определить причину повышения или понижения нейтрофилов, чтобы вовремя начать лечение или устранить провоцирующий фактор. Если это не сделать вовремя, последствия могут быть самыми тяжелыми (вплоть до летального исхода). Наибольшую опасность в числе возможных причин представляют инфекционные заболевания бактериальной природы, а также процессы местного нагноения и некротизации (омертвения) тканей.
Как уменьшить количество нейтрофилов в крови
Для снижения количества нейтрофилов в крови необходимо воздействовать на причину этого явления, поскольку каких-то обособленных способов его устранения не существует. Если повышение уровня нейтрофилов вызвано кратковременным стрессом или повышенной физической нагрузкой, то специфической коррекции не требуется.
При стойком нейтрофилезе в зависимости от заболевания, послужившего причиной его возникновения, используются следующие методы лечения:
При наличии местного очага воспаления может применяться хирургическое лечение. Например, оно актуально при аппендиците или абсцессах. В меню следует ограничить количество мясных продуктов, консервированных и копченых. Рацион должен быть насыщен овощами и фруктами.

Как увеличить количество нейтрофилов в крови
Для коррекции нейтропении необходимо выявить ее причину. Если снижение уровня нейтрофилов вызвано приемом медикаментозных препаратов, следует в первую очередь соотнести возможные риски падения уровня нейтрофилов с важностью терапевтического эффекта применяемых лекарств. В крайнем случае препарат могут заменить на аналог, не влияющий на уровень нейтрофилов в крови. Основные заболевания, ставшие причиной нейтропении, лечат при помощи антибиотиков, противовоспалительных и противовирусных препаратов.
Рекомендуется употреблять следующие продукты:
Тщательная термическая обработка мяса и яиц необходима для того, чтобы исключить возможность попадания в организм бактерий и микробов, которые активно размножаются в плохо прожаренных или недоваренных белковых блюдах.
Заключение
Отклонение уровня содержания нейтрофилов в крови от нормы может быть вызвано целым рядом заболеваний, травм, а также приемом медикаментов. Поэтому нет смысла поднимать или снижать их уровень искусственно: необходимо выявить и устранить причину, повлиявшую на результаты анализов. При своевременно начатом лечении и выполнении всех рекомендаций врача уровень нейтрофилов в крови нормализуется.
Еще раз об анемии… Точная дифференциальная диагностика – залог успешного лечения
Куриляк О.А., к.б.н.
Анемией обозначается состояние, которое характеризуется снижением содержания в крови гемоглобина ( 3 4,5-11,0*10 9 /л
Дети до 2 лет: 0,4-1,0 мг/л (7 – 18,0 мкмоль/л)
Итак, на первом этапе в лаборатории следует повести анализ образца на гематологическом анализаторе. При выявлении снижения гемоглобина необходимо прежде всего определить характер анемии: гипо-, нормо- или гиперхромный. Критерием является величина МСН, отражающая, как известно, среднее содержание гемоглобина в эритроците.
Гипохромные анемии характеризуются низким значением МСН ( 95 фл). Значение MCHC тоже не выходит за пределы нормы, а снижение гемоглобина обычно обусловлено резким снижением количества эритроцитов с преобладанием фракции клеток с большим объемом (макроцитов). К данному типу анемий относят В12-дефицитную, фолиеводефицитную и аутоиммунную гемолитическую анемии.
Нормохромные анемии в большинстве случаев являются и нормоцитарными, т.е. все эритроцитарные индексы находятся в пределах нормы (см. Табл. 1). Причиной снижения гемоглобина в этих случаях является снижение общего количества эритроцитов. В группу нормохромно-нормоцитарных анемий входят анемии при острой кровопотере, а также разнообразные гемолитические анемии и анемии при костномозговой недостаточности.
МСН является аналогом цветового показателя (ЦП),который вычисляют в тех случаях, когда в лаборатории нет гематологического анализатора и подсчет эритроцитов осуществляется в камере Горяева. Нормальные значения ЦП находятся в пределах 0,85 – 1,0. Однако, в случае ошибочного подсчета числа эритроцитов, в частности занижения их количества (что при ручном подсчете случается достаточно часто!), цветовой показатель может оказаться близким к единице. Это может служить источником серьезной ошибки на начальном этапе диагностического поиска, которая повлечет за собой назначение необоснованных исследований, и, как следствие, существенно усложнит дифференциальную диагностику.
Алгоритм диагностического поиска при анемии
Гипохромно-микроцитарные анемии
Как было упомянуто выше, при выявлении у пациента гипохромного характера анемии в первую очередь следует заподозрить ЖДА (все ЖДА являются гипохромными!). Однако факт наличия гипохромной анемии сам по себе не исключает других патогенетических вариантов анемии, поскольку не все гипохромные анемии являются железодефицитными. Например, гипохромная анемия может возникать при нарушении синтеза гемоглобина в результате нарушения включения в его молекулу железа при нормальном или даже повышенном уровне железа в сыворотке крови (см. нарушение синтеза порфиринов). Поэтому для дифференциальной диагностики этих состояний следует в первую очередь провести исследование содержания железа в сыворотке. Причем, этот анализ надо выполнять обязательно до назначения больным лекарственных препаратов железа или проведения трансфузий эритроцитов.
Если уровень железа в сыворотке крови находится в пределах нормы или повышен, следует заподозрить у пациента анемию, связанную с нарушением синтеза порфиринов или талассемию и на следующем этапе диагностики целесообразно определить концентрацию ретикулоцитов. Выявление пониженного уровня железа в сыворотке крови однозначно указывает на необходимость определения других показателей обмена железа (ОЖСС и уровень ферритина).
При ЖДА этот показатель снижается (менее 15%), а при перегрузке железом значительно повышается (более 50%).
Еще одним высоко специфичным диагностическим признаком ЖДА является концентрация ферритина в сыворотке крови. Уровень ферритина отражает величину запасов железа в организме. Поскольку истощение запасов железа является обязательным этапом формирования ЖДА, то снижение содержания ферритина (менее 15 мкг/л) – характерный признак не только ЖДА, но и латентного дефицита железа. Однако этот показатель следует оценивать с осторожностью при сопутствующих острых воспалительных процессах, болезнях печени и некоторых опухолях. Дело в том, что ферритин принадлежит к классу острофазных белков и при перечисленных выше состояниях его синтез увеличивается, что при ЖДА может маскировать гипоферритинемию.
снижение содержания ферритина в сыворотке.
Клинический пример №1: У 34-летней женщины выявлена гипохромная микроцитарная анемия с очень низкими MCV (49,0 фл) и МCH (15.0 пг), а также существенно увеличенным значением RDW ( 21.3%).
Т. о., биохимические исследования подтвердили диагноз ЖДА.
После 10-дневного курса терапии пероральными препаратами железа отмечено увеличение RDW, а также появление на гистограмме распределения эритроцитов по объему второго пика в области нормоцитов (отмечен стрелкой).
Полученная кривая свидетельствует об адекватности назначенного лечения.
Таким образом, по данным гемограммы анемия отсутствует. Однако, в картине крови преобладают микроциты с низким содержанием гемоглобина. Наиболее вероятен диагноз – латентный дефицит железа.
2. Анемии при хронических заболеваниях (АХЗ) = железораспределитель-ные анемии
Среди микроцитарно-гипохромных анемий второе место по частоте после ЖДА занимают анемии при различных воспалительных заболеваниях как инфекционного, так и неинфекционного происхождения.
При всем многообразии патогенетических механизмов анемий в данных ситуациях одним из основных при АХЗ считается перераспределение железа в клетки макрофагальной системы, активирующейся при различных воспалительных или опухолевых процессах. Поступающее в организм и высвобождающееся из разрушающихся эритроцитов железо переходит, главным образом, в депо, где и накапливается в макрофагальных клетках в виде железосодержащего белка ферритина. В то же время, перенос железа из клеточного ферритина к трансферрину нарушен, что влечет за собой снижение уровня сывороточного железа. Развивается перераспределительный, или функциональный, дефицит железа вследствие накопления и блокады освобождения железа в тканевых макрофагах, что приводит к снижению доставки железа к эритрокариоцитам костного мозга, нарушению эритропоэза и развитию анемии. Поскольку истинного дефицита железа при этих АХЗ не наблюдается, более оправданно говорить не о железодефицитных, а о железоперераспределительных анемиях. Выделение железоперераспределительных анемий в отдельный патогенетический вариант имеет важное значение, так как при сходстве данного варианта с ЖДА терапевтические подходы при этих анемиях абсолютно различны.
Критерии железоперераспределительных анемий:
3. Анемии, связанные с нарушением синтеза порфиринов = сидероахрести-ческие анемии
Картина гемограммы при данном типе анемий аналогична таковой при ЖДА, поэтому для уточнения диагноза следует обращать пристальное внимание на биохимические показатели обмена железа (Табл.3).
Критериями сидероахрестических анемий являются:
Пациентку лечили препаратами железа. Эффекта не было. После проведения дополнительных исследований получены следующие результаты:
Поскольку при мегалобластном типе кроветворения соотношение лейкопоэз/эритропэз сдвигается в сторону эритропоэза, при анализе гемограммы обычно отмечается лейкопения и тромбоцитопения, которые носят умеренно выраженный характер. Нарушение процессов созревания гранулоцитарного ростка приводит к появлению в крови гигантских гиперсегментированных нейтрофилов.
На этапе синдромной диагностики основным методом является исследование костного мозга, при котором выявляется мегалобластический тип кроветворения с высоким уровнем неэффективного эритропоэза. Данное исследование должно проводиться до назначения витамина В12, т.к. иньекция В12 в течение 1-2 суток изменяет тип кроветворения в костном мозге. Мегалобласты уменьшаются в размерах, меняется структура ядра, клетки становятся макронормобластами. Только по присутствию гиганских форм нейтрофилов можно предположить, что имело место мегалобластическое кроветворение. При невозможности выполнить диагностическое исследование костного мозга допустимо пробное назначение витамина В12 с последующим обязательным исследованием количества ретикулоцитов через 3–5 дней (не позже), приобретающим диагностическое значение. Если анемия связана с дефицитом витамина В12, то под влиянием нескольких инъекций препарата происходит трансформация мегалобластического кроветворения в нормобластическое, что приводит к значительному увеличению в периферической крови количества ретикулоцитов по сравнению с исходным (ретикулоцитарный криз).
Окончательная верификация В12-дефицитного характера анемии может быть осуществлена с помощью исследования концентрации в крови витамина В12 (норма для взрослых: 148-616 пмоль/л, старше 60-ти лет: 81-568 пмоль/л).
Макроцитоз в комбинации с гиперсегментацией нейтрофилов и дефицитом витамина В12 подтверждают диагноз В12-дефицитной анемии.
Фолиево-дефицитные анемии
Фолиево-дефицитные анемии по своим гематологическим признакам (макроцитоз, мегалобластический эритропоэз) аналогичны В12-дефицитным анемиям. Отличительной особенностью является снижение в сыворотке крови уровня фолата (норма 6-20 нг/мл), а также снижение его концентрации в эритроцитах (норма 160-640 нг/мл).
Нормохромно-нормоцитарные анемии
1. Гемолитические анемии ГА
Основным патогенетическим механизмом развития гемолитической анемии (ГА) является укорочение продолжительности жизни эритроцитов (в норме в среднем 120 дней) и их преждевременный распад под воздействием различных причин.
Критерии ГА:
Большинство ГА являются нормохромными, за исключением ГА, связанной с нарушением синтеза глобина (талассемия), которая, как было отмечено выше, является гипохромной. Основным лабораторным признаком, позволяющим заподозрить ГА, является повышение в крови количества ретикулоцитов, в связи с чем данный анализ следует считать обязательным при всех неясных анемиях. Фактически ретикулоцитоз встречается в двух ситуациях, при которых активируется нормальный эритропоэз – при гемолизе и острых кровопотерях. Наряду с ретикулоцитозом при интенсивном гемолизе в крови обнаруживаются ядросодержащие эритроидные клетки (эритрокариоциты), обнаруживаемые в норме только в костном мозге. Наличие или отсутствие гипербилирубинемии определяется, с одной стороны, интенсивностью гемолиза, а с другой – функциональной способностью печени связывать билирубин с глюкуроновой кислотой и экскретировать его в желчь. Поэтому нормальные показатели содержания билирубина в крови не исключают гемолиза. При некоторых ГА, сопровождающихся внутрисосудистым гемолизом (болезнь Маркиафавы, аутоиммунные ГА), в крови увеличивается содержание свободного гемоглобина, выделяющегося с мочой в виде гемосидерина. Последний может быть обнаружен в моче с помощью бензидиновой пробы (аналогичной исследованию скрытой крови в кале) или при окраске осадка мочи на выявление гемосидерина. Эти информативные тесты должны чаще использоваться в лабораторной практике при подозрении на внутрисосудистый гемолиз.
Наследственные ГА связаны с различными генетическими дефектами, в частности с дефектом мембраны эритроцитов (наследственный микросфероцитоз, овалоцитоз), дефицитом некоторых ферментов в эритроцитах (глюкозо-6-фосфат-дегидрогеназа, пируваткиназа и др.), нарушением синтеза цепей глобина (талассемия), наличием нестабильных гемоглобинов.
Среди приобретенных ГА наиболее распространенными являются аутоиммунные ГА (симптоматические и идиопатические). Симптоматические аутоиммунные ГА возникают на фоне лимфопролиферативных заболеваний (хронический лимфолейкоз, лимфогранулематоз и др.), системных васкулитов (системная красная волчанка, ревматоидный артрит), хронического активного гепатита, некоторых инфекций, в частности, вирусных, при приеме ряда медикаментов (альфа-метилдопа). Если причина аутоиммунного гемолиза не выявляется, то говорят об идиопатических ГА. К приобретенным ГА относятся болезнь Маркиафавы (перманентный внутрисосудистый гемолиз), микроангиопатические ГА (гемолиз вследствие ДВС-синдрома на фоне различных заболеваний), механический гемолиз при протезированных сосудах и клапанах сердца, маршевой гемоглобинурии, ГА при воздействии различных токсических веществ (уксусная кислота, мышьяк и др.).
При наличии соответствующих подозрений уточнению причины ГА, т.е. нозологической диагностике, могут способствовать следующие исследования:
2. Анемии при костномозговой недостаточности
В основе данного патогенетического варианта анемий лежит нарушение нормальной продукции эритроидных клеток в костном мозге. При этом часто одновременно с угнетением эритропоэза имеется нарушение продукции клеток гранулоцитарного и тромбоцитарного ростков, что отражается на составе периферической крови (панцитопения) и служит ориентиром в распознавании возможного механизма развития анемии.
Критерии анемии при костномозговой недостаточности:
Ключевой особенностью, позволяющей предположить данный патогенетический вариант анемий, является нарушение со стороны других ростков костного мозга (гранулоцитопения, тромбоцитопения), что может проявляться соответствующей клинической симптоматикой в виде инфекционных осложнений (часто отмечается только лихорадка) или геморрагического синдрома (зависит от выраженности тромбоцитопении). Уместно напомнить, что при В12-дефицитной анемии также может наблюдаться лейко- и тромбоцитопения, однако цитопении при этом выражены умеренно и обычно не сопровождаются описанными симптомами.
Анемия при костномозговой недостаточности может возникать при следующих заболеваниях и патологических процессах: острые и хронические лейкозы; метастазы злокачественных опухолей в костный мозг; замещение костного мозга фиброзной тканью (миелофиброз) вследствие различных причин; замещение костного мозга жировой тканью (апластическая анемия) вследствие различных причин; изолированное угнетение продукции эритроидных клеток костного мозга, чаще иммунной природы (парциальная красноклеточная анемия); миелодиспластический синдром (гетерогенная группа гематологических нарушений, одними из которых являются так называемые рефрактерные анемии).
Фактически с помощью исследования костного мозга (цитологического, гистологического) при данном патогенетическом варианте осуществляется нозологическая диагностика, хотя часто требуется уточнение формы и причины выявленных изменений.
В основе развития анемии может лежать так называемый миелодиспластический синдром (МДС), который является результатом приобретенного дефекта стволовой клетки-предшественницы миелопоэза, что приводит к нарушению нормальной дифференцировки клеток различных ростков костного мозга (эритроидного, гранулоцитарного, тромбоцитарного). В результате этого гемопоэз оказывается неэффективным, что в конечном счете проявляется цитопениями в различных сочетаниях. Неэффективность эритропоэза позволяет трактовать анемию при МДС как следствие костномозговой недостаточности. Основным признаком, позволяющим заподозрить МДС, является бедность клетками периферической крови в сочетании с высокой клеточностью костного мозга и признаками дисплазии всех ростков кроветворения. МДС встречается почти исключительно у больных пожилого и старческого возраста, характеризуется анемией, рефрактерной к лечению препаратами железа, витамином В12, фолиевой кислотой, повышением в костном мозге эритроидных клеток, содержащих железо (рефрактерная анемия с сидеробластами).
3. Анемия при уменьшении массы циркулирующих эритроцитов
Данный патогенетический вариант анемии отличается от остальных и характеризуется уменьшением количества эритроцитов и гемоглобина за счет уменьшения массы циркулирующей крови. Основной причиной развития данного варианта анемий являются острые кровопотери различной локализации.
Основные признаки анемии при уменьшении массы эритроцитов: