Гипертрофическая кардиомиопатия что это такое у взрослых
Что такое кардиомиопатия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Кузнецова Т. Н., кардиолога со стажем в 26 лет.
Определение болезни. Причины заболевания
Пусковым механизмом возникновения кардиомиопатии поначалу считали процесс воспаления в сердце, который мог быть спровоцирован вирусными, бактериальными и аутоиммунными повреждениями клеток. Исходя из этой теории, назначение антибиотиков, противовирусных и противовоспалительных препаратов должно было привести к регрессии повреждения и восстановлению функции сердца. Однако практика это не подтвердила.
Риск развития кардиомиопатий повышен у лиц с отягощённой наследственностью, а также после перенесённых острых инфекционных заболеваний. Для появления вторичных кардиомиопатий важно наличие системных аутоиммунных заболеваний, эндокринной патологии (сахарный диабет, тиреотоксикоз) и токсических факторов.
Первичные кардиомиопатии чаще выявляют в детском и молодом возрасте, вторичные же возможны в любом возрасте.
Симптомы кардиомиопатии
Специфических, характерных только для кардиомиопатии симптомов не существует. Именно эта особенность и затрудняет раннюю диагностику заболевания. Кардиомиопатия длительно протекает бессимптомно или малосимптомно, в развёрнутой стадии похожа по клинике на проявления ишемической болезни сердца, различных пороков сердца.
Первыми жалобами, с которыми пациенты обращаются к врачу, являются:
Патогенез кардиомиопатии
За последние годы благодаря возможностям генетики было установлено, что причиной многих кардиомиопатий являются генетические мутации, которые приводят к выработке дефектных белков кардиомиоцита. От того, какой белок рабочей клетки миокарда (кардиомиоцита) изменился, зависит развитие определённого вида кардиомиопатии.
Подобные изменения бывают также при наследственных нарушениях обмена веществ и лизосомальных болезнях накопления (редких заболеваниях, при которых нарушается функция внутриклеточных органелл лизосом). Из-за врождённой нехватки ферментов, перерабатывающих углеводсодержащие продукты, в организме накапливаются крупные молекулы гликогена, гликопротеина и др., которые повреждают организм. Таких заболеваний известно более сотни, но их распространённость невелика. Как правило, проявляются они в детском и молодом возрасте и помимо поражения сердца затрагивают практически весь организм: кости, мышцы, нервную систему, зрение и слух. Самыми изученными болезнями накопления являются гемохроматоз, болезнь Пике и болезнь Фабри.
Классификация и стадии развития кардиомиопатии
По мере накопления информации были выявлены самые распространённые типы кардиомиопатии и их семейные формы:
К редким формам кардиомиопатии относят также системные заболевания и патологические состояния, при которых возникают так называемые вторичные кардиомиопатии: диабетическая, тиреотоксическая, алкогольная, аутоиммунная и другие.
Исходя из причины развития болезни, становится ясным, что кардиомиопатии могут быть как изолированными – первичными, так и являться частью системного заболевания, т. е. быть вторичными.
В России традиционно применяется клинико-морфологическая классификация первичных кардиомиопатий, где кардиомиопатии разделяются на:
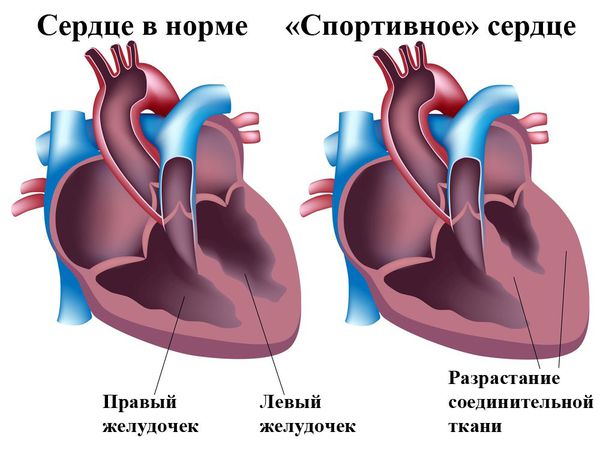
Анатомическая классификация гипертрофической кардиомиопатии в зависимости от локализации:
I. Гипертрофия левого желудочка:
В зависимости от наличия обструкции выносного тракта левого желудочка (область между межжелудочковой перегородкой и передней створкой митрального клапана) в покое и при нагрузке выделяют два типа гипертрофической кардиомиопатии :
К тяжело выявляемым видам относится аритмогенная дисплазия правого желудочка, при которой происходят структурные изменения в строении стенки правого желудочка — замещение кардиомиоцитов фиброзно-жировой тканью и развитие аритмии.
Неклассифицируемые кардиомиопатии: некомпактный миокард, стресс-индуцированная кардиомиопатия.
Вторичные (специфические) кардиомиопатии: при имеющемся известном заболевании тяжесть поражения сердца более выражена и не соответствует причине:
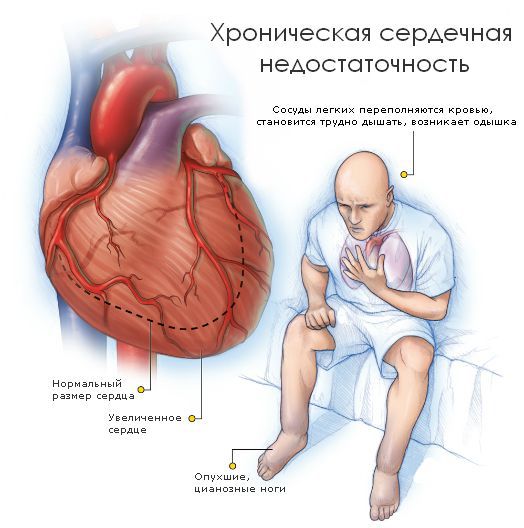
Осложнения кардиомиопатии
Особенности течения кардиомиопатии представляют угрозу для жизни. Болезнь может дебютировать сразу внезапной смертью или жизнеугрожающими аритмиями : фибрилляцей желудочков, желудочковой тахикардией. Высокий риск внезапной сердечной смерти связан с такими факторами риска, как:
С утяжелением недостаточности все симптомы становятся более выраженными. Выделяют пять стадий сердечной недостаточности:
Диагностика кардиомиопатии
Особых признаков, характерных для этого заболевания, при сборе жалоб и осмотре пациента выявить не удаётся.
При клиническом осмотре обращают на себя внимание признаки сердечной недостаточности различной степени выраженности, аритмии, возможны тромбоэмболические осложнения.
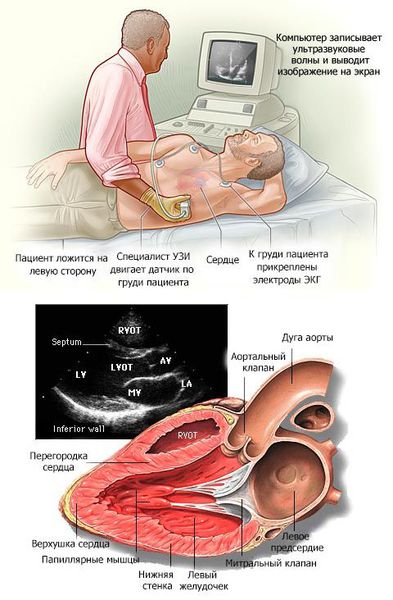
В основном кардиомиопатии выявляются при проведении эхокардиографии (ЭХОКГ) и электрокардиографии (ЭКГ). Дополнительно применяются рентгеноконтрастная вентрикулография и магнитно-резонансная томография (МРТ) с контрастированием гадолинием.
В современной кардиологии всё больше распространяются новые методы визуализации сердца и сосудов — например, магнитно-резонансная томография (МРТ). Но её недостатком является дороговизна оборудования и малая доступность методики из-за отсутствия качественного оборудовании и специалистов.
На стандартной ЭКГ также могут быть зарегистрированы изменения в виде признаков гипертрофии миокарда левого желудочка, а также признаки его перегрузки и различные нарушения ритма сердца.
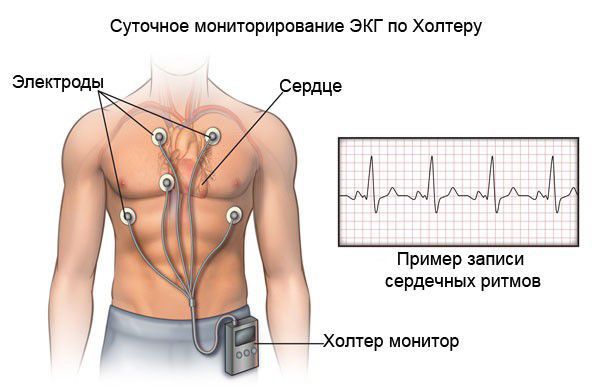
При холтеровском мониторировании ЭКГ также фиксируются нарушения ритма и проводимости практически в 100 % случаях. Выявление таких нарушении ритма сказывается на подборе базисной терапии кардиомиопатии.
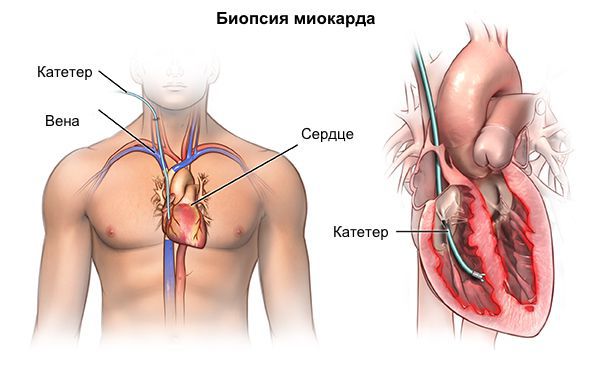
В особых случаях для уточнения диагноза редких форм кардиомиопатии (например, при амилоидозе) возможна прижизненная биопсия миокарда. Методика инвазивная, потенциально опасная для пациента, требует использования уникального комплекса аппаратуры и высочайшей квалификации специалистов, что возможно только в нескольких научных кардиологических центрах РФ.
Из лабораторных методов диагностики помимо стандартных анализов крови (клинического и биохимического), необходимо отметить ДНК-диагностику. Она является «золотым стандартом» при подозрении на кардиомиопатию согласно мировым (европейским и американским) руководствам. Этот подход на данный момент является практически единственным, который применим для раннего выявления и прогнозирования риска развития семейных форм кардиомиопатии. В России такой уровень диагностики возможен в единичных лабораториях и является дорогостоящей процедурой из-за своей уникальности.
Лечение кардиомиопатии
По современным представлениям стратегия лечения пациента определяется в процессе разделения больных на категории в зависимости от типа кардиомиопатии.
Все больные с выявленной кардиомиопатией, независимо от течения заболевания (в том числе и бессимптомные), нуждаются в динамическом наблюдении. Кратность наблюдения и объём обследований определяются индивидуально. В обязательный перечень входят стандартные анализы (клинический и биохимический анализ крови), ЭКГ, ЭХОКГ и холтеровское мониторирование ЭКГ.
Лечебная тактика зависит от множества факторов и подбирается индивидуально. При этом учитываются анатомические особенности — обструкция выносного тракта левого желудочка, растяжение полостей сердца, наличие клапанной патологи, стадия сердечной недостаточности и также сопутствующие заболевания. Необходимо выявлять факторы, повышающие риск внезапной смерти и жизнеугрожающих аритмий [15]
При дилатационной кардиомиопатии необходимо лечить причину развития растяжения полостей сердца, если это возможно. В медикаментозной терапии сердечной недостаточности применяют все стандартные группы лекарств:
Помимо лекарств в ряде случаев прибегают к хирургическим методам лечения кардиомиопатии.
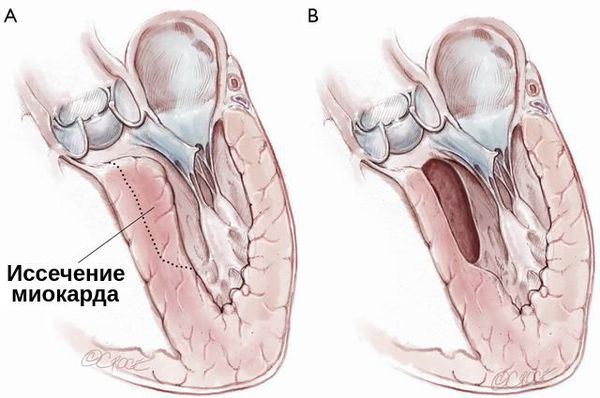
При гипертрофической кардиомиопатии применяется септальная миэктомия — иссечение миокарда, расположенного в основании межжелудочковой перегородки. Она может быть дополнена и вмешательством на изменённом митральном клапане: вальвулопластикой, протезированием митрального клапана и коррекцией кольца митрального клапана.
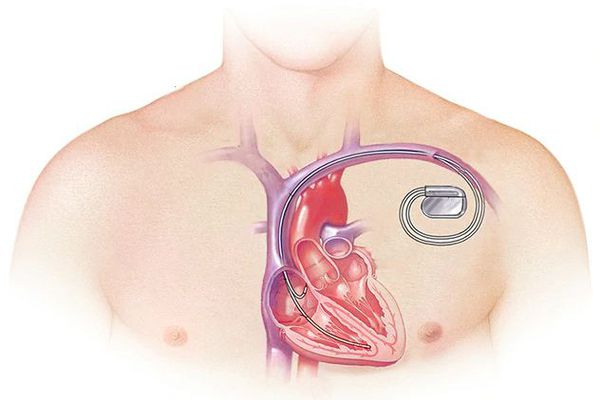
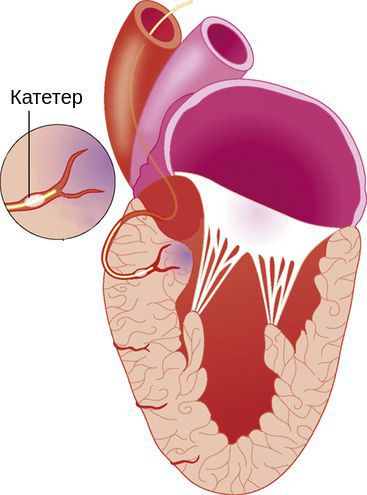
При тяжёлой обструктивной гипертрофической кардиомиопатии рассматривается проведение операции — иссечения части сердечной мышцы или более щадящая методика — чрескожная транслюминальная алкогольная абляция. При ней через катетер вводится до 3 мл 96 % спирта в зону максимальной гипертрофии миокарда и вызывается его инфаркт. Из-за этого мышца уменьшается в размере, исчезает препятствие (обструкция) току крови через митральное кольцо. Далее проводится установка кардиостимулятора для синхронизации работы всех отделов сердца. Эта процедура проводится кардиохирургами в специализированных отделениях.
Прогноз. Профилактика
Прогноз при гипертрофической кардиомиопатии также неблагоприятный, но смертность не такая высокая — в первый год умирают 1 % заболевших, чаще от внезапной смерти, обусловленной факторами риска (наследственностью, тахикардией, предшествующим обмороками, понижением давления).
При рестриктивной кардиомиопатии прогноз неблагоприятный, так как заболевание часто находят уже на поздней стадии развития. Лечение только симптоматическое и поддерживающее.
Для человека с выявленной кардиомиопатии частота посещений и обследований устанавливается индивидуально.
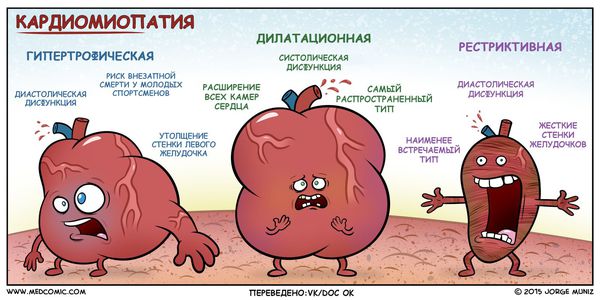
Гипертрофическая кардиомиопатия
Содержание
Что такое гипертрофическая кардиомиопатия?
Симптомы гипертрофической кардиомиопатии
Многие люди с ГКМП не имеют либо никаких признаков болезни, либо только незначительные симптомы, и живут нормальной жизнью. У других же пациентов симптомы могут прогрессировать и обостряться, ухудшая тем самым работу сердца. Симптомы гипертрофической кардиомиопатии могут возникнуть в любом возрасте и включают в себя:
Причины гипертрофической кардиомиопатии
ГКМП может быть как наследственной болезнью, связанной с мутацией генов, кодирующих синтез сократительных белков, так и болезнь, появляющаяся в процессе старения или из-за высокого кровяного давления. В некоторых случаях причины остаются неизвестными.
Диагностика гипертрофической кардиомиопатии
ГКМП диагностируется как на основе истории болезни (симптомы и семейная история), так и на основе медицинского осмотра и клинических анализов, таких как анализы крови, ЭКГ, рентген грудной клетки, эхокардиография (УЗИ сердца), стресс-тест, катетеризация сердца, КТ и МРТ.
Лечение гипертрофической кардиомиопатии
Лечение ГКМП показано лишь при наличии клиники либо факторов риска внезапной смерти. Лечение направлено на предотвращение симптомов и осложнений, и включает в себя выявление рисков, изменения образа жизни, приём лекарств. Также, по мере необходимости, врач кардиолог может назначить вам различные процедуры.
Рекомендации
Диета
Употребление большого количества жидкости имеет очень важное значение. Выпивайте по крайней мере от 6 до 8 стаканов воды в день. В жаркую погоду, следует увеличить потребление жидкости. Жидкость и ограничения в употреблении соли, необходимы для пациентов с сердечной недостаточностью. Посоветуйтесь с вашим лечащим врачом о принципах воздействия на ваш организм конкретных жидкостей и диетических напитков, включая информацию о воздействии алкоголя и кофеина.
Физические упражнения
Ваш врач подскажет, рекомендуется ли вам заниматься спортом или нет. Большинству людей с кардиомиопатией предлагаются легкие занятия аэробикой. Тем не менее, ваш врач, основываясь на симптомах и тяжести вашей болезни, может попросить вас воздержаться от каких либо физических нагрузок. Так же, как и при дилатационной кардиомиопатии, не рекомендуется поднятие тяжестей
Регулярное посещение врача
Пациенты с ГКМП минимум раз в год должны посещать врача кардиолога и контролировать свое состояние. Посещения врача могут быть более частыми, в том случае, когда гипертрофическая кардиомиопатия была диагностирована впервые.
Какие препараты используются для лечения гипертрофической кардиомиопатией?
Препараты, используемые для лечения симптомов и предотвращения дальнейшего осложнения ГКМП, снимают нагрузку с сердца и уменьшают препятствия для эффективной циркуляции крови в организме. При лечении гипертрофической кардиомиопатии используются также лекарства, в основе которых лежат бета-адреноблокаторы, способные снижать нагрузку на сердце за счет снижения давления и пульса, уменьшая гипертрофию миокарда. Также бета-блокаторы обладают антиаритмическим действием, в том числе способны уменьшить риск развития фатальных аритмий и внезапной смерти.
Врач может попросить вас избежать применения некоторых лекарственных препаратов, таких, как нитраты (они понижают кровяное давление) или дигоксин (он увеличивает силу сокращений сердца).
Ваш врач посоветует, какие лекарства вам больше всего подходят.
Хирургические процедуры, используемые для лечения гипертрофической кардиомиопатии
Хирургические методы, используемые для лечения ГКМП включают в себя:
Чрезаортальная септальная миэктомия. Данная методика предполагает уменьшение обструкции путем уменьшения толщины межжелудочковой перегородки.
Транскатетерная септальная алкогольная абляция. Введение склерозирующих веществ типа спиртовых растворов, создание в межжелудочковой перегородке зон инфаркта.
Имплантация искусственного митрального клапана сердца. Этот тип операции предлагается пациентам с высоким риском опасных для жизни аритмий и внезапной сердечной смерти. Митральный клапан постоянно отслеживает сердечный ритм. Когда он обнаруживает неправильный, очень быстрый ритм сердца, поставляя энергию в сердечную мышцу, он заставляет сердце биться в нормальном ритме.
Небольшое количество людей с HCM, подвержены повышенному риск внезапной сердечной смерти. Люди, которые входят в эту группу риска:
Если у вас присутствуют два или более факторов риска внезапной сердечной смерти, врач пропишет вам лекарства для предотвращения аритмии. У большинства пациентов с ГКМП риск внезапной сердечной смерти невелик. Поговорите со своим врачом о всех проблемах, с которыми вы можете столкнутся при гипертрофической кардиомиопатии.
Как предотвратить эндокардит?
Люди с обструктивным ГКМП могу быть подвержены повышенному риску инфекционного эндокардита, потенциально опасного для жизни состояния. Чтобы защитить себя, говорите на приёме у любого врача, в том числе у стоматолога, что у вас есть заболевание сердца.
Позвоните своему врачу, если у вас появились симптомы инфекции (боль в горле, слабость, лихорадка).
Позаботьтесь о ваших зубах и деснах, чтобы защититься от инфекций.
Принимайте антибиотики перед тем как подвергнуться каким-либо процедурам, которые могут вызвать кровотечение, таких как: стоматологическая помощь, анализы (любые анализы, которые могут быть связаны со сбором крови или которые могут вызвать кровотечение), хирургические операции. Проконсультируйтесь со своим врачом о типе и количестве антибиотика, который вам следует принять.
Современные подходы к лечению больных гипертрофической кардиомиопатией
Полувековая история изучения проблемы гипертрофической кардиомиопатии (ГКМП) отражает значительную эволюцию знаний в области этиологии, патогенеза, диагностики, клинического течения, прогноза и вариантов лечения этого заболевания. За указанный период тол
Полувековая история изучения проблемы гипертрофической кардиомиопатии (ГКМП) отражает значительную эволюцию знаний в области этиологии, патогенеза, диагностики, клинического течения, прогноза и вариантов лечения этого заболевания. За указанный период только в англоязычных изданиях опубликованы более 1000 крупных научных работ. ГКМП — одна из основных и, вероятно, наиболее распространенных форм кардиомиопатий, заболеваний миокарда, сопровождающихся его дисфункцией (Report of the 1995 WHO/ISFC Task Force on the Definition and Classification of Cardiomyopathy) [1].
В 2003 г. создан Международный комитет (ACC/ESC), объединивший американских и европейских экспертов по ГКМП, и опубликовано сообщение, суммировавшее основные положения, включая стратегию лечебных мероприятий [2].
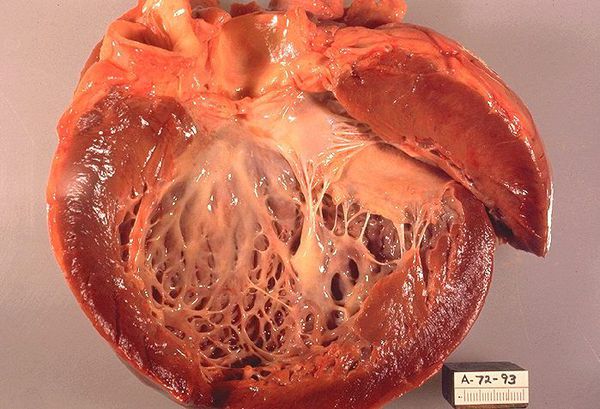
Определение заболевания носит описательный характер. Так, по современным представлениям, ГКМП является преимущественно генетически обусловленным заболеванием мышцы сердца, характеризующимся комплексом специфических морфофункциональных изменений и неуклонно прогрессирующим течением с высокой угрозой развития тяжелых, жизнеугрожающих аритмий и внезапной смерти (ВС). ГКМП характеризуется массивной гипертрофией миокарда левого и/или реже правого желудочка, чаще асимметричного характера за счет утолщения межжелудочковой перегородки (МЖП), нередко с развитием обструкции (систолического градиента давления) выходного тракта ЛЖ при отсутствии видимых причин (артериальная гипертония, пороки и специфические заболевания сердца). Основным методом диагностики остается эхокардиографическое исследование. В зависимости от наличия или отсутствия градиента систолического давления в полости ЛЖ, ГКМП разделяют на обструктивную и необструктивную, что имеет важное практическое значение при выборе тактики лечения. При этом различают 3 гемодинамических варианта обструктивной ГКМП: с субаортальной обструкцией в покое (так называемой базальной обструкцией); с лабильной обструкцией, характеризующейся значительными спонтанными колебаниями внутрижелудочкового градиента давления без видимой причины; с латентной обструкцией, которая вызывается только при нагрузке и провокационных фармакологических пробах (в частности, вдыханием амилнитрита, при приеме нитратов или внутривенном введении изопротеренола).
Типичными являются морфологические изменения: аномалия архитектоники сократительных элементов миокарда (гипертрофия и дезориентация мышечных волокон), развитие фибротических изменений мышцы сердца, патология мелких интрамиокардиальных сосудов [3, 4].
В настоящее время наблюдается повсеместный рост числа зарегистрированных случаев этой патологии как за счет внедрения в практику современных методов диагностики, так и, вероятно, в связи с истинным увеличением числа больных ГКМП [8, 9]. Согласно данным последних исследований, распространенность заболевания в общей популяции является более высокой, чем считалось ранее, и составляет 0,2% [10, 11]. ГКМП может диагностироваться в любом возрасте, от первых дней до последней декады жизни, однако преимущественно заболевание выявляется у лиц молодого трудоспособного возраста [12, 13]. Ежегодная смертность больных ГКМП колеблется в пределах от 1 до 6%: у взрослых больных составляет 1–3% [14, 15], а в детском и подростковом возрасте у лиц с высоким риском ВС — 4–6% [16, 17].
Общепризнанна концепция о преимущественно наследственной природе ГКМП [18, 19]. В литературе широкое распространение получил термин «семейная гипертрофическая кардиомиопатия». К настоящему времени установлено, что более половины всех случаев заболевания являются наследуемыми [20, 21], при этом основной тип наследования — аутосомно-доминантный. Оставшиеся приходятся на так называемую спорадическую форму; в этом случае у пациента нет родственников, болеющих ГКМП или имеющих гипертрофию миокарда. Считается, что большинство, если не все случаи спорадической ГКМП, также имеют генетическую причину, т. е. вызваны случайными мутациями.
ГКМП — это генетически гетерогенное заболевание, причиной которого являются более 200 описанных мутаций нескольких генов, кодирующих белки миофибриллярного аппарата [2, 22]. К настоящему времени известны 10 белковых компонентов сердечного саркомера, выполняющих контрактильную, структурную или регуляторную функции, дефекты которых наблюдаются при ГКМП. Причем в каждом гене множество мутаций могут становиться причиной заболевания (полигенное мультиаллельное заболевание).
Наличие той или иной ассоциированной с ГКМП мутации признается «золотым» стандартом диагностики заболевания. При этом описанные генетические дефекты характеризуются разной степенью пенетрантности, выраженностью морфологических и клинических проявлений. Тяжесть клинической картины зависит от присутствия и степени гипертрофии. Мутации, которые ассоциируются с высокой пенетрантностью и плохим прогнозом, выражаются большей гипертрофией левого желудочка и толщиной МЖП, чем те, которые характеризуются низкой пенетрантностью и имеют хороший прогноз. Так, было показано, что лишь отдельные мутации ассоциированы с плохим прогнозом и высокой частотой ВС. К ним относятся замены Arg 403 Gln, Arg 453 Cys, Arg 719 Trp, Arg 719 Gln, Arg 249 Gln в гене тяжелой цепи β-миозина, InsG 791 в гене миозин-связывающего белка С и Asp 175 Asn в гене α-тропомиозина [23, 24, 25, 26]. Для мутаций в гене тропонина Т характерна умеренная гипертрофия миокарда, однако прогноз достаточно неблагоприятен, а вероятность внезапной остановки сердца высока [27]. Другие генетические аномалии, как правило, сопровождаются доброкачественным течением и благоприятным прогнозом или занимают промежуточное положение по тяжести вызываемых ими проявлений.
Таким образом, ГКМП характеризуется крайней гетерогенностью вызывающих ее причин, морфологических, гемодинамических и клинических проявлений, разнообразием вариантов течения и прогноза, что существенно затрудняет выбор адекватных и наиболее эффективных лечебных подходов по контролю и коррекции имеющихся нарушений. При этом отчетливо выделяются 5 основных вариантов течения заболевания и исходов:
Вариабельность прогноза определяет необходимость детальной стратификации риска фатальных осложнений заболевания, поиск доступных прогностических предикторов и критериев оценки проводимого лечения.
По современным представлениям, лечебная стратегия определяется в процессе разделения больных на категории в зависимости от описанных выше вариантов течения и прогноза (рис.).
Все лица с ГКМП, включая носителей патологических мутаций без фенотипических проявлений болезни и пациентов с бессимптомным течением заболевания, нуждаются в динамическом наблюдении, в ходе которого оцениваются характер и выраженность морфологических и гемодинамических нарушений. Особое значение имеет выявление факторов, определяющих неблагоприятный прогноз и повышенный риск ВС (в частности, скрытых прогностически значимых аритмий).
К общим мероприятиям относятся ограничение значительных физических нагрузок и запрещение занятий спортом, способных вызывать усугубление гипертрофии миокарда, повышение внутрижелудочкового градиента давления и риска ВС. Для предупреждения инфекционного эндокардита в ситуациях, связанных с развитием бактериемии, при обструктивных формах ГКМП рекомендуется антибиотикопрофилактика, аналогичная таковой у больных с пороками сердца.
До настоящего времени окончательно не решен вопрос о необходимости проведения активной медикаментозной терапии у наиболее многочисленной группы больных с бессимптомной или малосимптомной формами ГКМП и низкой вероятностью ВС. Противники активной тактики обращают внимание на то, что при благоприятном течении заболевания продолжительность жизни и показатели смертности не отличаются от таковых в общей популяции [28, 29]. Некоторые же авторы указывают на то, что использование в этой группе пациентов β-адреноблокаторов и антагонистов кальция (верапамил) может приводить к сдерживанию гемодинамических нарушений и клинической симптоматики [30, 31]. При этом никто не оспаривает тот факт, что выжидательная тактика в случаях бессимптомного или малосимптомного течения ГКМП возможна лишь при отсутствии признаков внутрижелудочковой обструкции, обмороков и серьезных нарушений сердечного ритма, отягощенной наследственности и случаев ВС у близких родственников.
Следует признать, что лечение ГКМП, генетически обусловленного заболевания, обычно распознаваемого на поздней стадии, пока может быть в большей степени симптоматическим и паллиативным. Тем не менее к основным задачам лечебных мероприятий относятся не только профилактика и коррекция основных клинических проявлений заболевания с улучшением качества жизни пациентов, но и положительное влияние на прогноз, предупреждение случаев ВС и прогрессирования заболевания.
Основу медикаментозной терапии ГКМП составляют препараты с отрицательным инотропным действием: β-адреноблокаторы и блокаторы кальциевых каналов (верапамил). Для лечения весьма распространенных при этом заболевании нарушений сердечного ритма используются также дизопирамид и амиодарон.
β-адреноблокаторы стали первой и остаются и по сей день наиболее эффективной группой лекарственных средств, применяемых в лечении ГКМП. Они оказывают хороший симптоматический эффект в отношении основных клинических проявлений: одышки и сердцебиения, болевого синдрома, включая стенокардию, не менее чем у половины больных ГКМП [32, 33, 34], что обусловлено, в основном, способностью этих препаратов уменьшать потребность миокарда в кислороде. Благодаря отрицательному инотропному действию и уменьшению активации симпатоадреналовой системы при физическом и эмоциональном напряжении, β-блокаторы предотвращают возникновение или повышение субаортального градиента давления у больных с латентной и лабильной обструкцией, существенно не влияя на величину этого градиента в покое. Убедительно показана способность β-блокаторов улучшать функциональный статус пациентов в условиях курсового и длительного применения [35]. Хотя препараты не оказывают прямого влияния на диастолическое расслабление миокарда, они могут улучшать наполнение ЛЖ косвенно — за счет уменьшения частоты сердечных сокращений и предупреждения ишемии сердечной мышцы [36]. В литературе имеются данные, подтверждающие способность β-блокаторов сдерживать и даже приводить к обратному развитию гипертрофии миокарда [37, 38]. Однако другие авторы подчеркивают, что вызываемое β-блокаторами симптоматическое улучшение не сопровождается регрессией гипертрофии ЛЖ и улучшением выживаемости больных [39]. Хотя эффект этих препаратов в отношении купирования и предупреждения желудочковых и суправентрикулярных аритмий и внезапной смерти не доказан, ряд специалистов все же считают целесообразным их профилактическое назначение больным ГКМП высокого риска, включая пациентов молодого возраста с отягощенным случаями внезапной смерти семейным анамнезом [40].
Предпочтение отдается β-блокаторам без внутренней симпатомиметической активности. Наибольший опыт накоплен по применению пропранолола (обзидан, анаприлин). Его назначают начиная с 20 мг 3-4 раза в день, с постепенным увеличением дозы под контролем пульса и артериального давления (АД) до максимально переносимой в большинстве случаев 120–240 мг/сут. Следует стремиться к применению возможно более высоких доз препарата, так как отсутствие эффекта терапии β-блокаторами, вероятно, связано с недостаточной дозировкой. При этом нельзя забывать о том, что повышение дозировок существенно увеличивает риск известных побочных эффектов.
В настоящее время широко изучается возможность эффективного применения нового поколения кардиоселективных β-блокаторов пролонгированного действия, в частности атенолола, конкора и др. При этом существует мнение о том, что кардиоселективные β-блокаторы у больных ГКМП не имеют преимуществ перед неселективными, так как в больших дозах, к достижению которых следует стремиться, селективность практически утрачивается. Следует отметить, что рекомендуемый к применению у больных ГКМП с тяжелыми суправентрикулярными и желудочковыми аритмиями соталол сочетает в себе свойства неселективных β-блокаторов и антиаритмических средств III класса (кордароноподобный эффект).
Применение блокаторов медленных кальциевых каналов при ГКМП основано на снижении уровня свободного кальция в кардиомиоцитах и нивелировании асинхронии их сокращения, улучшении расслабления миокарда и снижении его сократимости, подавлении процессов гипертрофии миокарда. Среди блокаторов кальциевых каналов препаратом выбора, благодаря наибольшей выраженности отрицательного инотропного действия и наиболее оптимальному профилю фармакологических свойств, является верапамил (изоптин, финоптин). Он обеспечивает симптоматический эффект у 65–80% больных, включая случаи рефрактерности к лечению β-блокаторами, что обусловлено способностью препарата уменьшать ишемию миокарда, в том числе безболевую, и улучшать его диастолическое расслабление и податливость ЛЖ [41, 42, 43]. Это свойство верапамила обеспечивает повышение толерантности больных к физической нагрузке и снижение субаортального градиента давления в покое при меньшей по сравнению с β-блокаторами способности к уменьшению внутрижелудочковой обструкции в случаях физического и эмоционального напряжения и провокации изопротеренолом. Одновременно верапамил снижает периферическое сосудистое сопротивление вследствие вазодилататорного действия [44]. И хотя этот эффект чаще всего нивелируется непосредственным положительным влиянием на диастолическую функцию ЛЖ, у отдельных больных с базальной внутрижелудочковой обструкцией в сочетании с повышенным конечно-диастолическим давлением ЛЖ и склонностью к системной артериальной гипотензии при уменьшении постнагрузки внутрижелудочковый градиент давления может резко возрастать. Это способно приводить к развитию отека легких, кардиогенного шока и даже внезапной смерти [45]. Подобные грозные осложнения фармакотерапии верапамилом описаны также у больных необструктивной ГКМП с высоким давлением в левом предсердии, у которых они обусловлены отрицательным инотропным действием препарата. Очевидно, как важно соблюдать осторожность при начале лечения верапамилом этой категории больных. Прием препарата следует начинать в условиях стационара с малых доз — 20–40 мг 3 раза в день с постепенным их повышением при хорошей переносимости до снижения частоты сердечных сокращений в покое до 50–60 уд/мин. Клинический эффект наступает обычно при приеме не менее 160–240 мг препарата в сутки; более удобны в условиях длительного применения пролонгированные формы (изоптин-ретард, верогалид-ретард). С учетом благоприятного влияния верапамила на диастолическую функцию и величину субаортального градиента давления в ЛЖ, а также доказанной способности увеличивать выживаемость больных ГКМП по сравнению с плацебо [46], целесообразно его профилактическое назначение у асимптоматичных больных ГКМП высокого риска.
Место дилтиазема в лечении ГКМП окончательно не определено. Имеются данные, что в средней дозе 180 мг/сут за 3 приема он оказывает столь же выраженное, как 240 мг верапамила, благотворное влияние на диастолическое наполнение ЛЖ и одинаковый симптоматический эффект, однако в меньшей степени улучшает физическую работоспособность больных [47].
В нашей клинике продолжается проспективное наблюдение (от 1 до 5 лет) более 100 больных ГКМП. Больные были рандомизированы на 3 сопоставимые по количеству, полу, возрасту и тяжести клинических проявлений группы. Пациентам произвольно назначались атенолол или изоптин-ретард; в третьей группе преобладали лица с тяжелыми желудочковыми нарушениями ритма, и им был рекомендован прием соталола. Оценка эффективности различных вариантов медикаментозного лечения проводилась в условиях длительного (не менее 1 года) применения препаратов. Суточные дозы при двухкратном режиме приема титровались индивидуально и составили в среднем 85, 187, 273 мг для атенолола, изоптина и соталола соответственно. Длительная терапия привела к улучшению клинического состояния соответственно у 77, 72 и 83% пациентов каждой группы, что выражалось в достоверном уменьшении основных симптомов, проявлений сердечной недостаточности (СН), увеличении мощности и времени выполненной нагрузки и улучшении показателей качества жизни (на 25, 32 и 34% соответственно). При этом выявлены достоверное (p
С. А. Габрусенко, кандидат медицинских наук
Ю. В. Сафрыгина
В. Г. Наумов, доктор медицинских наук, профессор
Ю. Н. Беленков, доктор медицинских наук, профессор
НИИ кардиологии им. А. Л. Мясникова РК НПК МЗ РФ, Москва