Гипогонадизм у мужчин что это лечение
Гипогонадизм
Гипогонадизм – синдром, сопровождающийся недостаточностью функций половых желез и нарушением синтеза половых гормонов. Гипогонадизм, как правило, сопровождается недоразвитием наружных или внутренних половых органов, вторичных половых признаков, расстройством жирового и белкового обмена (ожирением или кахексией, изменениями костной системы, сердечно-сосудистыми нарушениями). Диагностика и терапия гипогонадизма осуществляется совместной работой эндокринологов, гинекологов и гинекологов-эндокринологов (у женщин), андрологов (у мужчин). Основу лечения гипогонадизма составляет заместительная гормональная терапия. При необходимости проводится хирургическая коррекция, пластика и протезирование половых органов.
Общие сведения
Гипогонадизм – синдром, сопровождающийся недостаточностью функций половых желез и нарушением синтеза половых гормонов. Гипогонадизм, как правило, сопровождается недоразвитием наружных или внутренних половых органов, вторичных половых признаков, расстройством жирового и белкового обмена (ожирением или кахексией, изменениями костной системы, сердечно-сосудистыми нарушениями). Различают мужской и женский гипогонадизм.
Гипогонадизм у мужчин
Классификация гипогонадизма у мужчин
Гипогонадизм делится на первичный и вторичный. Первичный гипогонадизм вызван нарушением функции тестикулярной ткани вследствие дефекта самих яичек. Хромосомные нарушения могут приводить к аплазии или гипоплазии тестикулярной ткани, что проявляется отсутствием секреции андрогенов или их недостаточностью для нормального формирования половых органов и вторичных половых признаков.
Различают также гипогонадотропный, гипергонадотропный и нормогонадотропный гипогонадизм. Гипергонадотропный гипогонадизм проявляется первичным поражением тестикулярной ткани яичек в сочетании с повышенным уровнем гонадотропных гормонов гипофиза. Гипогонадотропный и нормогонадотропный гипогонадизм возникают при поражении гипоталамо-гипофизарной системы. Гипогонадотропный гипогонадизм связан со снижением секреции гонадотропинов, в результате чего уменьшается выработка андрогенов тестикулярной тканью яичек. Нормогонадотропный гипогонадизм вызван гиперпролактинемией, проявляется нормальным уровнем гонадотропинов и сниженной тестикулярной функцией яичек.
Как первичный, так и вторичный гипогонадизм могут быть врожденными и приобретенными. Проявлением гипогонадизма могут служить некоторые формы мужского бесплодия (от 40 до 60% всех случаев мужского бесплодия). В зависимости от возраста развития недостаточности половых гормонов различаются эмбриональная, допубертатная (от 0 до 12 лет) и постпубертатная формы гипогонадизма.
Врожденный первичный (гипергонадотропный) гипогонадизм встречается:
Приобретенный первичный гипогонадизм развивается в результате воздействия на яички внутренних или внешних факторов после рождения.
Врожденный вторичный (гипогонадотропный) гипогонадизм развивается при состояниях:
Приобретенный вторичный гипогонадизм развивается при:
Причины и механизмы развития гипогонадизма у мужчин
Недостаточность андрогенов может быть вызвана снижением количества вырабатываемых гормонов или нарушением их биосинтеза в результате патологии самих яичек или нарушения гипоталамо-гипофизарной регуляции.
Этиологическими факторами первичного гипогонадизма нередко служат:
Некоторые случаи первичного гипогонадизма являются идиопатическими. Современная эндокринология не располагает достаточными данными об этиологии идиопатического гипогонадизма.
При первичном гипогонадизме происходит снижение уровня андрогенов в крови, развитие компенсаторной реакции надпочечников на гипоандрогенизацию, возрастание продукции гонадотропинов.
К вторичному гипогонадизму приводят нарушения гипоталамо-гипофизарной регуляции (воспалительные процессы, опухоли, сосудистые нарушения, патология эмбрионального развития). Развитие гипогонадизма могут вызывать аденомы гипофиза, продуцирующие гормон роста (при акромегалии) или адренокортикотропный гормон (при болезни Кушинга), пролактинома, послеоперационная или посттравматическая гипоталамо-гипофизарная дисфункция, гемохроматоз, процессы старения, сопровождающиеся возрастным снижением уровня тестостерона крови.
При вторичном гипогонадизме отмечается низкий уровень гонадотропинов, приводящий к уменьшению секреции андрогенов яичками.
Одной из форм мужского гипогонадизма является снижение продукции спермы при нормальном уровне тестостерона, а также крайне редкие случаи снижения уровня тестостерона без уменьшения продукции спермы.
Симптомы гипогонадизма у мужчин
Клинические проявления гипогонадизма обусловлены возрастом возникновения заболевания и степенью андрогенной недостаточности. Нарушение продукции андрогенов во внутриутробном периоде может приводить к развитию двуполых наружных половых органов.
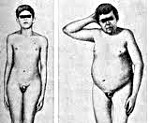
Если поражение яичек произошло у мальчиков в допубертатном периоде, происходит задержка полового развития, формируется типичный евнухоидизм: непропорционально высокий рост, связанный с запаздыванием окостенения эпифизарных (ростовых) зон, неразвитая грудная клетка и плечевой пояс, длинные конечности, слаборазвитая скелетная мускулатура. Может отмечаться развитие ожирения по женскому типу, истинной гинекомастии, гипогенитализма, что проявляется в малом размере полового члена, отсутствии пигментации и складчатости мошонки, гипоплазии яичек, недоразвитии предстательной железы, отсутствии оволосения на лице и лобке, недоразвитии гортани, высоком голосе.
В случаях вторичного гипогонадизма часто возникает ожирение, возможна симптоматика гипофункции коры надпочечников, щитовидной железы, проявления пангипопитуитаризма, отсутствие полового влечения и потенции.
Если снижение функции яичек развивается после завершения полового созревания, то симптомы гипогонадизма выражены слабее. Наблюдается уменьшение размеров яичек, незначительное оволосение лица и тела, жировые отложения по женскому типу, потеря эластичности и истончение кожи, бесплодие, снижение половой функции, вегетативно-сосудистые нарушения.
Уменьшение яичек наблюдается почти во всех случаях мужского гипогонадизма (исключение – если заболевание началось недавно). Уменьшение размеров яичек обычно тесно связано с уменьшением выработки спермы. При утрате спермопродуцирующей функции яичек развивается бесплодие с прекращением продукции тестостерона, снижается либидо, возникает регрессия вторичных половых признаков, эректильная дисфункция, отмечаются генерализованные симптомы (снижение мышечной силы, утомляемость, общая слабость).
Диагностика гипогонадизма у мужчин
Основывается на жалобах пациента, данных анамнеза, исследовании общего статуса с использованием антропометрии, осмотре и пальпации гениталий, оценке клинических симптомов гипогонадизма, степени полового созревания.
По данным рентгенологического исследования оценивается костный возраст. Для определения минеральной насыщенности костей проводится денситометрия. При рентгенографии турецкого седла определяются его размеры и наличие опухоли. Оценка костного возраста позволяет по срокам окостенения лучезапястного сустава и кисти достаточно точно определить начало полового созревания. Начало полового созревания связывают с формированием сесамовидной кости в I пястно-фаланговом суставе (примерно в 13,5 — 14 лет). О полной половой зрелости свидетельствует появление анатомических синостозов. Этот признак дает возможность разграничить допубертатный возраст от пубертатного. Оценивая костный возраст, нужно учитывать возможность более раннего (для пациентов из южных районов) и позднего (для пациентов из северных районов) окостенения, а также то, что нарушение остеогенеза может быть обусловлено и другими факторами. При допубертатном гипогонадизме отмечается отставание на несколько лет «костного» возраста от паспортного.
Лабораторное исследование анализа спермы (спермограмма) при гипогонадизме характеризуется азо- или олигоспермией; иногда эякулят получить не удается. Проводится измерение уровня половых и гонадотропинов: сывороточного тестостерона (общего и свободного), лютеинизирующего, фолликулостимулирующего гормона и гонадолиберина, а также антимюллеровского гормона сыворотки крови, пролактина, эстрадиола. Содержание тестостерона в крови снижено.
Лечение гипогонадизма у мужчин
Лечение гипогонадизма зависит от его клинической формы, выраженности нарушений в гипоталамо-гипофизарной и половой системах, сопутствующих патологий, времени возникновения болезни и возраста постановки диагноза. Терапию гипогонадизма начинают с лечения основного заболевания. Лечение взрослых пациентов состоит в коррекции недостаточности андрогенов и половой дисфункции. Бесплодие, возникшее на фоне врожденного и допубертатного гипогонадизма неизлечимо, особенно в случае аспермии.
Гипогонадизм у женщин
Дефицит эстрогенов вызывает недоразвитие и атрофические изменения женских половых органов, молочных желез, первичную аменорею. Если нарушение в яичниках возникло в допубертатный период, то вторичные половые признаки отсутствуют.
Причинами первичного гипергонадотропного гипогонадизма являются врожденное генетическое нарушение (синдром Шерешевского-Тернера), врожденная гипоплазия яичников, инфекционные процессы (сифилис, туберкулез, эпидемический паротит), ионизирующее излучение (лучевое, рентгеновское), оперативное удаление яичников, аутоиммунное поражение яичников (аутоиммунный оофорит), синдром тестикулярной феминизации (врожденное состояние, при котором внешний вид человека соответствует женщине при мужском генотипе), синдром поликистозных яичников.
Вторичный женский гипогонадизм (гипогонадотропный) возникает при гипоталамо-гипофизарной патологии, характеризуется дефицитом или полным прекращением синтеза и секреции гонадотропинов, регулирующих функцию яичников. Развивается вследствие воспалительных процессов в головном мозге (энцефалит, менингит, арахноидит), повреждающего действия опухолей головного мозга и сопровождается снижением стимулирующего действия гонадотропинов на функцию яичников.
Симптомы гипогонадизма у женщин
Один из основных симптомов гипогонадизма в детородном периоде – нарушение менструального цикла и аменорея. Недостаток женских половых гормонов ведет к недоразвитию половых признаков: гениталий, молочных желез, нарушению отложения жировой клетчатки по женскому типу, скудному оволосению. Если заболевание врожденное, или оно возникло в раннем детском возрасте, то вторичные половые признаки отсутствуют. Характерны узкий таз и плоские ягодицы. Если гипогонадизм развился в пуберантном периоде, половые признаки, которые уже успели развиться, сохраняются, но менструации прекращаются, ткани женских гениталий подвергаются атрофии.
Диагностика гипогонадизма у женщин
При гипогонадизме наблюдается заметное снижение содержания эстрогенов в крови, повышение уровня гонадотропинов (фолликулостимулирующего и лютеинизирующего гормонов). Ультразвуковое исследование выявляет матку, уменьшенную в размерах (гипоплазия матки), уменьшенные яичники. Рентгенография обнаруживает остеопороз или задержку формирования скелета.
Лечение гипогонадизма у женщин
Прогноз для жизни при гипогонадизме – благоприятный. Профилактика гипогонадизма состоит в медико-санитарном просвещении населения, наблюдении беременных женщин и охране их здоровья.
Методы лечения гипогонадизма. Прошлое, настоящее и будущее
Т.В. Шатылко,
К.м.н., уролог, онкоуролог, андролог. Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова (руководитель отделения андрологии и урологии – д.м.н., профессор С.И. Гамидов) (г. Москва)
Темой программы «Час с ведущим урологом» стал мужской гипогонадизм и перспективные методы его лечения. Гость программы Т.В. Шатылко выразил надежду, что единые подходы к диагностике и интерпретированию уровня тестостерона позволят выработать общие взгляды на лечение пациентов с гипогонадизмом.
Как рассказал Тарас Викторович, первым на эту тему в эндокринологии стал эксперимент Бертольда. Арнольд Бертольд, научный куратор зоопарка в Германии, заметил в 1849 г., что кастрированные петухи не дерутся, не поют и не пытаются топтать кур, а их гребень постоянно регрессирует. Ориентируясь на эксперименты Джона Хантера, выполненные в XVIII в., Бертольд выполнял реимплантацию яичек каплунам. При этом обычное поведение петухов восстанавливалось, а гребень снова начинал расти. Экспериментатор пришел к выводу, что «яички влияют на кровь, а кровь влияет на весь организм».
Следующим заявил о себе Шарль Броун-Секар, практиковавший применение тестикулярных экстрактов. В 1889 г. 72-летний ученый выступил перед Парижским биологическим обществом и заявил, что омолодил себя с помощью инъекций экстракта яичек собак и морских свинок. «Во мне произошли радикальные перемены. Полностью вернулась ко мне старая сила. Мои члены решительно вернули себе силу. Что касается способности к интеллектуальному труду, то возврат к моим прежним способностям полностью проявился уже через два или три дня экспериментов», – говорилось в сообщении Броун-Секара в журнале Lancet. Такой результат, скорее всего, объяснялся эффектом плацебо, однако исследователь предпринял одну из первых попыток заместительной гормональной терапии.
В 1920-х гг. Серж Воронов во Франции и другие хирурги по всему свету выполняли трансплантацию яичек, в том числе ксенотрансплантацию. В Советском Союзе Валерий Иванович Шумаков и другие трансплантологи выполняли операции по трансплантации яичка, которые позволяли восстановить уровень тестостерона в крови. Единственная трансплантация яичка, которая привела к восстановлению фертильности, была выполнена Шерманом Силбером в 1970-х гг. Донор и реципиент были однояйцевыми близнецами.
Поиск медикаментозной терапии при гипогонадизме в примитивном виде велся еще в средневековье и Новое время: женщинам из бесплодных пар иногда рекомендовали принимать мочу беременных животных. В 1910 г. Самюэль Джеймс Кроу и Харви Кушинг обнаружили, что без гипофиза половое созревание у животных не происходит. Александр Богданов, проводивший опыты по переливанию крови, предполагал, что химические факторы, присутствующие в донорской крови, могут приводить к омоложению пациента. В 1929 г. Бернхард Зондек открыл «пролан-А» и «пролан-Б», которые сегодня носят названия лютеинизирующего (ЛГ) и фолликуло-стимулирующего (ФСГ) гормонов. Сейчас он известен как человек, предложивший тест на беременность.
Также в 1920-х гг. был популярен препарат «Тестифортан», в состав которого входили экстракт яичек и йохимбин. Через несколько десятилетий в него был добавлен 17-альфа-метилтестостерон. В 1930 г. Леве и Фосс предложили тест для поиска так называемого «андрокинина», который заключался в оценке толщины эпителия семенных пузырьков лабораторных животных. В 1931 г. Альфред Бутенан выделил 15 мг первого мужского полового стероида (андростерон) из 15 тыс. л мочи берлинских полицейских.
Определение гипогонадизма до сих пор регулярно меняется в европейских клинических рекомендациях. Сейчас в них указано, что мужской гипогонадизм – это нарушение, ассоциированное со снижением функциональной активности яичек, сопровождающееся снижением продукции андрогенов и/или нарушением выработки сперматозоидов.
При лечении гипогонадизма предпочтение следует отдавать немедикаментозным методам и прежде всего проводить замену лекарственных препаратов, способных вызывать снижение уровня тестостерона. К ним относятся:
Нужно отметить, что заместительная терапия на сегодня одобрена FDA только для органического гипогонадизма. При функциональном гипогонадизме главным вариантом помощи остается изменение образа жизни. По некоторым данным, одна поведенческая терапия в 85% случаев дает положительный эффект. В частности, снижение массы тела помогает при гипогонадизме, ассоциированном с ожирением. С этой целью могут применяться низкокалорийная диета, физические упражнения и бариатрические операции [1–3]. К примеру, у кроликов с метаболическим синдромом упражнения уменьшали проявления функционального гипогонадизма, но также у них введение тестостерона облегчало выполнение физических упражнений.
Золотым стандартом остается тестостерон-заместительная терапия. Ее цель – поддержание уровня тестостерона в рамках физиологического диапазона, насколько это возможно. Использование неизмененной молекулы тестостерона позволяет добиться плейотропного эффекта по всему спектру активности естественного гормона и его метаболитов: сексуальная функция, либидо, состояние скелета и мышечной ткани, гемопоэз, когнитивная функция и т. д., кроме сперматогенеза.
Возникает вопрос, отчего не использовать тестостерон перорально: он хорошо всасывается в кишечнике и практически полностью метаболизируется печенью. Однако следует помнить, что для того, чтобы создать адекватную концентрацию тестостерона в крови, требуется пероральный прием около 500 мг тестостерона ежедневно. Кроме того, возможны непредсказуемые эффекты метаболитов и даже повреждение печени. Чуть большей переносимостью при пероральном приеме обладает ундеканоат тестостерона. Вместе с тем добавление тяжелой алифатической цепи приводит к тому, что эфир тестостерона всасывается преимущественно в лимфу. Требуется прием 2–4 капсул (25 мг) в день, что приводит к значительным антифизиологичным суточным колебаниям.
Еще одним вариантом пероральной заместительной терапии является прием метилированного тестостерона, или флуоксиместерона. Метильная группа замедляет метаболизм за счет стерического эффекта. Продукт ароматизации метилтестостерона – метилэстрадиол более стабилен, чем нативный эстрадиол, а атом фтора делает флуоксиместерон резистентным к ароматазе [4]. Флуоксиместерон нарушает соотношение активности глюкокортикоидов и минералокортикоидов [5]. В итоге при приеме этого препарата наблюдается выраженное эстрогенное воздействие. Кроме того, он крайне гепатотоксичен и, как следствие, запрещен во многих странах.
Также заслуживают упоминания препараты дигидротестостерона, в частности андростанолон – «чистый» андроген. Трансдермальная биодоступность таких препаратов составляет порядка 10%. Может применяться как гель, так и раствор для внутримышечных инъекций. Препарат практически не обладает анаболической активностью и не ароматизируется. Некоторые эксперты рекомендуют применение геля перед реконструктивными операциями при гипоспадии.
Хороший биодоступностью и стерическим эффектом обладает местеролон. Кроме того, у него низкий потенциал для гепатотоксичности и минимальная анаболическая активность благодаря вытеснению нативного тестостерона из связи с ГСПГ. Ароматизация практически отсутствует. Применение обосновано только при дефиците 5-альфа-редуктазы. Не подходит для полноценной заместительной терапии.
Также заслуживает упоминания дегидроэпиандростерон, DHEA, стероидпредшественник тестостерона и эстрадиола, парциальный агонист AR-рецепторов (при конкуренции с тестостероном и дигидротестостероном фактически работает как антагонист), агонист эстрогеновых рецепторов. DHEA-S, вероятно, обладает самостоятельной функцией как нейростероид. Заслуживает изучения как самостоятельный препарат, но не является альтернативой тестостерону в терапии гипогонадизма.
В тестостерон-заместительной терапии могут применяться букальные и гингивальные системы. Их аппликация производится два раза в день, что обеспечивает равномерный уровень тестостерона. Пациентам следует при ношении таких систем целоваться с осторожностью (возможна передача тестостерона со слюной), помнить о вероятности развития гингивита и смены вкусовых ощущений.
В России такие системы пока недоступны, но можно ожидать их появления в ближайшее время.
Возможно также внутримышечное введение эфиров тестостерона:
Могут применяться и трансдермальные формы. Пластыри не получили большого распространения из-за раздражения кожи и плохой адгезии. Гели более безопасны и удобны, а также позволяют симулировать циркадный ритм секреции тестостерона.
Согласно рекомендациям Европейской ассоциации урологов, заместительная терапия тестостероном позволяет:
Согласно европейским клиническим рекомендациям, актуальным на 2020 г., терапия тестостероном не показана у эугонадных мужчин (сильная рекомендация). Следует использовать терапию тестостероном в первой линии у симптоматических мужчин с гипогонадизмом и легкой эректильной дисфункцией (сильная рекомендация). При более тяжелых формах эректильной дисфункции необходимо использовать комбинацию ИФДЭ-5 и тестостерона, так как это может привести к лучшим результатам (слабая рекомендация). Для тяжелых депрессивных симптомов и остеопороза рекомендуется применять общепринятые виды лечения (сильная рекомендация). Не следует применять терапию тестостероном для улучшения состава тела, снижения массы тела и улучшения кардиометаболического профиля (слабая рекомендация). Также не рекомендуется применять терапию тестостероном для улучшения когнитивных возможностей, жизненного тонуса и физической силы у пожилых мужчин (сильная рекомендация).
Согласно рекомендациям Американской урологической ассоциации 2018 г., при заместительной терапии нужно титровать дозу тестостерона для достижения уровня в среднем терциле нормального диапазона, 450–600 нг/дл или 15,6– 20,8 нмоль/л (условная рекомендация, доказательность С). Также экзогенный тестостерон не должен назначаться мужчинам в парах, планирующих зачатие (сильная рекомендация, доказательность А). По мнению американских экспертов, у пациентов с сердечно-сосудистыми заболеваниями перед назначением тестостерона должен быть выдержан 3–6-месячный период наблюдения. Кроме того, не следует назначать алкилированные формы тестостерона для перорального применения (умеренная рекомендация, доказательность В). Следует обсуждать с пациентом возможность передачи действующего вещества другим лицам при использовании гелей с тестостероном (сильная рекомендация, доказательность А). У мужчин с дефицитом тестостерона, желающих сохранить фертильность, можно применять ингибиторы ароматазы, хорионический гонадотропин человека, селективные модуляторы эстрогеновых рецепторов или их комбинации (условная рекомендация, доказательность C). Наконец, следует назначать официальные, коммерчески доступные формы тестостерона, когда это возможно (условная рекомендация, доказательность С).
Также американские урологии напоминают о необходимости оценивать, достигнут ли целевой уровень тестостерона, через определенный интервал после инициации терапии. Для геля – через 2–4 недели, для эфиров короткого действия – через 3–4 цикла, для ундеканоата – в середине между планируемым и инъекциями, для альтернативных нестероидных препаратов – не ранее чем через 4 недели. При этом уровень тестостерона на фоне терапии нужно определять каждые 6–12 месяцев. Если через 3–6 месяцев после инициации терапии уровень тестостерона нормализуется, но не отмечается улучшения по симптомам и клиническим проявлениям, нужно обсуждать с пациентом прекращение терапии.
Выделяются три основных клинических симптома «позднего гипогонадизма»: снижение сексуального влечения, отсутствие утренних эрекций и эректильная дисфункция. При сомнительных данных лабораторных анализов на фоне явной клиники гипогонадизма у пожилых мужчин возможен пробный курс тестостерон-заместительной терапии [6].
В качестве альтернативной опции лечения некоторые специалисты рассматривают селективные модуляторы эстрогеновых рецепторов (SERM), такие как энкломифен, зукломифен и тамоксифен. Тарас Викторович подчеркнул, что, с его точки зрения, некорректно называть эти препараты антиэстрогенами, так как их фармакодинамика основана не на антиэстрогенной активности. Так, у энкломифена периферической антиэстрогенной активности нет вообще, а у тамоксифена она проявляется только в тканях молочной / грудной железы. Эти препараты часто обладают различным сродством и противоположным действием на Е2-рецепторы в разных тканях (иногда являются агонистами). Таким образом, все многообразие взаимодействий в приделах эндокринной системы нельзя ограничить ложной дихотомией «мужских» и «женских» гормонов.
Еще один вариант – кломицина цитрат (КЦ), представляющий из себя смесь энкломифена и зукломифена. Энкломифен блокирует Е2-рецепторы только в центральной нервной системе. Блокада Е2-рецепторов KNDy-нейронов приводит к нарушению механизма отрицательной обратной связи и активации выброса ЛГ и ФСГ. Стоит отметить, что зукломифен обладает гораздо более длительным периодом полувыведения, чем энкломифен, что серьезно осложняет контроль эффективности лечения.
Через 1 месяц после начала терапии КЦ рекомендуется оценка уровня тестостерона, эстрадиола и ЛГ [7]. Целесообразна также оценка уровня ФСГ и количества сперматозоидов, важен контроль артериального давления. При недостаточной эффективности нужно титрование препарата или его замена с повторной сдачей анализов через 1 месяц. Важно, что, согласно инструкции, период полувыведения препарата составляет 5–7 дней, однако в реальности – 7 ч для энкломифена и порядка 30 дней для зукломифена.
По словам Тараса Викторовича, КЦ – достаточно эффективный, однако непредсказуемый и рискованный препарат. Однозначно присутствует выраженный биохимический ответ. Спермиологический и соматический ответ могут присутствовать, симптоматический ответ под вопросом. Также примерно у 10% пациентов наблюдается парадоксальный ответ на КЦ с переходом к азооспермии и криптозооспермии.
Препарат тамоксифен является пролекарством, не имеет метаболитов с длительным периодом полувыведения, выступает агонистом E2-рецепторов костной ткани и антагонистом E2-рецепторов молочной (грудной) железы и обладает антифибротическим действием, но может назначаться только полностью off label. Парадоксальная реакция на него встречается реже, чем при приеме КЦ.
Всего у модуляторов эстрогеновых рецепторов существует несколько областей применения:
Последние два пункта, однако, Тарас Викторович поставил под вопрос как самостоятельные показания.
Важно иметь ввиду, что у применения SERM существует ряд подводных камней. Прежде всего, это риск парадоксального ответа на терапию. Также стоит вопрос о влиянии на либидо и другие «психологические» симптомы гипогонадизма. Существует большое количество недостаточно описанных побочных явлений, среди которых сперматоррея, гинекомастия и психопатологические явления: есть данные литературы о суицидальных тенденциях во время приема КЦ [8]. В целом эти препараты нельзя рекомендовать для эмпирической терапии.
Следующий доступный класс препаратов – ингибиторы ароматазы. Их механизм действия – торможение конверсии тестостерона в эстрадиол; торможение конверсии андростенедиона в эстрон; снижение концентрации эстрадиола в гипоталамусе с подавлением механизма отрицательной обратной связи; преобладание 5-альфа-редукции тестостерона над ароматизацией. Стероидные ингибиторы ароматазы могут напрямую взаимодействовать с рецепторами к андрогенам.
У ингибиторов ароматазы существует ряд областей применения: