Гипоксия мозга к чему приводит к
Кислородное голодание мозга: симптомы и лечение
Предугадать появление гипоксии весьма сложно. Заболевание может развиться не только в весьма преклонном возрасте, но и в процессе внутриутробного созревания плода. Состав крови во время болезни сильно изменяется, из-за чего к тканям головного мозга она поступать прекращает. Человеку с патологией необходима квалифицированная помощь врачей, иначе он может впасть в состояние комы, а иногда даже погибнуть. Поэтому важно проконсультироваться с врачом при первом подозрении на появление гипоксии. В быту для профилактики и лечения патологического состояния можно использовать кислородный концентратор.
Общая симптоматика
Выявить болезнь можно по таким признакам, как:
Чем дольше человек болеет, тем больше проявлений болезни на каждой из стадий возникает:
Гипоксический тип
Может развиваться если недостаточное питание кислородом было в течение весьма долгого промежутка времени. Чаще всего заболевание проявляется у людей, регулярно бывающих на горных склонах и вершинах, летающих самолетами, а также длительно находящихся в помещениях закрытого типа, где практически нет доступа к свежему воздуху (к примеру подлодки, бункеры и пр.). Уровень гемоглобина при этом значительно снижается. Нередко у больного возникают проблемы с водно-солевым балансом, а также тонусом кровеносных сосудов. Также возникает гипервентиляция легких из-за повышения возбудимости дыхательных центров.
Характерными признаками гипоксической формы заболевания являются:
Если вовремя не приступить к лечению, то на последних стадиях появляются приступы непроизвольного мочеиспускания. Человек нередко теряет сознание и, в итоге, впадает в кому.
Коматозный тип
Спустя примерно 50-60 сек после того, как кислород прекращает поступать к тканям, наступает коматозное состояние. Заболевание развивается постепенно, в несколько стадий, и сопровождается определенными симптомами:
Уже спустя пять минут после перехода больного в состояние комы мозг человека может погибнуть. На четвертой стадии возникает большой риск летального исхода (90%).
Лечение медикаментами
Гипоксию лечат, применяя лекарства различных групп:
Физиотерапевтические процедуры
Помимо этого пациенту могут назначить УВЧ, лечебные массажи, а также магнитную терапию. Часто обращаются и к восточной медицине, где применяются иглоукалывание, лекарства природного происхождения и чаи на основе лекарственных трав, а также специальные комплексы физических упражнений. Оптимальные способы лечения больному должен назначать только лечащий врач. Однако в любой ситуации желательно купить кислородный концентратор, чтобы восстанавливать здоровье не только в стенах медицинского учреждения, но и дома.
Гомеопатия
Людям с гипоксией можно принимать:
Народные методы
Больным рекомендуется выполнять гимнастические упражнения. Атеросклероз можно лечить смесью из имбиря, меда и оливкового масла. Если больного мучают спазмы, то нужно употреблять чесночную настойку. Чтобы быстро повысить уровень гемоглобина, многие советуют употреблять много гречневой крупы, смешанной с грецким орехом, имбирем и медом,
Гипоксию также часто лечат при помощи травяных отваров и настоев. Чаще всего для них используют пустырник, ромашку, валериану, боярышник и зверобой. Восстановить функционирование органов дыхания можно корнем солодки, бузиной, подорожником, мать-и-мачехой и почками сосны. А при помощи тысячелистника, полыни либо одуванчика обыкновенного нормализуют концентрацию гемоглобина в крови.
Хроническая гипоксия: причины, симптомы и способы лечения
Без кислорода жизнь невозможна. Его дефицит отрицательно влияет на все органы, особенно на головной мозг. Если с током плазмы О2 поступает не в полной мере, надвигается кислородный голод или по-другому гипоксия. Объясняется это просто: для полноценной работы мозга требуется более 20% минутного объема кровотока, а это солидное количество.
Наступление гипоксии губительно для мозга. При наступлении острой стадии он способен работать не более 4-5 секунд. По истечению 10-13 секунд наступает бессознательное состояние, а через 30-35 секунд – коматозное. Если патология сохраняется 5-6 минут, наступает гибель клеток, к тому же необратимая.
Причины появления
В основе классификации кислородного голодания лежат причины возникновения болезни.
Чаще всего у взрослых гипоксии развиваются на базе:
Кроме того, такая реакция может развиваться на алкоголь, на аллергены, что приводят к отеку гортани, и в результате болезней нервной системы.
Симптомы
У взрослых кислородное голодание выражается стандартной клинической картиной.
Способы лечения
Схема лечения для взрослых разрабатывается исходя из точной первопричины, которая диагностируется посредством современных технологий. Если больной детально сформулирует те факторы, что спровоцировали гипоксию, врачу будет легче назначить терапевтические мероприятия.
Они могут проходить дома, а также в стационаре. Как правило, рекомендуются средства, которые стабилизируют правильную работу организма. Больной принимает лекарства для восстановления полного кровоснабжения, а значит и полноценной работы тканей мозга.
Бывает, что взрослому человеку с легкой стадией нехватки кислорода достаточно дольше бывать на воздухе. Если же причина в нарушении или в болезни пациента, тогда ему в частности потребуются:
Последствия, если не лечить
Мгновенная и острая стадия может послужить причиной смертельного исхода. Остальные же случаи чреваты головокружениями, расстройством зрения и речи. Конечно, реабилитация поможет восстановить выполнение утраченных обязанностей, но остаточные отклонения могут сохраняться.
Хроническая гипоксия вызывает одышку и гипертонию, образование тромбов и повышенное число митохондрий. Длительное течение кислородного голодания постепенно приводит к нарушению функций и декомпенсации.
Как справляться с ХГ при помощи концентраторов кислорода? И можно ли это делать?
Это делать нужно, как для лечения, так и для предотвращения подобных болезней. Такая терапия насыщает организм кислородом, к тому же высокой концентрации. По эффективности такое лечение стоит рядом с СИПАП-терапией.
Современные концентраторы отделяют чистый кислород из окружающего воздуха посредством фильтров. Очищенный, он попадает в редуктор, увлажняется парами и немного нагревается.
Лечение проводится при каждом заболевании индивидуально. Кислород же применяется разной концентрации.
Гипоксия головного мозга
Гипоксия или кислородное голодание является одним из важнейших элементов в развитии огромного комплекса самых разных заболеваний и патологических состояний. Именно ей принадлежит одна из важнейших ролей в возникновении повреждения клеток, тканей и органов при многих болезнях и она же сопровождает гибель организма вне зависимости от характера провоцирующих ее причин. При этом наиболее чувствительная к кислородному голоданию нервная ткань. Поэтому гипоксии, а точнее предотвращению ее наступления и борьбе с ней отводится большая роль в современной медицине.
Что такое гипоксия головного мозга
Под понятием гипоксия подразумевают кислородную недостаточность, что чаще называют кислородным голоданием. То есть это состояние организма, которое возникает на фоне недостаточного его снабжения кислородом или нарушения его поступления к клеткам и тканям в результате действия тех или иных факторов. В ее основе лежит недостаточное энергетическое обеспечение постоянно протекающих в организме превращений. Ведь не зря человеческое тело сравнивают с большой, сложной химической лабораторией.
В организме энергия образуется из фосфорных соединений, для синтеза которых требуется кислород. В норме процессы биологического окисления удовлетворяют потребности организма и обеспечивают тот объем энергии, который необходим для поддержания функциональной активности органов и тканей, обновления клеток и т. д. Поэтому при нарушении этого баланса из-за недостаточного поступления кислорода, нарушения его транспортировки и использования тканями возникает энергетический дефицит. Это приводит к разным по характеру функциональным и морфологическим нарушениям, в том числе к гибели ткани.
Наиболее чувствительны к недостатку кислорода нервные клетки, а также сердца, почек и печени.
В зависимости от того, что стало причиной наступления гипоксии, темпа ее прогрессирования, продолжительности сохранения и ряда других факторов, выделяют несколько степеней:
Это определяет выраженность происходящих в организме изменений, характер возникающих вторичных нарушений, компенсаторных и приспособительных реакций. Но при истощении возможностей организма недополучающие кислород клетки погибают. А поскольку первым от него страдает головной мозг, это чревато необратимыми изменениями в его структуре и функционировании, а в тяжелых случаях и летальным исходом.
Виды и причины
Все гипоксии делят на острые и хронические. Первые развиваются менее чем за 2 часа, вторые же сохраняются неделями или даже годами. Иногда выделяют молниеносные формы, когда организм испытывает кислородную недостаточность в течение нескольких минут или менее. Они являются наиболее опасными и становятся следствием вдыхания лишенных кислорода газов, например, метана, гелия, азота и пр. Также иногда выделяют подострую форму кислородной недостаточности. Она сохраняется несколько часов.
Также гипоксии головного мозга классифицируют по этиологическому фактору, т. е. причине развития на:
Также выделяют смешанный тип, при котором наблюдается сочетание 2 или более видов гипоксии.
Определение того, что спровоцировало кислородное голодание и соответственно снижение интенсивности процессов биологического окисления, развитие дефицита энергии для обеспечения полноценного протекания жизненных процессов, имеет большое значение для подбора наиболее эффективной тактики лечения.
Экзогенные
Экзогенные гипоксии обусловлены действием внешних факторов, сопровождающихся снижением парциального давления кислорода во вдыхаемом воздухе. Подобное характерно в основном для:
В таких случаях наблюдается так называемая гипоксемия. Под этим термином подразумевают снижение концентрации кислорода в крови и степень насыщения им гемоглобина. На этом фоне может развиваться компенсаторная гипервентиляция легких, обусловленная непроизвольным увеличением частоты дыхательных движений, и снижение концентрации углекислого газа в крови (гипокапния). Это приводит к снижению качества кровоснабжения головного мозга и сердца.
Дыхательная
Легочная, респираторная или дыхательная гипоксия развивается на фоне нарушения протекания газообмена в легких, что может возникать при:
Циркуляторная
Сердечно-сосудистая или циркуляторная гипоксия может развиваться при возникновении нарушений кровообращения. Это может быть результатом большой кровопотери, выраженного обезвоживания или же следствием развития патологий сердца или сосудов, в частности:
При циркуляторном типе наблюдается уменьшение минутного объема крови.
Гипоксия в таких случаях может быть как генерализованной, так и локальной. В последнем случае изменения будут наблюдаться только в том участке, который будет испытывать недостаток в притоке артериальной крови или затруднения с отведением венозной крови.
Одной из часто диагностируемых причин гипоксии головного мозга сосудистого происхождения является развитие вертебрального синдрома. В основе его возникновения лежат травмы и патологии позвоночника. Чаще всего это остеохондроз шейного отдела и его осложнения в виде протрузий и межпозвоночных грыж, сколиоз, кифоз, болезнь Бехтерева, миозит, спондилез. При их развитии происходят изменения в положении позвонков, толщине расположенных между ними дисков и в целом строении позвоночника. В результате страдают проходящие через боковые поверхности 6-ти шейных позвонков позвоночные артерии. Это приводит к развитию синдрома позвоночной артерии, который также может иметь и сосудистое происхождение. В обоих случаях это сопровождаться сужением просвета одной или обеих артерий, деформацией стенок, но в любом случае приводит к нарушению кровоснабжения и гипоксии отдельных частей головного мозга.
Это может проявляться самым разным образом, в том числе вегетативными расстройствами от головокружений до сложностей с поддержанием равновесия, поскольку позвоночные артерии в области затылочного проема объединяются в базиллярную артерию, которая обеспечивает 15—30% кровоснабжения головного мозга и спинного мозга на уровне шейного отдела позвоночника.
Кроме развития гипоксии, возникновение вертебрального синдрома может сопровождаться компрессией спинномозговых корешков, выходящих сквозь естественные отверстия в позвонках. В результате будут наблюдаться сильные боли, иногда носящие характер прострелов, как непосредственно в месте поражения, так и отдающие в руки, голову, область за грудиной и другие части тела, а также нарушения их чувствительности и подвижности.
Гемическая
Для этого типа гипоксии характерно уменьшение кислородной емкости крови, что наблюдается при:
Тканевая
Тканевая гипоксия возникает при нарушении способности тканей поглощать доставленный кровью кислород в результате снижения скорости протекания биологического окисления. Это может быть следствием:
Тканевая гипоксия может развиваться на фоне экзогенной, респираторной, циркуляторной или гемической гипоксии.
Симптомы гипоксии
Характер и выраженность возникающих симптомов напрямую зависят от:
Поэтому в каждом случае кислородное голодание может проявляться по-разному. При этом наличие определенных симптомов помогает определить его вид и сузить перечень заболеваний и состояний, которые могли спровоцировать его развитие. А потому благодаря проведению ряда диагностических процедур удается максимально быстро установить причину возникновения гипоксии и подобрать оптимальную тактику для ее устранения и предотвращения развития в будущем.
При любых признаках развития кислородной недостаточности нужно как можно скорее обратиться к врачу, а при симптомах острой гипоксии – вызвать бригаду скорой помощи.
При острой гипоксии головного мозга симптомы нарастают прогрессивно. Изначально человек впадает в возбужденное состояние и чувствует прилив энергии. Но это сопровождается нарушениями координации движений, шаткостью походки, покраснением или наоборот побледнением кожи, холодным потом. Если на этой стадии не принять меры и не восстановить нормальное поступление кислорода к клеткам головного мозга, наступает 2-я стадия – торможение. Из-за истощения запасов энергии, накопленной в виде гликогена, работа нервной системы замедляется, что приводит к возникновению головокружения, тошноты или даже рвоты. Также наблюдается снижение остроты зрения, причем нередко пациенты жалуются на внезапное потемнение в глазах, что может закончиться обмороком. При отсутствии медицинской помощи развиваются необратимые изменения ЦНС, что приводит к коме и отказу жизненно важных органов.
Также кислородное голодание может проявляться:
При молниеносной гипоксии может немедленно наступать остановка сердца и прекращение жизненно важных функций.
Проявления хронического кислородного голодания
Хроническая гипоксия часто становится следствием длительно сохраняющейся недостаточности кровообращения, в частности в позвоночных артериях, нарушения дыхания. Она диагностируется намного чаще других форм кислородной недостаточности и не требует срочных реанимационных мероприятий. В таком случае значительно важнее установить причину ее развития и воздействовать на нее. Для этой формы характерны:
При кислородном голодании, возникшем в результате вертебрального синдрома с вовлечением в патологический процесс одной или обеих позвоночных артерий, наблюдаются:
Эти симптомы могут возникать периодически и носить острый характер или присутствовать практически постоянно.
Одной из главных опасностей гипоксии любого типа является возникновение в коре головного мозга функциональных и структурных изменений, так как именно нервная ткань наиболее чувствительна к кислородному голоданию. При тяжелой гипоксии развиваются судороги и кома.
Диагностика
Для определения наличия и степени выраженности кислородного голодания врач оценивает состояние пациента и характер имеющихся симптомов. В первую очередь он обращает внимание на наличие одышки, учащение сердцебиения, наличие признаков поражения головного мозга и характер возникших неврологических расстройств, измеряет артериальное давление и оценивает работу сердца. Уже на основании этих факторов можно диагностировать наличие гипоксии и немедленно принять меры для ее ликвидации во избежание развития нежелательных, а нередко и необратимых последствий.
Точно установить наличие гипоксии головного мозга за считаные секунды можно с помощью пульсоксиметра. Этот компактный прибор надевается на палец больного и показывает уровень сатурации, т. е. насыщения крови кислородом, а также частоту сердцебиения. В норме сатурация выше 95%.
Параллельно с проведением лечения гипоксии проводится диагностика причин ее развития, если их не удалось установить в ходе первичного опроса и осмотра пациента. С этой целью назначаются:
При наличии подозрений на развитие заболеваний позвоночника проводится рентген и МРТ шейного отдела, УЗИ сосудов шеи с допплерографией.
Важно точно определить причины гипоксии головного мозга и воздействовать непосредственно на них. В противном случае первоначальное заболевание будет прогрессировать, а состояние пациента ухудшаться. В результате резко увеличивается вероятность развития осложнений и необратимых изменений в тканях.
Лечение гипоксии головного мозга
Характер терапии зависит от выраженности гипоксии и причины ее развития. В наиболее легких случаях, когда она является следствием дефицита кислорода во вдыхаемом воздухе, достаточно вывести человека из душного помещения, спуститься с высоты, подняться с глубины и т. д. При развитии эндогенной гипоксии головного мозга лечение подирается индивидуально. Если наблюдается средняя степень кислородной недостаточности, для предотвращения ухудшений состояния могут вводиться нейролептики, кортикостероиды и другие средства экстренной помощи. Также проводится оксигенотерапия для быстрого восстановления нормального количества кислорода в организме.
Дальнейшее лечение разрабатывается в зависимости от формы гипоксии. Так:
В тяжелых случаях лечение осуществляется в стационаре с проведением оксигенотерапии или подключением пациента к аппарату ИВЛ.
Таким образом, гипоксия головного мозга представляет собой опасное состояние, которое может привести к тяжелым последствиям или даже смертельному исходу. Чаще встречается хроническая гипоксия, которая может сохраняться годами. Но прогноз всегда лучше при начале лечения на самых ранних стадиях развития заболевания. Поэтому не стоит игнорировать его проявления. Лучше сразу записаться на консультацию к неврологу и либо полностью развеять свои сомнения, либо начать соответствующее ситуации лечение и избежать нежелательных последствий для здоровья.
Гипоксия, негипоксическая гипоксия и иммунитет
Автор
Редактор
Статья на конкурс «био/мол/текст»: За миллионы лет с момента появления кислорода на Земле Природа-матушка наэволюционировала весьма сложный и красивый механизм чувствительности к сниженному содержанию кислорода — гипоксии. Механизм этот регулировал массу разнообразных процессов, и было бы очень жаль (а может быть и лень) упускать возможность сделать его не только кислород-чувствительным. Так появилась так называемая негипоксическая гипоксия или гипоксия без гипоксии, проявления которой ученые в настоящее время находят в самых разнообразных органах и тканях. Не обделена была и иммунная система, для которой функционирование кислород-чувствительных систем является зачастую очень критичным моментом. В статье предпринята попытка осветить некоторые современные аспекты этой области и рассмотреть наиболее интригующие механизмы.
Обратите внимание!
Эта работа опубликована в номинации «лучшая статья по иммунологии» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
«Опять гипоксия! Слышали уже много раз!» — возразит читатель, который, должно быть, уже приготовился услышать томный пересказ глав учебника по патофизиологии про то, что гипоксия бывает экзогенной, респираторной, гемической и много еще какой; возможно, читатель приготовился к рассказам об альпинистах или жизни людей в барокамерах. Позвольте рассказать о другом. О негипоксической гипоксии, например. Как не слышали? Тогда приятного чтения!
История открытия
Рисунок 1. Первооткрыватель HIF, профессор Грегг Семенза.
Как и многие истории, всё началось с пивных баров и, увы, весьма печально. В середине 1960-х годах по США, Бельгии и ряду других стран среди отчаянных любителей пива прокатилась необычная хворь — кардиомиопатия, имеющая по всем характеристикам признаки токсической, обусловленной накоплением неизвестного тяжелого металла. Довольно быстро виновник был найден: им оказался хлорид кобальта (II) — популярный среди ряда крупных пивоварен эффективный пеногаситель. Интересно, что помимо кардиомиопатии у бедняг-пьяниц наблюдался высокий уровень гемоглобина, который коррелировал с высоким уровнем эритропоэтина [1]. Да-да, именно того самого эритропоэтина, на выработку которого так уповают спортсмены, тренируясь в условиях высокогорной гипоксии. Означало ли это, что гипоксию можно заменить приемом двухвалентого пива кобальта? Похоже, что так!
Успокою взволнованных любителей пива и замечу, что чтобы получить кобальтовую кардиомиопатию, потреблять пива необходимо было неимоверно много — около 4 литров в сутки, а всем остальным, возможно, пиво дарило даже некоторое «окрыление» на фоне повышенного гемоглобина. Так или иначе, добавку запретили, разрешив ее ограниченно применять в скотоводстве.
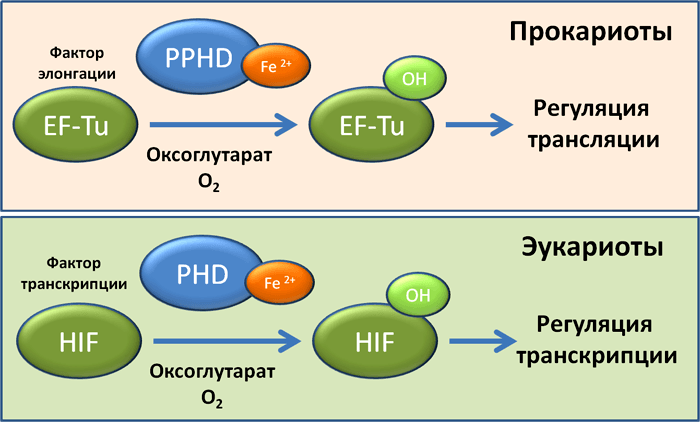
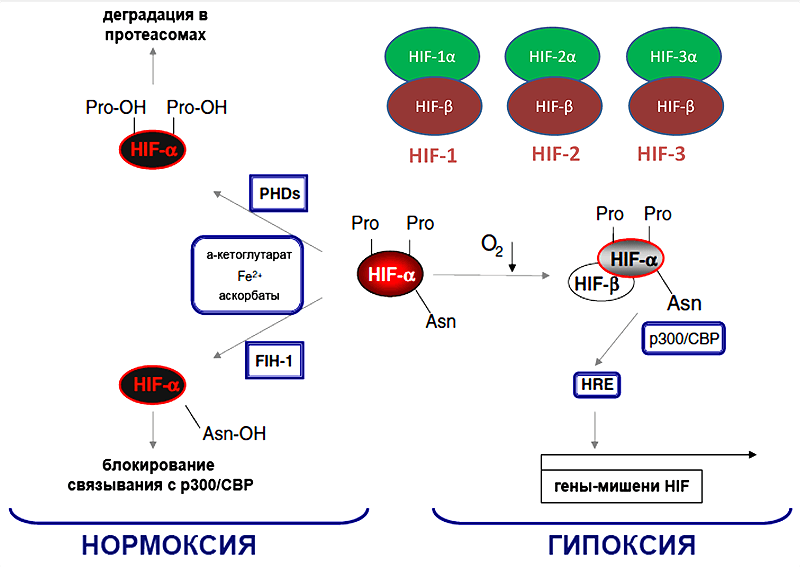
Неизвестно, был ли знаком с этой историей молодой врач-педиатр Грегг Семенза из госпиталя Джонса Хопксинса (рис. 1). Задача постдока Грегга состояла в поиске фактора, регулирующего активность промотора гена эритропоэтина в условиях гипоксии. Постепенно, шаг за шагом, в 1992 году был найден фактор, в 1995 году стало ясно, что фактор представляет собой гетеродимер, в котором одна из субъединиц является кислород-зависимой, в 2001 году был определен механизм, благодаря которому происходит регуляция стабильности кислород-зависимой субъединицы — гидроксилирование с помощью пролилгидроксилаз. Фактору дали красноречивое название — hypoxia-induced factor, или, сокращенно, HIF [2].
Следует отметить, что во всех клеточных экспериментах Семензы гипоксия могла быть заменена добавлением хлорида двухвалентного кобальта. И это уже не просто совпадение, это научный факт.
Некоторые современные сведения о факторах HIF
Далее дорогой читатель будет вынужден простить мне несколько справочный раздел, суммирующий часть современных сведений о факторе HIF.
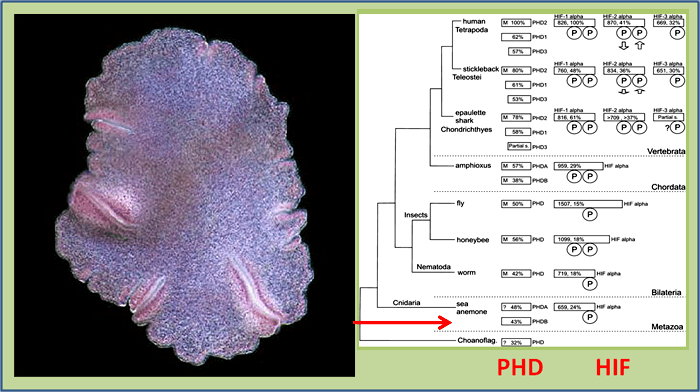
Рисунок 3. Простейшее многоклеточное животное Trichoplax adhaerens (слева) и его положение в истории эволюции PHD-HIF системы у животных (справа). Фото трихоплакса с сайта geneticarchaeology.com.
Рисунок 4. Факторы транскрипции HIF 1-3 и классический кислород-зависимый путь регуляции их активности.
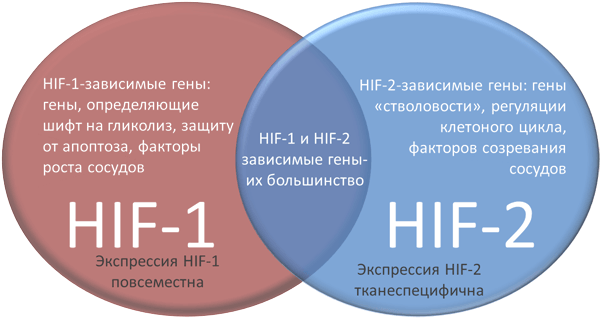
Рисунок 5. Различия HIF-1 и HIF-2.
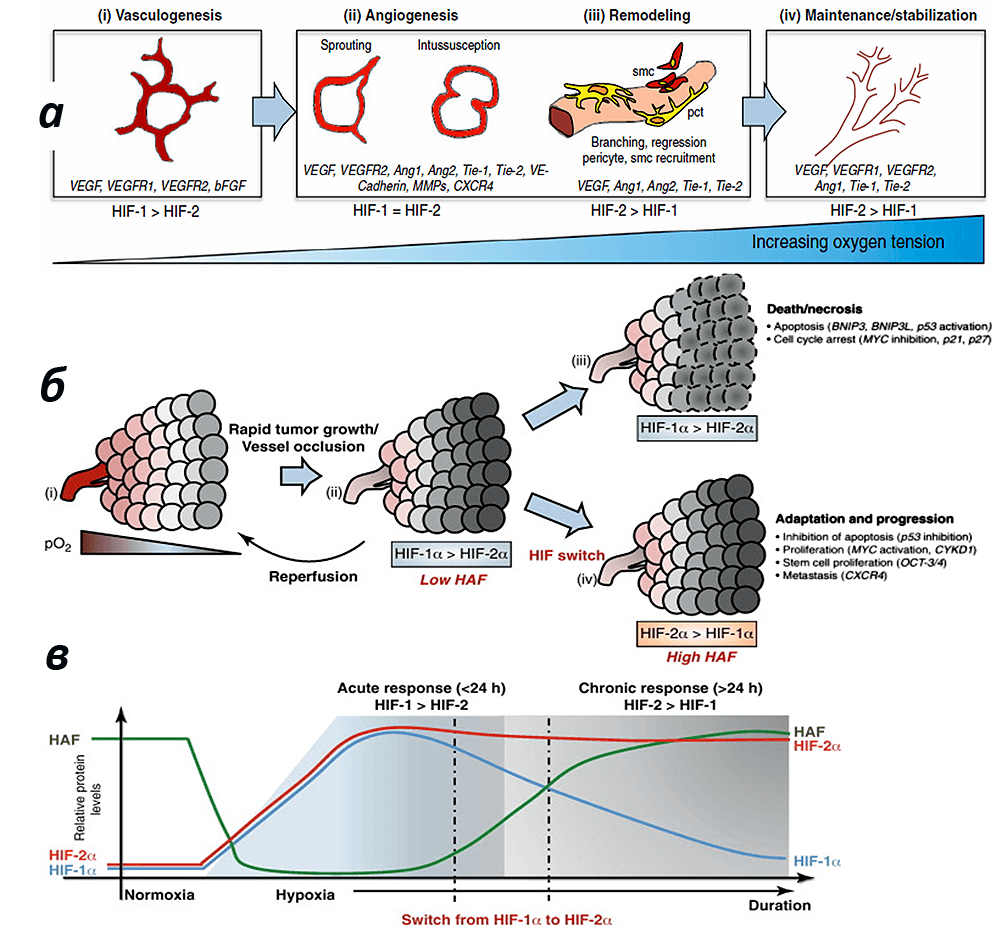
Рисунок 6. Понятие переключения изоформ HIF-1 → HIF-2. По мере роста сосуда (а) опухолевой ткани (б) в след за изменением степени гипоксии от острой до умеренной происходит переключение с HIF-1 изоформы на HIF-2 (в) c экспрессией различного спектра факторов. Рисунок из [12] с изменениями.
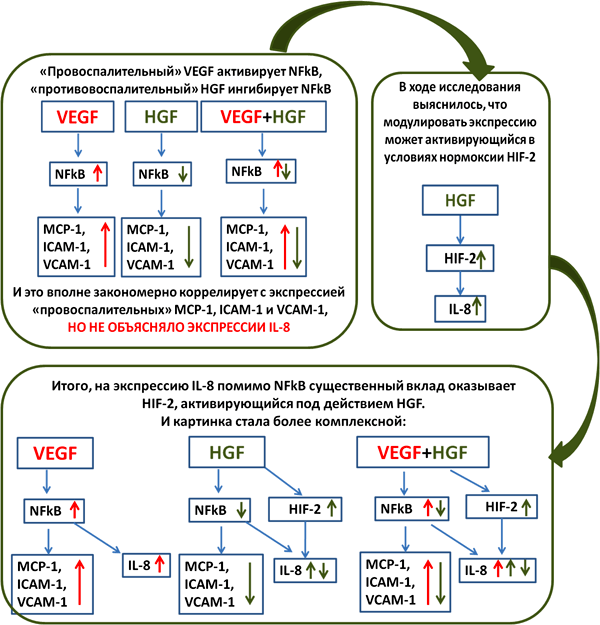
Рисунок 7. Этапы моей дипломной работы, иллюстрирующие то, как негипоксическая активация HIF-2 может вносить свои коррективы в экспрессию хемокинов.
Итак, дорогой читатель, я надеюсь, что вы не сильно утомились ознакомлением первой части рассказа. Скорее перейдем к его иммунологическому разделу!
Роль факторов HIFs в иммунных клетках
И для начала несколько соображений общего характера [16, 17]:
Тема неимоверно интересная и обширная, поэтому я ограничусь парой историй.
История 1: Treg-лимфоциты vs. Th17-лимфоциты
Наивные CD4+ T клетки в зависимости от микроокружения способны дифференцироваться в различные субпопуляции с весьма отличающимися друг от друга функциями: Th1, Th2, Tfh, Th17 и iTreg. Огромное внимание в вопросах аутоиммунных заболеваний и противоопухолевого иммунитета обращено к двум не так давно открытым популяциям T лимфоцитов — Th17 и iTreg [17].
Th17-клетки дифференцируются из наивных CD4+ лимфоцитов под действием TGF-β и IL-6; критичным является активация транскрипционных факторов STAT3 и RORgt. Th17-лимфоциты обладают мощным бактерицидным и фунгицидным действием за счет секреции IL-17 и IL-22. Однако вследствие своего избыточного воспалительного потенциала, Th17 печально известны как участники многих аутоиммунных заболеваний.
Индуцированные iTreg дифференцируются из наивных CD4+ лимфоцитов под действием TGF-β и IL-2; критичным является активация транскрипционного фактора Foxp3. Treg вырабатывают IL-10, TGFβ, экспрессируют на своей поверхности много интересных молекул (типа рецептора к IL-2 СD25, ингибиторного корецептора CTLA-4), за счет которых проявляют свои иммуносупрессивные свойства.
Итого, мы имеем две субпопуляции лимфоцитов, обладающих диаметрально противоположными свойствами, не способными перепрограммироваться друг в друга и происходящие из единого предшественника — наивных CD4+ лимфоцитов. Часто говорят о балансе Treg и Th17, сдвиге баланса либо в иммуносупрессивную, либо в провоспалительную сторону при разных заболеваниях, и подчеркивают первостепенную важность механизмов, определяющих дифференцировку по одному из двух путей. Кратко рассмотрим механизмы и попытаемся понять, в чем соль.
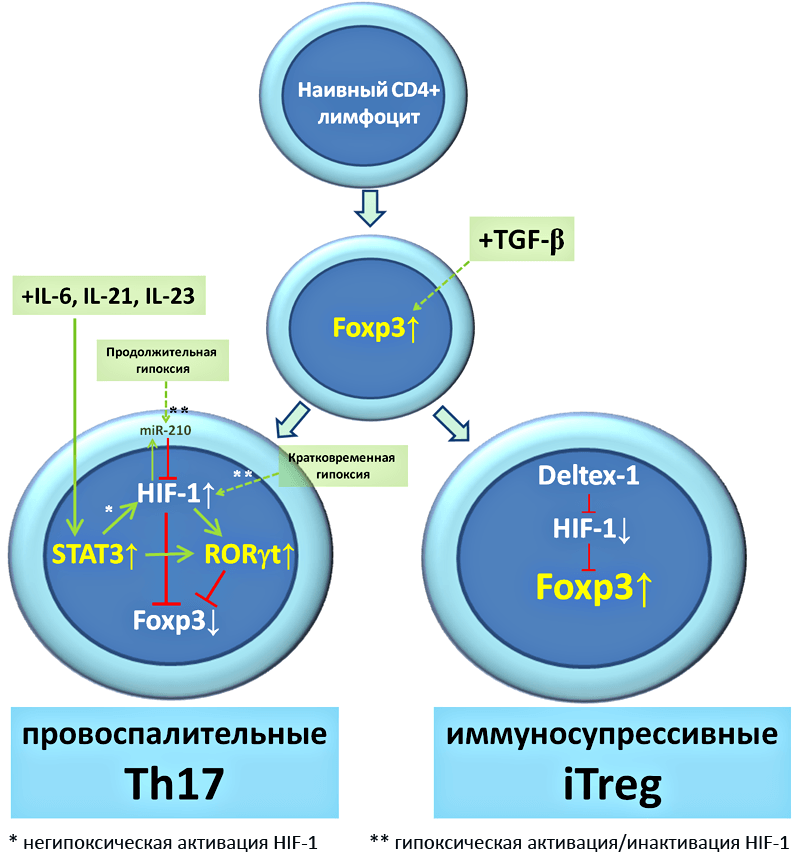
Первое, на что внимательный читатель обратит внимание, это общий для двух субпопуляций индуктор TGFβ. Известно, что сами по себе высокие концентрации TGFβ способны поддерживать активацию Foxp3 и коммитировать образование iTreg. Однако для Th17 также характерна активация Foxp3, которая в обязательном порядке должна быть подавлена. Подавляется она за счет активации фактора STAT3 (под действием IL-6, IL-21 или IL-23), что, в свою очередь, активирует RORgt, который активно подавляет активность Foxp3 и определяет экспрессию Th17-специфичных хемокинов.
Теперь о роли HIF-1. Для немиелоидных клеток показано, что активация STAT3 может приводить к негипоксической активации HIF-1. HIF-1, в свою очередь, способен ингибировать Foxp3, причем, вероятно, за счет механизма активации полиубиквитинирования с последующей протеасомной деградацией, т.е. механизма по которому HIF-1 разрушается сам. Ингибируя Foxp3, HIF-1 способствует дифференцировке CD4+ наивных лимфоцитов в Th17 направлении. Что интересно, данную STAT3-зависимую негипоксическую активацию HIF-1 с последующим ингибированием Foxp3 можно заменить циклами периодической гипоксии-нормоксии, которая приводит к стабилизации и накоплению HIF-1 (рис. 8).
Рисунок 8. Роль HIF-1 в дифференцировке CD4+ наивных лимфоцитов в Treg и Th17.
Любопытно, что то же самое не случается в условиях длительной гипоксии. И виной здесь отрицательная обратная связь — длительная гипоксия повышает экспрессию HIF-зависимой микроРНК-210, которая способна подавлять трансляцию HIF-1α.
Приведенную выше концепцию особой роли HIF-1 в активации фактора RORgt (критичного для Th17) и ингибирования Foxp3 (критичного для Treg) подтверждает недавняя замечательная статья о роли фактора Deltex1 в поддержании стабильности Foxp3 за счет ингибирования его негативного регулятора HIF-1 [18].
Не так давно была открыта новая субпопуляция лимфоцитов — Tr1, обладающих иммуносупрессивными свойствами, при этом не экспрессирующих Foxp3 (маркер регуляторных T-лимфоцитов). Tr1 играют особую роль в супрессии воспаления в нервной системы и кишечнике [19].
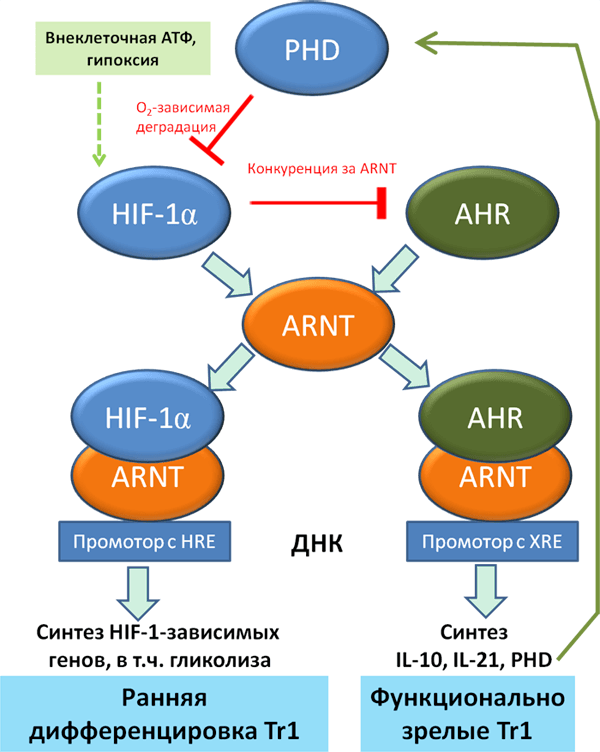
Интересно, что гипоксия и повышенная концентрация внеклеточного АТФ — частые атрибуты воспаления — способны угнетать дифференцировку Tr1-лимфоцитов. Весьма красивым оказался механизм: критичным фактором для дифференцировки в Tr1 лимфоциты является фактор AHR, который при взаимодействии со своим ядерным переносчиком ARNT, переносится в ядро и активирует экспрессию IL-10, IL-21 и прочих факторов, определяющих иммуносупрессивные свойства Tr1-лимфоцитов. Однако ARNT хорошо известен нам как HIF-1β, кислород независимая субъединица, с которой димеризуется HIF-1α. Между HIF-1α и AHR в указанных условиях происходит конкуренция за ARNT и HIF-1α в этой конкуренции побеждает. Впрочем, если условия позволяют, и в схватке побеждает ARNT, ему есть чем ответить — активируясь, он способствует деградации HIF-1α, предположительно за счет повышения экспрессии пролилгидроксилаз PHDs по кислород-зависимому механизму (рис. 9).
Рисунок 9. Роль HIF-1 в дифференцировке иммуносупрессивных Tr1-лимфоцитов.
Хочется отметить также, что угнетающая роль HIF-1α на дифференцировку Tr1-лимфоцитов оказалась не столь уж однозначной — исследователи отмечают то, что активность HIF-1α важна на ранних стадиях дифференцировки, главным образом, за счет своей способности переключать метаболизм на гликолитический тип.
История 2: Врожденный иммунитет и макрофаги
В марте 2015 года в Кембридже прошла любопытнейшая конференция по теме, которая может показаться на первый взгляд очень провокационной — формированию парадигмы памяти врожденного иммунитета. Но не пугайтесь громкого названия; ознакомившись с материалами конференции [20], очень скоро понимаешь, что главной темой было понятие «тренированного» (trained) иммунитета, ставшее уже своего рода классикой.
Суть явления проста: моноцит (или неполяризованный макрофаг М0) после встречи с антигеном через активацию рецепторов врожденного иммунитета (dectin-1, TLRs и др.) способен программироваться метаболически (переходя на гликолитический тип метаболизма) и эпигенетически, становясь таким образом «тренированным» и обеспечивая при повторной инфекции активный ответ. Несложно заметить, что «тренированные» макрофаги есть ни что иное как «классически активируемые» макрофаги, или M1 макрофаги (рис. 10).
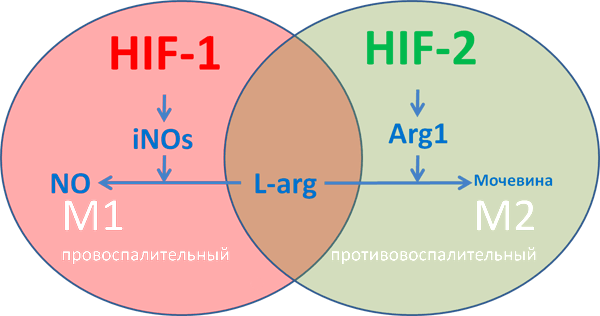
Рисунок 10. М1-макрофаги характеризуются «провоспалительным» фенотипом, преимущественно гликолитическим типом метаболизма, синтезом провоспалительных хемокинов типа IL-1β, экспрессией индуцибельной NO-синтазы iNOs. М2 макрофаги характеризуются «противовоспалительным» фенотипом, преимущественно окислительным фосфорилированием, синтезом аргиназы ARG1 и противовоспалительных хемокинов типа IL-10. У iNOs и ARG1 имеется единый субстрат — L-аргинин, содержание которого в межклеточной среде ограничено.
Про макрофаги, в том числе роль их в противоопухолевом иммунитете, очень здорово и находчиво написано в статье «Одураченные макрофаги, или несколько слов о том, как злокачественные опухоли обманывают иммунитет» [21]. Добавлю — сейчас не вызывает сомнений факт, что важнейшим условием для поляризации в М1-макрофаги является активация HIF-1, а поляризации в M2-макрофаги — активация HIF-2. Активируясь, HIF-1 и HIF-2 контролируют экспрессию соотвествующих генов.
Как в случае с провоспалительными Th17 и супрессорными Treg, между провоспалительными M1 и противоспалительными M2 в тканях наблюдается баланс, нарушение которого может приводить к различным заболеваниям. Так, например, сдвиг в сторону M1-макрофагов в жировой ткани патогенетически связан с развитием метаболического синдрома за счет постоянного хронического воспаления в жировой ткани, ее инсулинрезистентностью, секрецией в кровь провоспалительных хемокинов и адипокинов [22].
Вместо заключения
В настоящее время разработаны/разрабатываются методы селективного ингибирования HIF-1 и HIF-2; селективного ингибирования различных изоформ пролилгидроксилаз PHDs, за счет чего возможно активировать HIF-1 и HIF-2, причем также селективно; можно ингибировать фермент FIH-1и прочие участники пути регуляции кислород-зависимого пути деградации. При желании и достаточной фантазии можно пробовать воздействовать на кислород-независимые пути.
Все это, несомненно, должно найти и, я уверен, найдет применение в практической медицине. Но это потребует крайней обдуманности, многостадийного контроля и досконального изучения. Чем далеко ходить, лучше приведу пример.
Не так давно, в начале-середине 2000-х годов, наблюдался некоторый бум: для многих типов онкологических заболеваний была показана сверхэкспрессия HIF-1α, что вполне соответствовало понятиям об опухолевой биологии: быстрорастущая опухолевая масса в условиях жесткой гипоксии переходит на гликолитический анаэробный тип метаболизма [23], при этом активно секретируя вокруг себя многочисленные факторы роста сосудов, факторы инвазии и т.д. Что делать? Подавим экспрессию HIF-1α и дело в шляпе! Не тут-то было — реальность оказалась сложнее и запутанней.
Так, например, при применении siRNA против HIF-1α на культуре пигментного эпителия сетчатки и эндотелия сосудов, наблюдалось вполне закономерное снижение секреции таких ангиогенных факторов как VEGF, TGF-β (это очень хорошо), но росла секреция IL-8, мощного хемокина с ярко выраженными ангиогенными свойствами (это очень плохо) [24]. Позднее, группой профессора Лобода был раскрыт механизм — дело в том, что HIF-1 подавляет экспрессию IL-8, а HIF-2 — активирует. Подавляя HIF-1 в клетках, исследователи добивались реципрокной активации HIF-2 и экспрессии IL-8 [25]. Такая неоднозначная выходила терапия.
Также нужно быть аккуратными с иммунной системой. Системное подавление HIF-1 при аутоиммунных заболеваниях, возможно, и приведет к снижению популяции Th17 и росту числа Treg, что теоретически способно облегчить течение заболевания, но также способно привести к искусственному комбинированному иммунодефициту за счет дисфункции M1-макрофагов, нейтрофилов, Th1, Th2, Th17 и СD8+ T лимфоцитов.