Гипоплазия аорты у новорожденного что это
Гипоплазия аорты у новорожденного что это
Коарктация может представлять собой истинный порок, обусловленный генетическими нарушенияими, или являться следствием наличия аберрантной ткани протока в стенке аорты, что приводит к сужению перешейка в период закрытия протока (так называемая теория Skodaic). Третья гипотеза предполагает, что коарктация является морфологическим результатом нарушения гемодинамики во внутриутробном периоде, которая обусловлена внутрисердечными аномалиями, приводящими к перераспределению кровотока из аорты в легочную артерию и артериальный проток. В пользу, по крайней мере, двух последних гипотез имеются клинические и анатомические данные.
Тубулярная гипоплазия аорты выражается в генерализованном сужении проксимального отдела дуги аорты, при этом чаще всего страдает сегмент между левой общей сонной артерией и левой подключичной артерией или перешейком. В этот процесс, кроме того, могут вовлекаться брахиоцефальные сосуды.
Видео ЭхоКГ при коарктации аорты у плода
При эхокардиографическом обследовании плодов с коарктацией аорты характерным признаком является гиперэхогенное утолщение, выступающее в просвет аорты. Однако данная особенность обычно обнаруживается менее чем у половины плодов. Формирование коарктации может происходить в постнатальном периоде, что во многих случаях ограничивает возможности пренатальной диагностики. Тем не менее, эта аномалия уже описана у плодов, хотя была диагностирована только на поздних сроках беременности.
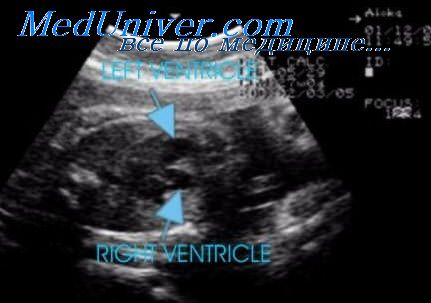
В этой ситуации в 50% наблюдений обнаруживается увеличение правого предсердия и желудочка (когда правый желудочек превосходит по размерам левый в 1,3 раза) в сочетании с расширением ствола легочной артерии и повышением скорости кровотока через трикуспиданый клапан (более чем в два раза по сравнению с кровотоком через митральный клапан). При тубулярной гипоплазии аорта становится тонкой и имеет малый диаметр просвета. Диагноз в таких ситуациях, по-видимому, бывает не очень надежен из-за трудностей, возникающих при ультразвуковом осмотре.
Известно, что во внутриутробном периоде кровоток через перешеек аорты минимален, и нисходящая аорта получает кровь преимущественно из артериального протока, поэтому изолированная коарктация аорты не будет существенно нарушать сердечную гемодинамику. Тем не менее тубулярная гипоплазия дуги аорты способна приводить к увеличению гемодинамической нагрузки, что может объяснять расширение правых отделов сердца, которое выявляется при эхокардиографии в антенатальном периоде.
Гипоплазия аорты у новорожденного что это
Перерыв дуги аорты может быть полным или (реже) сегментарным, когда между дугой и нисходящей аортой выявляется атрезированный сегмент в виде фиброзного тяжа. Данная форма порока может рассматриваться как крайняя степень коарктации. Его классифицируют в зависимости от уровня относительно брахиоцефальных артерий. При типе А (42%) аорта снабжает кровью три брахиоцефальных сосуда, а нисходящая аорта получает кровь из ствола легочной артерии через артериальный проток.
Сопутствующие аномалии сердца в этих случаях могут быть представлены такими пороками, как дефекты межпредсердной перегородки, субаортальный стеноз, гипоплазия восходящей аорты, двустворчатый аортальный и/или легочный клапан, аномальное отхождение правой подключичной артерии и дефекты межжелудочковой перегородки.
К сопутствующим экстракардиалыным аномалиям относятся синдром ДиДжорджи (DiGeorge) (аплазия тимуса, перерыв дуги аорты (типа В) и гипоплазия нижней челюсти), голопрозенцефалия, расщелины верхней губы и/или неба, атрезия пищевода, удвоение желудка, диафрагмальная грыжа, подковообразная почка, двусторонняя агенезия почек, олигодактилия, кисть в виде «клешни краба» (claw hand) и сиреномелия.
Характерные изменения дуги аорты в верхних отделах грудной клетки, от которой не отходят сосуды, или отходит слишком мало сосудов, позволят предположить данный диагноз. При продольной плоскости сканирования плода аорту можно будет проследить только до сонных артерий, но не удастся выявить ее переход в нисходящую аорту. Другим признаком будет различие в размерах желудочков сердца, с преобладанием объема правого.
Видео ЭхоКГ при критическом стенозе аортального клапана у плода
Гипоплазия левых отделов сердца
Синдром гипоплазии левых отделов сердца (ГЛОС) характеризуается очень малыми размерами левого желудочка в сочетании с атрезией митрального и/или аортального клапана. В этих случаях приток крови к сосудам головы и шеи осуществляется ретроградным путем через артериальный проток.
Эхографическая диагностика синдрома ГЛОС у плода основывается на выявлении уменьшения размеров левого желудочка и диаметра восходящей аорты. В большинстве случаев эхографическая картина говорит сама за себя и установление диагноза не представляет трудности. Однако степень гипоплазии левого желудочка может широко варьировать. Мы наблюдали случаи, когда его полость была почти нормальных размеров, что может представлять диагностические трудности, особенно на ранних сроках беременности.
Такие изменения зачастую могут быть легко пропущены при обычном ультразвуковом исследовании анатомии плода, поскольку изображение четырехкамерного среза сердца будет почти аналогично нормальному. Однако при более тщательном осмотре обнаруживается, что движения створок митрального клапана значительно ограничены или отсутствуют, сократимость левого желудочка явно снижена, а также выявляется гиперэхогенность внутреннего контура его полости, что, вероятно, связано с фиброэластозом эндокарда.
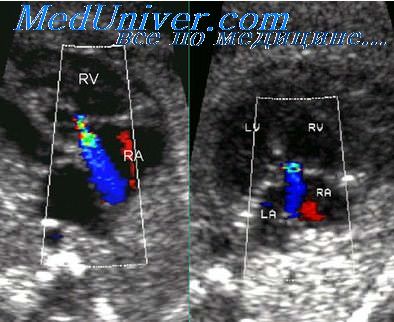
Окончательному установлению диагноза синдрома ГЛОС способствует выявление гипоплазии восходящей аорты и атрезии аортального клапана. Цветовое картирование кровотока в этой ситуации является чрезвычайно полезной дополнительной методикой при исследовании в режиме «реального времени», так как оно позволяет визуализировать ретроградный поток крови в просвете восходящей аорты и ее дуги, а для выявления недостаточности атриовентрикулярных клапанов может помочь импульсно-волновая допплерометрия.
Прогноз для новорожденных с синдромом ГЛОС чрезвычайно неблагоприятен. Именно этим пороком обусловливается 25% летальности на первой неделе жизни среди тех, у кого имеются сердечные аномалии. Почти все дети с синдромом ГЛОС, если их не лечить, умирают в течение первых 6 недель жизни. В современной литературе имеются данные о предлагаемых паллиативных вмешательствах и сведения об отдаленных исходах при лечении этого вида пороков. Не так давно стали предприниматься попытки трансплантации сердца в неонатальном периоде.
Во внутриутробном периоде при гипоплазии левых отделов сердца гемодинамика плода хорошо компенсирована. Нормальное функционирование артериального протока обеспечивает адекватную перфузию сосудов головы и шеи. Размеры плода могут оставаться нормальными, и первые клинические симптомы наиболее часто возникают после рождения. Застойная сердечная недостаточность наблюдается только в тех случаях, когда имеется недостаточность атриовентрикулярных клапанов и встречается достаточно редко.
Синдром гипоплазии левых отделов сердца
Общие сведения
Синдром гипоплазии левых отделов сердца (СГЛОС) – термин, используемый для обозначения критического врожденного порока сердца, характеризующегося резким недоразвитием его левых камер и восходящей части аорты, а также митральным или аортальным стенозом. Синдром входит в пятерку наиболее часто встречающихся в кардиологии ВПС, наряду с дефектом межжелудочковой перегородки, транспозицией магистральных сосудов, тетрадой Фалло и коарктацией аорты. СГЛОС составляет 2-4% от всех встречающихся врожденных аномалий сердца, являясь ведущей причиной гибели новорожденных в первые дни и недели жизни. Мальчики страдают данным сочетанным пороком сердца в 2 раза чаще, чем девочки.
Причины СГЛОС
Причины гипоплазии левых отделов сердца достоверно неясны. Предполагается возможность аутосомно-рецессивного, аутосомно-доминантного и полигенного типов наследования. Наиболее вероятной является теория мультифакториальной этиологии порока.
Различают два морфологических варианта СГЛОС. Первый (наиболее тяжелый) вариант включает гипоплазию левого желудочка и атрезию устья аорты, которые могут сочетаться с атрезией либо стенозом митрального отверстия; при этом полость левого желудочка щелевидна, ее объем составляет не более 1 мл. При втором (наиболее распространенном) варианте порока имеет место гипоплазия левого желудочка, стеноз устья аорты и гипоплазия ее восходящего отдела в сочетании с митральным стенозом; объем полости левого желудочка равен 1-4,5 мл.
Особенности гемодинамики
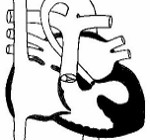
Тяжелые расстройства кровообращения при гипоплазии левых отделов сердца развиваются вскоре после рождения и характеризуются в литературе как «гемодинамическая катастрофа». Сущность нарушения гемодинамики определяется тем фактом, что кровь из левого предсердия не может поступить в гипоплазированный левый желудочек, а вместо этого попадает через открытое овальное окно в правые отделы сердца, где происходит ее смешение с венозной кровью. Эта особенность приводит к объемной перегрузке правых отделов сердца и их дилатации, которые наблюдаются с момента рождения.
В дальнейшем основной объем смешанной крови из правого желудочка поступает в легочную артерию, остальная же часть недонасыщенной кислородом крови через открытый артериальный проток устремляется в аорту и большой круг кровообращения. Ретроградным путем небольшое количество крови поступает в гипоплазированную часть восходящей аорты и венечные сосуды.
Фактически правый желудочек берет на себя двойную функцию, перекачивая кровь в легочный и системный круг кровообращения. Попадание крови в большой круг кровообращения возможно только по артериальному протоку, в связи с чем гипоплазия левых отделов сердца рассматривается как порок с дуктус-зависимым кровообращением. Прогноз для жизни ребенка зависит от сохранения артериального протока открытым.
Тяжелейшие расстройства гемодинамики приводят к выраженной легочной гипертензии вследствие высокого давления в системе сосудов малого круга; артериальной гипотонии, обусловленной неадекватным наполнением большого круга; артериальной гипоксемии, связанной со смешением крови в правом желудочке.
Симптомы СГЛОС
Клинические признаки, указывающие на гипоплазию левых отделов сердца, проявляются в первые часы или сутки после рождения. По своим проявлениям они схожи с респираторным дистресс-синдромом или кардиогенным шоком.
Как правило, дети с СГЛОС рождаются доношенными. У новорожденных наблюдается адинамия, сероватый цвет кожных покровов, тахипноэ, тахикардия, гипотермия. При рождении цианоз выражен незначительно, однако вскоре нарастает и становится диффузным либо дифференцированным, только на нижней половине туловища. Конечности наощупь холодные, периферическая пульсация на них ослаблена.
С первых дней жизни нарастает сердечная недостаточность с застойными хрипами в легких, увеличением печени, периферическими отеками. Характерно развитие метаболического ацидоза, олигурии и анурии. Нарушение системной циркуляции сопровождается неадекватной церебральной и коронарной перфузией, что приводит к развитию ишемии головного мозга и миокарда. В случае закрытия артериального протока ребенок быстро погибает.
Диагностика
Во многих случаях диагноз синдрома гипоплазии левых отделов сердца ставится еще до рождения ребенка при проведении ЭхоКГ плода. При объективном обследовании новорожденного ребенка определяется слабый пульс на руках и ногах, одышка в покое, усиленный сердечный толчок и видимая эпигастральная пульсация; выслушивается систолический шум изгнания, ритм галопа и одинарный II тон.
На ЭКГ отмечается отклонение ЭОС вправо, признаки резкой гипертрофии правых отделов сердца и левого предсердия. Фонокардиография фиксирует наличие низко- или среднеамплитудного систолического шума. Рентгенография грудной клетки при синдроме гипоплазии левых отделов сердца выявляет высокую степень кардиомегалии, шарообразные контуры сердечной тени, усиление легочного рисунка.
Эхокардиография обнаруживает следующие характерные признаки гипоплазии сердца: стеноз устья аорты и ее восходящего отдела, уменьшение размеров левого желудочка и увеличение правого желудочка, грубые изменения митрального клапана.
Дифференциальный диагноз при синдроме гипоплазии левых отделов сердца необходим с гипоплазией правого желудочка, единственным желудочком сердца, аномальным дренажем легочных вен, транспозицией магистральных сосудов, изолированным аортальным стенозом. Из внесердечных аномалий необходимо исключить острую дыхательную недостаточность, травму черепа, кровоизлияние в мозг.
Лечение СГЛОС
Наблюдение за новорожденными осуществляется в отделении реанимации. Для предупреждения закрытия или попытки открытия артериального протока осуществляется инфузия простагландина Е1. Необходимо проведение ИВЛ, коррекция метаболического ацидоза, введение диуретиков и инотропных препаратов.
Хирургическая коррекция гипоплазии левых отделов сердца проводится поэтапно и последовательно. Первый этап лечения – паллиативный; проводится в первые 2 недели жизни и заключается в выполнении операции Норвуда для уменьшения нагрузки на легочную артерию, и в то же время, для обеспечения кровоснабжения аорты. На втором этапе, в возрасте 3-6 месяцев ребенку выполняется операция Геми-Фонтена (или операция Гленна по наложению двухстороннего двунаправленного кава-пульмонального анастомоза). Окончательная гемодинамическая коррекция порока проводится примерно через год путем выполнения операции Фонтена (наложения тотального кавопульмонального анастомоза), позволяющей полностью разобщить круги кровообращения.
Прогноз
Если гипоплазия левых отделов сердца выявляется у ребенка внутриутробно, ведение беременности и родоразрешение проводится в условиях специализированного перинатального медицинского центра. С первых дней жизни ребенок должен находиться под наблюдением неонатолога, детского кардиолога и кардиохирурга для проведения как можно более ранней коррекции порока.
Другие врожденные аномалии аорты (Q25.4)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Другие врожденные аномалии аорты
Отсутствие >
Аплазия >
Врожденное(ая): > аорты
• аневризма >
• расширение >
Аневризма синуса Вальсальвы (разорванная)
Двойная дуга аорты [сосудистое кольцо аорты]
Гипоплазия аорты
Сохранение:
• витков дуги аорты
• правой дуги аорты
Исключена: гипоплазия аорты при синдроме левосторонней гипоплазии сердца (Q23.4)
Аномалия дуги аорты и главных ее ветвей, которые окружают трахею и пищевод, могут приводить к их сдавлению и сужению. Эти аномалии очень разнообразны и называются сосудистыми кольцами. Одним из наиболее часто встречающихся видов данной патологии является двойная дуга аорты (ДДА). ДДА представляет собой одновременное существование правой и левой аортальных дуг
Под аневризмами аорты понимают локальное или диффузное расширение ее просвета, превышающего нормальный диаметр аорты в 2 раза и более.
Перерыв дуги аорты может быть полным или (реже) сегментарным, когда между дугой и нисходящей аортой выявляется атрезированный сегмент в виде фиброзного тяжа. Данная форма порока может рассматриваться как крайняя степень коарктации. Его классифицируют в зависимости от уровня относительно брахиоцефальных артерий. При типе А (42%) аорта снабжает кровью три брахиоцефальных сосуда, а нисходящая аорта получает кровь из ствола легочной артерии через артериальный проток.
Сопутствующие аномалии сердца в этих случаях могут быть представлены такими пороками, как дефекты межпредсердной перегородки, субаортальный стеноз, гипоплазия восходящей аорты, двустворчатый аортальный и/или легочный клапан, аномальное отхождение правой подключичной артерии и дефекты межжелудочковой перегородки.
К сопутствующим экстракардиалыным аномалиям относятся синдром ДиДжорджи (DiGeorge) (аплазия тимуса, перерыв дуги аорты (типа В) и гипоплазия нижней челюсти), голопрозенцефалия, расщелины верхней губы и/или неба, атрезия пищевода, удвоение желудка, диафрагмальная грыжа, подковообразная почка, двусторонняя агенезия почек, олигодактилия, кисть в виде «клешни краба» (claw hand) и сиреномелия.
Характерные изменения дуги аорты в верхних отделах грудной клетки, от которой не отходят сосуды, или отходит слишком мало сосудов, позволят предположить данный диагноз. При продольной плоскости сканирования плода аорту можно будет проследить только до сонных артерий, но не удастся выявить ее переход в нисходящую аорту. Другим признаком будет различие в размерах желудочков сердца, с преобладанием объема правого.
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Целесообразно разделить возможные варианты аномалии на сосудистые кольца и сосудистые петли. При сосудистом кольце трахея и пищевод оказываются со всех сторон окруженными сосудистыми образованиями. При сосудистых петлях трахеопищеводная компрессия вызывается аномальным отхождением одного из сосудов дуги аорты или одной из ветвей легочной артерии, охватывающей пищевод и трахею сдавливающей петлей.
Сосудистые кольца:
Этиология и патогенез
Аномалия дуги аорты
В процессе эмбриогенеза у плода имеются две и дорсальная, соединенные между собой 8 парами сосудистых дуг. При окончательном формировании сосудов часть дуг остается, образуя дугу аорты и легочные артерии, другие, напротив, регрессируют и исчезают. При любом нарушении этого процесса могут развиться аномалии дуги аорты и ее ветвей.
Аневризма аорты
Развивается на фоне врожденных заболеваний стенки аорты (болезнь Марфана, синдром Элерса—Данлоса, фиброзная дисплазия); При синдроме Марфана основные изменения отмечаются в соединительной ткани, что связано с врожденными нарушениями метаболизма хондроитинсерной кислоты и основной субстанции соединительной ткани. Для этого заболевания характерны дегенерация эластических волокон и дезорганизация средней оболочки сосудов эластического типа.
Перерыв дуги аорты:
Причина порока неизвестна, но некоторый прогресс достигнут в понимании этиологии синдрома DiGeorge, который часто встречается при перерыве дуги аорты. Приблизительно у 90% пациентов с синдромом DiGeorge имеется делеция 22q11.
Эмбриология данного порока остается невыясненной. Приблизительно половина пациентов с перерывом дуги аорты имеют делецию 1,5-3 МБ участка хромосомы 22q11.2. В пределах делеции участка 3 МБ находятся 30 генов, но все еще неизвестно, какие из них вносят вклад в фенотип порока.
При полном перерыве дуги аорты кровь поступает в нисходящую аорту только через открытый артериальный проток. При гипоплазии дуги аорты кровоток в ней частично сохраняется, его величина зависит от выраженности обструкции и способности левого желудочка справляться с повышенной посленагрузкой. Большой сброс крови слева направо через дефект межжелудочковой перегородки ведет к увеличению легочного кровотока, что задерживает падение легочного сосудистого сопротивления, происходящее вскоре после рождения. Высокое легочное сосудистое сопротивление ведет к сбросу крови справа налево через открытый артериальный проток в нисходящую аорту и поддерживает кровоснабжение нижней половины тела.
Вначале, при широком артериальном протоке, АД в сосудах нижней и верхней частей тела может быть одинаковым. Сброс венозной крови справа налево через открытый артериальный проток приводит к цианозу ног при нормальном цвете рук (дифференцированный цианоз). Со временем, однако, артериальный проток сужается, что ведет к падению АД в сосудах нижней половины тела и уменьшению пульсового АД. При падении легочного сосудистого сопротивления усиливается легочный кровоток, а ток крови через открытый артериальный проток в нисходящую аорту падает еше ниже. В результате увеличивается наполнение левого желудочка, которому помимо перегрузки давлением теперь приходится справляться с перегрузкой объемом; это часто ведет к левожелудочковой недостаточности. Скорость развития всех этих нарушений может варьировать. По мере снижения кровотока в сосудах нижней половины тела развивается метаболический ацидоз, а снижение почечного кровотока приводит к олигурии и анурии.
Эпидемиология
Перерыв дуги аорты
Данный синдром является редким заболеванием; встречается в 0,03 на 1000 рожденных детей. В литературе отсутсвтвуют указания на семейный характер этой аномалии. Установлена делеция 22q11. Почти все случаи порока выявляются в первые 2 недели жизни, как только происходит закрытие артериального протока. У большинства пациентов диагностика происходит на первом дне жизни.
Факторы и группы риска
Факторы риска, влияющие на формирование врожденных пороков сердца у плода
Семейные факторы риска:
— наличие детей с врожденными пороками сердца (ВПС);
— наличие ВПС у отца или ближайших родственников;
— наследственные заболевания в семье.
Клиническая картина
Cимптомы, течение
Аневризма аорты
Систолический шум, который выслушивается над аневризматически расширенными участками аорты, обычно достаточно мягок. Если во втором межреберье справа (в проекции восходящей части аорты) выслушивается выраженный систолический шум, следует думать в первую очередь о стенозе аортального клапана. В подобных случаях, однако, встречается наиболее типичная ошибка, когда больному ставится диагноз аортального стеноза и не диагностируется аневризма восходящей части аорты. Диастолический шум, выслушиваемый во втором межреберье справа и в точке Боткина, наряду со снижением диастолического давления свидетельствует об аортальной недостаточности вследствие дилатации аортального кольца при диффузном расширении восходящей части аорты. Продолжительный шум в проекции аортального клапана обычно характерен для прорыва аневризм синуса Вальсальвы в одну из полостей сердца. Перкуторно можно выявить расширение сосудистого пучка вправо при аневризмах восходящей части аорты и влево при аневризмах нисходящей части аорты.
Перерыв дуги аорты
До закрытия артериального протока клиническая симптоматика порока может не определяться. Порок манифестирует при закрытии артериального протока тяжелой сердечной недостаточностью (тахипноэ, тахикардия, отказ от еды, летаргия).
Генетические синдромы, сопровождающиеся перерывом дуги аорты:
Синдром аномалии дуги аортs с умственной отсталостью и лицевым дизморфизмом
Редкий наследственный синдром с умственной отсталостью, патологией аорты и лицевым дизморфизмом. Умственная отсталость на уровне субнормальной, возможна микроцефалия.Различные дизморфии лица, не имеющие специфических проявлений.Поражение сердца проявляется перерывом дуги аорты, правосторонней дугой аорты, возможно в сочетании со стенозом левой подключичной артерии. Тип наследования аутосомно-доминантный.
Коарктация аорты у плода. Точность и ошибки диагностики
Журнал «SonoAce Ultrasound»
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Большинство врожденных пороков сердца (ВПС) относятся к заболеваниям, ставящим под угрозу здоровье или жизнь новорожденного. Опыт российских и зарубежных коллег показывает, что частота врожденных пороков сердца колеблется от 10 до 13 случаев на 1000 новорожденных, из них 4:1000 составляют сложные ВПС. В нашей стране средняя частота ВПС колеблется от 8-9 до 11-13 случаев на 1000 живорожденных. От сердечной патологии в раннем младенчестве погибает до 50% новорожденных.
Распределение диагностики ВПС в зависимости от нозологической формы значительно варьирует. Определенные ВПС пренатальная диагностика позволяет выявить в 90% случаев. Цифры статистики неумолимо показывают низкий процент выявления ВПС (30%) по результатам скринингового исследования. В специализированных учреждениях частота выявления ВПС выше и достигает 54% [1, 2].
Точность ультразвуковой диагностики патологии плода за последние годы многократно подвергается критике со стороны акушеров-гинекологов и в большей степени педиатров. Порой клинические признаки интересуют специалистов значительно меньше, чем данные ультразвукового антенатального исследования плода.
В этой работе представлен анализ возможностей ультразвукового пренатального исследования при коарктации аорты. В работе учтены данные, имеющиеся в публикациях отечественных и зарубежных авторов, а также материал отделения функциональной диагностики Центра.
У детей первого года жизни коарктация аорты занимает четвертое место cреди ВПС. Как правило, она развивается дистальнее места ответвления левой подключичной артерии вблизи артериального протока (ductus arteriosus). В зависимости от локализации сужения аорты относительно артериального протока различают два классических типа коарктации: предуктальную и постдуктальную [5].
Первые работы по диагностике коарктации аорты у плода относятся к 1984 г. [6, 7]. По данным литературы, трансвагинальный доступ в 12-15 нед гестации позволяет диагностировать коарктацию аорты в 21,4% случаев [1]. При трансабдоминальном доступе частота выявления коарктации аорты увеличивается: в 16-30 нед она составляет 43%, после 30 нед, по мере прогрессирования гемодинамических нарушений, не превышает 54% [8].
Согласно результатам скринингового ультразвукового обследования 20 248 плодов при сроках 19-22 нед беременности в крупном регионе Германии (1990-1994) пренатальный диагноз коарктации аорты не был установлен ни в одном из 7 случаев. Аналогичные данные были получены в Норвегии, даже в специализированном центре пренатальной диагностики. Согласно данным мультицентрового анализа, проведенного в 12 европейских странах, точный пренатальный диагноз изолированной коарктации аорты в конце 90-х гг. был установлен только в 9 (15,8%) из 57 случаев [9]. Средний срок обнаружения изолированной коарктации составил 22 нед, при этом 7 из 9 случаев было выявлено до 24 нед. При сочетании коарктации аорты с экстракардиальными пороками и хромосомными аномалиями точность ее пренатальной диагностики была существенно выше за счет выраженности гемодинамических нарушений и расширенного эхокардиографического исследования плода и составила 52%.
По данным института сердечно-сосудистой хирургии им. А.Н. Бакулева, точность диагностики не превышает 27%. Как правило, патология наиболее часто отмечается при сочетании коарктации аорты с другими кардиальными аномалиями [10].
Таким образом, обобщая статистические данные материала Центра, публикации ведущих специалистов России и зарубежных коллег, можно отметить очень низкий процент диагностики коарктации аорты у плода.
В чем же причина столь низкого процента выявления коарктации аорты антенатально?
Существует несколько факторов, затрудняющих диагностику коарктации аорты антенатально.
Рис. 1. Восходящий отдел, дуга и нисходящий отдел аорты плода в режиме энергетического допплера в норме.
Согласно «теории дуктальной ткани» коарктация аорты возникает в результате миграции гладких мышечных клеток протока в предуктальную аорту, с последующей констрикцией и сужением просвета аорты [4]. При формировании коарктации аорты в области перешейка сохраняется сужение различной протяженности и формы (рис. 2, 3). Наиболее часто это проявляется в виде локальной перетяжки, выше или ниже которой диаметр аорты сохраняется в норме.
Рис. 2. Ультразвуковое исследование восходящего отдела, дуги и нисходящего отдела аорты. Стрелкой указано место сужения.
Следовательно, оценка сужения аорты в типичном месте как признак развивающейся патологии не всегда представляется возможной в ранние сроки беременности. Поскольку речь идет о предуктальной коарктации аорты (сужение аорты локализовано проксимальнее протока), то, очевидно, что в период внутриутробной жизни в более поздние сроки отмечается снижение кровотока через левые отделы сердца и перешеек аорты и развивается гипоплазия левого желудочка и аорты. Это и способствует более позднему проявлению патологии и возможности ее ультразвуковой диагностики.
Постдуктальная коарктация развивается уже после рождения и практически всегда представляет собой изолированный дефект. Эта аномалия, вероятнее всего, является результатом разрастания мышечной ткани артериального протока в аорту плода. Когда же проток после рождения сужается, эктопическая ткань внутри аорты также сжимается, перекрывая, как тампоном, просвет сосуда по всей его окружности. В отличие от предуктальной коарктации в данном случае гипоплазия аорты не развивается. Закрытие артериального протока у некоторых детей приводит к наличию сужения аорты и развитию коарктации через 2-3 нед после рождения [13].
Третья причина не диагностированной коарктации аорты состоит в особенностях внутрисердечной гемодинамики у плода. Кровообращение плода, так же, как и взрослого, подчиняется ряду основных закономерностей физического и биологического воздействия. Поток крови движется из зоны высокого давления в область низкого давления. При выраженном потоке размеры увеличиваются, при уменьшении объема потока уменьшаются. Так, гипоплазия левого желудочка и коарктация аорты часто сопутствуют порокам со сниженным выбросом крови в аорту (стеноз аорты, дефект межжелудочковой перегородки) и практически не встречаются при пороках с большим объемом потока через аорту (при тетраде Фалло).
Во второй половине 90-х гг. было опубликовано несколько работ, посвященных изучению диагностической ценности увеличения правого желудочка и уменьшения левого желудочка при коарктации аорты. Авторы, опубликовавшие эти результаты [2], считают, что чем раньше проводится исследование (от 14-16 до 25 нед гестации), тем оно информативнее для диагностики коарктации аорты. Доказательством могут служить данные, полученные D. Brown и соавт. [15]. В представленных исследованиях коарктация аорты отмечена у 8 (62%) из 13 плодов с диспропорцией размеров желудочков до 34 нед и только у 6 (21%) из 29 плодов после 34 нед беременности. Несмотря на то, что более половины случаев коарктации аорты сопровождается диспропорцией размеров желудочков, что достаточно легко выявляется при изучении четырехкамерного среза сердца плода, во многих исследованиях в Норвегии она не была диагностирована, даже при обязательном скрининговом изучении размеров сердца до 18 нед беременности [9].
Допплеркардиография, позволяющая оценить кровоток, информативна лишь при выраженном сужении аорты [18]. При этом возникает обратная зависимость максимальной скорости кровотока в восходящем и нисходящем отделах аорты. В норме скорость в восходящем отделе немного преобладает над скоростью нисходящего отдела.
При перерыве дуги аорты отмечается ретроградный кровоток заполнения участка дуги аорты после перерыва через открытый артериальный проток и отсутствие прямого кровотока на уровне перерыва.
И, наконец, последняя причина не диагностированной коарктации аорты заключается в частоте сочетания с другими аномалиями сердца. Изолированная коарктация аорты составляет всего лишь 15-18%. По данным M. Campell и P. Polani [19], процент сочетания коарктации аорты с кардиальными аномалиями колеблется от 13 до 18%. Наиболее часто (85%) коарктация аорты сочетается с двустворчатым аортальным клапаном [20], нередко сочетается с фиброэластозом эндомиокарда, распространяющимся на выходной тракт левого желудочка и на межжелудочковую перегородку. Возможно, при коарктации аорты аномальное отхождение правой подключичной артерии или обеих подключичных артерий от нисходящей аорты, дистальней коарктации (5%).
Наличие сопутствующей кардиальной патологии может нивелировать типичные для коарктации гемодинамические изменения со стороны сердца плода, на которые обязательно обращает внимание специалист при ультразвуковом исследовании.
Рис. 5. Кинкинг аорты у плода в 34 нед беременности. Исследование в энергетическом режиме.
Итак, становится очевидным, что практически ни один из ультразвуковых признаков в антенатальном периоде не имеет высокой степени диагностической точности.
Ключом к пренатальной диагностике коарктации аорты является комплексный учет данных, получаемых как при изучении четырехкамерного среза сердца (дилатация правого желудочка, гипоплазия левого желудочка), так и при оценке самих главных артерий. При наличии коарктации диаметр аорты в среднем в 2 раза меньше диаметра дилатированной легочной артерии. Поэтому для диагностики коарктации аорты следует использовать визуализацию самой аорты, что наиболее целесообразно при скрининговой оценке среза через три сосуда. Помощь в диагностике может оказать измерение диаметра артериального протока, который при коарктации аорты широкий.
Важное дополнительное значение имеет допплерэхокардиографическое исследование, которое при коарктации орты позволяет выявить ускорение и турбулентный характер кровотока в аорте. Однако в антенатальном периоде этот признак может не проявиться [2]. Более надежно выявление левоправого шунта через овальное окно. Предполагается, что этот шунт является компенсаторным механизмом, обеспечивающим уменьшение потока крови в левый желудочек и аорту. G. Sharland и соавт. [18] отметили левоправый шунт через овальное окно у 7 из 12 плодов с коарктацией аорты. У оставшихся 5 плодов обнаруживалось как левоправое, так и праволевое направления потоков крови через овальное окно.
В случаях резко выраженных анатомических изменений аорты и функции левого желудочка с увеличением постнагрузки может наблюдаться сердечная недостаточность [21]. Нарушения гемодинамики и сердечная недостаточность характеризуются антенатально наличием выпота в перикарде, уменьшением сердечного выброса с уменьшением размеров левого желудочка [22].
После рождения и закрытия артериального протока весь поток крови поступает в восходящий отдел аорты и перешеек расширяется до нормального уровня. После рождения, когда проток перекрывается, коарктация аорты приводит к серьезными клиническим проявлениям.
Итак, анализ возможностей и ошибок ультразвуковой диагностики коарктации аорты в пренатальном периоде показывает насколько проблематично поставить диагноз во всех случаях данного порока сердца у плода. К сожалению, все эхокардиографические антенатальные признаки патологии не обеспечивают высокий процент диагностики.
Хочется надеяться, что развитие новых технологий и накопление позитивного и анализ негативного опыта позволят в будущем повысить процент диагностики такого сложного порока сердца с высокой неонатальной смертностью.
Литература
Журнал «SonoAce Ultrasound»
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.