Гипоплазия гипофиза что это такое
Что такое нанизм гипофизарный? Причины возникновения, диагностику и методы лечения разберем в статье доктора Скворцовой О. В., детского эндокринолога со стажем в 8 лет.
Определение болезни. Причины заболевания
Наиболее частые причины гипофизарного нанизма:
Теоретически, спровоцировать развитие гипофизарного нанизма может любое заболевание, которое будет затрагивать работу гипофиза.
Симптомы гипофизарного нанизма
Гипофизарный нанизм проявляется по-разному. Симптоматика зависит от причин дефицита гормона роста.
Задержка полового развития в период полового созревания объясняется отставанием костного возраста. В норме начало полового созревания у девочек наступает в период с 8-13 лет, у мальчиков — с 9-14 лет. При этом у девочек начинают расти грудные железы, а у мальчиков увеличивается объём яичек. У детей с дефицитом гормона роста эти признаки полового созревания появляются позже обычного.
Симптомами врождённого гипофизарного нанизма у новорождённых являются:
Часто у детей с гипопитуитаризмом встречается множественный кариес зубов. Это объясняется задержкой окостенения скелета и снижением обменных процессов в костной ткани.
Психоинтеллектуальное развитие у детей с гипофизарным нанизмом, как правило, не страдает, но возможны некоторые психологические проблемы: повышенная потребность в родительской опеке, снижение самооценки, трудности в общении со сверстниками.
Патогенез гипофизарного нанизма
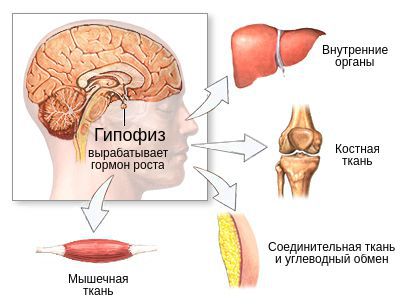
В зависимости от причин дефицита соматотропного гормона есть несколько вариантов механизмов развития заболевания. При этом в основе патогенеза всегда будет лежать нарушение выработки гормона роста. В дальнейшем его нехватка станет причиной нарушения работы органов и систем, на которые он оказывает влияние: костной, мышечной и соединительной ткани, жирового углеводного обмена. В некоторых случаях первоначально будут развиваться гипоталамические нарушения, а недостаточность соматотропного гормона станет вторичным проявлением.
Молекулярной основой изолированного дефицита гормона роста является мутация определённого гена, которая не даёт организму синтезировать гормон. От видов генетических мутаций зависит, будет ли дефицит соматотропного гормона изолированным, или же он будет сочетаться с нехваткой других гормонов гипофиза, которые лежат в основе других патологий:
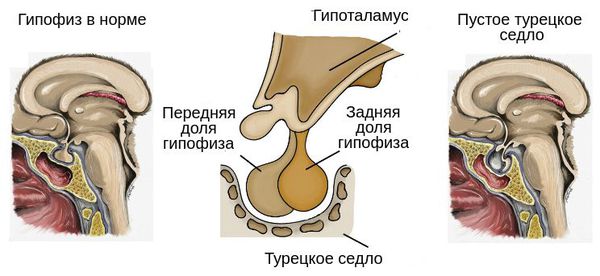
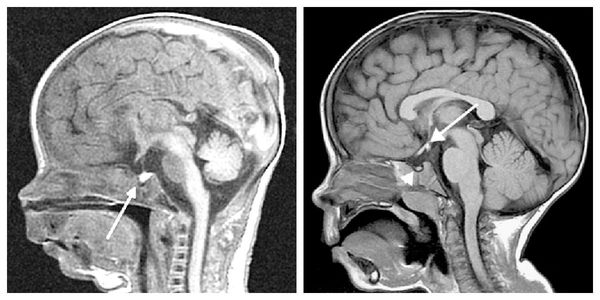
У некоторых пациентов с мутацией конкретных генов выявляется гиперплазия передней доли гипофиза (аденогипофиза). В процессе жизни может произойти её атрофия вплоть до формирования синдрома «пустого турецкого седла» — недостаточности области головного мозга, где расположен гипофиз. Данный синдром приводит к внедрению мягкой мозговой оболочки в полость турецкого седла, сдавлению и уменьшению гипофиза, что нарушает или полностью прекращает его работу.
Классификация и стадии развития гипофизарного нанизма
Врождённый гипофизарный нанизм делится на три подгруппы:
Приобретённый гипофизарный нанизм включает в себя девять причин развития болезни:
Осложнения гипофизарного нанизма
Осложнения заболевания связаны с утратой воздействия гормона роста на органы и системы. Они развиваются вследствие несвоевременной диагностики.
Так как сомтатотропин усиливает синтез белка и тормозит его распад, у детей с дефицитом этого гормона может снизиться уровень общего белка в организме и его фракций. Это сказывается на общем физическом развитии: снижается иммунитет, повышается риск присоединения других гормональных сопутствующих нарушений.
Значительная часть эффектов гормона роста передаётся через ИПФР-I (инсулиноподобный фактор роста-I). Он вырабатывается в печени под действием соматотропина и стимулирует рост внутренних органов. Вследствие дефицита соматотропного гормона рост и своевременное развитие органов может частично нарушиться. Это приводит к нарушению работы печени, почек, сердечно-сосудистой системы. Такое осложнение встречается нечасто.
При дефиците гормона роста совместно с другими гормонами гипофиза (пангипопитуитаризме) будет развиваться недостаточность других эндокринных желёз — щитовидной железы, надпочечников, репродуктивной системы. Несвоевременная диагностика этих нарушений после рождения опасна для жизни, а также может стать причиной необратимым нарушений психического или интеллектуального развития.
Диагностика гипофизарного нанизма
Диагностика заболевания начинается с оценки линейного роста ребёнка и скорости прибавки в росте. Для этого врачи сравнивают фактические параметры ребёнка с предполагаемым ростом и среднестатистической скоростью роста. Подставив все данные в специальную формулу, они вычисляют коэффициент стандартного отклонения. Если у ребёнка отставание в росте больше двух сигмальных отклонений, плохая скорость прибавки роста, то проводится дальнейшее обследование.
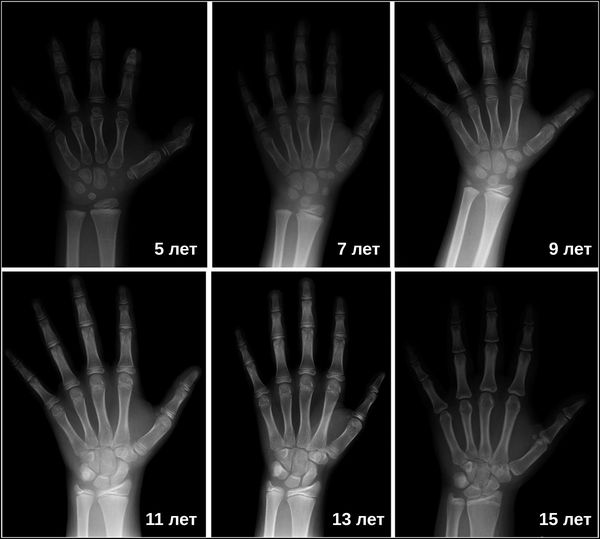
Затем врачи определяют костный возраст. Сделать это можно с помощью рентгена или УЗИ запястья. В норме костный возраст может отставать или опережать паспортный на два года.
Также важно провести оценку гормонального профиля:
Прямая оценка уровня соматотропина, как правило, не проводится. Гормон роста в течение суток выделяется в разном количестве, поэтому узнать его истинный уровень невозможно.
Для дифференциальной диагностики задержки роста, не связанной с гормоном роста, исключают дефицит железа, дефицит витамина D, общего белка и другие дефицитные состояния, т. к. их наличие может отрицательно влиять на скорость линейного роста. Рентгенография черепа в данном случае не информативна.
Для исключения определённых генетических синдромов может потребоваться консультация генетика.
При подозрении на истинный дефицит гормона роста проводятся пробы на стимуляцию соматотропина. Эти провокационные тесты стимулируют выброс гормона роста при введении определённых препаратов. Они проводятся только после исключения других возможных причин низкорослости. На основании этих проб, при отсутствии должного выброса гормона роста, будет установлен диагноз «гипопитуитаризм».
Лечение гипофизарного нанизма
Лечение проводится рекомбинантным гормоном роста, который получают методом генной инженерии. Он назначается после исключения активных злокачественных новообразований и тяжёлых сопутствующих заболеваний (как физических, так и психических). Эти состояния являются противопоказанием к использованию данного препарата.
Если имеются другие дефициты гормонов гипофиза, то перед лечением их также нужно компенсировать. Иначе должного эффекта от применения гормона роста не будет.
Цели лечения:
Противопоказания к назначению рекомбинантным гормоном роста:
Прекращают терапию гормоном роста при:
Крайне редко возможны побочные эффекты и осложнения при терапии гормоном роста:
Прогноз. Профилактика
Прогноз заболевания при своевременной диагностике и проведении должного лечения, как правило, благоприятный. Дети достигают своего генетически прогнозируемого роста и иногда даже опережают его.
Если дефицит гормона роста сочетается с дефицитом других гормонов гипофиза, то для достижения желаемого эффекта, профилактики ухудшения состояний и более лёгкой социальной адаптации ребёнка необходимо лечение других дефицитов.
Мониторинг детей, находящихся на лечении, проводится раз в полгода, при других сопутствующих дефицитах гормонов гипофиза — по показаниям.
Вопрос профилактики данного заболевания сложен, т. к. речь идёт о генетических нарушениях. В первую очередь важен ответственный подход будущих родителей к рождению ребёнка:
Для профилактики дефицита гормона роста, который возникает вследствие другого заболевания (инфекции, опухоли, травмы), следует проводить профилактики первоисточника.
Гипоплазия гипофиза что это такое
Гипопитуитаризм – довольно редко встречаемое заболевание, проявляющееся недостаточностью одного или нескольких гормонов гипофиза. Развивается оно в связи со снижением функционирования передней доли гипофиза.
Различают первичный и вторичный гипопитуитаризм. Первичный тип возникает из-за поражения гипофиза, а вторичный – гипоталамуса, что нарушает выработку гормонов, регулирующих функцию гипофиза. Недостаточность передней доли гипофиза проявляется нарушением секреции одного или нескольких гормонов гипофиза.
При нарушении секреции лишь одного гормона мы имеем дело с изолированной недостаточностью, которая развивается из-за поражения гипоталамуса и нарушения секреции им релизинг-гормонов. Обычно изолированная недостаточность свойственна для нарушения секреции СТГ и гонадотропинов.
Часто при данной патологии выявляют компенсированное, либо субкомпенсированное снижение секреции и других гормонов передней доли гипофиза, что проявляется симптомами их недостаточной секреции.
ПРИЧИНЫ ГИПОПИТУИТАРИЗМА
Развитию гипопитуитаризма способствуют такие заболевания, как: аденома гипофиза, кровоизлияния в гипофизарную аденому, опухоли, заболевание Крисчена-Хенда-Шюллера, туберкулез, сифилис, сахарный диабет, хроническая почечная недостаточность, нервная анорексия. Причинами развития гипопитуитаризма также могут быть: послеродовые кровотечения, кровоизлияния в гипофиз, тромбоз кавернозного синуса, воспалительные заболевания (базальный менингит, энцефалит), травмы черепа, синдром «пустого» турецкого седла, врождённая аплазия и гипоплазия, гипофизэктомия.
Гипоплазия гипофиза обычно протекает с недостаточностью или полным отсутствием секреции АКТГ и ТТГ. Для аплазии передней доли гипофиза характерны небольшие размеры надпочечников, атрофия щитовидной железы и недоразвитие гениталий. Наряду с этим наблюдается задержка роста, которая вызывает значительные трудности в лечении. Помимо этого наблюдаются признаки поражения других структур мозга, включая зрительный нерв.
СИМПТОМЫ И ДИАГНОСТИКА
Наиболее ранними симптомами гипопитуитаризма являются: головная боль, снижение остроты зрения и обоняния, битемпоральная гемианопсия, Брадикардия, тошнота, рвота, гипотония, изменение менструального цикла или полное прекращение менструальных выделений у женщин, снижение полового влечения, выпадение волос в подмышечных впадинах и на лобке, снижение работоспособности, усталость, понижение тургора кожи и её восковидность, плохая лактация в послеродовом периоде, сонливость, снижение температуры тела, гипогликемия, нарушение аппетита, мышечная слабость, анемия, задержка роста и полового развития у детей.
Первый этап диагностики – это тщательный сбор анамнеза и клинических жалоб у пациента, затем анализ крови на гормоны гипофиза, щитовидной железы и надпочечников. Немаловажную роль в диагностике имеет определение уровня половых гормонов и гонадотропинов в сыворотке крови, а также их экскреции с мочой.
Специальные исследования: проверка зрения, осмотр глазного дна, рентген грудной клетки, костей рук, черепа, ангиография, пневмоэнцефалография, МРТ и КТ головного мозга.
ЛЕЧЕНИЕ
После проведения диагностики назначается лечение. Если выявлена опухоль показано хирургическое вмешательство, либо рентгено-, гамма-терапия, также на протяжении всей жизни назначается заместительная терапия. Проводится это для того, чтобы восстановить необходимый уровень гормонов в организме. Гормональная заместительная терапия назначается индивидуально для каждого больного.
Причина гипофизарной недостаточности обычно устанавливается до начала терапии. В качестве заместительной терапии назначается гидрокортизон, тиреоидные гормоны. Для восстановления менструального цикла назначают эстроген-прогестерон, а для восстановления потенции у мужчин – тестостерон. На протяжении всего лечения врачами нашей клиники ведется динамическое наблюдение, а повторная оценка состояния здоровья больного после гормональной терапии проводится через три и двенадцать месяцев.
Своевременный и правильный диагноз минимизирует ущерб вашему здоровью. Будем рады Вам помочь.
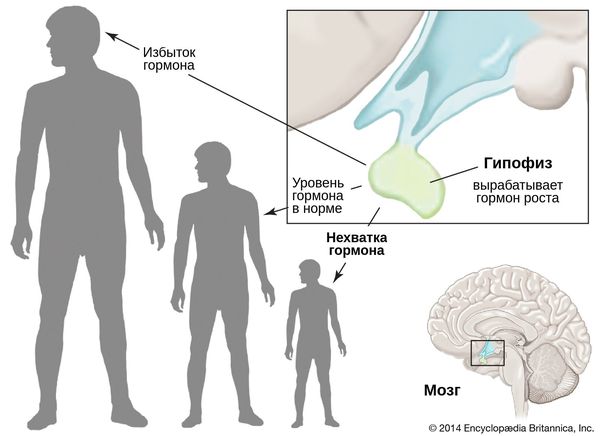
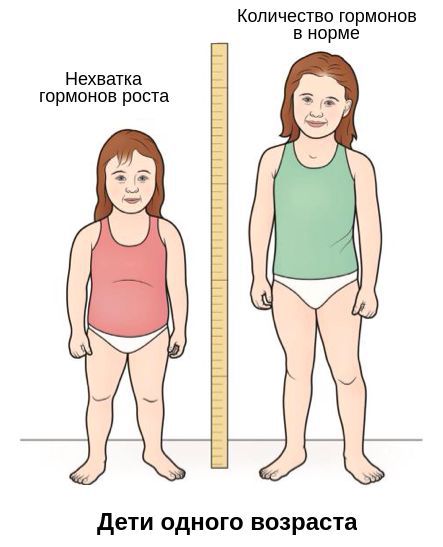
Гипофизарный нанизм – эндокринное заболевание, в основе которого лежит нарушение синтеза гормона роста (соматотропина) в передней доле гипофиза, что приводит к задержке роста скелета, внутренних органов и физическому недоразвитию. Гипофизарный нанизм характеризуется аномальной низкорослостью: рост мужчин ниже 130 см, рост женщин ниже 120 см; отмечается отставание в развитии костно-мышечной системы, гипогонадизм, уменьшение размеров внутренних органов, гипотензия, брадикардия и др. Диагностика гипофизарного нанизма предполагает определение базальной концентрации СТГ в сыворотке крови, проведение фармакологических проб, рентгенографии черепа, кистей рук и лучезапястных суставов. Лечение гипофизарного нанизма включает заместительную терапию соматотропином, анаболическими стероидами, тиреоидными препаратами, половыми гормонами.
МКБ-10
Общие сведения
Причины
Соматотропная недостаточность, лежащая в основе гипофизарного нанизма, может быть обусловлена тремя группами причин: врожденным дефицитом соматотропного гормона (СТГ), приобретенным гипосоматотропным состоянием и периферической резистентностью тканей к воздействию СТГ.
1. Врожденная недостаточность соматотропина может быть связана с генетическими дефектами (мутацией гена гормона роста, мутацией гена рецептора к соматолиберину и др.) либо аномалиями развития гипоталамо-гипофизарной системы (анэнцефалией, врожденной аплазией, гипоплазией или эктопией гипофиза).
2. Приобретенный гипофизарный нанизм развивается при:
3. Гипофизарный нанизм вследствие нечувствительности тканей-мишеней к гормону роста может развиваться при дефиците СТГ-рецепторов, отсутствии биологической активности соматотропного гормона, резистентности к инсулиноподобному фактору роста 1.
Наряду с изолированной недостаточностью СТГ, при гипофизарном нанизме может отмечаться снижение синтеза других гормонов гипофиза: гонадотропинов, ТТГ, АКТГ, что сопровождается недостаточностью функции соответствующих периферических эндокринных желез (половых, щитовидной, надпочечников), что также влияет на рост и физическое развитие. В этом случае в эндокринологии говорят о пангипопитуитарной форме карликовости.
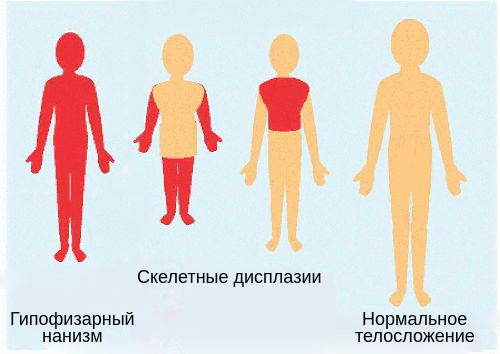
Классификация
Различают нанизм с пропорциональным и непропорциональным телосложением. К группе заболеваний с пропорциональным телосложением относят:
Нанизм с непропорциональным телосложением представлен следующими формами:
От случаев нанизма следует отличать семейные (конституциональные) формы низкорослости, которые рассматриваются как вариант индивидуального физического развития и не являются патологией.
Симптомы гипофизарного нанизма
Кожные покровы у пациентов с гипофизарным нанизмом бледные, сухие, морщинистые, с желтоватым или мраморным оттенком, что обусловлено тиреоидной недостаточностью. Волосы на голове часто тонкие, сухие, ломкие. Недоразвитие костей лицевого черепа обусловливает наличие мелких черт лица («кукольное лицо»), западение переносицы.
Распределение подкожно-жировой клетчатки может быть различным – от слабого развития до избыточного отложения жира по «кушингоидному» типу (на груди, животе, бедрах). Отмечается задержка окостенения скелета, слабое развитие мышечной системы, нарушение смены зубов. Из-за недоразвития гортани у взрослых с гипофизарным нанизмом сохраняется высокий детский тембр голоса. В соответствии с низким ростом и массой тела отмечается уменьшение размеров внутренних органов (спланхномикрия). Нередко при гипофизарном нанизме выявляется брадикардия и артериальная гипотензия.
Интеллектуальное развитие при гипофизарном нанизме, как правило, сохранно. Могут отмечаться такие психологические особенности, как негативизм, замкнутость, снижение самооценки, инфантильное поведение. При наличии дополнительных жалоб на головную боль, рвоту, нарушение зрения следует заподозрить внутричерепную патологию. При пангипопитуитарном нанизме определяются признаки вторичного гипокортицизма и гипотиреоза.
Диагностика
Критериями диагностики гипофизарного нанизма служат данные анамнеза, объективного обследования, лабораторных и инструментальных исследований. У пациентов определяются абсолютные размеры тела, а также показатель дефицита роста – разница между фактическим ростом больного и средними нормативными половозрастными показателями в популяции. При гипофизарном нанизме дефицит роста составляет более чем 2-3 квадратичных отклонения.
Основная роль при диагностике гипофизарного нанизма принадлежит определению базального уровня СТГ в сыворотке крови, циркадного ритма секреции и резервов на фоне стимуляции. У пациентов с гипофизарным нанизмом исходный уровень СТГ значительно снижен, при проведении стимулирующих тестов с инсулином, тиреолиберином, аргинином и др. повышается незначительно.
Рентгенография турецкого седла выявляет его детскую форму («стоячий овал») и широкую (т. н. ювенильную) спинку. При увеличении размеров турецкого седла и наличии участков обызвествления, в первую очередь, следует думать об опухоли. Рентгенография лучезапястных суставов и кистей позволяет определить рентгенологический («костный») возраст. При гипофизарном нанизме отмечается значительное замедление процессов окостенения скелета.
Для выяснения формы нанизма необходимо исследование инсулиноподобного фактора роста (соматомедина-С), ТТГ, ЛГ, ФСГ, Т3, Т4, кортизола в плазме и моче, антител к тиреоглобулину, микросомальной фракции тироцитов и др. Для исключения опухолевого поражения проводится КТ (МРТ) головного мозга.
При гипофизарном нанизме пациент должен быть проконсультирован эндокринологом, гинекологом (женщины), андрологом (мужчины), неврологом или нейрохирургом, офтальмологом, генетиком.
Лечение гипофизарного нанизма
У детей младшего возраста для исключения диагностических ошибок на протяжении 6-12 мес. выдерживают период наблюдения, во время которого особое внимание уделяется полноценному питанию, общеукрепляющей терапии, приему витаминов (А и D) и минералов (фосфора, кальция). Отсутствие динамики роста и физического развития является основанием для перехода к гормонотерапии.
Основу патогенетического лечения гипофизарного нанизма составляет заместительная терапия препаратами гормона роста, которая проводится прерывистыми курсами (по 2-3 мес. с такими же интервалами). Соматотропин человека назначается пациентам с доказанной эндогенной недостаточностью гормона и дифференцировкой скелета, не превышающей возрастных показателей 13-14 лет. Лечение с помощью СТГ проводится до закрытия зон роста или до достижения приемлемых ростовых параметров.
Прогноз и профилактика
При гипофизарном нанизме, обусловленном генетическими причинами, прогноз хороший. Своевременная и рациональная ЗГТ позволяет пациентам быть в достаточной степени физически развитыми, социально активными и трудоспособными. При выборе профессии не рекомендуется работа, предусматривающая повышенные физические и нервно-психические нагрузки. При отсутствии необходимого лечения у пациентов остается малый рост и физическое недоразвитие. В случае органических поражений мозга прогноз определяется основным заболеванием и динамикой его развития.
Пациенты с гипофизарным нанизмом находятся на пожизненном диспансерном учете у эндокринолога и должны посещать его каждые 2-3 месяца. Профилактика гипофизарного нанизма заключается в предупреждении инфекций, физических и психических травм у беременных; недопущении родовых травм, нейроинфекций, ЧМТ, интоксикаций у детей.
Гипоплазия гипофиза что это такое
Эта глава посвящена болезням гипофиза, которые встречаются только у детей или требуют особого внимания именно в детском возрасте. Более подробная характеристика болезней адено- и нейрогипофиза дана в гл. 6 и гл. 7.
Этим термином обозначают дефицит одного или нескольких гормонов гипофиза. Клинические проявления гипопитуитаризма зависят от того, какой гормон находится в недостатке, а также от возраста, в котором возникает дефицит гормона. Например, дефицит СТГ у грудных детей может быть причиной гипогликемии голодания, у детей препубертатного возраста приводит к задержке роста, а у взрослых проявляется морщинами вокруг глаз и рта, отложением жира в подкожной клетчатке и снижением мышечной массы.
Б. Ятрогенный гипопитуитаризм (осложнение лучевой терапии или передозировки глюкокортикоидов).
В. Аномалии развития и заболевания ЦНС
3. Голопрозэнцефалия (полное неразделение больших полушарий головного мозга) в сочетании с дефектами лицевого черепа.
4. Синдром Кальмана (изолированный дефицит гонадотропных гормонов, аносмия или гипосмия, дефекты лицевого черепа).
Г. Опухоли гипоталамуса и гипофиза
1. Краниофарингиома. Секреция гормонов аденогипофиза отсутствует или сильно снижена. Иногда поражается нейрогипофиз, что приводит к несахарному диабету. Типичные проявления краниофарингиомы — низкорослость и ожирение. При рентгенографии черепа часто выявляют супра- или интраселлярные кальцификаты, эрозию стенок или увеличение размеров турецкого седла. Возможны нарушения зрения. Краниофарингиому следует заподозрить при задержке роста, отставании костного возраста от паспортного, ожирении.
2. Глиома зрительного нерва.
3. Хромофобная аденома гипофиза.
Д. Первичный синдром пустого турецкого седла
2. Описаны случаи преждевременного полового развития.
II. Лабораторная диагностика идиопатического гипопитуитаризма. Проводят стимуляционные пробы с либеринами. Если гипопитуитаризм обусловлен дисфункцией гипоталамуса, получают следующие результаты:
А. Проба с тиролиберином: после в/в введения протирелина концентрация ТТГ в сыворотке повышается до уровня, свойственного здоровым людям, но это повышение запаздывает на 30—60 мин по сравнению с нормой.
Б. Проба с гонадолиберином: стимулировать секрецию ЛГ и ФСГ удается только путем многократного в/в или п/к введения гонадорелина на протяжении нескольких суток.
В. Проба с соматолиберином: после введения соматорелина уровень СТГ возрастает незначительно или вообще не возрастает.
1. При задержке полового развития уровень тестостерона после курса инъекций ХГ возрастает, а при изолированном дефиците гонадотропных гормонов не изменяется. Чтобы исключить первичный гипогонадизм, изучают анамнез, проводят физикальное исследование и пробы с гонадолиберином и тиролиберином.
Гормонально-активные опухоли головного мозга у детей
V. Хромофобные аденомы гипофиза (у детей встречаются редко)
VI. Пролактиномы (см. гл. 10). Высокий уровень пролактина может блокировать секрецию ФСГ и ЛГ и тем самым вызывать вторичный гипогонадизм.
В последние годы задача лечения высокорослости становится для врачей-эндокринологов все менее актуальной, поскольку высокорослость в современном обществе считается скорее преимуществом, чем недостатком.
IX. Этиология. Чаще всего высокорослость — конституциональный или наследственный признак. Другие причины высокорослости:
Б. Синдром Марфана — наследственная болезнь, для которой характерны высокорослость, диспропорциональный рост туловища и конечностей, аномалии развития глаз и ушей, артериальная гипотония, кифосколиоз, клапанные пороки сердца, медионекроз аорты. Способы лечения неизвестны.
Г. Церебральный гигантизм (синдром Сотоса). Характерные признаки: высокорослость, крупный шишковатый череп, выпуклый лоб, гипертелоризм, высокое небо, опущенные вниз наружные края глазной щели (антимонголоидный разрез глаз), умеренная задержка психического развития, костный возраст опережает паспортный. Эндокринный статус — нормальный.
Д. Синдром Беквита—Видемана (грыжа пупочного канатика, макросомия, макроглоссия, гипогликемия).
Е. Нелеченная врожденная гиперплазия коры надпочечников в препубертатном возрасте.
И. Преждевременное половое развитие (гиперсекреция эстрогенов или андрогенов).
X. Диагностика. Многие причины высокорослости можно выявить при физикальном исследовании. Для установления и подтверждения диагноза определяют:
А. Уровень СТГ (гигантизм).
Б. Костный возраст (любые заболевания).
В. Содержание и спектр аминокислот, в том числе метионина и гомоцистина, в моче и сыворотке (гомоцистинурия).
Г. Уровень 17-гидроксипрогестерона (врожденная гиперплазия коры надпочечников).
Д. Уровень глюкозы (гипогликемия при синдроме Беквита—Видемана).
Е. Уровень андрогенов или эстрогенов (преждевременное половое развитие).
Ж. Проводят цитогенетический анализ (синдром Клайнфельтера).
XI. Лечение. Эффективные и безопасные способы лечения высокорослости не разработаны. Применение высоких доз эстрогенов вызывает тяжелые побочные эффекты и потому не рекомендуется для лечения высокорослости у девочек.
Преждевременное половое развитие
Преждевременное половое развитие — это появление некоторых или всех вторичных половых признаков (а в некоторых случаях — и наступление половой зрелости) у девочек младше 8 лет или у мальчиков младше 9 лет. При истинном преждевременном половом развитии формирование вторичных половых признаков изосексуальное (соответствующее генетическому и гонадному полу ребенка) и завершенное; обусловлено активацией гипоталамуса и гиперсекрецией гонадотропных гормонов. Ложное преждевременное половое развитие вызвано другими причинами, обычно остается незавершенным и может быть как изо-, так и гетеросексуальным.
XII. Эпидемиология. Преждевременное половое развитие у девочек наблюдается гораздо чаще, чем у мальчиков. Основные причины преждевременного полового развития:
1. Идиопатическое преждевременное половое развитие (80—90%).
2. Заболевания яичников (5%).
3. Заболевания ЦНС ; преимущественно опухоли головного мозга (3—5%).
1. Заболевания ЦНС ; преимущественно опухоли головного мозга (40—50%).
2. Заболевания надпочечников (25%).
3. Идиопатическое преждевременное половое развитие (10—20%).
4. Заболевания яичек (8—10%).
Таким образом, преждевременное половое развитие, обусловленное опухолями головного мозга, встречается у мальчиков намного чаще, чем у девочек. Из этого не следует, однако, что опухоли мозга встречаются у девочек реже, чем у мальчиков.
XIII. Классификация и этиология преждевременного полового развития
А. Истинное преждевременное половое развитие (полное, изосексуальное; обусловлено преждевременной активацией импульсной секреции гонадолиберина или гиперфункцией гонадотропных клеток аденогипофиза).
1. Идиопатическое преждевременное половое развитие.
4) Пинеалома (в том числе эктопическая).
5) Нейрональная гамартома гипоталамуса.
д. Постинфекционное преждевременное половое развитие.
б. Рассела—Сильвера (другие компоненты синдрома: внутриутробная задержка развития, задержка роста, маленькая треугольная голова, гипогликемия, повышенный уровень ЛГ и ФСГ ).
г. Нейрофиброматоз (болезнь Реклингхаузена).
Б. Ложное преждевременное половое развитие (не зависит от секреции гонадолиберина и не связано с первичными нарушениями секреции гонадотропных гормонов)
1) Гранулезоклеточная опухоль: костный возраст опережает паспортный; высокий уровень эстрогенов, низкое содержание ФСГ и ЛГ ; в 30% случаев опухоль злокачественная, обычно пальпируется; наблюдаются маточные кровотечения, хотя лобковое оволосение отсутствует и молочные железы не развиваются.
2) Лютеома: высокий уровень эстрогенов и прогестерона; высокое содержание прегнандиола в моче.
3) Фолликулярная киста яичника: самое частое эстрогенсекретирующее новообразование у девочек; объемное образование или боли в животе; рекуррентные признаки преждевременного полового развития; нециклические менструации; нередко встречается у девочек, родившихся недоношенными.
б. Феминизирующие (эстрогенсекретирующие) опухоли надпочечников.
в. Гиперплазия сетчатой зоны коры надпочечников (очень редко).
2. Мальчики (заболевания надпочечников или яичек)
а. Врожденная гиперплазия коры надпочечников (например, недостаточность 21-гидроксилазы или 11бета-гидроксилазы).
б. Вирилизирующие опухоли надпочечников.
г. Наследственный тестостероновый токсикоз — не зависящее от гонадотропных гормонов преждевременное созревание клеток Лейдига, клеток Сертоли и сперматогенных клеток. Лечение: медроксипрогестерона ацетат, кетоконазол, спиронолактон (или флутамид, нилутамид) в сочетании с тестолактоном.
3. Девочки и мальчики
В. Варианты истинного преждевременного полового развития
3. Преждевременное изолированное менархе.
Г. Гетеросексуальное преждевременное половое развитие
1. Феминизация у мальчиков.
а. Опухоли надпочечников или врожденная гиперплазия коры надпочечников.
2. Вирилизация у девочек: врожденная гиперплазия коры надпочечников (недостаточность 21-гидроксилазы, 11бета-гидроксилазы, 3бета-гидроксистероиддегидрогеназы).
XIV. Лабораторные и инструментальные исследования
4. Рентгенография скелета и черепа.
6. Андрогены — при гетеросексуальном преждевременном половом развитии.
2. Тестостерон, дегидроэпиандростерона сульфат, андростендион.
4. Рентгенография скелета и черепа.
6. Эстрогены — при гетеросексуальном преждевременном половом развитии.
XV. Дифференциальная диагностика кровянистых выделений из влагалища. Кровянистые выделения из влагалища характерны для всех форм преждевременного полового развития; они обусловлены маточными кровотечениями и обычно появляются на фоне пубертатного ускорения роста, развития молочных желез и лобкового оволосения. Другие причины кровянистых выделений из влагалища:
В. Травма (инородное тело, последствие аварии, изнасилование или развратные действия).
Г. Выпадение мочеиспускательного канала или влагалища.
1. Аденокарцинома влагалища, шейки матки.
2. Идиопатическое преждевременное половое развитие.
4. Врожденная гиперплазия коры надпочечников.
5. Эстрогенсекретирующие опухоли яичников или надпочечников.
А. Аналоги гонадолиберина (средство выбора при истинном преждевременном половом развитии).
Несахарный диабет (см. также гл. 7)
XVII. Центральный несахарный диабет
1. Первичный центральный несахарный диабет
2. Вторичный центральный несахарный диабет
а. Опухоли — самая частая причина центрального несахарного диабета. У детей чаще всего встречается краниофарингиома.
б. Гистиоцитоз X. Для диссеминированной формы этой болезни (синдром Хенда—Шюллера—Крисчена) характерны эндокринные нарушения. Менее чем у 10% больных с этим синдромом наблюдается классическая триада признаков (триада Крисчена): дефекты развития черепа, экзофтальм и несахарный диабет. У 5—50% больных проявляется только несахарный диабет. Другие эндокринные нарушения: гиперосмоляльность плазмы, сопровождающаяся гипернатриемией (гипернатриемический синдром гиперосмолярности), задержка роста, гиперпролактинемия, вторичный гипогонадизм, гипопитуитаризм, первичный или вторичный гипотиреоз, сахарный диабет. Все эти нарушения обусловлены инфильтрацией гипоталамуса или нейрогипофиза клетками Лангерганса. У больных с гистиоцитозом X и несахарным диабетом при МРТ обнаруживают дефекты гипоталамуса и нейрогипофиза.
в. Инфекции (например, менингит) могут вызывать преходящий несахарный диабет.
д. Черепно-мозговая травма (у детей — редкая причина несахарного диабета).
е. Синдром Вольфрама (синдром DIDMOAD): несахарный диабет, сахарный диабет, атрофия зрительных нервов, глухота.
1. Центральный несахарный диабет может быть как наследственным, так и спорадическим.
2. Наследование центрального несахарного диабета аутосомно-доминантное.
1. Никтурия и ночное недержание мочи.
6. Иногда косоглазие или диплопия.
7. Дегидратация (у грудных детей и у детей старшего возраста с нарушенным механизмом жажды может привести к сопору или коме).
1. Концентрационная способность почек нарушена (низкие удельный вес и осмоляльность мочи); осмоляльность плазмы и концентрация натрия в сыворотке в норме или повышены.
2. Если ребенку ночью не давать пить, удельный вес утренней порции мочи должен быть не ниже 1,018; при меньшем удельном весе следует заподозрить несахарный диабет.
4. Рентгенография и КТ или МРТ головы (для исключения новообразований и повреждений сосудов мозга).
5. Исследование полей зрения.
6. Определение всех гормонов гипофиза.
7. Семичасовая проба с лишением жидкости. Во время исследования внимательно следят за состоянием ребенка.
а. Перед пробой потребление жидкости не ограничивают.
б. Между 7:00 и 8:00 дают обычный завтрак; после завтрака не позволяют ни есть, ни пить.
в. В 8:00 ребенок должен помочиться, чтобы полностью освободить мочевой пузырь.
г. Перед началом пробы (в 8:00) и затем через каждый час ребенка взвешивают, берут мочу и определяют удельный вес каждой пробы.
1) Пробу, собранную за 1-й час, отправляют в лабораторию для срочного определения осмоляльности мочи (М1).
2) В течение 1-го часа берут кровь и определяют содержание электролитов и осмоляльность плазмы (П1).
ж. Внимание: если вес ребенка уменьшился более чем на 10%, сразу переходят к заключительному этапу (см. гл. 8, п. XVII.Г.7.л).
з. Если диурез заметно уменьшился или удельный вес мочи превысил 1,012, врач имеет право прекратить исследование.
и. В течение 7-го часа (между 14:00 и 15:00) отправляют в лабораторию вторую пробу мочи для срочного определения осмоляльности (М2).
к. Второй раз берут кровь для срочного определения электролитов и осмоляльности плазмы (П2).
1) Распыляют в носу одну дозу аэрозольной формы липрессина (7 мкг).
2) Вводят десмопрессина ацетат в дозе 1,25—1,5 мкг в виде капель в нос.
3) Вводят аргипрессин (водный раствор для инъекций с концентрацией 20 ед/мл) в дозе 2,5—5 ед в виде капель в нос либо помещают в нос ватный тампон, пропитанный раствором аргипрессина. На протяжении 2 ч (начиная с 15:00) продолжают собирать мочу с интервалами 30 мин, измеряют объем и удельный вес мочи. Если изменений нет, направляют пробу в лабораторию для определения осмоляльности мочи (М3) и снова берут кровь для определения электролитов и осмоляльности плазмы (П3). В течение этих последних 2 ч ребенку разрешают пить; количество жидкости должно равняться выделенному за предшествующие 30 мин объему мочи.
3) Центральный несахарный диабет (чувствительность почек к АДГ сохранена): М3 возрастает, П3 не меняется или падает; М3/П3 > 1,0.
4) Нефрогенный несахарный диабет (почки нечувствительны к АДГ ): М3 не меняется, П3 не меняется или возрастает; М3/П3 — 0,2—1,0.
5) Нервная полидипсия: М1/П1 может быть как при несахарном диабете, но М2/П2 обычно в пределах нормы.
н. В конце пробы можно определить концентрацию АДГ в плазме, но это не всегда помогает установить диагноз.
о. Если причиной несахарного диабета является изолированное нарушение осморецепторной системы регуляции секреции АДГ (при нормальном функционировании барорецепторной системы регуляции), проба может оказаться неинформативной.
1. Нервная полидипсия (у детей встречается редко). При длительном потреблении большого количества воды осмоляльность интерстициальной жидкости мозгового вещества почек снижается, их концентрационная функция нарушается, развивается полиурия.
2. Нефрогенный несахарный диабет.
4. Почечный канальцевый ацидоз.
Е. Лечение. Основной принцип — возмещение дефицита АДГ (или усиление действия АДГ ) и обеспечение достаточного количества жидкости.
2. Липрессин тоже распыляют в носу (по 1—2 вдувания в каждую ноздрю; 3—4 дозы в сутки). Действие препарата продолжается 2—4 ч.
3. Аргипрессин вводят в/м или п/к в дозе 2,5—5 ед 2—4 раза в сутки.
5. Особенности лечения грудных детей:
а. Диета с низкой осмотической нагрузкой.
б. При назначении тиазидных диуретиков — обильное питье.
в. Некоторые эндокринологи рекомендуют перед сном вводить одну дозу липрессина.
г. Если ребенок не может самостоятельно есть, устанавливают назогастральный зонд или прибегают к гастростомии.
6. При частичном центральном несахарном диабете (легкая форма заболевания) медикаментозное лечение не требуется. Необходимо обеспечить достаточное количество жидкости.
Ж. Прогноз. На фоне заместительной гормональной терапии и достаточного потребления жидкости рост и развитие ребенка постепенно нормализуются.
А. Патогенез. Нефрогенный несахарный диабет обусловлен дефектом рецепторов АДГ типа V2 на клетках дистальных отделов нефрона, в частности — неспособностью рецепторов активировать аденилатциклазу. Об этом свидетельствует отсутствие прироста уровня цАМФ в моче после в/в введения АДГ (аргипрессина).
Б. Генетика. Заболевание наследуется рецессивно, сцепленно с X-хромосомой, поэтому у мальчиков с генетическим дефектом всегда проявляется тяжелая форма болезни. У гетерозиготных девочек заболевание не проявляется или проявляется в легкой форме.
В. Клиническая картина. Симптомы появляются в первые 3 нед жизни.
1. Ребенок не прибавляет в весе, постоянно плачет, возбужден, раздражителен.
4. Дегидратация на фоне гиперосмоляльности плазмы.
5. У детей младшего возраста — расширение мочевого пузыря и мочеточников.
6. Для детей старшего возраста характерны задержка роста и психического развития, плохая успеваемость в школе.
1. Гипернатриемия; гиперосмоляльность плазмы.
2. Нет прибавки в весе.
3. Функция почек не нарушена.
4. Отсутствие реакции на АДГ на заключительном этапе 7-часовой пробы с лишением жидкости. Проба с гипертоническим раствором NaCl противопоказана из-за опасности тяжелой гипернатриемии.
5. Концентрация АДГ в плазме повышена.
7. Для выявления носительства дефектного гена у матери определяют осмоляльность мочи после 12-часового лишения жидкости.
Д. Лечение. Цель — снижение диуреза, предотвращение дегидратации и синдрома гиперосмолярности.
2. Естественное вскармливание следует предпочесть искусственному, так как грудное молоко создает меньшую осмотическую нагрузку.
3. Уменьшают содержание осмотически активных веществ — белков и поваренной соли — в рационе.
4. Для усиления экскреции натрия назначают диуретики (тиазидные, фуросемид, этакриновую кислоту, спиронолактон).
а. Хлортиазид, 30 мг/кг/сут (или 1 г/м 2 /сут) внутрь в 3 приема.
б. Гидрохлортиазид, 3 мг/кг/сут (или 0,1 г/м 2 /сут) внутрь в 3 приема.
в. Хороший способ лечения врожденного нефрогенного несахарного диабета — комбинация гидрохлортиазида (2 мг/кг/сут внутрь) с калийсберегающим диуретиком амилоридом (20 мг/1,73 м 2 /сут внутрь). Этот способ позволяет обойтись без добавления калия к пище и почти не вызывает отдаленных побочных реакций. Антидиуретическое действие обоих препаратов, по-видимому, суммируется
Синдром гиперсекреции АДГ (см. также гл. 7)
Синдром гиперсекреции АДГ характеризуется гипонатриемией, гипоосмоляльностью плазмы и выведением концентрированной мочи (осмоляльность мочи > 300 мосмоль/кг). Синдром может быть обусловлен избыточной нерегулируемой секрецией АДГ (не зависящей от осмотических и неосмотических стимулов) или усилением действия АДГ на клетки дистальных отделов нефрона.
А. Самые частые причины у детей — заболевания легких (пневмония, туберкулез) и головного мозга (инфекции, кровоизлияния, черепно-мозговая травма).
Б. Опухоли (у детей бывают причиной синдрома гораздо реже, чем у взрослых).
В. У новорожденных — ИВЛ с положительным давлением.
Г. Иногда — применение винкристина и циклофосфамида для лечения лейкозов.
Д. Хлорпропамид, некоторые анальгетики, барбитураты.
Е. Болезни сердца, тяжелый гипотиреоз, первичная надпочечниковая недостаточность.
XX. Клиническая картина: слабость, сонливость, оглушенность.
В. Осмоляльность мочи превышает осмоляльность плазмы.
Г. Нормальная функция почек и коры надпочечников.
Д. Потеря натрия с мочой даже на фоне гипонатриемии; концентрация натрия в моче обычно > 20 мэкв/л.
Е. Иногда — повышенный уровень АДГ в плазме.
А. Ограничивают потребление жидкости.
Б. Если улучшения нет, медленно вводят 3% NaCl (5 мл/кг) в/в в сочетании с фуросемидом (см. гл. 7, п. XVI.А).
В. Устраняют причину: отменяют лекарственные средства, вызвавшие заболевание; при инфекциях назначают антимикробные препараты.
Г. Назначать демеклоциклин и литий детям не рекомендуется.
Этот синдром встречается у больных несахарным диабетом. Он обусловлен дисфункцией осморецепторной системы регуляции секреции АДГ (см. гл. 7, п. III.Б). Ведущие нарушения при этом синдроме — гипернатриемия и гиперосмоляльность плазмы.
XXIII. Клиническая картина. Нарушение механизма жажды у больных несахарным диабетом приводит к тому, что потребление жидкости на фоне полиурии не увеличивается. Поэтому возможно развитие тяжелой дегидратации и гиперосмолярной комы.
А. Нормализация ОЦК (инфузия жидкости).
1. Copinschi G, et al. Enhanced ACTH and blunted cortisol responses to corticotropin-releasing factor in idiopathic panhypopituitarism. J Pedi 105:591, 1984.
2. Dashe AM, et al. A water deprivation test for the differential diagnosis of polyuria. JAMA 185:699, 1963.
3. Dunkel L, et al. Gonadotropin-releasing hormone test and human chorionic gonadotropin test in the diagnosis of gonadotropin deficiency in prepubertal boys. J Pediatr 107:388, 1985.
4. Ehrmann DA, et al. A new test of combined-testicular function using th gonadotropin-releasing hormone agonist Nafarelin in the differentiation gonadotropin deficiency from delayed puberty: Pilot studies. J Clin Endocrinol Metab 69:963, 1989.
5. Frasier SD. Pediatric Endocrinology. New York: Grune and Stratton, 1980.
6. Frasier SD, et al. A water deprivation test for the diagnosis of Diabetes insipidus in children. Am J Dis Child 114:157, 1967.
7. Kaplan SA (ed.). Clinical Pediatric and Adolescent Endocrinology. Philadelphia: Saunders, 1982.
8. Knoers N, Monnens L. Amiloride-hydrochlorothiazide vs. indomethicine hydrochlorothiazide in the treatment of nephrogenic diabetes insipidus. Pediatr 117:499, 1990.
9. Mendoza SA. Syndrome of inappropriate antidiuretic hormone secretion (S Pediatr Clin North Am 23:681, 1976.
10. Partsch C-J, et al. Differentiation of male hypogonadotropic hypogonadism constitutional delay of puberty by pulsatile administration of gonadotropin releasing hormone. J Clin Endocrinol Metab 60:1196, 1985.
11. Robertson GL. Differential diagnosis of polyuria. Annu Rev Med 39:425, 1985.
12. Stosel H, Braunstein G. Endocrine abnormalities associated with Langerhans cell histiocytosis. The Endocrinologist 1:393, 1991.
13. Tien RD, et al. Thickened pituitary stalk on MR image in patients with and DI. AJNR 11:703, 1990.
14. Williams, RD (ed). Textbook of Endocrinology (7th ed). Philadelphia: Saunders, 1985.
15. Yanovski J, et al. Repeated, childhood vaginal bleeding is not always precocious puberty. Pediatrics 89:149, 1992.