Гипоплазия надпочечников что это такое
Что такое надпочечниковая недостаточность (гипокортицизм)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Зотовой Ю. А., эндокринолога со стажем в 24 года.
Определение болезни. Причины заболевания
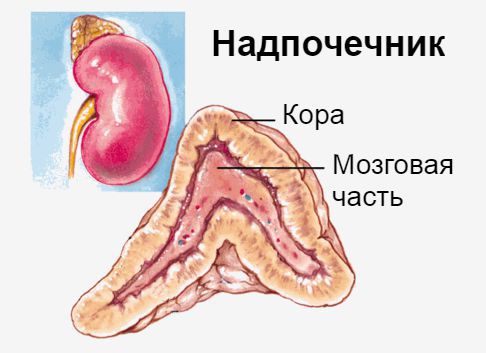
Надпочечники — это эндокринные железы. Их внутренняя (мозговая) часть производит гормон адреналин, который мобилизует все защитные силы организма. Наружная часть надпочечников — кора — вырабатывает кортикостероиды:
Причины первичной надпочечниковой недостаточности:
1. Нарушение развития надпочечников:
2. Деструкция надпочечников (разрушение):
3. Нарушения стероидогенеза (образования стероидов):
Причины вторичной и третичной надпочечниковой недостаточности:
1. Врождённый вторичный гипокортицизм.
2. Деструкция гипоталамо-гипофизарных структур:
Симптомы надпочечниковой недостаточности
Часть симптомов недостаточности маскируется под синдром хронической усталости: необъяснимая утомляемость, отсутствие бодрости в утренние часы. Человек начинает хуже переносить физические нагрузки, самочувствие становится лучше в горизонтальном положении. Астению сопровождает раздражительность, нетерпимость, проблемы с памятью.
Нарушается работа желудочно-кишечного тракта: снижается аппетит вплоть до полного отсутствия, возникает тошнота, рвота, боли в животе. Уменьшение массы тела связано с ухудшением аппетита, нарушением всасывания в кишечнике, обезвоживанием.
При дефиците надпочечниковых андрогенов у женщин снижается либидо, оволосение в подмышечной впадине становится скудным.
В ситуации стресса, острой инфекции, операции значительно повышается потребность организма в гормонах коры надпочечников, поэтому в таких случаях состояние может значительно ухудшиться из-за декомпенсации надпочечниковой недостаточности — опасного для жизни нарушения работы надпочечников, при котором у организма исчерпаны возможности механизмов приспособления. Обращают на себя внимание необычно быстрая утомляемость и чрезмерная усталость, головокружение, очень низкое артериальное давление, тяга к солёной пище, плохой аппетит, тошнота, рвота, понос (диарея), боли в животе, мышечная слабость, похудание без видимых причин, снижение настроения.
Патогенез надпочечниковой недостаточности
Глюко- и минералокортикоиды участвуют в белковом, углеводном, жировом и водно-электролитном обмене. Поэтому при их нехватке данные процессы нарушаются и снижается артериальное давление.
Дефицит альдостерона — естественного минералокортикоида — становится причиной выраженных сердечно-сосудистых нарушений из-за снижения реабсорбции (обратного всасывания) Na+ в почках. В связи с этим уменьшается объём циркулирующей крови и снижается артериальное давление вплоть до шока. При повышении уровня калия нарушается сердечный ритм и развиваются миопатии — заболевания, проявляющиеся мышечной слабостью. При снижении реабсорбции Na+ в кишечнике возникает целый каскад симптомов нарушения пищеварения, таких как боли в животе, нарушение всасывания.
Дефицит андрогенов, которые вырабатывают надпочечники, усиливает процессы распада сложных веществ в организме и повышает уровень остаточного азота.
Отличия центральных форм гипокортицизма от первичного:
Классификация и стадии развития надпочечниковой недостаточности
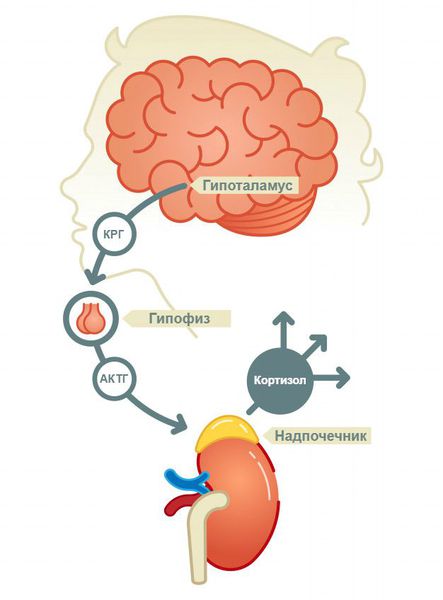
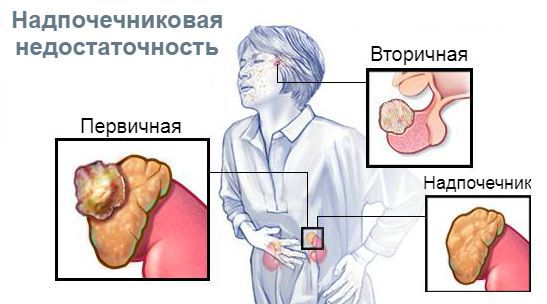
В зависимости от уровня поражения гипоталамо-гипофизарно-надпочечниковой системы различают три вида надпочечниковой недостаточности:
По клиническому течению выделяют два вида надпочечниковой недостаточности:
При заместительной гормонотерапии первичного хронического гипокортицизма лечащий врач подбирает своему пациенту дозу глюкокортикоидов для возмещения недостающих гормонов, причём важно, чтобы в итоге уровень гормонов был строго в норме — не меньше и не больше.
Если лекарства полностью возмещают дефицит и не дают избытка гормонов в организме, то пациент чувствует себя гораздо лучше. Это означает, что заболевание не излечено раз и навсегда, так как оно хроническое, но находится в фазе компенсации.
Осложнения надпочечниковой недостаточности
Диагностика надпочечниковой недостаточности
Иногда при частичном поражении надпочечников эти показатели остаются в пределах нормы. Чтобы получить более надёжный результат, исследовать функцию коры надпочечников лучше с помощью стимулирующих тестов. Данный этап необходим, если по результатам клинико-лабораторного обследования не удалось однозначно подтвердить наличие надпочечниковой недостаточности.
Лечение надпочечниковой недостаточности
Лечение надпочечниковой недостаточности жизненно необходимо. Оно направлено на ликвидацию процесса, который вызвал поражение надпочечников, и на замещение дефицита гормонов и электролитов.
Все перечисленные препараты всегда нужно принимать строго в определённое время. Пропуск приёма лекарств может быть очень опасен. Если по какой-то причине приём был пропущен, обязательно нужно принять ту же дозу препарата позже или увеличить дозу вдвое.
Если пациенту с недостаточностью предстоит операция, то нужно обязательно обсудить с лечащим врачом изменение дозы: она будет зависеть от сложности вмешательства.
Прогноз. Профилактика
При своевременной диагностике заболевания и адекватном лечении прогноз для жизни благоприятный.
Пациент с этой болезнью может делать всё: учиться, работать, заниматься спортом, иметь семью, как и все здоровые люди. Для этого нужно соблюдать простые правила:
1. Важно всегда иметь при себе информационную карточку. В ней должно быть указано следующее: «У меня надпочечниковая недостаточность. Если я без сознания или у меня судороги, рвота, бред, мне нужно СРОЧНО сделать инъекцию гидрокортизона 100 мг внутримышечно или внутривенно. Промедление опасно для жизни». Также в карточке нужно указать телефон, по которому можно связать с родственниками или лечащим врачом. Эта информация крайне важна для людей или врачей, которые будут помогать в экстренной ситуации.
Надпочечниковая недостаточность у детей
Надпочечниковая недостаточность у детей (НН), или гипокортицизм, — это клинический синдром, обусловленный дефицитом секреции гормонов коры надпочечников. В зависимости от локализации патологического процесса выделяют первичную, вторичную и третичную НН.
Надпочечниковая недостаточность у детей (НН), или гипокортицизм, — это клинический синдром, обусловленный дефицитом секреции гормонов коры надпочечников. В зависимости от локализации патологического процесса выделяют первичную, вторичную и третичную НН. При первичной НН поражается сама ткань надпочечников, при вторичной — передняя доля гипофиза с нарушением секреции АКТГ, третичная форма связана с патологией гипоталамуса и дефицитом продукции последним кортикотропин-релизинг гормона. Подразделяют НН на острую и хроническую. Хроническая надпочечниковая недостаточность (ХНН) была описана еще в середине XIX в. Аддисоном на основании результатов вскрытия. Эта форма встречается с периодичностью 1 случай на 10 тыс. чел., в 2 раза чаще у лиц мужского пола зрелого и пожилого возраста. Многие авторы отмечают, что ХНН у детей диагностируется редко, в связи с многообразием и неспецифичностью симптомов гипокортицизма.
Клинические симптомы хронической надпочечниковой недостаточности возникают при поражении 95% ткани коры надпочечников. Почти у 60% больных недостаточность надпочечников возникает в результате идиопатической атрофии надпочечников.
В этой группе основной причиной развития заболевания в настоящее время считается аутоиммунная деструкция коры надпочечников (аутоиммунный адреналит 70–85%).
В ткани пораженных надпочечников при этой форме патологии отмечается обширная лимфоплазмоцитарная инфильтрация, надпочечники уменьшены в размерах, кора атрофирована. В сыворотке крови таких больных обнаруживаются антитела к микросомальным и митохондриальным антигенам коры надпочечников, а также антитела к 21-гидроксилазе — одному из ключевых ферментов стероидогенеза.
Аутоиммунный адреналит нередко сочетается с другими аутоиммунными эндокринопатиями. Аутоиммунный полигландулярный синдром типа 1 (АПС-1) включает в себя недостаточность надпочечников, гипопаратиреоз и кандидамикоз. У части больных этот синдром сочетается с гипогонадизмом, алопецией, витилиго, пернициозной анемией, аутоиммунными заболеваниями щитовидной железы, хроническим гепатитом.
Аутоиммунный полигландулярный синдром типа 2 (АПС-2) характеризуется сочетанием сахарного диабета 1 типа, аутоиммунных заболеваний щитовидной железы и надпочечниковой недостаточности (синдром Шмидта). АПС-1 наследуется по аутосомно-рецессивному типу, а АПС-2 — по аутосомно-доминантному. О генетической предрасположенности к аутоиммунной недостаточности надпочечников свидетельствует обнаружение у большинства больных ассоциации с генами системы НLADR3, DR4 и HLAB8. У этих пациентов имеет место снижение супрессорной активности Т-лимфоцитов. Описывают семейные формы данного поражения. Деструкция коркового вещества надпочечников возможна в результате ее поражения при туберкулезе, диссеминированной грибковой инфекции, токсоплазмозе, цитомегалии. Возникновение XНН отмечается после тяжело перенесенных вирусных инфекций (ОРВИ, корь и др.), реже причинами ее развития становятся адренолейкодистрофия, опухолевые процессы, врожденная жировая гиперплазия надпочечников. Иногда XНН развивается на фоне обызвествления надпочечников, являющегося следствием любого из вышеперечисленных процессов. В других случаях петрификаты в надпочечниках обнаруживаются случайно, при рентгенологическом исследовании — задолго до появления клинических симптомов XНН.
Значительно реже встречаются вторичные и третичные XНН, при которых атрофия коры надпочечников является следствием недостаточной продукции гипофизом АКТГ, или гипоталамусом — кортиколиберина. Снижение секреции этих гормонов может наблюдаться при различных патологических процессах гипоталамо-гипофизарной области: опухолях, сосудистых нарушениях, травме, инфекции, внутриутробном поражении гипофиза. Снижение продукции АКТГ может наблюдаться при различных органических поражениях ЦНС, длительном применении глюкокортикоидов, опухолевом поражении коры надпочечников.
Основные клинические симптомы проявления XHH связаны с недоста-точной секрецией кортикостероидов и альдостерона. Клинические симптомы при XHH обычно развиваются медленно, исподволь — пациенты не могут определить, когда началось заболевание. Однако в случае врожденной гипоплазии надпочечников симптомы заболевания могут появляться вскоре после рождения и связаны они с потерей соли. Такие дети вялые, плохо прибавляют в весе (потеря в весе после рождения превышает физиологическую норму на 300–500 г), срыгивают, мочеиспускания вначале обильные, частые, тургор ткани снижен, с удовольствием пьют подсоленную воду. В таких случаях следует обратить внимание на потемнение кожи, реже — слизистых оболочек. Часто диспептические расстройства, интеркуррентные заболевания провоцируют кризы острой надпочечниковой недостаточности.
У детей старшего возраста основными симптомами хронической надпочечниковой недостаточности являются слабость, утомляемость, адинамия, особенно в конце дня. Эти симптомы проходят после ночного отдыха, но могут возникать периодически, в связи с интеркуррентными заболеваниями, оперативными вмешательствами, психическими нагрузками. В патогенезе данного синдрома основное значение придается нарушениям углеводного и минерального обмена.
Часто у больных возникает ортостатическая гипотония, с чем связаны головокружения и обморочные состояния. Однако следует иметь в виду, что артериальное давление при надпочечниковой недостаточности у больных с гипертонией может быть нормальным. Размеры сердца уменьшаются, могут наблюдаться одышка, сердцебиение, нарушение сердечного ритма. Изменения на ЭКГ обусловлены внутриклеточной гиперкалиемией, проявляются в виде желудочковой экстрасистолии, уплощенного двухфазного зубца Т, удлинения интервала PQ и комплекса QRS.
Гипогликемические состояния, появляющиеся натощак или через 2–3 ч после приема пищи, типичны для надпочечниковой недостаточности и связаны с дефицитом глюкокортикоидов, снижением запасов гликогена в печени. Гипогликемические приступы протекают легко и сопровождаются чувством голода, потливостью, бледностью, тремором пальцев рук. Нейрогипогликемический синдром характеризуется апатией, недоверчивостью, подавленностью, чувством страха, возможны судороги.
Изменения функции центральной нервной системы проявляются в снижении памяти, быстрой эмоциональной утомляемости, рассеянности внимания, расстройстве сна. Надпочечниковая недостаточность сопутствует адренолейкодистрофии. Это генетическое, сцепленное с Х-хромосомой рецессивное заболевание, которое протекает с поражением белого вещества нервной системы и коры надпочечников. Быстро прогрессирует демиелинизация, проявляющаяся генерализованной атаксией, судорогами. Неврологической симптоматике предшествуют клинические признаки надпочечниковой недостаточности.
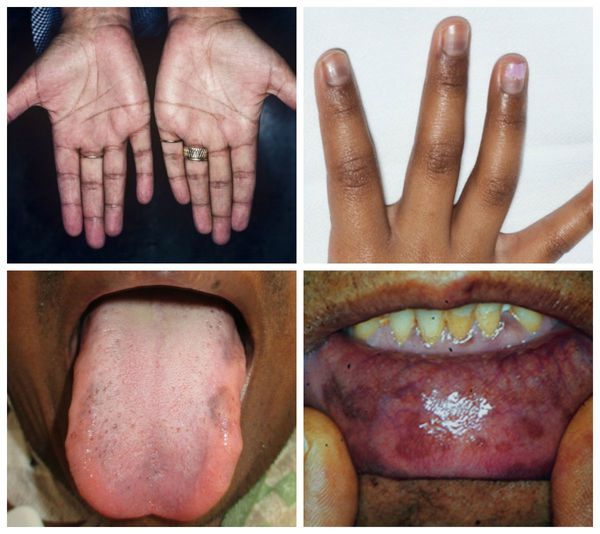
Пигментация кожи и слизистых наблюдается почти у всех больных и мо-жет быть выражена задолго до появления других симптомов XHH. Генерализованная пигментация обусловливается избыточной секрецией АКТГ и β-меланоцитостимулирующего гормона. Кожа детей чаще имеет золотисто-коричневую окраску, реже — светло-коричневую или бронзовый оттенок. Наиболее насыщенная пигментация выражена в области сосков грудных желез, мошонки и полового члена у мальчиков, белой линии живота, в местах трения кожи одеждой, рубцов, коленных, локтевых суставов, мелких суставов кистей, слизистой десен. Иногда первым указанием на наличие заболевания служит длительно сохраняющийся загар. Пигментация усиливается в период нарастания надпочечниковой недостаточности. У 15% больных пигментация может сочетаться с участками депигментации. Редко встречается беспигментная форма заболевания, которая характерна для вторичной XHH.
При рано начавшемся заболевании дети отстают в физическом и половом развитии. Нередко XHH у детей протекает стерто и диагностируется в случае присоединения интеркуррентных заболеваний.
При типичном течении XHH в крови выявляются увеличение количества эозинофилов, относительный лимфоцитоз, умеренная анемия. Характерным биохимическим признаком заболевания является повышение в сыворотке крови уровня калия, креатинина, мочевины, при одновременном снижении содержания натрия и хлоридов. Гиперкальциемия сочетается с полиурией, никтурией, гипоизостенурией, гиперкальциурией. Подтверждает диагноз низкий уровень кортизола в крови (менее 170 нмоль/л), взятой в утренние часы. Для определения стертых форм гипокортицизма и дифференциальной диагностики рекомендуется проведение нагрузочных проб с синактеном. Синтетический АКТГ стимулирует кору надпочечников и позволяет выявить наличие резервов. После определения уровня кортизола в плазме крови, внутримышечно вводят синактен и через полчаса вновь исследуют концентрацию кортизола. Пробы считаются положительными, если уровень кортизола удваивается. Исследование можно проводить на фоне заместительной терапии преднизолоном. Эта проба позволяет также дифференцировать первичную и вторичную HH.
Прямым подтверждением наличия первичной надпочечниковой недостаточности является резкое повышение уровня АКТГ в плазме крови, при вторичной — его снижение. С целью диагностики гипоальдостеронизма определяют содержание альдостерона и ренина в плазме крови. При первичной надпочечниковой недостаточности содержание альдостерона снижено или находится на нижней границе нормы, а уровень ренина повышается. Визуализация надпочечников (УЗИ, компьютерная томография) также позволяет уточнить форму надпочечниковой недостаточности.
Дифференциальный диагноз Аддисоновой болезни необходимо проводить с рядом заболеваний, протекающих с потерей веса, гипотонией, полиурией, анорексией: кишечными инфекциями, интоксикациями другой этиологии, глистной инвазией, хроническим пиелонефритом, несахарным диабетом, с сольтеряющей формой дисфункции коры надпочечников, с гипоальдостеронизмом. Диагноз XHH облегчается наличием пигментации кожи, хотя при вторичной XHH она может отсутствовать. Необходимо учесть, что при условии своевременной диагностики и правильно подобранной заместительной терапии хроническая надпочечниковая недостаточность имеет благоприятный прогноз.
Часть больных поступают с ошибочным диагнозом: астения, вегетососудистая дистония, гипотрофия неясной этиологии, глистная инвазия, гастрит и т. д.
Диагностические ошибки при кризе XHH связаны с недооценкой основных симптомов заболевания. Среди неправильных диагнозов фигурируют острый аппендицит, гастрит, холецистит, опухоль мозга, энцефалит, ацетонемическая рвота.
Угрожающим жизни больных XHH должен быть признан аддисонический криз — острая надпочечниковая недостаточность (ОНН), развивающаяся вследствие быстрого снижения продукции гормонов коры надпочечников. Это состояние может развиваться после многолетнего субклинического течения XHH, либо появлению ОНН предшествует острая инфекция или другая стрессовая ситуация (травма, операция). Усиливаются слабость и гиперпигментация кожных покровов и слизистых оболочек, аппетит прогрессивно ухудшается вплоть до отвращения к пище. Тошнота переходит в рвоту, с развитием криза она становится неукротимой, появляется жидкий стул. У некоторых больных возникают резкие боли в животе. Ведущими клиническими симптомами ОНН обычно являются: глубокое снижение артериального давления, пульс слабого наполнения, тоны сердца глухие, слизистые бледные, периферический акроцианоз, профузный пот, конечности холодные, гипотермия. Нарастают электролитные нарушения, гипогликемия, гиперазотемия. Гиперкалиемия оказывает токсическое действие на миокард и может привести к остановке сердца.
Основным принципом заместительной терапии XHH и аддисонического криза является сочетанное использование препаратов глюкокортикоидов и минералокортикоидов, которые поддерживают жизненно важные функции: обеспечивают адаптацию организма к стрессовым воздействиям внешней среды и сохранение водно-солевого баланса. Предпочтение отдают гидрокортизону, преднизолону, флудрокортизону. Гидрокортизон обладает как глюкокортикоидным, так и минералокортикоидным действием.
Монотерапия минералокортикоидами или глюкокортикоидами проводится в небольшом проценте случаев. В настоящее время в клинической практике широко используются эффективные и удобные в употреблении таблетированные препараты гидрокортизона и флудрокортизона.
Большинство больных с XHH нуждаются в постоянной заместительной глюкокортикоидной терапии, чаще всего с этой целью используются гидрокортизон и преднизолон. Предпочтение отдается гидрокортизону, который обладает как глюкокортикоидным, так и минералокортикоидным действием. Заместительная терапия глюкокортикостероидами должна имитировать физиологическую секрецию этих гормонов. Согласно циркадному ритму глюкокортикоидов, гидрокортизон или преднизолон при легкой форме следует назначать в утренние часы, при заболевании средней тяжести — утром и после обеда.
При постоянной заместительной терапии XHH доза гидрокортизона у детей раннего возраста ориентировочно должна составлять 1–3 мг, а у больных старшего возраста — до 15 мг и 7,5 мг соответственно.
Следует помнить, что уровень секреции глюкокортикоидов в норме зависит от функционального состояния организма. При травмах, острых инфекциях, физическом или психическом стрессе суточная доза глюкокортикоидов должна быть увеличена в 2–3 раза. Перед малыми вмешательствами (гастродуоденоскопия, применение наркоза, экстракция зубов и др.) больному необходимо однократное парентеральное введение гидрокортизона 12,5–25–50 мг за 30 мин до манипуляции. При плановых операциях повышение дозы глюкокортикоидов рекомендуется начинать накануне вмешательства и вводить их только парентерально. Гидрокортизон вводят внутримышечно по 12,5–25–50 мг 2–4 раза в сут. В день операции дозу препарата увеличивают в 2–3 раза, причем часть лекарства вводят внутривенно капельно, а остальное — внутримышечно каждые 4–6 ч в течение 1–2 с. В последующие дни постепенно переходят на заместительную терапию.
Критерием адекватности глюкокортикоидной терапии являются поддер-жание нормальной массы тела, отсутствие жалоб на постоянное чувство голода и признаков передозировки гормонов, гиперпигментации кожи, нормальное артериальное давление.
Если при использовании глюкокортикоидов не происходит нормализации артериального давления, отсутствует прибавка в весе, сохраняется гипонатриемия, необходимо назначить минералокортикоиды. Комбинированная терапия глюко- и минералокортикоидами, как правило, необходима большинству больных с тяжелой формой XHH.
Суточная доза флудрокортизона подбирается индивидуально. Потребность в этом гормоне может возникать ежедневно или раз в 2–3 дня. У детей грудного возраста в первые месяцы жизни потребность флудрокортизона на килограмм массы тела выше.
Об адекватности дозы минералокортикоидов свидетельствуют нормальные уровни калия и натрия плазмы, активности ренина плазмы.
При передозировке минералокортикоидов могут развиться периферические отеки, отек мозга, нарушение сердечного ритма в связи с задержкой воды. Для устранения этих осложнений надо отменить минералокортикоиды, повысить дозы глюкокортикоидов в 1,5–2 раза, ограничить содержание в пище поваренной соли, назначить соки, 10 % раствор хлорида калия.
Экстренные мероприятия требуются при развитии аддисонического криза. Наибольшая опасность для жизни возникает в первые сутки острого гипокортицизма. Первоочередными задачами являются введение достаточного количества кортикостероидов или его синтетических аналогов, борьба с обезвоживанием, коррекция электролитных нарушений.
При парентеральном введении кортикостероидов предпочтение отдается препаратам гидрокортизона, тогда как преднизолон и дексаметазон должны использоваться только в крайнем случае.
Гидрокортизон вводится внутривенно капельно вместе с глюкозой в течение 4–6 ч. В первые сутки доза гидрокортизона составляет 10–15 мг/кг, преднизолона — 5 мг/кг. В последующие сутки доза внутривенно вводимых препаратов уменьшается в 2–3 раза. Одновременно внутримышечно вводят гидрокортизон через 4–6 ч 25–75 мг/сут.
Наряду с введением глюкокортикоидов проводят лечебные мероприятия по борьбе с обезвоживанием и явлениями шока. Количество изотонического раствора натрия хлорида и 5–10% раствора глюкозы составляет примерно 10% от массы тела, половина суточного объема жидкости вводится в первые 6–8 ч. При многократной рвоте рекомендуется внутривенное введение 5–10 мл 10% раствора хлорида натрия. В капельницу добавляют аскорбиновую кислоту 5–10 мл.
При улучшении состояния больного заканчивают внутривенное введение гидрокортизона, продолжая его внутримышечное введение 4 раза в сут 25–50 мг на прием. Затем постепенно уменьшают дозу гидрокортизона и удлиняют интервал между введениями. После стабилизации болезни можно перевести больного на таблетированный гидрокортизон.
У части больных возникает необходимость сочетать введение гидрокортизона и обязательно, при применении преднизолона, назначение препарата ДОКСА, который вводится по 1–2 мл в день внутримышечно. После прекращения рвоты, вместо инъекции ДОКСА используются таблетки флудрокортизона по 0,1 мг/сут. Своевременная диагностика XHH и правильно подобранная заместительная терапия, которая проводится пожизненно, являются залогом профилактики аддисонического криза: при этих условиях дети, как правило, развиваются нормально.
В. В. Смирнов, доктор медицинских наук, профессор
И. С. Мавричева, кандидат медицинских наук
РГМУ, Москва
Врожденная дисфункция коры надпочечников у детей: этиопатогенез, клиника, лечение
В статье освещены принципы регуляции стероидогенеза в надпочечниках в норме и патологии. Приводятся современные данные о этиологии, патогенезе, клинике, лечении врожденной дисфункции коры надпочечников у детей.
The article deals with the principles of the regulation of steroidogenesis in the adrenal glands in normal and pathological conditions. Modern data on the etiology, pathogenesis, clinical presentation, treatment of congenital adrenal hyperplasia are presented.
Врожденная дисфункция коры надпочечников (ВДКН, врожденная вирилизирующая гиперплазия коры надпочечников, адреногенитальный синдром) является наследственным заболеванием, в основе которого лежит ферментативный дефект на различных этапах стероидогенеза, приводящий к дефициту синтеза кортизола и/или альдостерона. В настоящее время получены сведения о генетических дефектах этого заболевания, разработаны методы пренатального и неонатального скрининга 21-гидроксилазного дефицита. Своевременная диагностика и правильное лечение способствуют нормальному формированию физического и полового развития.
Физиология надпочечников
Надпочечники состоят из двух анатомических слоев: коркового и мозгового. Корковая ткань имеет три зоны, которые вырабатывают различные стероидные гормоны: клубочковая, пучковая и сетчатая. Исходной структурой биосинтеза этих гормонов является холестерин. Он синтезируется в самих надпочениках из ацетата и частично поступает с микрочастицами липопротеидов низкой плотности. В митохондриях из холестерина образуется прегненолон. В разных зонах последний подвергается различным превращениям.
В клубочковой зоне из него образуется прогестерон, с последующим синтезом дезоксикортикостерона (ДОК) — соединения, обладающего умеренной минералокортикоидной активностью. Основным продуктом клубочковой зоны является альдостерон с максимальным минералокортикоидным эффектом. Альдостерон в почечных канальцах задерживает натрий и выводит калий.
В пучковой зоне прегненолон через ряд промежуточных продуктов превращается в 17a-гидроксипрогестерон, последний под воздействием фермента 21-гидроксилазы превращается в 11-дезоксикортизол, предшественник кортизола.
Среди продуктов пучковой и сетчатой зоны имеются С-19 стероиды, обладающие андрогенной активностью, — дегидроэпиандростерон (ДГЭА), андростендион, тестостерон. Андрогеновая активность надпочечниковых стероидов в основном обусловлена их способностью преобразовываться в тестостерон.
В процессе стероидогенеза принимают участие несколько ферментных систем. Для биосинтеза кортизола и альдостерона необходимы 21-гидроксилаза и 11-гидроксилаза, которые экспрессируются только в надпочечниках. Другие ферменты являются общими для надпочечников и гонад [1]. Контролирует глюкокортикоидную функцию надпочечников адренокортикотропный гормон гипофиза (АКТГ) по типу обратной связи. Синтез и секреция альдостерона зависят от ренин-ангиотензиновой системы, уровня калия в сыворотке крови и в меньшей степени от гипофиза.
Этиопатогенез
Ферментативные дефекты при ВДКН обусловлены мутациями генов. В настоящее время выявлены многочисленные точечные мутации генов, определяющих тот или иной дефицит ферментов, коррелирующий с клиникой глюко- и минералокортикоидной недостаточности и выраженностью вирилизации.
Надпочечники секретируют стероиды, единым субстратом которых является холестерин. Под влиянием 11α-гидроксилазы из него образуются все предшественники кортикостероидов. При дефекте этого фермента нарушается синтез всех гормонов коры надпочечников — глюкокортикоидов, минералокортикоидов, андрогенов и формируется липоидная гиперплазия надпочечников, очень редкая форма заболевания. Практически все больные умирают в раннем детском возрасте.
Кортизол, местом синтеза которого является кора надпочечников при участии ферментов 17-гидроксилазы, 21-гидроксилазы, 3β-гидроксистероид дегидрогеназы (3β-ГСД), образуется через промежуточные продукты обмена 17а-оксигидропрогестерон и 11-дезоксикортизол.
Минералокортикоиды находятся под контролем 3β-ГСД, 21-гидроксилазы, 11β-гидроксилазы и синтезируются в клубочковой зоне надпочечников.
Синтез андрогенов происходит в сетчатом слое коры надпочечников и у большинства больных с ВДКН не страдает.
В подавляющем числе случаев выявляется дефицит фермента 21-гидроксилазы, который встречается с частотой 1:14 000 новорожденных, а в Российской Федерации 1:9500. Диагностика этого заболевания важна с первой недели жизни ребенка. Другие формы ВДКН встречаются редко: дефект STAR, дефицит 11α-гидроксилазы, дефицит 17α-гидроксилазы, 3β-ГСД, дефицит 21-гидроксилазы, дефицит 11β-гидроксилазы, дефицит оксидоредуктазы [2].
Дефицит 11β-гидроксилазы вызывает нарушение синтеза кортизола и приводит к избыточной продукции 11-дезоксикортикостерона, который способствует задержке натрия и воды в организме. Артериальная гипертензия и вирилизация наружных половых органов характерная картина для этой формы ВДКН.
Фермент 3β-ГСД участвует в биосинтезе минералокортикоидов, глюкокортикоидов, андрогенов. При дефиците этого фермента рано развиваются симптомы обезвоживания, рвота. Наружные половые органы как у девочек, так и у мальчиков имеют черты гермафродитного строения из-за дефицита активных андрогенов.
Снижение активности 17-гидроксилазы приводит к нарушению синтеза кортизола и половых гормонов, что обуславливает недоразвитие наружных гениталий у мальчиков и гипогонадизм у девочек в пубертатном периоде.
21-гидроксилаза участвует в биосинтезе кортизола и минералокортикоидов. При умеренном дефиците этого фермента снижается продукция кортизола, что вызывает повышение секреции АКТГ. Минералокортикоидная недостаточность чаще сопровождается грубым дефицитом 21-гидроксилазы. Снижение выработки дезоксикортикостерона и альдостерона стимулирует рениновую активность плазмы и, соответственно, ангиотензина II.
При ВДКН дефект перечисленных ферментных систем, обеспечивающих синтез глюкокортикоидов в системе гипоталамус–гипофиз–надпочечники, по принципу обратной связи вызывает избыточное выделение аденогипофизом АКТГ, который приводит к значительному повышению предшественников кортизола или альдостерона с избыточной одновременной продукцией адреналовых андрогенов.
В базальных клетках аденогипофиза помимо АКТГ образуется a- и β-меланоцитостимулирующие гормоны, общим предшественником которых является проопиомеланокортин. Продукция последнего стимулируется кортиколиберином, гормоном гипоталамуса и угнетается кортизолом.
Клинические особенности
В практике врача встречаются три основные формы болезни: вирильная, сольтеряющая и реже гипертоническая.
Вирильная форма ВДКН развивается при умеренном дефиците фермента 21-гидроксилазы и связана с действием надпочечниковых андрогенов, без выраженных симптомов глюко- и минералокортикоидной недостаточности.
Активная вирилизация плода начинается с 20–25 недели гестации, когда запускается гипоталамо-гипофизарно-надпочечниковая ось. При рождении наружные половые органы девочек имеют гетеросексуальное строение: различная степень гипертрофии клитора; сращенные большие половые губы напоминают мошонку, что формирует единое мочеполовое отверстие у основания клитора — урогенитальный синус. У некоторых больных внутриутробная андрогенизация настолько выражена, что наружные половые органы чрезвычайно сходны с мужскими, и нередко девочкам при рождении присваивается мужской гражданский пол. Гипертрофированный клитор напоминает нормальный половой член, мочеполовое отверстие открывается чаще снизу ствола на разном уровне его протяженности, давая повод для постановки диагноза «гипоспадия» [3].
Формирование наружных половых органов у мальчиков происходит по изосексуальному типу — при рождении ребенка можно заметить небольшое увеличение полового члена. Следует отметить, что в период новорожденности поставить диагноз вирильной формы ВДКН у мальчиков весьма затруднительно, т. к. явных нарушений в развитии половых органов не определяется. Однако у некоторых больных мужского пола с рождения можно заметить увеличение полового члена, морщинистость мошонки, пигментацию срединного шва пениса, кожи мошонки, срединной линии живота, ареолы сосков.
В постантенатальном периоде продолжается избыточная секреция андрогенов, усиливаются симптомы вирилизации. Если диагноз ВДКН не поставили своевременно, не начато соответствующее лечение, то вследствие анаболического действия андрогенов в первые годы дети быстро растут, у них активно развивается скелетная мускулатура, появляется грубый голос, гирсутизм (оволосение по мужскому типу на лице, груди, животе, конечностях), т. е. признаки маскулинизации. У девочек увеличивается размер клитора, отмечается его напряжение. У мальчиков ускоряется рост полового члена, рано появляются эрекции.
У девочек в пре- и пубертатном периодах отсутствуют вторичные половые признаки и менструации. Повышенная секреция андрогенов надпочечниками по принципу обратной связи блокирует выделение гонадотропинов в аденогипофизе. У девочек по этой причине яичники уменьшены в размерах, с множественными кистами, матка недоразвита, а у мальчиков угнетается развитие тестикул — они остаются допубертатными. У взрослых, не леченных больных, нередко наблюдается олигоспермия. У лиц обоего пола значительно ускоряется дифференцировка скелета («костный» возраст опережает паспортный). К 10–12 годам происходит закрытие эпифизарных зон роста костей, что определяет конечную низкорослость больных. Пропорции тела у них нарушены: широкий плечевой пояс, узкий таз, хорошо развитая мускулатура. У девочек не развиваются молочные железы [4].
Степень выраженности влияния андрогенов при дефиците 21-гидроксилазы связана с индивидуальными особенностями метаболизма предшественников андрогенов и различием в активности периферических рецепторов андрогенов.
Сольтеряющая форма обусловлена более выраженным дефицитом фермента 21-гидроксилазы. Болезнь проявляется с первых недель после рождения и представляет серьезную угрозу жизни больному ребенку. Клинически эта форма характеризуется рвотой, расстройством стула, дегидратацией, снижением артериального давления (АД). У таких детей следует обратить внимание на потемнение кожи, реже — слизистых оболочек. Происходит быстрая потеря массы тела ребенка, что можно охарактеризовать как аддисонический криз. Клинические проявления болезни связаны со снижением биосинтеза альдостерона, что приводит к потере натрия через почки, кишечник, потовые железы. Эти симптомы болезни являются ведущими и часто приводят к диагнозу острого кишечного токсикоза и экзикоза как инфекционного, так и ферментативного характера (лактазная недостаточность).
Особенности в нарушении строения наружных половых органов у девочек быстро направляют мысли врача на возможность ВДКН. У мальчиков диагноз вызывает определенные затруднения. Однако именно эта форма болезни приводит впервые к правильному диагнозу у них при соответствующих электролитных нарушениях и результатах других лабораторных инструментальных методов обследования.
Гипертоническая форма ВДКН встречается в популяции в 10 раз реже, чем предыдущие формы, и обусловлена дефектом гена, контролирующего 11β-гидроксилазу. Дефицит этого фермента приводит к недостаточному образованию кортизола, что стимулирует выработку АКТГ. Повышается количество стероидов, предшествующих ферментативному блоку: 11-дезоксикортизола и 11-дезоксикортикостерона, надпочечниковых андрогенов. В клинической картине болезни, кроме симптомов вирилизации, повышение АД за счет 11-дезоксикортикостерона, обладающего минералокортикоидной активностью. Это способствует задержке натрия и жидкости в организме. Последние два фактора приводят к повышению АД, которое обнаруживается в связи с трудностью его измерения у детей раннего возраста в 3–4 года, вследствие длительно текущей гипертонии могут быть выражены изменения со стороны глаз, сердца и почек. Имеется корреляция между степенью вирилизации наружных половых органов и артериальной гипертензией. При этой форме ВДКН отсутствует гиперплазия юкстагломерулярного аппарата и уровень активности ренина в плазме не повышен [3].
При ВДКН у детей обоих полов истинный пубертат наступает позже. У девочек нормальный менструальный цикл может быть только при применении сбалансированной гормональной терапии. Но у детей, лечение которых начато поздно, после появления сесамовидной косточки (рентгенография кисти рук), возможно преждевременное половое развитие. Причина этого феномена объясняется активацией гипоталамуса после уменьшения выделения надпочечниковых андрогенов в результате глюкокортикоидной терапии. В этих случаях ростовой прогноз ухудшается.
У девочек с дефицитом 21-гидроксилазы в раннем возрасте преобладают маскулинный тип телосложения, а также мальчиковые черты поведения — предпочтение механических игрушек, более жесткий тип общения со сверстниками. Интеллектуальное развитие таких детей не страдает.
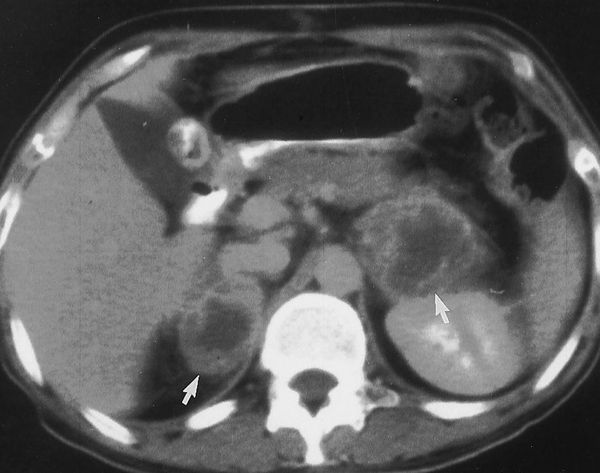
Новорожденный, имеющий бисексуальное строение наружных половых органов, должен быть обязательно осмотрен эндокринологом и урологом. Необходимо провести пальпацию в области расщепленной мошонки на наличие тестикул. При отсутствии их назначается ультразвуковое исследование (УЗИ) органов малого таза и надпочечников. У больных с женским биологическим полом видны гипоплазированная матка, надпочечники увеличены в размере, однородны, с четкими ровными контурами. При длительном течении заболевания надпочечники становятся аденоматозными с неровными краями.
Диагностика
С первых дней жизни ребенка вирильная и сольтеряющие формы болезни характеризуются высоким уровнем 17-оксипрогестерона в крови, который в 10–100 раз превышает нормальные показатели (15–20 нмоль/л). С учетом суточного ритма исследование 17-оксипрогестерона достаточно проводить один раз, в интервале от 7 до 9 часов утра, для чего необходимо взять каплю крови ребенка на фильтровальную бумагу на 2–5 день жизни. Неонатальный скрининг эффективен для диагностики классических форм дефицита 21-гидроксилазы. Известна возможность проведения этого теста и со слюной ребенка, а также в амниотической жидкости в первый триместр беременности с целью пренатальной диагностики ВДКН. В нашей стране неонатальный скрининг проводят с 2006 г. При положительном результате повторно проводят исследование. В сомнительных случаях с целью подтверждения заболевания проводят ретестирование с использованием тандемной масс-спектрометрии и молекулярно-генетического анализа [5, 6].
Важным диагностическим критерием служит определение тестостерона, но в более поздние сроки — с 4–5 месяцев жизни. Уровень его обычно повышается в 5–10 раз по сравнению с нормальными показателями (0,17–0,7 нмоль/мл).
Помогает в диагностике дефицита 21-гидроксилазы повышение уровня АКТГ, а у больных с сольтеряющей формой одновременно возрастает активность ренина плазмы. При гипертонической форме ВДКН повышен уровень 11-дезоксикортизола и 11-дезоксикортикостерона в крови, непосредственных предшественников ферментативного блока 11β-гидроксилазы. В диагностике неклассической формы дефицита 21-гидроксилазы и дифференциальной диагностике редких форм ВДКН является проба с синактеном с определением широкого спектра стероидов.
При рождении ребенка с интер- или гетеросексуальным строением наружных гениталий обязательным диагностическим методом исследования должно являться определение полового хроматина и кариотипа. Выявление кариотипа 46ХХ у такого ребенка с большей вероятностью может говорить о наличии 21-гидроксилазной недостаточности. Иногда указанные исследования необходимы и у мальчиков с двусторонним брюшным крипторхизмом и гипоспадией уретры, что также может вызвать сомнение в правильном установлении пола ребенка.
Характерным признаком сольтеряющей формы ВДКН при лабораторном исследовании является нарастание уровня натрия и хлора. Изменяется соотношение натрия к калию в сторону снижения. Гиперкалиемия может быть выявлена и на электрокардиографии. Всем новорожденным мужского пола с клиническими признаками обезвоживания, сочетающимися с гиперкалиемией и гипонатриемией, необходимо исследовать содержание 17-оксипрогестерона в крови.
Для диагностики ВДКН и уточнения половой принадлежности необходимо проводить УЗИ надпочечников, матки, яичников. В норме на УЗИ надпочечники имеют треугольную или округлую форму, при ВДКН определяется их гиперплазия, которую одновременно необходимо дифференцировать с андростеромой. При опухолях надпочечников проба с дексаметазоном должна быть отрицательной, высокая концентрация ДГЭА-С не изменяется на этом фоне. В настоящее время используется также компьютерная томография надпочечников и внутренних гениталий.
Лечение
Основной задачей лечения является заместительная терапия глюкокортикоидами при вирильной форме и глюко- и минералокортикоидами — при сольтеряющей форме ВДКН. Назначение этих гормонов подавляет избыточную секрецию АКТГ и снижает уровень стероидов, секреция которых повышена в результате ферментативного дефекта. При регулярном применении кортикостероидов уменьшается вирилизация гениталий, дети нормально растут, у девочек под влиянием собственных овариальных гормонов развиваются молочные железы, происходит становление менструального цикла. У мальчиков в обычные сроки начинается истинное половое развитие, появляется сперматогенез.
Критериями компенсации при вирильной форме болезни являются нормализация темпов роста и полового развития, скелетного созревания, отсутствие признаков прогрессирования вирилизации и кризов острой надпочечниковой недостаточности, снижение 17а-гидропрогестерона и тестостерона в крови. При возникновении у больных интеркуррентных заболеваний необходимо увеличивать дозы глюкокортикоидов в 1,5–2 раза.
Детям с сольтеряющей формой ВДКН необходимо назначить минералокортикоиды. Среди них широко в практике используется флудрокортизон, в таблетке которого содержится 0,1 мг препарата. Суточная доза составляет 0,05–0,3 мг и распределяется в 2–3 приема: утром, перед обедом, иногда перед сном. Лечение следует начинать с меньших доз — 1/4–1/2 таблетки. В дальнейшем под контролем общего состояния больного и уровня электролитов крови, а также данных электрокардиографии (ЭКГ) дозу корригируют. У детей первого года жизни потребность в минералокортикоидах выше и у некоторых детей может составлять 0,3 мг в сутки. С пищей рекомендуется дополнительно принимать поваренную соль (1–4 г). Об адекватности применяемой дозы можно судить по показателю рениновой активности, который снижается при избыточной дозе и повышается при недостаточности.
Критериями правильного лечения сольтеряющей формы ВДКН являются исчезновение дегидратации, тошноты, рвоты, нормализации АД, содержания натрия и калия в сыворотке крови. Следует обратить внимание на необходимость наиболее адекватной терапии этих больных. Нужно помнить, что перерыв в лечении неизбежно приводит к рецидиву заболевания, а большие дозы глюкокортикоидов — к быстрому нарастанию веса, гипертонии, появлению стрий на коже, матронизму, остеопорозу, снижению иммунитета, образованию язв в желудке и кишечнике, повышению уровня сахара в крови. В связи с этим необходим систематический контроль дозы препарата по данным 17ОНП, а также уровня активности ренина в плазме. Содержание 17ОНП в сыворотке может превышать нормальные показатели не более чем в 2 раза.
Тяжелым осложнением сольтеряющей формы ВДКН является криз острой надпочечниковой недостаточности, который проявляется бледностью кожных покровов, акроцианозом, похолоданием конечностей, профузным потом, гипотермией, тошнотой, рвотой, жидким стулом. У маленьких детей быстро нарастают симптомы эксикоза — западение большого родничка, заостренные черты лица, сухость кожи, снижение тургора ткани, снижение АД, тахикардия. В крови нарастает уровень калия и снижается содержание натрия, меняется соотношение натрия к калию, оно снижается до 20 и ниже (норма 30). Гиперкалиемия может вызвать блокаду сердца с последующей остановкой его. Все это требует срочной лечебной помощи больным. Для выведения из криза необходима не только заместительная гормональная терапия, но и борьба с дегидратацией. С этой целью используются капельное внутривенное введение физраствора и 5% раствора глюкозы из расчета 100–150 мл на кг массы тела в сутки и внутривенное введение гидрокортизона 10–30 мг на кг массы тела в сутки или преднизолона 10–15 мг на кг массы тела, распределенные на 4–6 приемов, а также ДОКСА не менее 2–3 мг в течение первых суток.
Следует заметить, что применение преднизолона, мало влияющего на задержку жидкости, вместо гидрокортизона ведет к более медленной компенсации обменных процессов во время аддисонических кризов. Более того, применение таких препаратов, как дексаметазон или метилпреднизолон, в данной ситуации нецелесообразно, т. к. они обладают только глюкокортикоидной активностью в отличие от гидрокортизона.
В последующие сутки продолжается инфузионная терапия с постепенным снижением глюкокортикоидов и минералокортикоидов. После улучшения состояния пероральное лечение гидрокортизоном по 12,5–25–50 мг каждые 6 часов. Вместо ДОКСА при стабильном улучшении состояния через 3–5 дней назначают лечение флудрокортизоном, который обладает выраженным минералокортикоидным свойством (в 5–10 раз превышает ДОКСА) и умеренным глюкокортикоидным эффектом. Лечение надо начинать с меньших доз — 1/4 или 1/2 таблетки один раз утром. В дальнейшем под контролем общего состояния больного и уровня электролитов крови, а также данных ЭКГ дозу флудрокортизона увеличивают до 1, а иногда до 2 таблеток в сутки, при этом можно уменьшить дозу гидрокортизона или преднизолона.
При назначении минералокортикоидов нужно следить за симптомами возможной передозировки препарата: появление отечности, повышение АД, парестезии, параличи, повышение уровня натрия в крови. В этих случаях достаточно сократить дозу препарата или временно отменить его, прервать дачу поваренной соли. Следует назначить хлористый калий в растворе или в порошке. При выраженной гипокалиемии показано в/в капельное введение 4% хлорида калия 10–15 мл в 250 мл 5% раствора глюкозы.
К отработанной схеме лечения переходят при отсутствии рвоты, нормализации стула. Как уже было сказано, гипертоническая форма ВДКН у детей встречается очень редко. При лечении этой формы наряду с глюкокортикоидами назначаются гипотензивные препараты. Применение только гипотензивных средств не эффективно.
Хирургическое лечение при ВДКН применяется у лиц с генетическим и гонадным женским полом для устранения вирильных нарушений наружных гениталий и осуществляется только в специализированных клиниках. Корригирующая пластическая операция на фоне адекватной гормонотерапии проводится через год после начала лечения: на первом этапе производят клитеротомию, на втором — ближе к пубертатному периоду — вскрытие урогенитального синуса (интроитопластику). Даже при резкой вирилизации наружных гениталий не встает вопрос об образовании искусственного влагалища, т. к. оно развивается до обычных размеров под влиянием систематического лечения глюкокортикоидными препаратами. Хирургическое лечение продиктовано не только косметической необходимостью. Гетеросексуальное строение наружных гениталий может приводить к патологическому формированию личности и даже к суициду. Корригирующая операция направлена на реализацию возможности нормальной половой жизни и выполнения детородной функции [5].
Выбор пола у больных ВДКН является очень важным вопросом, который может быть правильно решен при раннем распознавании болезни — в первую неделю жизни. Но, к сожалению, нередко при выраженной вирилизациии наружных половых органов девочки с рождения регистрируются как мальчики и получают соответствующее воспитание. При ВДКН у лиц с генетическим и гонадным женским полом единственно целесообразным решением является выбор женского пола не только в первые 2 года жизни, но в любом возрасте, в котором впервые был правильно определен биологический женский пол.
Однако перемена пола — очень сложный вопрос для больного, особенно в пре- и пубертатном периоде. При этом необходимо, учитывая возраст больного, знать его психосоциальные и психосексуальные установки. Подчас нужна длительная постепенная психологическая подготовка, а после перемены гражданского пола — продолжительная адаптация. Нередко семье больного приходится сменить место жительства для меньшей психологической травматизации ребенка и всей семьи. Пациенты, пожелавшие сохранить ошибочно присвоенный им мужской пол, обречены на бесплодие, на невозможность полноценной жизни из-за порока развития «полового члена», на необходимость применять андрогены на фоне глюкокортикоидной терапии. Кроме того, приходится прибегать к оперативному вмешательству — удалению внутренних половых органов (матки и ее придатков), что может привести к развитию посткастрационного синдрома. Отечественные авторы считают врачебной ошибкой сохранение мужского пола больным с генетическим и гонадным женским полом. В ряде случаев сохранение мужского пола является следствием недостаточной психологической подготовки больного, которая должна проводиться урологом, гинекологом, психотерапевтом, сексопатологом (в зависимости от возраста пациента).
В то же время при правильном подходе к смене гражданского пола и началу лечения глюкокортикоидами быстро осуществляется феминизация — развитие молочных желез, появление менструаций и становится реальной возможность осуществления репродуктивной функции в дальнейшем. Следует подчеркнуть, что смена гражданского пола должна осуществляться с учетом всех юридических правил.
При своевременно начатом и адекватно проводимом лечении, особенно вирильной формы ВДКН, прогноз в отношении жизни и трудовой деятельности может быть вполне благоприятным.
Особого внимания требует сольтеряющая форма болезни, дающая тяжелые обострения у ребенка при присоединении интеркуррентных заболеваний, стрессовых состояниях или нерегулярном лечении.
Больные ВДКН должны находиться на диспансерном учете у эндокринолога, т. к. они нуждаются в пожизненном применении гормональных препаратов. В зависимости от возраста и адекватности проводимой терапии дети осматриваются эндокринологом не реже 2 раз в год (по показаниям — чаще); минимум дважды в течение года у них должны контролироваться показатели 17ОНП.
Литература
В. В. Смирнов, доктор медицинских наук, профессор
ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва