Гистаминергическая система что это
Гистаминергическая система что это
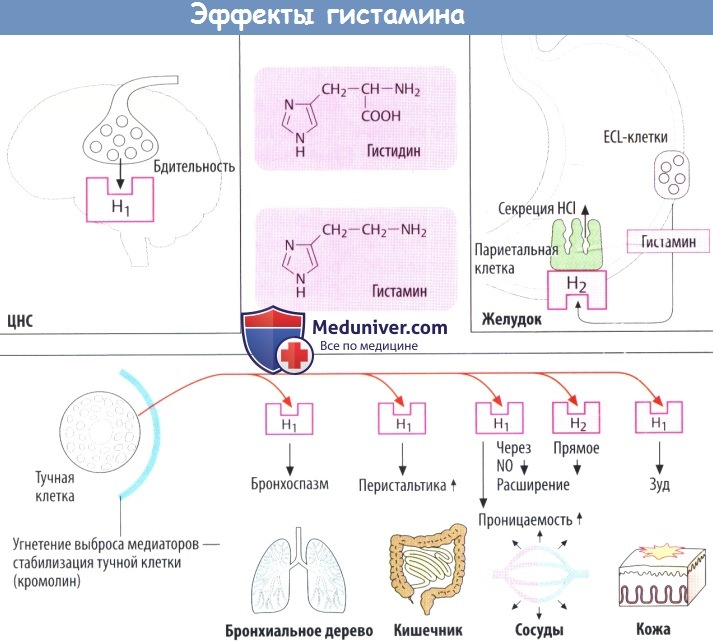
а) Функции гистамина. Гистамин служит в качестве нейромедиатора/модулятора в ЦНС, вызывающего среди прочих эффектов состояние бодрствования. В слизистой оболочке желудка он действует как медиатор, который выделяется энтерохромаффиноподобными (ECL) клетками для стимуляции секреции кислоты желудочного сока соседними париетальными клетками.
Гистамин, содержащийся в базофилах крови и тканевых тучных клетках, играет роль медиатора в IgE-опосредованных аллергических реакциях. Гистамин, повышая тонус гладкой мускулатуры бронхов, может спровоцировать приступ бронхиальной астмы. Он стимулирует перистальтику кишечника, о чем свидетельствует появление диареи при пищевой аллергии.
Гистамин увеличивает проницаемость кровеносных сосудов, вызывая образование щелей между эндотелиальными клетками посткапиллярных венул, что позволяет жидкости проходить в окружающие ткани (образование волдырей). Кровеносные сосуды расширяются, т. к. гистамин стимулирует выход NO из эндотелия, а также оказывает прямое релаксирующее действие на сосуды. Стимулируя чувствительные нервные окончания кожи, гистамин может вызывать зуд.
б) Рецепторы. Гистаминовые рецепторы связаны с белками G. Гистаминовые Н1— и Н2-рецепторы служат мишенями для веществ с антагонистическими свойствами. Н3-рецепторы находятся в нервных клетках и могут ингибировать выход разнообразных медиаторов, включая сам гистамин. Позже был обнаружен еще один подтип рецепторов — Н4-рецепторы; они локализуются на определенных клетках воспаления.
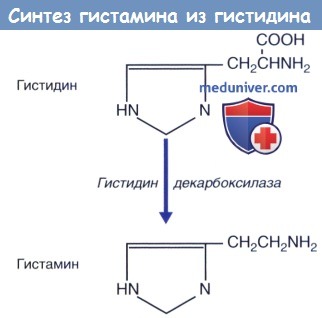
в) Метаболизм. Гистаминсодержащие клетки образуют гистамин путем декарбоксилирования аминокислоты гистидина. Выброшенный гистамин разрушается, т. к. для негоотсутствуетсистема обратного захвата, как для норадреналина, дофамина и серотонина.
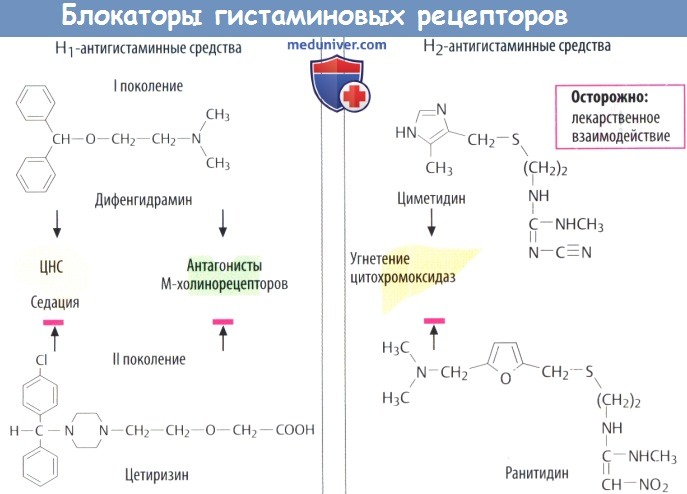
г) Антагонисты. Селективные антагонисты могут блокировать Н1— и Н2-гистаминовые рецепторы.
Н1-антигистаминные средства. Давно открытые вещества этой группы (I поколения) неспецифичны и блокируют другие рецепторы (М-холинорецепторы). Эти средства используют для устранения симптомов аллергии (бамипин, клемастин, диметинден, мебгидролин, фенирамин), в качестве противорвотных (меклизин, дименгидринат) и как седативные снотворные, отпускаемые без рецепта врача.
Прометазин олицетворяет собой переход к психофармакологическим средствам типа нейролептиков из группы фенотиазинов.
Большинство Н1-антигистаминных препаратов вызывает сонливость (ослабляя реакцию при управлении автомобилем) и атропиноподобные реакции (сухость во рту, запор). Более новые вещества (Н1-антигистаминные препараты II поколения) не проникают в ЦНС и поэтому практически не оказывают седативного действия. Предположительно, они переносятся обратно в кровь с помощью Р-гликопротеида находящегося в эндотелии ГЭБ.
Более того, они практически не обладают какой-либо антихолинергической активностью. В эту группу входят цетиризин (рацемат) и его активный энантиомер левоцетиризин, а также лоратадин и его активный метаболит дезлоратадин. Фексофенадин — активный метаболит терфенадина, чрезмерная концентрация в крови которого достигается при слишком медленной биотрансформации (посредством CYP3A4), что может приводить к сердечным аритмиям (удлинение интервала ОТ). Также к этой группе препаратов относятся эбастин и мизоластин.
Н2-блокаторы (циметидин, ранитидин, фамотидин, низатидин) угнетают секрецию кислоты желудочного сока и поэтому подходят для лечения пептических язв. Применение циметидина может сопровождаться межлекарственными взаимодействиями, т. к. он ингибирует печеночную цитохромоксидазу. У последующих поколений (ранитидин) эти побочные эффекты практически отсутствуют.
д) Стабилизаторы тучных клеток. Кромогликат (кромолин) и недокромил уменьшают (по пока еще неизвестному механизму) способность тучных клеток высвобождать гистамин и другие медиаторы в ходе аллергических реакций. Оба препарата применяются местно.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гистаминергическая система что это
Гистамин синтезируется из гистидина под действием гистидиндекарбоксилазы. Предполагают, что тела гистаминергических нейронов находятся в туберомамиллярном ядре, расположенном в задней части гипоталамуса. Аксоны этих нейронов направляются ко всем участкам коры головного мозга.
Гистаминергические нейроны вместе с холинергическими и серотонинергическими нейронами обеспечивают поддержание состояния бодрствования, а во время сна находятся в неактивном состоянии. Активацию гистаминергических нейронов обеспечивает пептид орексин, синтезируемый в нейронах латеральной части гипоталамуса. Нарушения синтеза орексина приводит к развитию нарколепсии — дневных приступов внезапного засыпания.
Рецепторы. Выделяют H1, Н2— и Н3-гистаминовые рецепторы. Все виды гистаминовых рецепторов активируют G-белки. Активация Gs.-белков под действием Н1— и Н2-рецепторов происходит за счет образования арахидоновой кислоты, которая в дальнейшем превращается в простагландины и другие эндопероксиды, которые способны изменять активность цАМФ или напрямую связываться с ионными каналами. Н3-рецепторы являются тормозными ауторецепторами.
В клинической практике антигистаминные препараты применяют для блокирования Н2-рецепторов с целью понижения секреции кислоты клетками желудка и оказания противоаллергического эффекта. Частыми побочными эффектами этих лекарственных средств были вялость и сонливость; однако создание препаратов на основе циметидина (блокатора Н2-гистаминовых рецепторов), не проникающего через гематоэнцефалический барьер, позволило избежать подобных осложнений.
Редактор: Искандер Милевски. Дата публикации: 12.11.2018
Бетагистин – гармония равновесия
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Единственная красота, которую я знаю, – это здоровье.
Головокружение – один из симптомов, наиболее часто встречающихся в медицинской практике. Среди амбулаторных больных, обращающихся к врачам всех специальностей, головокружение является основной жалобой в 2–5% случаев. Причиной головокружения служит дисбаланс сенсорной информации, поступающей от основных афферентных систем, обеспечивающих пространственную ориентацию, – вестибулярной, зрительной и проприоцептивной.
Головокружение является также одним из наиболее частых симптомов у больных ишемической болезнью головного мозга, особенно при патологии вертебрально–базилярной системы. В этой группе больных головокружение обусловлено, как правило, возрастными изменениями сенсорной системы, снижением компенсаторных возможностей центральных механизмов поддержания равновесия, сосудисто–мозговой недостаточностью с преимущественным поражением вертебрально–базилярной системы. При этом большую роль играет изменение вестибулярных ядер ствола или вестибуло–мозжечковых связей, однако определенное значение имеет и так называемый периферический компонент, обусловленный атеросклеротическим поражением сосудов внутреннего уха.
В клинике неврологических проявлений шейного остеохондроза особое место занимают синдромы, сопровождающиеся выраженным головокружением. Это так называемый вертеброгенный синдром позвоночной артерии, или задний шейный симпатический синдром, который обусловлен воздействием патологических костных и хрящевых структур на позвоночную артерию. Наиболее часто на стенку сосуда воздействуют унковертебральные разрастания, которые деформируют медиальную стенку сосуда либо травмируют окружающее ее симпатическое сплетение, вызывая при этом спазм артерии и ее разветвлений. Проявления синдрома развертываются по территориям васкуляризации ветвей позвоночной артерии. Клиническая картина складывается из головных болей затылочной локализации с фронтальным распространением, зрительных (в виде субъективных ощущений «тумана», «песка в глазах») и кохлеовестибулярных нарушений. Последние зачастую выходят на первый план и проявляются системными и несистемными головокружениями, иногда с тошнотой, рвотой, параакузиями (шум, гул, треск) и снижением слуха на стороне поражения.
Необходимо отметить также высокую частоту головокружения (более чем 20%) как симптома у пациентов, перенесших неосложненные сотрясения головного мозга.
Важную роль в функционировании вестибулярных структур играет гистаминергическая система. Так, передача импульсации от вестибулярных рецепторов и вестибулярных ядер обеспечивается преимущественно гистаминергическими нейронами. Основным источником гистаминергической иннервации является задний гипоталамус, главным образом туберомамиллярное ядро, нейроны которого связаны практически со всеми структурами диэнцефальной области и конечного мозга, включая базальные ганглии и кору, а также со стволом и, в частности, с комплексом вестибулярных ядер. Гистаминергическая иннервация наиболее представлена в медиальном вестибулярном ядре. При периферических вестибулярных расстройствах наблюдается усиление спонтанной импульсации нейронов ипсилатеральных вестибулярных ядер, главным образом медиального. Одновременно отмечается снижение экспрессии рецепторов ГАМК, что ведет к преобладанию возбуждающих гистаминергических влияний. Кроме того, происходит увеличение плотности ГАМК–рецепторов в контралатеральном медиальном вестибулярном ядре. Гистаминергическая система также обеспечивает передачу возбуждения между вестибулярными ядрами и рвотным центром. Определенное значение в формировании связей вестибулярной системы имеет серотонинергическая, норадреналинергическая и дофаминергическая иннервация.
Одним из препаратов, имеющих структурное сходство с гистамином, аффинитет к блокированию Н3– и стимуляции Н1–рецепторов, является Тагиста, содержащий бетагистина гидрохлорид. Вследствие блокады Н3–рецепторов Тагиста увеличивает высвобождение нейромедиаторов из нервных окончаний пресинаптической мембраны, оказывает ингибирующий эффект в отношении вестибулярных ядер ствола мозга и улучшает кровоснабжение внутреннего уха.
Бетагистин как лекарственный препарат в Европе был зарегистрирован в 1970 г., это синтетический препарат, обладающий способностью соединяться с рецепторами гистамина типа Н1, которые заложены в нейрорецепторных клетках внутреннего уха. Он оказывает местное мощное стимулирующее действие, увеличивая высвобождение нейромедиаторов (гистамина) из нервных окончаний рецепторных клеток внутреннего уха в синапс. Нейромедиаторы действуют на прекапиллярные сфинктеры, вызывая вазодилатацию сосудов внутреннего уха, увеличивая проницаемость их и тем самым нормализуя внутрилабиринтное давление, т.е. устраняя гидропс.
Кроме воздействия на рецепторы внутреннего уха бетагистин оказывает влияние на рецепторы вестибулярных ядер, находящихся в стволе продолговатого мозга. Экспериментальные работы на животных показали повышение уровня серотонина в продолговатом мозгу. Это приводит к снижению активности вестибулярных ядер, к уменьшению их возбудимости и прекращению головокружения. Таким образом проявляется вестибулодепрессивное действие.
Эффективность препарата Тагиста связана с уменьшением как спонтанной, так и вызванной импульсации от вестибулярных рецепторов и вестибулярных ядер. Было показано, что назначение бетагистина приводило к дозозависимому снижению частоты спонтанной импульсации от рецепторов полукружных канальцев. Кроме того, Тагиста способствует уменьшению интенсивности и амплитуды импульсации нейронов латерального вестибулярного ядра как в покое, так и при стимуляции. Тагиста также стимулирует синтез эндогенного гистамина, о чем, в частности, свидетельствует усиление синтеза матричной РНК, кодирующей гистидиндекарбоксилазу – основной фермент синтеза гистамина. Наряду с воздействием на гистаминовые рецепторы периферических и центральных вестибулярных структур Тагиста оказывает вазоактивное влияние. Препарат вызывает расширение артериол и капилляров внутреннего уха, что приводит к избирательному увеличению кровотока. Кроме того, прием препарата способствует некоторому усилению мозгового кровотока как в вертебрально–базилярном, так и в каротидном бассейне, что приводит к улучшению когнитивных функций у больных с хронической цереброваскулярной недостаточностью (табл. 1).
Назначение бетагистина уменьшает частоту, выраженность и продолжительность приступов системного головокружения (табл. 2). Наряду с положительным влиянием на вестибулярную функцию на фоне лечения также отмечается улучшение слуха, что, по–видимому, связано с вазоактивным действием препарата.
В ходе исследования эффективности бетагистина [А.Б. Гехт, 2001] у пациентов пожилого возраста с хронической вертебрально–базилярной недостаточностью выявлена значительная положительная динамика собственно кохлеовестибулярных расстройств (головокружение, нарушение слуха, атаксия). Также отмечалось уменьшение головной боли, дефектов полей зрения. Очень важна высокая переносимость бетагистина при применении его у пациентов пожилого возраста с сопутствующей соматической патологией.
Бетагистин эффективен также для купирования приступов острого головокружения (вертиго). Препарат уменьшает частоту, продолжительность и тяжесть приступов. До недавних пор в медицине наблюдалась тенденция контроля очень тяжелых приступов вертиго препаратами, влияющими на лабиринт (прохлорперазин). Седация, или сонливость, – обычный побочный эффект этих лекарств, которые задерживают вестибулярную компенсацию [Kirtane, 1999]. Тагиста в дозе 16 мг 3 раза/сут. – лучший выбор для контроля острого головокружения. В клинике острого вертиго, которое возникает в значительной степени из–за нарушений баланса электрических потенциалов в вестибулярных ядрах обоих полушарий, обнаруживается такая тенденция: во время острой фазы клетки мозжечка ингибируют вестибулярные ядра и тем самым облегчают симптомы. Это явление очень образно называют «мозжечковым зажимом». Постепенно, в течение нескольких недель, вестибулярные ядра неповрежденной стороны берут на себя функ¬цию пораженных ядер. Это наблюдается анатомически как возникновение кросс–синапсов и приводит к балансу импульсной активности ядер обеих сторон. Как только это происходит, вестибулярные ядра постепенно высвобождаются от эффекта «мозжечкового зажима». Весь этот процесс называют «компенсацией», благодаря ей человек или животное, страдавшие острыми приступами головокружения, вновь обретают чувство равновесия, даже если исходная патология необратима (рис. 1–3).
Большинство лекарств от головокружения вызывают седацию и угнетение ЦНС. Это замедляет процесс компенсации, который столь необходим для реабилитации пациента. Бетагистин, не вызывающий угнетения ЦНС, не мешает процессу компенсации.
Тагиста не является седативным средством, поэтому не нарушает нормального образа жизни пациентов. Препарат действительно оказывает эффект «ускорения» на вестибулярную адаптацию, что жизненно необходимо для скорейшей реабилитации пациентов с острой периферической вестибулярной катастрофой. Вiswas (1998), Тighilet et al. (1995) делали выводы из наблюдений, что прием бетагистина per os (50 или 100 мг/на 1 кг веса тела) значительно ускоряет выздоровление, восстанав¬ливает статику и динамику после перерезки левостороннего вестибулярного нерва у подопытных кошек и таким образом значительно ускоряет у них вестибулярную компенсацию.
Препарат Тагиста выпускается в таблетках по 8, 16 и 24 мг. Оптимальная суточная доза составляет 48 мг. Наиболее адекватное терапевтическое воздействие достигается при приеме препарата во время еды. С осторожностью следует применять препарат у пациентов, страдающих язвенной болезнью желудочно–кишечного тракта (в том числе в анамнезе), феохромоцитомой, бронхиальной астмой. Указанных больных следует регулярно наблюдать в период лечения. Сроки лечения во всех случаях определяются лечащим доктором с учетом клинической картины и индивидуальных особенностей пациента.
Синдром нарушения толерантности к гистамину: этиология, патогенез, клиника, современные подходы к диагностике и лечению
Впоследние годы в клинической практике все чаще встречаются пациенты с проявлениями двух и более гистамин-индуцированных симптомов. В первую очередь такие пациенты могут обращаться к аллергологу или дерматологу с жалобами на периодические высыпания, которые сопровождаются зудом, особенно после приема пищи или ряда медикаментов. При детализации анамнеза выясняется, что у пациентов также часто бывают боли в животе, метеоризм, диарея, головные боли и др. Обычно консультация заканчивается назначением диеты, антигистаминных препаратов, пробиотиков, спазмолитиков, локально – эмольентов и т. д. На фоне данных рекомендаций состояние больного, конечно, улучшается, но после отмены терапии пациент снова обращается к врачу, а часто просто учится жить с данной проблемой.
Как улучшить качество жизни пациента? Что должен знать клиницист о синдроме низкой толерантности к гистамину?
В 1910 г. Henry Daleand и соавт. с Wellcome Laboratories впервые описали биогенный амин – гистамин (2-[4-имидазолил] этиламин), выделенный ими с Claviceps purpurea [7]. Впоследствии, в 1927 г. Best и соавт. доказали, что гистамин – это естественный компонент человеческого организма, который синтезируется из аминокислоты гистидина путем декарбоксилирования при участии фермента L-гистидиндекарбоксилазы, коферментом которой является пиридоксальфосфат (витамин В6) [24].
Гистамин производится во многих клетках организма (мастоциты, базофилы, желудочные энтерохроматофильные клетки, гистаминергические нейроны и др.), сохраняется внутриклеточно в везикулах и выделяется при стимуляции клеток, инициируя значительное количество физиологических и патологических процессов. В частности, гистамин способствует спазму гладкой мускулатуры бронхов и кишечника, расширению сосудов и увеличению их проницаемости, усилению желудочной секреции, развитию тахикардии и аритмии, влияет на артериальное давление, нейропередачу, иммунокоррекцию и т. д. [15]. Гистамин также может синтезироваться в клетках эпидермиса, слизистой оболочке желудка и в нейронах. В этих клетках скорость его обмена довольно высокая, поэтому он почти не депонируется и выделяетсяпостоянно [12]. Многообразие эффектов гистамина связано с его способностью влиять на мембранные рецепторы различных клеток, которых в настоящее время описано четыре типа: H1-, Н2-, Н3— и Н4-гистаминорецепторы [19].
Знания о клинических эффектах гистамина необходимы многим практикующим врачам. К примеру, аллергологам, дерматологам, клиническим иммунологам важно знать, что дегрануляция тучных клеток с высвобождением гистамина может быть результатом связывания специфического антигена (в частности, аллергена) с FcωRI-рецептором на их поверхности. Активация тучных клеток также может происходить за счет неиммунных механизмов, а именно: стимулируют дегрануляцию нейропептиды (субстанция Р), компоненты системы комплемента (C3a и C5a), ряд цитокинов (интерлейкин-1 (IL-1), IL-3, IL-8, гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), фактор активации тромбоцитов, липопротеиды, гиперосмолярность, состояние гипоксии, некоторые физические и химические факторы (экстремальная температура, травмы, вибрация, употребление алкоголя, ряд продуктов питания, медикаментов и т. д.) [16].
Катаболизм гистамина происходит двумя путями:
Фермент DAO накапливается в мембраноассоциированных везикулярных структурах эпителиальных клеток и высвобождается из них при стимуляции. DAO отвечает за уровень внеклеточного гистамина, который может повышаться после употребления богатой гистамином пищи или активации тучных клеток [21]. С другой стороны, фермент HNMT является цитозольным протеином, действие которого проявляется только во внутриклеточном пространстве [23]. Поэтому данные ферменты не конкурируют между собой за субстрат.
Синдром нарушения толерантности к гистамину (СНТГ) – это патологический процесс, который возникает вследствие дисбаланса между потреблением гистамина и способностью организма элиминировать его. Избыточное накопление гистамина приводит к развитию симптоматики, возникающей за счет связывания его с упомянутыми выше гистаминорецепторами. Определено, что указанный синдром имеют более 1% людей (в основном женщины среднего возраста). Однако существует мнение, что данный показатель значительно занижен из-за гиподиагностики СНТГ [14].
У здоровых людей ферментативный барьер клеток эпителия тонкой кишки обеспечивает DAO, противодействуя чрезмерному всасыванию в кровь гистамина внешнего происхождения. Нарушение толерантности к гистамину (НТГ), то есть увеличение уровня гистамина в плазме, может возникать в условиях недостаточности фермента или его ингибирования. В таких случаях развитие симптомов возможно даже при поступлении небольшого количества гистамина (например, с продуктами питания), который обычно хорошо переносится здоровыми людьми [22].
Причины снижения активности DAO могут быть разными: генетическая предрасположенность, заболевания желудочно-кишечного тракта (ЖКТ; воспалительные заболевания кишечника, болезнь Крона, неспецифический язвенный колит, инфекции, паразитарные инвазии, мальабсорбция, дисбактериоз), хронические заболевания почек, вирусные гепатиты, цирроз печени, хроническая крапивница и др. [4]. Возможно угнетение активности DAO другими биогенными аминами, алкоголем или медикаментами (см. таблицу) [2]. Также активность DAO может уменьшаться при недостаточности кофакторов: витамина В6, С, микроэлементов Cu и Zn [8]. Некоторые вещества-гистаминолибераторы способны вызвать высвобождение гистамина из эндогенных источников организма [10]. Гормоны, которые выделяются во время стресса, способны как непосредственно активизировать мастоциты и высвобождать гистамин, так и негативно влиять на эпителий тонкой кишки, инициируя уменьшение синтеза DAO [3].
Источники гистамина и возможные причины повышения его уровня в организме
Причины
Источники
Натуральные продукты с большим количеством гистамина
Помидоры, баклажаны, шпинат, рыба, мясо курицы и мясо, которое долго хранилось. Все ферментативные продукты (творог, квашеная капуста, вино, пиво и т. д.)
Ананас, бананы, цитрусовые, клубника, орехи, папайя, помидоры, лакрицы, специи, бобовые, какао, алкоголь; рыба, морепродукты, свинина, яичный белок
Гистаминолибераторы искусственного происхождения
Добавки (красители, консерванты, стабилизаторы, усилители вкуса, ароматизаторы)
Бактерии и дрожжи, которые способствуют продукции гистамина
Закваска, французский хлеб
Пищевые продукты, снижающие активность DAO
Медикаменты, которые ингибируют активность DAO
Антиаритмические (верапамил, пропафенон), антибиотики (цефуроксим, клавулановая кислота, доксициклин, изониазид), антидепрессанты (амитриптилин, диазепам, ингибиторы МАО-1, галоперидол), противотошнотное (метоклопрамид), антигистаминные препараты (АГП; прометазин, циметидин), антигипертензивные (дигидролазин), бронходилататоры (аминофиллин, теофиллин), диуретики (фуросемид), муколитики (N-ацетилцистеин, амброксол), миорелаксанты (панкуроний, d-тубокурарин), хинидин
Медикаменты, вызывающие высвобождение гистамина
Препараты, инактивирующие пиридоксин (витамин В6)
Антигипертензивные препараты (гидралазин), антибиотики (d-циклоспорин, изониазид), гормональные контрацептивы (с эстрогенами)
IgE-независимое высвобождение гистамина из тучных клеток
Вещества, потенциирующие IgE-независимое высвобождение гистамина
Обезболивающие/жаропонижающие (ацетилсалициловая кислота, диклофенак, флурбипрофен, индометацин, кетопрофен, мефенаминовая кислота, напроксен)
Инфекции, травмы, шок
Что касается роли генетических факторов, то сегодня определены разные генетические варианты фермента DAO. Ген, кодирующий DАО, находится во фрагменте 7-й хромосомы (7q34-Q36) генома человека, состоит из 5 экзонов и 4 интронов. Выявлена значительная взаимосвязь между активностью DAO и 7 единичными нуклеотидными полиморфизмами (SNP). Считается, что только один из этих семи SNP, расположенный в третьем экзоне, непосредственно связан с низкой активностью DAO [20].
Установлено, что при концентрации гистамина в плазме от 0,3 до 1 нг/мл не возникает никаких клинических признаков [17]. СНТГ характеризуется дозозависимым эффектом [5]. Даже у здоровых людей может развиться сильная головная боль или приливы из-за употребления большого количества продуктов, содержащих гистамин [9]. Типичные симптомы НТГ включают гастроинтестинальные расстройства, чихание, ринорею, заложенность носа, головную боль, дисменорею, гипотонию, аритмию, крапивницу, приливы и пр. В большинстве случаев на вероятность СНТГ указывает наличие двух и более типичных симптомов [6].
Нервная система: неврологические симптомы НТГ проявляются головными болями. Было обнаружено, что у пациентов с диагностированной мигренью наблюдается повышенный уровень гистамина не только во время приступов, но и в асимптомный период. У многих пациентов этой группы причиной НТГ была сниженная активность DAO. Продукты, содержащие гистамин, были триггерами головной боли.
В настоящее время известно, что гистамин может вызывать, поддерживать и усиливать головную боль, хотя механизмы этого установлены пока не полностью. Считают, что при некоторых патологических состояниях (мигрень, кластерные головные боли, рассеянный склероз) количество тучных клеток в головном мозге увеличивается. Хотя гистамин не проникает через гематоэнцефалический барьер (ГЭБ), он может влиять на активность гипоталамуса. Исследование Levy et al. подтвердили, что дегрануляция тучных клеток в твердой мозговой оболочке активирует болевой путь, лежащий в основе мигрени [3, 25]. Однако большинство АГП неэффективны при остром приступе мигрени.
С другой стороны, гистамин играет важную роль нейромодулятора путем воздействия на Н3-рецепторы, расположенные в центральной нервной системе (ЦНС) на уровне базальных ганглиев, гипокампа и коры головного мозга. Определено, что гистамин влияет на процессы корковой возбудимости (сон–бодрствование), возникновение мигрени, головокружения, тошноты или рвоты центрального происхождения, изменения температуры тела, памяти, восприятия информации и регуляции аппетита. Было доказано, что независимо от времени суток активность приступов мигрени уменьшалась, что коррелировало с уменьшением уровня центрального гистамина. В свою очередь, избыток гистамина приводил к перевозбуждению некоторых участков ЦНС, что вызывало различные нарушения сна, в том числе затрудненное засыпание [26]. Известно также, что снотворное действие некоторых АГП I поколения, проникающих через ГЭБ (например, димедрола), связано с блокирующим влиянием на гистаминовые рецепторы, расположенные в ЦНС [11, 27].
ЖКТ: важными симптомами НТГ являются диффузная боль в животе, колики, метеоризм, диарея или запоры, часто возникающее уже через 30 мин после приема пищи, содержащей высокие дозы или стимулирующей выброс гистамина. Рост концентрации гистамина и снижение активности DAO было обнаружено также при других заболеваниях ЖКТ (болезнь Крона, язвенный колит, аллергическая энтеропатия, колоректальный рак). У пациентов с пищевой аллергией слизистая оболочка кишечника кроме низкой активности DAO характеризуется еще и низкой активностью HNMT. Ферменты DAO и HNMT при таких условиях не могут компенсировать друг друга, поэтому общая способность к катаболизму гистамина значительно снижается [28]. Уровень DAO уменьшается также у пациентов с нервной анорексией вследствие недоедания, что влечет за собой атрофические повреждения слизистой оболочки кишечника. С другой стороны, симптоматика НТГ может быть схожа с таковой при нервной анорексии (снижение массы тела, диарея, боль в животе и др.). Точный диагноз и диета с исключением продуктов, содержащих гистамин, у таких больных могут привести к увеличению массы тела и уменьшению выраженности всех симптомов.
Следует отметить, что соблюдение строгой безгистаминовой диеты является непростой задачей и фактически лишает пациентов нормального сбалансированного питания. Особенно если идет речь о пациентах детского возраста, людях пожилого возраста или больных с сопутствующей патологией, где рациональное питание нужно рассматривать как главный источник поступления в организм большинства необходимых макро- и микронутриентов, витаминов и прочих веществ [36].
Важно также отметить, что уровень гистамина в пище можно определить только специальными лабораторными методами, он зависит от сроков и условий хранения продуктов. Заморозка или горячая обработка не уменьшает содержание гистамина в пище. Чем дольше хранится пища, тем больше в ней образуется гистамина. Одни и те же продукты могут содержать разное количество гистамина и, соответственно, вызывать (или нет) разную степень проявления симптомов, что усложняет диагностику СНТГ [30].
Дыхательные пути: СНТГ может проявляться у пациентов с атопическими аллергическими заболеваниями и без таковых. Во время или после употребления алкоголя либо пищевых продуктов, богатых гистамином, у пациентов с НТГ могут возникать такие симптомы, как ринорея, заложенность носа, кашель, одышка, бронхоспазм, приступы бронхиальной астмы [35]. Именно такие случаи представляют большой дифференциальный интерес для грамотной и своевременной верификации диагноза. Нужно также помнить, что течение сезонной, круглогодичной аллергии может быть более тяжелым при сопутствующем СНТГ. Что касается бронхиальной астмы, то имеются данные, что у пациентов с данной патологией обнаружена сниженная активность HNMT, которая является основным ферментом катаболизма гистамина в эпителии бронхов [41].
Кожа: чаще всего СНТГ на коже проявляется в виде крапивницы различной локализации и степени тяжести, что связано с естественным уровнем DAO на фоне поступления пищи, богатой гистамином, или сниженной концентрацией фермента при употреблении диетической пищи или медикаментов, усиливающих метаболизм гистамина. Наличие СНТГ – одна из причин псевдоаллергической пищевой реакции. На основании двойного слепого плацебо-контролируемого исследования с помощью провокационных тестов с пищевыми добавками, проведенного Di Lorenzo и соавт., было показано, что в 3% случаев у пациентов с хронической идиопатической крапивницей причиной патологии был СНТГ [37].
Снижение активности DAO было установлено у пациентов с атопическим дерматитом. В большинстве описанных в литературе клинических случаев такое сочетание сопровождалось усилением тяжести течения дерматита, особенно в детском возрасте. При соблюдении диеты с ограничением гистамина или приеме препаратов заместительной терапии наблюдалось облегчение симптомов атопического дерматита [45]. Заметим также, что во всех этих случаях диагноз был верифицирован только спустя 2–3 года на фоне неэффективной терапии. Наличие СНТГ не позволяет также добиться желаемого эффекта от аллерген-специфической иммунотерапии (АСИТ) у пациентов с установленным аллергеном, например, при аллергии на пыльцу весенних деревьев или к клещам домашней пыли. Таким пациентам были рекомендованы препараты заместительной терапии, что со временем улучшило клинические эффекты АСИТ [18, 31].
Сердечно-сосудистая система: избыток гистамина влияет на сердечно-сосудистую систему по-разному, что связано с гиперактивацией Н1— и Н2-рецепторов, расположенных в сердце и сосудах. Это приводит к развитию множества разнообразных клинических симптомов, которые вуалируют стандартное представление о данном заболевании. В частности, через взаимодействие с Н1-рецепторами сосудов гистамин опосредует расширение их оксидом азота и простагландинами (через эндотелиальные клетки); увеличивает проницаемость посткапиллярных венул, в результате чего формируется отек; влияет на сокращение сосудов сердца. Через взаимодействие с Н2-рецепторами вызывает расширение сосудов, опосредованное цАМФ (гладкомышечные клетки сосудов) [40]. Кроме того, гистамин способствует снижению атриовентрикулярной проводимости через взаимодействие с Н1-рецепторами в сердечной ткани, а также увеличивает хронотропию и инотропию посредством влияния на Н2-рецепторы сердца [53].
Репродуктивная система: женщины с НТГ часто страдают от дисменореи в сочетании с циклической головной болью. Данные симптомы объясняются взаимодействием гистамина и женских половых гормонов, в частности способностью гистамина поддерживать сокращение матки. Это связывают с тем, что гистамин, в зависимости от дозы, стимулирует синтез эстрадиола и незначительно – прогестерона [39]. Эстрадиол, в свою очередь, обладает способностью ингибировать образование прогестерона F2α, который отвечает за болезненные сокращения матки при дисменорее. Интенсивность симптомов НТГ может варьировать в зависимости от фазы менструального цикла, в частности при лютеиновой фазе уменьшаются проявления, что обусловлено высокой активностью DAO [44].
Баланс между гистамином и DAO необходим для неосложненного течения беременности. Благодаря способности стимулировать рост и пролиферацию клеток гистамин играет важную роль во взаимодействии между маткой и эмбрионом, участвуя в созревании плаценты. В свою очередь, плацента продуцирует большое количество фермента DAO, который играет роль своеобразного барьера, препятствующего попаданию в кровоток эмбриона избытка гистамина от матери. Таким образом, концентрация DAO у беременных женщин почти в 500 раз выше [50]. Благодаря высокой плацентарной продукции DAO у беременных женщин с НТГ наблюдается уменьшение клинической симптоматики [45].
Таким образом, указанные клинические симптомы часто требуют дифференцированного подхода к диагностике патологических нарушений со стороны различных органов и систем и, соответственно, осведомленности клиницистов в отношении данного синдрома.
Диагностика СНТГ, Maintz L. и соавт., 2006
Диагностика СНТГ, Maintz L. и соавт., 2006
Алгоритм диагностики СНТГ, предложенный Maintz L. и соавт. (2006), представлен на рисунке. До недавнего времени использовали несколько различных методов определения DАО, однако некоторые из них были признаны недостаточно информативными (метод деградации утресцина, меченного радиоактивной меткой), с определенными ограничениями (исследование биоптата участка кишечника) или дорогостоящими [11].
В последнее время широкое применение получил кожный прик-тест с 1% раствором гистамина, описанный в литературе как Histamin 50-Skin-Prick Test. Суть теста заключается в определении размера папулы через 50 мин после скарификации. Размер папулы более 5 мм указывает на пониженную активность DАО. Данный тест является простым в исполнении и абсолютно безопасным [13].
Удобство и безопасность использования Histamin 50-Skin-Prick Test, а также необходимость диагностики СНТГ продемонстрированы на примере клинического случая.
Пациент М., 28 лет, обратился с жалобами на заложенность носа, ринорею и слезотечение, чихание, зуд, которые отмечал в течение последних 4 лет четко в период с марта до начала июня.
По данным анамнеза стало известно, что у больного периодически появлялся дискомфорт в ротовой полости (ощущение отека и онемение языка, губ, зуд) после употребления в пищу косточковых. Была проведена этапная диагностика в соответствии с консенсусом по молекулярной аллергодиагностике [1]. По результатам аллергодиагностики определено: кожные прик-тесты: гистамин (++), тест-контроль (–), береза (> 5 мм), ольха (> 5 мм), лещина (++++), граб (+++), яблоко (–), персик (++++). Аллергокомпонентная диагностика: rBet v 1 (PR-10) – 31,07 kU/l, rBet v 2–4 – 0,03 kU/l, rPru p 1 (PR-10) – 12,04 kU/l, rPru p 4 – 0,03 kU/l, rPru p 3 (nsLTP) – 0,02 kU/l.
Диагноз: «Аллергический ринит, интермиттирующее течение, сенсибилизация к пыльце весенних деревьев. Перекрестная пищевая аллергия к фруктам семейства Розоцветных».
Пациенту рекомендовано проведение АСИТ смесью пыльцы деревьев. Исключить из употребления фрукты в сыром виде и употреблять их только после термической обработки.
Через год лечения (на этапе поддерживающей терапии) пациенту провели мониторинг уровня специфических аллергенов для оценки эффективности АСИТ. Получили результат ImmunoCAP (Phadia AB): rBet v 1 – 15,02 kU/l, rBet v 2–4 – 0,03 kU/l, что указывало на хорошую эффективность выбранного лечения. Однако пациента продолжала беспокоить заложенность носа, причем независимо от периода палинации и на фоне предложенной диеты.
Кроме того, периодически появлялись кожные высыпания, метеоризм. В связи с этим пациенту предложено проведение 50-минутной гистаминовой пробы, результат которой оказался положительным.
Таким образом, пациенту верифицирован диагноз: «Аллергический ринит, интермиттирующее течение, сенсибилизация к пыльце весенних деревьев. Перекрестная пищевая аллергия к фруктам семейства Розоцветных. Синдром нарушения толерантности к гистамину». Было рекомендовано продолжение АСИТ, соблюдение указанной выше диеты, ограничение продуктов-гистаминолибераторов или обогащенных гистамином. При необходимости приема других медикаментов следует проконсультироваться с врачом относительно возможного влияния данного средства на метаболизм гистамина. Заместительная терапия препаратами диаминоксидазы (HistDAO).
Подходы к лечению СНТГ
Увеличение уровня DAO в крови пациентов с СНТГ возможно при комплексном лечении препаратами, которые содержат данный фермент. При низком уровне DAO в крови эти препараты могут быть использованы в комплексном лечении на фоне антигистаминной диеты и в случае употребления медикаментов, которые увеличивают уровень гистамина в крови. В настоящее время в Украине зарегистрирован препарат HistDAO, представляющий собой пищевую добавку для разрушения внеклеточного гистамина и содержащий фермент DAO, который полностью идентичен человеческому и повышает уровень DAO в ЖКТ. HistDAO не имеет побочных реакций, поскольку не всасывается в кровь, его действие ограничено только в тонком кишечнике. Согласно рекомендациям, возможно применение у детей с 6 лет и взрослых с CНТГ; не содержит гистамин, лактозу, глютен [46].
Положительные результаты применения фермента DAO в качестве пищевой добавки были представлены на XXI Всемирном конгрессе по неврологии (WCN) профессором Joan Izquierdo из Каталонского медицинского университета (Испания, 2013) [52]. Проводили двойное слепое плацебо-контролируемое исследование использования пищевой добавки DAO у пациентов с мигренью. По данным исследования, у 87% пациентов (в большинстве случаев – женщин) с мигренями, диагностированными в соответствии с критериями Международного общества головной боли, выявлен СНТГ. На основании результатов лечения был сделан вывод, что использование пищевой добавки DAO показало значительное снижение продолжительности приступа мигрени и тенденцию к уменьшению количества приступов. Кроме того, лечение не вызывало каких-либо побочных эффектов.
Особенно важна заместительная терапия препаратами DAO для пациентов, которые в силу лечения сопутствующих заболеваний вынуждены регулярно принимать медикаментозные препараты, влияющие на метаболизм гистамина. Что касается педиатрической практики, то все чаще появляются описания клинических случаев пациентов с СНТГ и преобладанием гастроэнтерологических проблем, у которых эффективность лечения была достигнута на фоне заместительной терапии [48].
Список литературы находится в редакции