Глюкуроновая кислота для чего применяют
Глюкуроновая кислота
Из Википедии — свободной энциклопедии
наименование
Глюкуроновая кислота (от глюкоза и др.-греч. οὖρον — моча) — одноосновная органическая кислота, относящаяся к группе уроновых кислот.
Свойства глюкуроновой кислоты аналогичны свойствам глюкозы, но вследствие наличия в её молекуле карбоксильной группы, она способна образовывать лактоны и соли. При нагревании глюкуроновая кислота дегидратируется и декарбоксилируется.
Глюкуроновая кислота способна образовывать растворимые конъюгаты (глюкурониды) со спиртами, фенолами, карбоновыми кислотами, тиолами, аминами и рядом других веществ, за счёт чего достигается их обезвреживание (снижение токсичности) и выведение из организма.
Глюкуроновая кислота для чего применяют
Биополимеры полисахаридной структуры – важнейший класс природных соединений, находящих практическое использование в различных областях науки и техники [10].
Сегодня микробные полисахариды находят широкое применение в самых различных сферах человеческой деятельности, от медицины до металлургии. Наиболее известным является ксантан – внеклеточный полисахарид бактерии Xanthomonas Campestris. Ксантан используют как добавку, улучшающую качество самых различных продуктов и технологических операций. Чаще всего его применяют для повышения нефтедобычи, при буровых работах, для повышения урожайности, а также в пищевой, фармацевтической и косметической промышленности [5].
Известно, что ксантан состоит из двух D-глюкопиранозильных звеньев, двух D-маннопиранозильных звеньев и звена D-глюкопиранозилуроновой кислоты [9], степень ветвления и ацетилирования полисахарида зависит от штамма продуцента, благодаря чему биополимер приобретает различные характеристики и свойства. В чистом виде ксантан представляет собой мягкий пушистый порошок белого или кремового цвета. Неорганические элементы составляют около 5,5 % [7]. Процентный состав нейтральных и кислых сахаров зависит от способа выделения ксантана [12], поэтому для его использования в пищевой, медицинской и косметической промышленности важно контролировать количество нейтральных и кислых сахаров.
Для определения кислых сахаров в образце ксантана используют карбазол-серный метод, основанный на цветной реакции карбазола с продуктами окисления моносахаров, образующихся после разрушения полимерных молекул полисахаридов концентрированной серной кислотой. Данный метод обладает рядом недостатков, таких как длительность подготовки эксперимента, использование вредных и концентрированных кислот и щелочей [6].
Существующие методы анализа, такие как фенол-серный, карбазол-серный методы и др., не всегда обладают хорошей воспроизводимостью результатов, трудоемки, дорогостоящи и часто малопригодны для использования в надлежащей лабораторной практике [2, 11, 8]. На сегодняшний день отсутствуют комплексные подходы по исследованию ксантана инструментальными методами анализа для его использования в медицинской, пищевой и технической сферах. В этой связи востребованными являются комплексные экспериментальные исследования, обладающие удовлетворительными валидационными параметрами.
Цель работы – исследование химического состава ксантана инструментальными методами анализа, а именно определение нейтральных и кислых сахаров.
Материалы и методы исследования
В качестве модельного объекта исследования использовался коммерческий образец пищевого ксантана («Company Plasma Product Specification», Китай).
Измерения оптической плотности проводили на УФ-спектрофотометре Cary 60 (Agilent Technologies, Германия) в кварцевых кюветах 10 мм.
Регистрацию ИК-спектров проводили на ИК-спектрометре Agilent 660 FTIR (Agilent Technologies, Германия).
Определение нейтральных сахаров в пересчете на глюкозу в ксантане
При определении нейтральных сахаров в пересчете на глюкозу в образце ксантана использовали фенол-серный метод, основанный на реакции взаимодействия оксиметилфурфурола с фенолом в концентрированной серной кислоте [4]. Сначала под воздействием концентрированной серной кислоты глюкоза дегидратируется в течение 45 минут до образования оксиметилфурфурола. А далее при действии фенола на оксиметилфурфурол образуется ауриновый краситель, имеющий спектр поглощения в видимой области. Для определения нейтральных сахаров готовили растворы с концентрациями 20 мг/см3, 50 мг/см3, 80 мг/см3, 100 мг/см3. Затем к полученным растворам добавляли по 5 см3 воды и проводили измерение оптической плотности при 483±2 нм [16].
Определение кислых сахаров в пересчете на глюкуроновую кислоту в ксантане
При определении кислых сахаров в пересчете на глюкуроновую кислоту в образце ксантана использовали карбазол-серный метод, основанный на цветной реакции карбазола с продуктами окисления моносахаров, образующихся после разрушения полимерных молекул концентрированной серной кислотой [15]. Для определения кислых сахаров в пересчете на глюкуроновую кислоту в образце ксантана готовили раствор с концентрацией 100 мг/см3. Измерение оптической плотности проводили при 525 ± 2 нм [16].
Результаты исследования и их обсуждение
Определение структуры ксантана
Для установления структуры ксантана и его идентификации использовали метод ИК-спектроскопии.
В качестве стандартного вещества был использован ксантан («Sigma-Aldrich», США) с высокой стабилизирующей активностью, высокой растворимостью, высокой вязкостью даже при маленьких концентрациях.
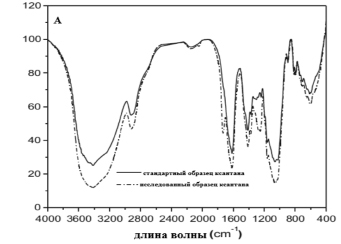
На рис. 1 представлены ИК-спектры стандартного вещества ксантана и исследуемого образца ксантана.
Рис. 1. ИК-спектры стандартного и исследуемого образцов ксантана
При сравнении стандартного образца ксантана и исследуемого образца ксантана очевидно, что некоторые полосы поглощения образца коммерческого ксантана и стандартного образца ксантана совпадают, что указывает на идентичность стандартного образца ксантана исследуемому.
Так, на ИК-спектре имеется область отпечатков пальцев при 1200–850 см-1, которая соответствует области «отпечатков пальцев» пектиновых веществ как для стандартного образца ксантана, так и для исследуемого образца.
Кроме того, ИК-спектр исследуемого образца ксантана показывает наличие свободных, а также неэтерифицированных карбоксильных групп.
Кроме того, имеются полосы поглощения 1416, 1331 и 1240 см-1, которые являются областью «отпечатков пальцев» глюкуроновой кислоты, которые характерны как для стандартного образца ксантана, так и для исследуемого образца. Использованный метод ИК-спектроскопии позволяет судить о том, что ксантан является кислым сахаром, содержащим глюкуроновую кислоту.
Определение глюкозы и глюкуроновой кислоты является обязательным этапом контроля образца ксантана, для установления его состава, также по количеству процентного содержания глюкозы в образце ксантана, говорит о том, что при его получении источником углеродного питания являлись глюкоза и глюкуроновая кислота [3, 13].
Определение нейтральных сахаров
Определение нейтральных сахаров в образцах ксантана проводили при помощи фенол-серного метода. В основу количественного определения нейтральных сахаров в пересчете на глюкозу в исследуемом образце положена реакция взаимодействия оксиметилфурфурола с фенолом в среде серной концентрированной кислоты. Сначала под воздействием концентрированной серной кислоты глюкоза дегидратируется в течение 45 минут до образования оксиметилфурфурола. А далее при действии фенола на оксиметилфурфурол образуется ауриновый краситель, имеющий в видимой области спектра максимум поглощения λmax 483–485 нм [16].
Для точного определения процентного содержания нейтральных сахаров в пересчете на глюкозу в образце ксантана использовали только свежеприготовленные растворы глюкозы, а также раствор 5 % фенола, т.к. раствор фенола достаточно быстро окисляется на свету. Использовали метод сравнения со стандартным раствором глюкозы.
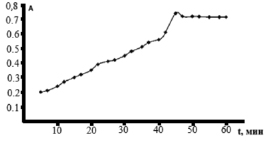
На рис. 2 представлена зависимость величины оптической плотности оксиметилфурфурола от времени его формирования.
Рис. 2. Зависимость величины оптической плотности оксиметилфурфурола от времени его формирования
Замечено, что оксиметилфурфурол формируется в концентрированной серной кислоте в течение 45 мин (рис. 2), тогда как образование ауринового красителя при действии фенола происходит сразу при внесении фенола в реакционную среду. Формирование оксиметилфурфурола завершается к 45 мин и сохраняется величиной постоянной.
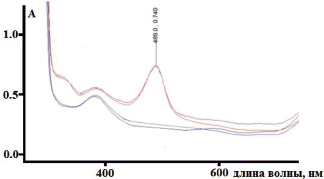
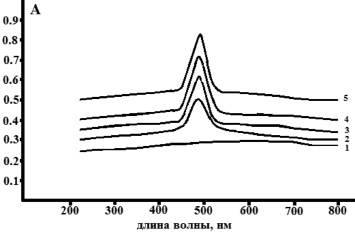
На рис. 3 представлен спектр поглощения в видимой области ауринового красителя, с концентрацией стандартного раствора глюкозы 25 мг/см3. Полоса поглощения ауринового красителя соответствует 489 нм.
Рис. 3. Cпектр поглощения в видимой области ауринового красителя с концентрацией глюкозы 0 мг/см3 (1), 25 мг/см3 (2)
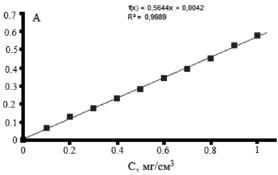
На рис. 4 представлен градуировочный график зависимости оптической плотности раствора глюкозы от ее концентрации при 489 нм. Прямолинейная зависимость наблюдалась в области концентраций глюкозы от 0,1 до 1,0 мг/см3.
Рис. 4. Зависимости оптической плотности раствора глюкозы от ее концентрации в растворе
Рис. 5. Спектр поглощения в видимой области исследуемых растворов ксантана разных концентраций: 0 мг/см3 (1), 20 мг/см3 (2), 50 мг/см3 (3), 80 мг/см3 (4), 100 мг/см3 (5)
На рис. 5 представлен спектр поглощения в видимой области исследуемых образцов ксантана, разных концентраций.
Содержание нейтральных сахаров в пересчете на глюкозу в образце ксантана составило 52,0 ± 3 %. Известно, что содержание нейтральных сахаров в пересчете на глюкозу в образцах ксантана может варьироваться от 35 до 80 %.
Таким образом, рабочими условиями для количественного определения нейтральных сахаров в пересчете на глюкозу в образце ксантана являются:
– время выдерживания в концентрированной серной кислоте 45 мин;
– максимум поглощения ауринового красителя при 485 нм;
– свежеприготовленные 5 % раствор фенола и раствор глюкозы в день эксперимента.
Определение глюкуроновой кислоты
Для увеличения селективности определения глюкуроновой кислоты в образце ксантана и уменьшения влияния нейтральных сахаров на результаты определения глюкуроновой кислоты карбазол-серным методом разрушение полимерной молекулы проводили концентрированной серной кислотой в присутствии сульфаминовой кислоты, которая препятствует реакции карбазола с альдозами, образовавшимися при гидролизе полисахаридов.
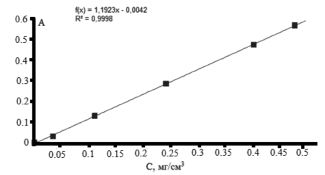
На рис. 6 представлена зависимость оптической плотности комплекса карбазола с кислыми сахарами при λ = 525 нм от концентрации глюкуроновой кислоты в стандартных растворах. Прямолинейная зависимость наблюдалась в области концентраций глюкуроновой кислоты от 0,03 до 0,5 мг/см3. Общее содержание глюкуроновой кислоты в исследуемом образце ксантана определяли по методу градуировочного графика. Содержание глюкуроновой кислоты в исследуемом образце ксантана в пересчете на % составило 24,79 ± 1,24 %. Известно, что содержание глюкуроновой кислоты в образце ксантана составляет от 5 до 40 %.
Следует отметить, что данная методика трудоемка, длительна, требует использования вредных концентрированных кислот и щелочей и занимает 6 ч. Кроме того, результаты плохо воспроизводятся.
В связи с этим в качестве альтернативы определения кислых сахаров в ксантане предложен метод потенциометрического титрования раствором 0,1 Н KOH [16].
Потенциометрическое титрование образца ксантана проводили в водном растворе. Методика заключалась в следующем: навеску ксантана 0,0100 г растворяли в 10 мл воды в стакане для титрования емкостью 50 мл. Для непрерывного перемешивания использовали магнитную мешалку. Электрохимическая ячейка состояла из стеклянного и хлоридсеребряного электродов. В качестве титранта использовали 0,1 Н раствор щелочи KOH. Измерение рН производили через каждые 0,2 мл добавки титранта. Точку эквивалентности определяли по методу Грана [1, 14].
Рис. 6. Зависимость оптической плотности комплекса карбазола с кислыми сахарами при λ = 525 нм от концентрации глюкуроновой кислоты в стандартных растворах
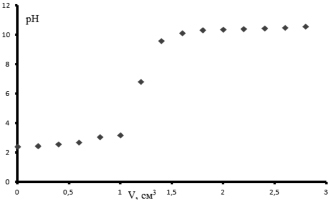
Рис. 7. Кривая потенциометрического титрования образца ксантана
На рис. 7 представлена кривая потенциометрического титрования образца ксантана.
При использовании потенциометрической индикации конечной точки титрования возникают трудности, связанные с отсутствием четко выраженных перегибов на кривых титрования функциональных групп кислотного характера, что требует последующей математической обработки результатов, такой как построение кривых Грана [14, 15]. Все кривые потенциометрического титрования образца ксантана обработаны по методу Грана.
На рис. 8 представлен пример определения конечной точки титрования по методу Грана образца ксантана (зависимость величины G от объема титранта):
G = (W + V)·10-Е – для кислой среды;
G = (W + V)·10(E-14) – для щелочной среды,
где V – объем титранта, мл; E – значения потенциала, В; W – начальный объем пробы, мл.
На основании рис. 8 конечная точка титрования равна объему 1,2 мл, что соответствует количеству глюкуроновой кислоты 23,13 ± 1,6 мг/см3.
Сравнительное содержание глюкуроновой кислоты в образце ксантана, полученное потенциометрическим титрованием и карбазол-серным методом, представлено в таблице.
Сравнительное содержание глюкуроновой кислоты в образце ксантана методом потенциометрического титрования и карбазол-серным методом
Карбазол-серный метод, мг/см3
Согласно таблице количество глюкуроновой кислоты, определенное двумя методами, согласуется между собой, однако результаты определения глюкуроновой кислоты карбазол-серным методом имеют завышенные значения, что связано с мешающим влиянием нейтральных сахаров на результаты определения глюкуроновой кислоты. Метод потенциометрического титрования может быть использован для определения количества свободных неэтерифицированных карбоксильных групп, т.к. достаточно прост в исполнении, нет необходимости в использовании дополнительных реактивов.
Заключение
Методом ИК-спектроскопии проведена идентификация структуры образца ксантана. Выявлено, что ксантан содержит кислые сахара. Подобраны рабочие условия определения нейтральных сахаров в пересчете на глюкозу в образце ксантана фенол-серным методом. Количество нейтральных сахаров в пересчете на глюкозу в исследуемом образце ксантана составило 52,0 ± 3 %. Проведено сравнительное определение кислых сахаров в пересчете на глюкуроновую кислоту в образце ксантана карбазол-серным методом и потенциометрическим титрованием. Количество кислых сахаров в пересчете на глюкуроновую кислоту в исследуемом образце ксантана составило 24,79 ± 1,24 мг/см3.
Глюкуроновая кислота для чего применяют
Основная функция гиалуроновой кислоты заключается в уменьшении трения в суставах, поддержании плавности движений. Гиалуроновая кислота отвечает за вязкость синовиальной жидкости, является важным компонентом суставного хряща, в котором присутствует в виде оболочки каждой клетки (хондроцита). Гиалуроновая кислота входит в состав кожи, где участвует в регенерации ткани. За счет высокого содержания во внеклеточных матриксах гиалуроновая кислота играет важную роль в гидродинамике тканей, процессах миграции и пролиферации клеток.
Наш организм в состоянии вырабатывать гиалуроновую кислоту благодаря ферментам ГКС (синтазы гиалуроновой кислоты, гиаулуронат-синтазы). Ферменты объединяют два сахара, D-глюкуроновую кислоту и N-ацетилглюкозамин.
Также гиалуроновую кислоту можно получить из пищевых продуктов, таких как мясо (свинина, птица и говядина), костный бульон. Определенные продукты могут помочь синтезировать и оптимизировать выработку гиалуроновой кислоты в организме. К таким продуктам относятся продукты, богатые витамином С (специи и цитрусовые). Не менее полезны для синтеза гиалуроновой кислоты продукты, богатые магнием (темно-зеленые листовые овощи, орехи, бобы, авокадо и бананы).
Считается, что снижение уровня выработки гиалуроновой кислоты в организме начинается примерно в 18-20 лет и резко возрастает в возрасте около 40 лет. Важно поддерживать уровень гиалуроновой кислоты для снижения риска развития различных состояний.
Научные исследования демонстрируют эффективность использования гиалуроновой кислоты при остеоартрозе благодаря ее способности уменьшать боль и улучшать функцию суставов.
Использование капель с гиалуроновой кислотой при синдроме сухого глаза облегчает состояние людей, им страдающих.
Гиалуроновая кислота может помочь сохранить молодость и здоровье кожи. Именно поэтому производители многих косметических продуктов по уходу за кожей включают этот ингредиент в состав кремов, масок, сывороток.
При снижении выработки гиалуроновой кислоты может увеличиваться риск развития первичной открытоугольной глаукомы.
Богаты гиалуроновой кислотой мясо говядины, индейки, свинины, баранины и курицы, в также бульон из костей и хрящей.
Витамин С играет важную роль в производстве гиалуроновой кислоты. Отличным выбором будут красный, желтый и оранжевый болгарский перец, цитрусовые, петрушка и кинза.
Магний может помочь синтезировать гиалуроновую кислоту. Магнием богаты бананы, яблоки, авокадо, помидоры, дыни, груши и персики. Они также богаты другими питательными веществами, которые могут помочь оптимизировать ваше здоровье.
С осторожностью следует использовать гиалуроновую кислоту при наличии аллергических реакций на яйца и/или мясо птицы; в случае приема лекарств, влияющих на свертываемость крови; при гемофилии; при инфекционных заболеваниях суставов или кожных заболеваниях в области пораженных остеоартрозом суставов.
Гиалуроновая кислота не рекомендуется беременным и кормящим женщинам. Также не рекомендуется применение гиалуроновй кислоты лицам, не достигшим 18 лет.
В настоящее время существует не много информации о неблагоприятном влиянии гиалуроновой кислоты, и большая часть таких сведений относится к медицинскому применению гиалуроновй кислоты при ее иньекционном введении при остеоартрозах. Известно, что использование гиалуроновой кислоты в средствах по уходу за кожей может вызвать сухость кожи.
Следует отметить, что проводимые в настоящее время клинические испытания гиалуроновой кислоты не демонстрируют ее эффективность при пероральном приеме, в виде биологически активных добавок к пище. В таком виде гиалуронова
я кислота разрушается в желудочно-кишечном тракте.
Есть ли смысл принимать гиалуроновую кислоту?
Гиалуроновая кислота — это макромолекула-полимер, которая входит в состав множества тканей и биологических жидкостей нашего организма. Она является компонентом кожи, глазного яблока и суставного хряща, слюны и синовиальной жидкости.
Молекула гиалуроновой кислоты представляет собой полимер гликозаминогликан, способный удерживать до 1000 молекул воды. Это свойство гиалуроновой кислоты и отвечает за упругость суставного хряща, вязкость синовиальной жидкости и тургор кожи.
Известно, что с возрастом продукция собственной гиалуроновой кислоты организмом снижается. Ранее ее получали из гребней петухов или глаз крупного скота, сейчас технологии позволяют получать более чистую гиалуроновую кислоту путем бактериального синтеза.
Применение гиалуроновой кислоты наиболее распространено в кометологии, но не стоит преуменьшать ее значение в других областях медицины.
Препараты гиалуроновой кислоты используются в разных областях медицины, когда требуется улучшить качество суставного хряща, повысить тургор и упругость кожи, а также во время операций на глазах, когда требуется защитить глазное яблоко от высушивания.
Разберем каждое из направлений и целесообразность использования в ней гиалуроновой кислоты.
Гиалуроновая кислота в лечении суставов
При артрозных изменениях суставов, когда пациента беспокоят боль, скованность и «хрусты», часто рекомендуют уколы гиалуроновой кислоты. В основе заболевание лежит истончение хряща и изменение в качестве и количестве смазки – синовиальной жидкости (снижается ее вязкость и объем).
Процедура инъекций гиалуроновой кислоты относительно проста и безопасна.
При внутрисуставном введении гиалуроновой кислоты, еще называемом «протез синовиальной жидкости», отмечают улучшение функции суставов, снижение боли и уменьшение хрустов. Процедура инъекций относительно проста и безопасна, часто требуется провести их курсом, длительность которого определяется индивидуально. Наибольшую эффективность такие инъекции показали в коленном суставе, однако также могут применяться при болях в других суставах.
Гиалуроновая кислота в офтальмологии
Часто препараты с гиалуроновой кислотой используются в хирургии глаза, как внутренняя среда для проведения операции. Капли с гиалуроновой кислотой помогают при синдроме «сухого глаза» и при пользовании контактными линзами.
Гиалуроновая кислота в уходе за кожей
Именно применение в косметологии больше всего на слуху, когда речь идет о гиалуроновой кислоте, и это неслучайно. Она, как губка, задерживает влагу во всех слоях эпидермиса и дерме. Когда гиалуроновой кислоты достаточно – кожа увлажненная, упругая, не формирует мелких складок и морщин. То есть, молодая.
Сейчас предлагается большой выбор кремов, масок, сывороток с гиалуроновой кислотой. Они обладают хорошими увлажняющими свойствами.
Хотя и было показано, что большая молекула гиалуроновой кислоты не может пройти между клетками в более глубокие слои кожи, даже ее присутствие и удержание влаги на поверхности будет хорошо увлажнять кожу.
Также появляются продукты с солями гиалуроновой кислоты – гиалуронат натрия и калия, это маленькие молекулы, которые проникают в более глубокие слои кожи.
Гиалуроновая кислота используется косметологами в процедуре мезотерапии, или по-другому, биоревитализации, цель которой – увлажнить кожу, убрать мелкие морщины, а также стимулировать синтез собственных молекул коллагена и эластина.
Гиалуроновая кислота еще и вариант филлера – препарата для заполнения объема при коррекции овала лица, придания формы губам, скулам. Филлеры бывают коллагеновые, жировые и гиалуроновые.
Последние пользуются популярностью, так как родственны коже, достаточно безопасны. Немалым плюсом является наличие в арсенале косметологов гиалуронидазы – фермента, расщепляющего гиалуроновую кислоту в случае, если хочется уменьшить выраженность эффекта или по иной причине удалить препарат.
Существует гиалуроновая кислота в виде капсул, таблеток, порошков.
Таким образом, гиалуроновая кислота хороший, проверенный косметологический препарат, его эффективность в увлажнении кожи не оставляет сомнений. Но, приписываемые ей антивозрастное действие, способность предупреждать и устранять морщины сильно преувеличены.
Существует гиалуроновая кислота в виде биологически активных добавок для приема внутрь: капсулы, таблетки, порошки.
В таком виде ее применение не целесообразно, так как крупная молекула гиалуроновой кислоты просто расщепится в кишечнике на маленькие молекулы глюкозы и уже в таком виде поступит в кровь.
Наш организм умеет и ежедневно синтезирует около 15 граммов гиалуроновой кислоты из сахаров, которые мы потребляем с пищей.
Таким образом, оправдано лишь местное введение и применение гиалуроновой кислоты, и оно достаточно эффективно, когда проводится по показаниям.