Гонадное спокойствие что это
Гонадное спокойствие что это
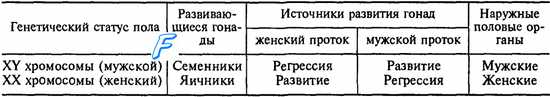
Примерно до 6—7-й недели внутриутробной жизни эмбриона его гонады развиваются идентично как у мужчин, так и у женщин. Это так называемая индифферентная стадия развития эмбриона, когда половая система обоих полов развивается по одной генетической программе. В период формирования гонадного пола у плода развиваются мужской (вольфов) и женский (мюллеров,) протоки. Первоначально развитие этих протоков начинается унипотенциально, т. е. независимо от будущего пола, и только один из них может развиваться в половой тракт, связанный с конкретным генетическим полом плода. В частности, вольфов проток превращается в структуры мужского полового тракта, а мюллеров — женского (табл. 16.1). Закладка индифферентных гонад происходит у эмбриона в виде гонадных валиков. В эпителии гонадных валиков обособляются крупные первичные половые клетки, которые в дальнейшем дают начало развитию половых клеток. Первичные половые клетки дифференцируются на 5-й день после фертилизации. По прошествии 3 нед они определяются среди клеток внезародышевой энтодермы в стенке желточного мешка (часть первичной кишки, вынесенная за пределы зародыша). От поверхности внутрь половых валиков прорастают тяжи, состоящие из первичных половых клеток фолликулярного эпителия, который выполняет для первичных половых клеток трофическую роль. В течение 3 нед жизни эмбриона в половых валиках эти клеточные элементы развивается в ткань, которая будет основой первичных гонад. Первичные половые клетки из вольфова тела мигрируют в эту ткань, в которой из них будут образовываться половые клетки или гаметы. В индифферентный период развития первичных гонад в их стро-мальной ткани содержится два типа клеток. Один тип клеток на гонадной стадии дифференциации пола развивается в гранулезные клетки яичников или в клетки Сертоли семенных трубочек в яичках. Второй тип клеток на стадии гонад дифференцируются в клетки прозрачной оболочки (theca pellucida) в яичниках или в клетки Лейдига в семенниках.
Таблица 16.1. Особенности формирования гонадного пола у плода
У эмбриона мужского пола на 6—7-й неделе эмбриональной жизни после миграции первичных половых клеток в первичные гонады в присутствии Y-хромосомы, содержащей SRY-ген, происходит дифференциация клеток Сертоли. В процессе дифференциации клетки Сертоли располагаются вокруг первичных половых клеток, в результате начинается развитие трубочек семенников в первичных гонадах. Дифференциация мезенхи-мальных (стромальных) клеток гонад в интерстициальные клетки Лейдига, которые в последующем будут секретировать мужской половой гормон тестостерон, начинается с 8—9-й недели и заканчивается на 10-й неделе развития плода.
У женского эмбриона дифференцирование первичных гонад в яичники начинается с 9-й недели, когда активируются Х-хромосомы. Их активация приводит к пролиферации первичных половых клеток, деление которых осуществляется путем митоза. К моменту рождения плода женского пола в яичниках содержатся первичные ооциты, которые образуются в период развития плода из первичных половых клеток путем мейотического деления. Однако уже в периоде внутриутробного развития мейоз первичных половых клеток блокируется (стадия поздней профазы) после образования первичного ооцита. В первичном ооците мейоз на стадии поздней профазы вновь возобновится спустя много лет в одну из будущих овуляций, под влиянием гонадотропинов гипофиза и гормонов половых желез, в периоде пубертатного развития женского организма.
Медицинские интернет-конференции
Языки
Физиологические периоды развития половой системы мальчиков (обзор)
Резюме
Ключевые слова
Обзор
Роль гормонов в процессе внутриутробного формирования половой системы у плода мужского пола
Формирование половой системы начинается с 3-й недели эмбрионального развития. От мезонефроса отделяются первичные бипотенциальные гонады, парамезонефральные (Мюллеровы) и мезонефральные (Вольфовы) протоки – предшественники наружных и внутренних гениталий. C4-й недели эмбриогенеза начинается миграция герминативных клеток в первичную гонаду. Под контролем специфических генов – SRY и SOX 9 – происходит формирование тестикула из бипотенциальной гонады, дифференцировка клеток Сертоли и Лейдига.
Следующий этап внутриутробного развития обусловлен гормональной активностью эмбрионального тестикула.
Рис. 1. Схема гормональной активности эмбрионального тестикула
Антимюллеров гормон (АМГ), секретируемый фетальными клетками Сертоли, приводит к регрессии Мюллеровых протоков. Тестостерон, секретируемый фетальными клетками Лейдига, действует через андрогеновый рецептор Вольфовых протоков, индуцируя формирование придатков, семявыносящих протоков, семенных пузырьков. Под действием эмбриональной 5-альфа-редуктазы 2 тестостерон трансформируется в дигидротестостерон (ДГТ), который активирует андрогеновый рецептор предстательной железы и наружных гениталий, запускает процесс их маскулинизации.
Любые нарушения секреции или действия андрогенов могут привести к крипторхизму, часто ассоциированному с гипоспадией, расщеплением мошонки, микропенисом. Кроме того, доказано значение дефицита ЛГ в генезе паховой задержки яичка. В экспериментальном изучении гипогонадотропного гипогонадизма, обусловленного нарушением синтеза и действия гонадотропин-рилизинг гормона, показано нарушение пахово-мошоночной фазы опускания яичка. По данным клинического исследования, частота крипторхизма при полной форме гипогонадотропного гипогонадизма составила 40%, из которых 23% пациентов имели двусторонний крипторхизм, 17% – односторонний [Pitteloud, 2002].
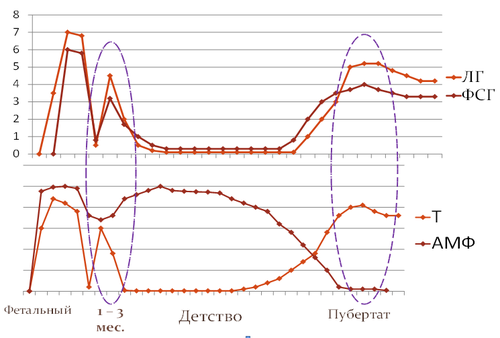
Периоды физиологической активности гипоталамо-гипофизарно-гонадной системы
Итак, внутриутробное развитие плода – период высокой активности половых желез, результатом которой является дифференцировка наружных и внутренних гениталий. Гипоталамо-гипофизарно-гонадные взаимосвязи также формируются в этот период, они способствуют развитию гонад, регулируют процесс опускания яичек в мошонку. Совокупность генетических и гормональных факторов обеспечивает полноценное формирование половой системы к рождению ребенка.
Период транзиторной постнатальной активности гипоталамо-гипофизарно-гонадной системы сменяется ювенильной паузой – периодом физиологического покоя половых желез. В это время уровень половых гормонов резко снижается и имеет допубертатные значения до наступления полового созревания. Исключение составляет антимюллеровый гормон, его уровень остаётся высоким в течение всего допубертатного периода и является маркером функционального созревания клеток Сертоли [GrinsponR.P., ReyR.A., 2010]. Вместе с тем незначительное и постепенное увеличение секреции гормонов гипофиза и гонад в этот период имеет место, что косвенно подтверждает созревание диэнцефальных структур головного мозга. Развития половых желез в этот период не происходит, оно тормозится гипофизарным гонадотропин-ингибирующим фактором, секреция которого регулируется гипоталамическими и эпифизарными нейропептидами. Гонадотропин-ингибирующий фактор очень похож на гонадотропный гормон по строению молекулы, а потому легко и прочно соединяется с рецепторами тех клеток, которые настроены на чувствительность к гонадотропинам. Никакого стимулирующего действия на половые железы он не оказывает, при этом перекрывает доступ к рецепторам гонадотропного гормона.
Рис.2. Схема изменения активности гипоталамо-гипофизарно-гонадной системы у мальчиков
Следующим периодом активации гипоталамо-гипофизарно-гонадной системы является пубертат. Пубертат – транзиторный период между детством и половой зрелостью, контролируется комплексом нейроэндокринных факторов, обеспечивающих ряд физических и психических изменений, приводящих к физической, психической и репродуктивной зрелости организма. Начало пубертата определяется способностью центральной нервной системы индуцировать синтез и импульсную секрецию гонадотропин-рилизинг гормона (ГТ-РГ). Результатом пульсирующей секреции ГТ-РГ является увеличение секреции гонадотропинов и стимуляция синтеза половых стероидов. Одновременно с этим повышается чувствительность гипофиза к действию гонадотропин-рилизинг гормона, происходит созревание рецепторного аппарата гонад. Лютеотропный гормон активно стимулирует синтез андрогенов в клетках Лейдига, под действием тестостерона и дигидротестостерона происходит развитие вторичных половых признаков. Фолликулостимулирующий гормон связывается с рецепторами клеток Сертоли, стимулируя продукцию ингибина Б. Уровень антимюллерова гормона к началу пубертата снижается. Под действием ФСГ в период пубертата происходит увеличение массы семенных канальцев и созревание сперматозоидов в клетках Сертоли.
Пубертатный период характеризуется становлением гипоталамо-гипофизарно-гонадных взаимосвязей, обеспечивающих работу половых желез по принципу отрицательной обратной связи. Снижение концентрации гонадотропинов на фоне пубертата является результатом обратного ингибирующего влияния половых стероидов. Учитывая особенности регуляции гонадотропной секреции, однократное исследование базального уровня гонадотропинов, как правило, неинформативно. Динамический анализ образцов сыворотки крови имеет большее диагностическое значение в определении инициации и прогрессирования пубертата.
Синтез андрогенов в надпочечниках и гонадах
По биохимической классификации, соответствующей количеству атомов углерода в молекуле, андрогены являются С-19 стероидами [А.Д. Подтетнев, 2000]. Единым субстратом для биосинтеза всех стероидных гормонов в надпочечниках и гонадах является холестерин. Андрогены синтезируются из эфиров холестерина, образующихся в печени и поступающих в эндокринные железы в составе липопротеинов низкой плотности. Внутриклеточный транспорт холестерина к внутренней мембране митохондрий регулируется преимущественно стероидогенным регуляторным протеином StAR. Биосинтез стероидов осуществляется при участии ферментов двух групп: гидроксилазы/десмолазы и дегидрогеназы/изомеразы. Гидроксилазы входят в состав цитохром Р 450- зависимой группы оксидаз. Синтез ферментов стероидогенеза в надпочечниках регулируется АКТГ, в тестикулах – ЛГ. Схема биосинтеза андрогенов представлена на рисунке 3.
Рис.3. Схема биосинтеза андрогенов в надпочечниках и гонадах
Первые три энзим-зависимых превращения являются общими для надпочечников и гонад и реализуются при участии ферментов 20,22 – холестерол-десмолазы, 17-α-гидроксилазы, 17,20-лиазы и 3-β-гидроксистероиддегидрогеназы. Заключительный этап биосинтеза половых стероидов происходит исключительно в клетках Лейдига при участии 17-β-гидроксистероиддегидрогеназы, катализирующей превращение андростендиола в тестостерон, и периферических тканях при участии 5-α-редуктазы, катализирующей синтез дигидротестостерона [И.И. Дедов, Т.В. Семичева, 2002].
Биологическое действие андрогенов в период препубертата и пубертата
Андростендион и дегидроэпиандростерон (ДГЭА) синтезируются в тестикулах в незначительном количестве. Основной пул этих андрогенов является результатом надпочечникового стероидгенеза. Андростендион и ДГЭА являются промежуточными продуктами биосинтеза тестостерона, поэтому повышение их концентрации в сыворотке крови может быть результатом дефицита фермента одного из звеньев этой цепи. Уровень дегидроэпиандростерона существенно возрастает за два года до повышения тестостерона в сыворотке. Концентрация андростендиона в крови постепенно растёт, начиная примерно с 7 лет жизни, а после 30 лет плавно снижается.
Адренархе
Биологическая роль адренархе
В двух независимых исследованиях проведена оценка роста у здоровых детей в период адренархе. Небольшой, но значимый скачок роста был обнаружен в возрасте от 6,5 до 8,5 лет [Zemel B.S., Katz S.H., 1986; Largo R.H.,1993]. Другими авторами показана положительная корреляция показателей костного возраста и ДГЭА у пациентов с преждевременным половым развитием на фоне лечения гонадотропин-рилизинг-гормоном и подавления секреции гонадотропинов [Wierman M.E., 1986].
В проспективном исследовании, проводимом на большой когорте здоровых детей [OngK.K., PotauN., 2004], была обнаружена взаимосвязь между антропометрическими показателями в постнатальном периоде, избыточной прибавкой массы тела в течение препубертатного периода и высоким уровнем надпочечниковых андрогенов (дегидроэпиандростерона сульфата, андростендиона) в возрасте 8 лет для детей обоих полов. Полученные результаты показали, что исследование секреции андрогенов у детей препубертатного возраста имеет важное значение для определения риска возникновения инсулинорезистентности и центрального ожирения у взрослых.
Тестостерон является основным продуктом секреции яичек в результате их стимуляции ЛГ. Большая часть тестостерона (20-78%), поступающего в кровь, связывается со специфическим транспортным белком – глобулином, связывающим половые гормоны (ГСПГ). Эта связь непрочная, тестостерон легко высвобождается, превращаясь в активную форму, и оказывает биологическое воздействие на андрогенные рецепторы тканей. Физиологически высокий уровень ГСПГ сохраняется у мальчиков в течение всего допубертатного периода, а к началу полового созревания его уровень резко снижается [SorensenK., AndersonA.M., 2007].
Тестостерон, доминирующий среди циркулирующих андрогенов, является одновременно активным гормоном и прогормоном для синтеза 5α-дигидротестостерона. Тестостерон диссоциирует от ГСПП и диффундирует в клетку. Конверсия тестостерона в дигидротестостерон происходит непосредственно в андроген-зависимых тканях и регулируется двумя изоэнзимами: 5-α-редуктазой I и II типа. Известно, что основное биологическое действие 5α-дигидротестостерона проявляется внутриутробно в развитии наружных половых органов плода мужского пола. В период пубертата ДГТ несет основную ответственность за рост и дифференцировку предстательной железы [Wilson J.D., 1996]. Методом иммуногистохимии ферментативная активность 5α-RD2 была определена и в других урогенитальных тканях: придатках, яичках, губернакулюме, кавернозных телах. Мутация гена 5αRD2 приводит к редкому аутосомно-рецессивному варианту нарушения формирования пола. Подавление активности данного фермента – к регрессии предстательной железы [Zhu Y.S., Imperato-McGinley J.L., 2009]. Экспрессия 5α-RD 1 типа происходит в печени, коже, эпителиальных клетках придатков.
Андрогены осуществляют своё действие посредством связывания с внутриклеточным андрогеновым рецептором. Взаимодействие андрогена с рецептором индуцирует ряд конформационных изменений, таких как димеризация, внутриклеточный транспорт и связывание со специфической последовательностью ДНК, целью которой является транскрипция гена – синтез РНК [QuigleyC.A., De-BellisA. etal., 1995]. Дигидротестостерон обладает большей афинностью к АР по сравнению с тестостероном, главным образом за счет того, что тестостерон быстро освобождается из своей связи с рецептором. Другие стероиды, такие как андростендион, ДЭАС, эстрадиол, прогестерон, имеют еще меньшее сродство с АР, нежели тестостерон.
Очевидными андроген-зависимыми органами являются мужские гонады и придатки, наружные гениталии, предстательная железа, семенные пузырьки, мышцы, кожа. Однако АР найден и во многих других тканях: гипоталамусе, гипофизе, почке, селезенке, сердце, слюнных железах [WeinbauerG.F., LuetjensC.M., 2010]. В эмбриональный период андрогены определяют дифференцировку наружных гениталий. В период пубертата обеспечивают формирование мужского фенотипа.
В яичках АР экспрессируется в клетках Лейдига, клетках Сертоли, перитубулярных клетках. Экспериментальные исследования показали, что связь андрогенов с АР клеток Сертоли необходима для созревания сперматоцитов [ChangC., ChenY.T., 2004].
Мышцы имеют очень низкую активность 5 альфа-редуктазы, но высокую активность гидроксистероиддегидрогеназы. В скелетных мышцах может осуществляться конверсия андростедиона втестостерон и эстрогены. Основной андроген мышц тестостерон оказывает прямой анаболический эффект на гладкую и поперечно-полосатую мускулатуру с увеличением мышечной массы и гипертрофией волокон. Количество волокон при этом не изменяется. Как следствие действия тестостерона увеличивается синтез РНК и гликогена поперечно-полосатых мышечных волокон. Отсутствие секреции тестостерона может привести к атрофии мышц [WeinbauerG.F., LuetjensC.M., 2010].
Андрогены и эстрогены стимулируют минерализацию костной ткани, увеличивают костную плотность. Метаболизм кости обусловлен взаимодействием тестостерона и эстрадиола. Тестостерон способствует образованию костной ткани. Эстрадиол тормозит как образование, так и резорбцию кости [ValimakiV.V., AlfthanH. еtal., 2004]. Результатом дефицита половых стероидов является остеопороз. В период пубертата увеличение линейного роста кости прямо коррелирует с увеличением концентрации тестостерона. К завершению пубертата происходит закрытие эпифизарных зон роста. При низкой концентрации гормона эти события могут задерживаться.
В период пубертата происходит тестостерон-зависимый рост гортани в длину. Одновременно с этим происходит увеличение длины и массы голосовых связок, приводящее к понижению голосового регистра [ClaassenH., MonigH., 2006]. После завершения периода полового созревания АР теряется, поэтому модификация голоса не может быть достигнута у взрослых мужчин с гипогонадизмом.
В центральной нервной системе также возможна конверсия тестостерона в дигидротестостерон, однако активность ферментов и распределение рецепторов неоднородно в различных зонах мозга. Развитие мозга по мужскому типу детерминировано действием тестостерона. Половая идентификация, поведение, сексуальная ориентация программируются в течение внутриутробного периода развития [ZitzmannM., 2006]. Существует тесная взаимосвязь между уровнем андрогенов и телесной и духовной деятельностью человека. Андрогены влияют на работоспособность, настроение, ощущение уверенности в себе.
Помимо очевидных точек приложения, андрогены влияют на функцию печени, стимулируя синтез белка. Наличие АР в костном мозге обусловливает стимуляцию функции эритропоэза. Влияние андрогенов на жировой обмен характеризуют исследования, подтверждающие снижение уровня ЛПВП при низком уровне тестостерона. Один из механизмов влияния андрогенов на артериальное давление обусловлен стимуляцией выработки эритропоэтина. С другой стороны, прогипертензивный эффект обусловлен влиянием на ренин-ангиотензин-альдостероновую систему [WeinbauerG.F. etal., 2010].
Заключение. Изменение уровня гонадотропинов и половых стероидов на фоне нормально протекающего развития половой системы обусловлено их взаиморегулирующим влиянием друг на друга. Каждый этап развития контролируется комплексом гормональных факторов. Диагностика патологии полового развития основана на комплексной оценке гонадотропинов, половых стероидов в сыворотке крови пациента и их соотношений. Анализируя гормональный профиль детей и подростков, необходимо учитывать физиологические изменения активности половых желез, определяемые онтогенезом и имеющие характерные особенности.
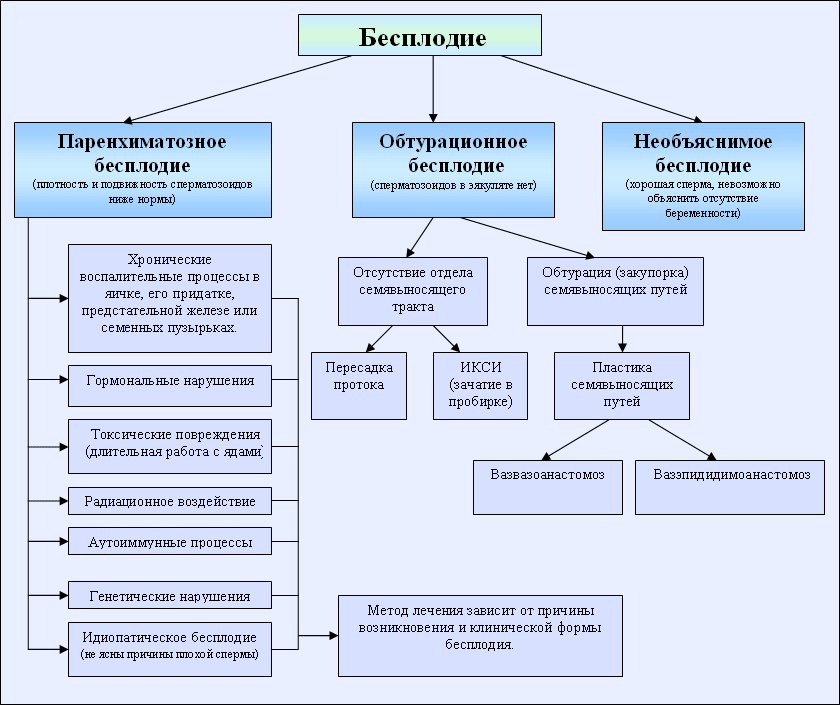
Бесплодие
УЗНАЙТЕ БОЛЬШЕ ПО ТЕЛЕФОНУ ГОРЯЧЕЙ ЛИНИИ:
Бесплодие
Найти причину нелегко!
Современные методы дают возможность гораздо лучше выявлять причины бесплодия, чем это было несколько десятилетий назад. Однако, несмотря на прогресс, нередко врачам так и не удается установить точную и однозначную причину бесплодия.
По приблизительным оценкам, во всем мире примерно в 30% проблемных случаев медики говорят об «идиопатическом бесплодии», когда даже самое тщательное обследование не дает возможности установить точные причины отсутствия возможности зачать ребенка естественным путем.
Мы предлагаем самое полное обследование для установления причины бесплодия!
Получите консультацию сейчас.
Диагностика причин женского бесплодия
Первичная недостаточность яичников
Причина первичной яичниковой недостаточности — патология яичников. Отличительный признак первичной яичниковой недостаточности — повышение уровня гормона ФСГ.
Виды яичниковой недостаточности:
Причинами развития недостаточности яичников могут быть:
Характерны жалобы на приливы, нерегулярный цикл или его отсутствие, бесплодие. Как правило, первичная яичниковая недостаточность является следствием генетических аномалий – потому, по клинической картине (аркообразное нёбо, крыловидные складки на шее, широкая грудная клетка) легко выявить наличие грубых генетических заболеваний. Что подтверждается при генетическом обследовании. Женщины с истощёнными или резистентными яичниками имеют нормальный женский внешний вид, но УЗИ исследование выявляет отсутствие созревающих фолликулов.
Эндокринологические нарушения и вторичная недостаточность яичников
Вторичная яичниковая недостаточность характеризуется снижением секреции гонадолиберина в гипоталамусе или гонадотропных гормонов в аденогипофизе. Чаще всего обусловлена врожденными или приобретенными заболеваниями гипоталамуса или аденогипофиза, но может быть вызвана и избыточной продукцией эстрогенов вне яичников.
Для вторичной яичниковой недостаточности характерно снижение уровней ЛГ и ФСГ. Несмотря на различия в этиологии и патогенезе, первичная и вторичная яичниковая недостаточность характеризуются сходными клиническими проявлениями: аменореей или опсоменореей и бесплодием.
При эндокринном бесплодии в организме женщины нарушается процесс образования зрелых яйцеклеток, готовых к оплодотворению при отклонениях гормональной регуляции репродуктивной системы. Это значит, что овуляция не происходит, вследствие чего не может возникнуть и беременность. В этом случае причинами бесплодия у женщин являются гормональные нарушения в работе эндокринных желез: яичников, надпочечников, щитовидной железы.
Наиболее частым заболеванием эндокринной системы, с которым обращаются женщины, является синдром поликистозных яичников, который сопровождается отсутствием овуляции на фоне превышения количества выработки андрогенов (мужских половых гормонов), внутри яичников образуются множественные кисты – мешочки, наполненных жидкостью. Эти кисты представляют собой незрелые фолликулы с погибшими яйцеклетками, которые не смогли в свое время выйти из яичников.
Сопровождается эндокринное бесплодие:
Аномалии развития репродуктивных органов
К аномалиям развития половой системы относят пороки развития половых органов и нарушения процесса полового созревания.
В настоящее время аномалии развития репродуктивных органов рассматриваются как многофакторные пороки, связанные с генетическими и хромосомными нарушениями, с воздействием вредных факторов во внутриутробном периоде, с нарушениями гормональной регуляции.
Существует множество классификаций врожденных пороков развития, основанных на различных признаках, однако единой классификации, учитывающей нарушения формирования пола и аномалии развития матки и влагалища, нет.
Как правило, врожденные пороки развития диагностируются в пубертатном либо в детском возрасте. Поэтому в клинику обращаются пациентки с известным диагнозом. В случае первичного обращения в клинику пациентки с впервые заподозренным диагнозом необходимо, по возможности, организовать весь комплекс диагностических мероприятий, направленных на уточнение диагноза. Для уточнения характера генетических нарушений необходима консультация генетика.
Синдром Шерешевского-Тернера
Синдром Рокитанского-Кюстнера
При аплазии матки и влагалища (синдром Рокитанского-Кюстнера-Майера-Хаузера) отсутствуют матка и влагалище, однако отмечается нормальная функция яичников, гормональный профиль не изменен.
Синдром Свайера
При синдроме Свайера определяется кариотип 46ху, наблюдается дисгенезия яичек, при этом сформирована нормальная матка, маточные трубы.
Пороки развития, связанные с аплазией влагалища
Данная категория пациенток является одной из самых проблемных в плане эффективности оперативного лечения, в большинстве случаев пациенткам выполняется удаление матки и создание искусственного влагалища из тазовой брюшины.
Двурогая матка, удвоение матки, перегородки матки, рудиментарный рог
При наличии двурогой матки возможность вынашивания беременности должна решаться индивидуально в каждом конкретном случае (после проведения МРТ, гистероскопии или, возможно, лапароскопии), пациентка должна быть предупреждена о высоком риске невынашивания беременности. При полном удвоении матки и шейки матки тактика определяется индивидуально после проведения дополнительных методов исследования (ГСГ, МРТ, гистероскопия, лапароскопия).
Возможности реализации репродуктивной функции при различных вариантах пороков развития половых органов разнообразны.
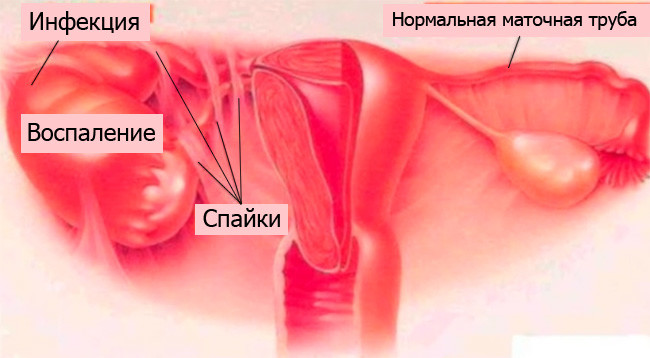
Инфекционные заболевания и нарушение проходимости маточных труб
Непроходимость маточных труб. Встречается у женщин, которые перенесли инфекционные или воспалительные женские заболевания. Гонорея, хламидиоз, уреаплазмоз – являются основной причиной бесплодия. Выскабливания и аборты истончают выстилку матки, и оплодотворенная яйцеклетка не может закрепиться. Эти состояния также приводят к сужению просвета маточных труб и образованию спаек. Непроходимость труб – частая причина бесплодия.
В основе лежит механическая преграда на пути слияния сперматозоида с яйцеклеткой в маточных трубах. Чаще всего перекрытие возникает за счет образования спаек внутри или снаружи маточных труб. Изменения, происходящие в маточных трубах, обусловлены их анатомическими особенностями. Так как это тонкостенный орган, в нем могут развиваться сужения, переходящие в облитерацию просвета на любом уровне, и, чаще всего, к заращению фимбриального отдела трубы.
Причинами трубного бесплодия являются воспалительные и деструктивные процессы в маточных трубах, придатках матки, воспалительные изменения после осложненных абортов, самопроизвольных выкидышей и патологических родов, туберкулез женских половых органов, спаечный процесс, возникающий после оперативных вмешательств на органах малого таза (при миоме, кистах яичников, внематочной беременности и др.) или на фоне хронического сальпингоофорита. Нередко причиной трубного бесплодия бывает воспаление смежных органов, в частности острый аппендицит, инфекционные и неинфекционные заболевания кишечника в результате перехода инфекции со смежных органов.
Маточные причины бесплодия
Гинекологические заболевания с нарушением анатомо-функционального состояния эндометрия, не сопровождающиеся ановуляцией и непроходимостью маточных труб:
При обследовании женщин часто выясняется, что причиной женского бесплодия стал эндометриоз. Эта патология характеризуется разрастанием клеток эндометрия, которые должны находиться только в слизистой матки, в других органах, например, на яичниках, в мышечном слое матки, в трубах или брюшной полости.
Причиной бесплодия у женщин могут быть изменения состава слизи цервикального канала и РН содержимого влагалища, что нарушает, или полностью блокирует поступательное движение сперматозоидов.
Иммунологическое бесплодие
— выработка антиспермальных антител (АСАТ) у женщины к сперматозоидам партнера.
Иммунологическое бесплодие относится к особым формам нарушения репродуктивной функции. Оно встречается редко, но может привести к невозможности зачатия, поэтому во время обследования бесплодной супружеской пары этот фактор обязательно учитывается.
Основная негативная роль при иммунологическом бесплодии принадлежит антиспермальным антителам (АСАТ). Они могут появиться в организме женщины или мужчины. В зависимости от этого бесплодие разделяют на мужское и женское. Дополнительно иммунологическое бесплодие разделяют по тяжести заболевания в зависимости от количества антиспермальных антител, их класса, их негативного действия на сперматозоид.
Эти антитела могут находиться в крови или в других средах организма (у мужчин – в эякуляте, а у женщин – в среде цервикального канала или матки). Антиспермальные антитела нарушают фертильность из-за их действия на сперматозоиды. Они могут нарушить сперматогенез, что в итоге приводит к уменьшению количества сперматозоидов или даже к полному их отсутствию. Из-за негативного влияния на сами сперматозоиды, может снижаться их подвижность.
АСАТ разделяются на спермоиммобилизирующие, спермоагглютинирующие и спермолизирующие.
Они могут прикрепляться к поверхности сперматозоида, а такой «груз» будет «непосильной ношей», поэтому ему будет сложно добраться до яйцеклетки. Антиспермальные антитела класса IgG чаще всего прикрепляются к головке и хвосту сперматозоида, антитела класса IgA обычно прикрепляются к хвосту и в некоторых случаях к головке сперматозоида, антитела класса IgM обычно прикрепляются в области хвоста. Локализация в области хвоста в наибольшей степени влияет на подвижность сперматозоида, что особенно важно при прохождении его через цервикальный канал. При локализации в области головки подвижность значительно не нарушается, но это может повлиять на пенетрационные свойства.
Причины иммунологического бесплодия
Существуют предрасполагающие факторы, которые могут повысить риск развития такой патологии. К ним относят инфекции, передающиеся половым путем, хронические воспалительные заболевания, разнообразные перенесённые травмы и операции, анатомические патологии. Механизм развития подобной отрицательной реакции более изучен у мужчин, чем у женщин. Предполагается, что организм женщины может реагировать на сперматозоид аналогично реакции на чужеродные клетки. С каждым половым актом женский организм сталкивается с большим количеством сперматозоидов, что может вызвать иммунный ответ, но такая реакция наблюдается у небольшого числа женщин. Провоцирующими факторами, которые могут повысить риск подобной женской иммунной реакции, являются не только инфекции и воспалительные заболевания, но и эндометриоз, а также отягощенный аллергический анамнез.
У женщин антиспермальные антитела наиболее часто создают иммунный ответ именно в шейке матки. Значительно реже иммунная реакция развивается на уровне влагалища, эндометрия или в маточных трубах.
По вопросам женского бесплодия связанного с генетическими отклонениями вы можете получить консультацию врача-генетика
Киевской Юлии Кирилловны
Диагностика причин мужского бесплодия
Генетические факторы мужского бесплодия
По вопросам мужского бесплодия связанного с генетическими отклонениями вы можете получить консультацию врача-генетика
Канивца Ильи Вячеславовича
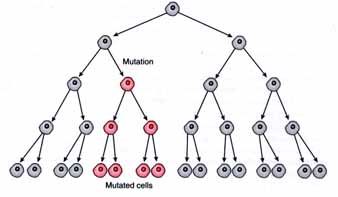
Одной из возможных причин бесплодия является гонадный мозаицизм.
Что это такое?
Как известно, в большом количестве случаев бесплодие имеет генетические причины. Такие причины несложно определить с помощью генетических тестов. Для проведения таких исследовний обычно используются лимфоциты крови. При этом мы исходим из предпосылки, что все клетки организма генетически однородны и обнаруженные изменения содержатся во всех клетках, в том числе и половых.
Однако, в ряде случаев это не так. Иногда бывает, что генетические изменения происходят на определенной стадии развития эмбриона, когда формируются основные органы и ткани. В этом случае, генетические изменения затрагивают только часть клеток организма. Такое явление называется мозаицизм.
Во многих случаях мозаицизм фенотипически не проявляется и человек этого не замечает. Но, однако, если такие генетические изменения затрагивают предшественники половых клеток (гаметогонии), это называется гонадный мозаицизм. Патогенный клон половых клеток может првалировать над нормальными клетками, а в некоторых случаях нормальные половые клетки могут вовсе отсутствовать. Это невозможно обнаружить путем генетического анализа другого материала, например крови или буккального эпителия.
Как определить гонадный мозаицизм
У мужчин гонадный мозаицизм можно определить путем сравнения результатов генетического исследования сперматозоидов и лимфоидных клеток. Процедура сдачи анализа ничем не отличается от таковой при спермограмме. Более того, материал может быть получен дома и доставлен в лабораторию в течение суток. Далее из сперматозоидов и лимфоидных клеток выделяется ДНК и исследуется на наличие хромосомных аномалий делеций, дупликаций или мутаций. Результаты, полученные из разного материала сопоставляются между собой.
Методы определения гонадного мозаицизма.
Хромосомный микроматричный анализ в диагностике гонадного мозаицизма и других причин бесплодия.
Микроделеции и микродупликации, которые являются причиной бесплодия.
Однако, известно, что AZF-микроделеции обнаруживаются только у 7,3% мужчин с бесплодием. Во многих других случаях причиной могут быть микроделеции и микродупликации в других генах.
Как правило, в таких случаях спермограмма не выявляет каких либо отклонений в морфологии и подвижности хромосом. Более того, такие сперматозоиды могут обладать способностю к оплодотворению яйцеклетки. К сожалению, при этом получается дефектный эмбрион неспособный к развитию, котоый элиминируется на ранних сроках беременности.
Хромосомный микроматричный анализ выявляет все возможные структурные изменения хромосом
Существует более 30 генов непосредственно связанных с нарушением репродуктивной функции. Повреждения в некоторых из них порут проявляться в нарушении сперматогенеза, развития половых органов, эндокринных отклонениях. В болшей же части эти изменения могут не проявляться никак, кроме их отрицательного влияния на репродуктивную функцию. Выявить такие нарушения можно с помощью хромосомного микроматричного анализа.
Микроделеции и микродупликации не проявляющиеся в виде нарушений сперматогенеза или дргуих нарушений составляют примерно 3,4% от всех случаев мужского бесплодия.
Истории пациентов:
Пациентка О., 28 лет
Обратилась для профилактического осмотра. На момент обследования жалоб не предъявляла, у врача-гинеколога в последний раз была 5 лет назад, не обращалась чаще, так как «все было в порядке».
По результатам обследования выявлена патология шейки матки, воспалительный процесс в подострой стадии. Проведена диагностика инфекций, затем терапия инфекционных заболеваний, радиоволновая терапия шейки матки. В настоящее время пациентка регулярно наблюдается, никаких отклонений от нормы нет.
Пациентка Л., 33 лет
Обратилась для консультации с результатами анализов, по которым выявлен острый воспалительный процесс органов малого таза. В момент обращения беспокоили боли внизу живота, выделения из половых путей, проблемы с интимной близостью.
В результате проведенного лечения выявленной инфекции, передающейся половым путем, получены «хорошие» контрольные результаты анализов. Качество жизни пациентки полностью восстановлено.
Пациентка К., 29 лет
Обратилась с жалобами на плохую переносимость гормональной контрацепции (тошнота, головокружение, слабость, депрессивное состояние, прибавку массы тела). Ранее обследована не была, контрацепцию подобрали без предварительного обследования.
В результате тщательного обследования, включая генетические особенности, выявлена непереносимость одного из компонентов препарата – произведен персонифицированный выбор гормонального контрацептива, учитывая все показания и противопоказания. Пациентка довольна, так как препарат оказывает не только контрацептивный эффект, но и лечебный на предменструальный синдром.