Гонадотропин или кломид что лучше
Заместительная гормональная терапия для мужчин с возрастным андрогенным дефицитом
Специализация: урология, андрология
Синдром возрастного андрогенодефицита у мужчин — это нарушение биохимического баланса, возникающее в зрелом возрасте по причине недостаточности андрогенов в сыворотке крови, нередко сопровождающейся снижением чувствительности организма к андрогенам. Как правило, это приводит к значительному ухудшению качества жизни и неблагоприятно сказывается на функциях практически всех систем организма. Естественно, что огромный интерес вызывают вопросы терапии андрогенного дефицита, поскольку именно она ставит сложную задачу перед врачом-клиницистом: выбрать из широкого арсенала методов и препаратов гормональной терапии наиболее оптимальный, сочетающий в себе качество, эффективность, а также удобство в применении.
В настоящее время врачи-урологи и андрологи наиболее часто применяют заместительную терапию тестостероном. Данный метод позволяет решить целый ряд задач: снизить симптомы возрастного андрогенодефицита путем повышения либидо, общей сексуальной удовлетворенности, уменьшить выраженность либо полностью ликвидировать вегетососудистые и психические расстройства. Кроме того, если заместительная терапия тестостероном применяется более 1 года, у пациентов наблюдается повышение плотности костной массы, снижение выраженности висцерального ожирения, а также нарастание мышечной массы. Также после длительного курса лечения нормализуются лабораторные параметры: наблюдается повышение уровня гемоглобина или количества эритроцитов, снижение уровня ЛПОНП (липопротеинов очень низкой плотности) и ЛПНП (липопротеинов низкой плотности) при неизмененном уровне ЛПВП (липопротеинов высокой плотности). Многие авторы считают, что такого эффекта можно достичь, добившись восстановления концентрации тестостерона в крови до нормального уровня (10–35 нмоль/л). Следует также учитывать, что *17α-алкилированные препараты тестостерона флуоксиместеролон и метилтестостерон обладают выраженной гепатотоксичностью, оказывая токсическое и канцерогенное влияние на печень, а также отрицательно воздействуют на липидный спектр крови (резкое повышение уровня атерогенных и снижение уровня антиатерогенных липопротеидов). Поэтому применение этих производных тестостерона в клинической практике было прекращено.
В настоящее время из пероральных препаратов предпочтение отдается тестостерону ундеканоату (Андриол). Указанный эфир тестостерона не подвергается первичному печеночному метаболизму, так как всасывается в лимфатическую систему, минуя печень. После гидролиза тестостерона ундеканоата в лимфатической системе в системный кровоток поступает тестостерон, который оказывает лечебное действие как сам по себе, так и через свои основные метаболиты – дигидротестостерон (ДГТ) и эстрадиол, обусловливающие полный спектр андрогенной активности тестостерона. Таким образом, тестостерона ундеканоат сохраняет свою активность при пероральном применении. Вместе с этим, минуя систему воротной вены и прохождение через печень, тестостерона ундеканоат не оказывает гепатотоксического и гепатоканцерогенного действия. Период полувыведения препарата из плазмы составляет 3–4 часа. В связи с этим режимом дозировки тестостерона ундеканоата является 2-кратный прием в течение суток, это не всегда удобно для пациентов. Исходя из собственного опыта, мы считаем, что Андриол является достаточно мягким препаратом и помогает только в случаях начальных и минимальных проявлений возрастного андрогенного дефицита.
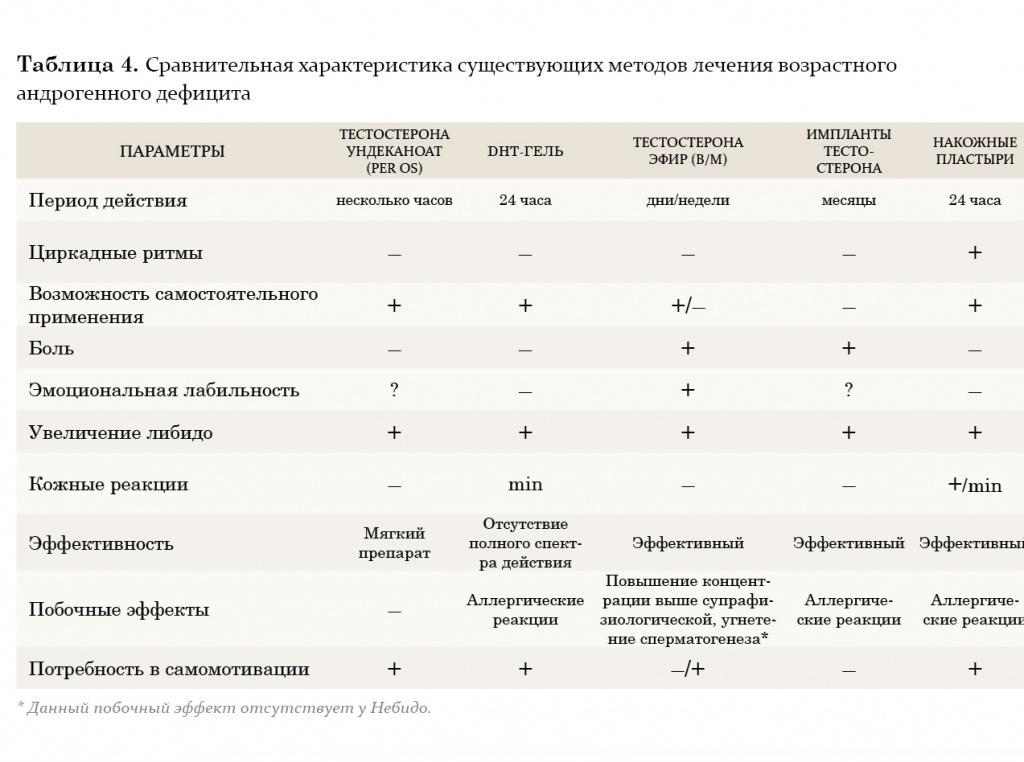
Внутримышечные инъекции пролонгированных эфиров тестостерона также являются широко применяемым методом заместительной терапии у мужчин с гипогонадизмом. Два наиболее известных эфира тестостерона – тестостерона ципионат и тестостерона энантат, имеют похожую фармакокинетику. При внутримышечном введении этих препаратов создается депо, из которого препарат высвобождается в кровеносное русло. В течение первых 2–3 дней после введения уровень тестостерона повышается до супрафизиологических цифр, а затем медленно снижается на протяжении последующих 2 недель до субнормальных значений. Положительной стороной этих препаратов является длительность терапевтического действия. Тем не менее резкие изменения в уровне тестостерона, зачастую ощущаемые самим пациентом в виде подъемов и снижения либидо, общего самочувствия, эмоционального статуса, являются нежелательными качествами данных препаратов. В связи с этим большие надежды возлагаются на новый препарат Небидо (Шеринг), фармакокинетика которого значительно отличается от других эфиров тестостерона. Небидо представляет собой тестостерона ундеканоат и является препаратом, не обладающим пиком повышения концентрации.
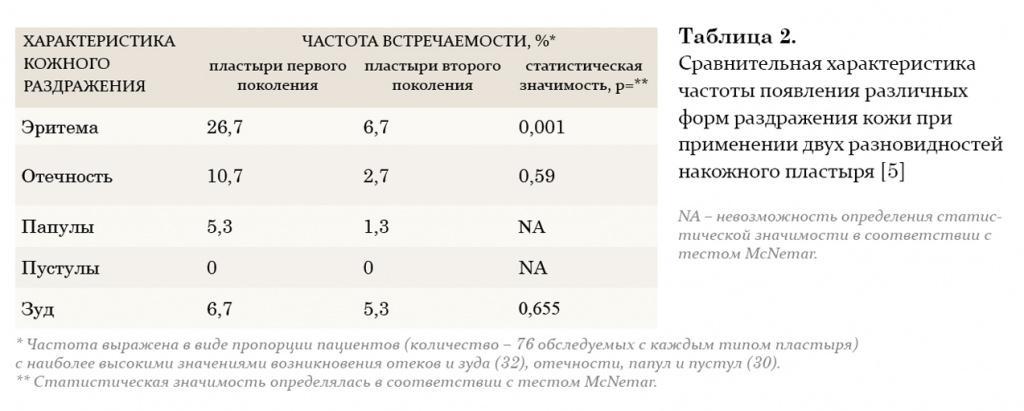
На протяжении двух последних десятилетий большое внимание уделяется исследованию преимуществ трансдермального применения препаратов тестостерона. Мошоночные пластыри обладают эффективным действием, и некоторые пациенты считают их наиболее удобным методом лечения. Накожные пластыри наиболее хорошо воспринимаются пациентами и дают эффективный уровень тестостерона в сыворотке крови. Тем не менее существуют некоторые различия между этими двумя разновидностями пластырей относительно их аллергогенного потенциала: при применении накожных пластырей отмечается гораздо большая частота возникновения аллергических реакций и раздражения кожи, чем при применении мошоночных пластырей.
Гель тестостерона обладает всеми преимуществами пластырей и не вызывает развития кожных реакций. Единственный его недостаток заключается в наличии возможности контакта геля с партнершей и недостаточном количестве долговременных исследований по его применению.
Трансдермальный путь введения тестостерона позволяет избежать его первичного метаболизма в печени и инактивации, как это происходит при применении пероральных андрогенных препаратов, а также позволяет имитировать циркадные ритмы высвобождения физиологического немодифицированного тестостерона и его естественных метаболитов, эстрадиола и ДГТ. К тому же терапию с использованием пластырей и геля в случае необходимости можно легко прервать. К положительным моментам этого метода лечения также относится низкий риск возникновения лекарственной зависимости.
Европейский препарат 5-α-дигидротестостерон-гель (ДГТ) хотя и признан эффективным, однако неизвестно, оказывает ли изолированное применение неароматизированного андрогена, каким является ДГТ, такое же действие, как тестостерон, в связи с тем, что метаболиты тестостерона включают эстрадиол. По мнению многих авторов, применение препарата не рекомендуется, так как ДГТ вследствие невозможности превращения в эстрадиол не обладает полным спектром терапевтических свойств тестостерона (например, влиянием на костную ткань и сердечно-сосудистую систему).
Некоторые из препаратов заместительной терапии, такие как тестостерона ундеканоат, ДГТ-гель и мошоночные пластыри, вызывают существенное увеличение концентрации ДГТ в сыворотке крови. ДГТ известен как главный андроген простаты, и в связи с этим проводилось много дискуссий по поводу способности его вызывать заболевания предстательной железы. Однако, несмотря на эти предположения, в последнее 10-летие не зафиксировано данных в пользу увеличения частоты возникновения патологии простаты при назначении препаратов ДГТ.
Таким образом, существует множество препаратов заместительной андрогенотерапии, однако все они имеют те или иные побочные эффекты, а также обладают угнетающим действием на сперматогенез. В последнее время появляется все больше работ, демонстрирующих вторичный характер возрастного андрогенного дефицита. Согласно материалам ВОЗ, получены данные о сохранении секретирующей функции клетками Лейдига у пожилых мужчин, что позволило ученым предложить принципиально новый подход в лечении возрастного андрогенного дефицита, основанный на стимуляции синтеза эндогенного тестостерона.
Однако не стоит забывать, что наряду с абсолютными противопоказаниями для заместительной терапии андрогенами (рак грудной и предстательной желез) существуют и дополнительные (доброкачественная гиперплазия предстательной железы с выраженной обструкцией, пролактинома, полицитемия). К относительным противопоказаниям относятся нарушения сна в виде апноэ, обструктивные заболевания легких, интенсивное курение.
К побочным эффектам андрогенов относятся усиление ночного апноэ, полицитемия, гинекомастия, приапизм, задержка жидкости, повышение АД, отеки, увеличение размеров простаты, торможение сперматогенеза.
То есть сегодня существуют методы лечения возрастного андрогенного дефицита, которые можно разделить на две группы, принципиально различающиеся по механизму действия:
заместительная терапия экзогенными андрогенными препаратами; терапия, стимулирующая синтез эндогенного тестостерона.
Таким образом, можно сказать, что оптимального для всех средства для лечения возрастного андрогенного дефицита у мужчин не существует. И к выбору препарата следует подходить строго индивидуально, учитывая возраст пациента, индекс массы тела, необходимость сохранения сперматогенеза, показатели гематокрита и сопутствующие заболевания.
Гонадотропин или кломид что лучше
Московский областной НИИ акушерства и гинекологии (дир. — акад. РАМН В.И. Краснопольский), Москва, Россия, 101000
Центр лечения бесплодия ‘Лера’, Москва
Гормональная стимуляция функции яичек при гипогонадотропном гипогонадизме, обусловленном приемом андрогенных анаболических стероидов (клинический случай)
Журнал: Проблемы репродукции. 2016;22(4): 102-105
Назаренко Р. В., Здановский В. М. Гормональная стимуляция функции яичек при гипогонадотропном гипогонадизме, обусловленном приемом андрогенных анаболических стероидов (клинический случай). Проблемы репродукции. 2016;22(4):102-105.
Nazarenko R V, Zdanovskiĭ V M. Hormonal stimulation of testicular function in patient with hypogonadotrophic hypogonadism due to androgenic anabolic steroids abuse (a case report). Russian Journal of Human Reproduction. 2016;22(4):102-105.
https://doi.org/10.17116/repro2016224102-105
Московский областной НИИ акушерства и гинекологии (дир. — акад. РАМН В.И. Краснопольский), Москва, Россия, 101000
Московский областной НИИ акушерства и гинекологии (дир. — акад. РАМН В.И. Краснопольский), Москва, Россия, 101000
Центр лечения бесплодия ‘Лера’, Москва
Андрогенные анаболические стероиды (ААС) используются профессиональными атлетами и бодибилдерами для повышения силы и увеличения мышечной массы вот уже более 50 лет [2]. Вместе с тем распространившееся в последнее время повальное увлечение фитнесом привело к неконтролируемому и, подчас, безрассудному применению ААС даже среди людей, далеких от профессионального спорта. Согласно официальным данным, только в США насчитывается порядка 3 млн человек, употребляющих ААС для увеличения мышечной массы [3, 4]. В России такой статистики нет. Удручающе низкий уровень медицинской грамотности населения вкупе с многочисленными интернет форумами и чатами привел к распространению недостоверной, непроверенной информации об их использовании. Как итог, все больше молодых мужчин репродуктивного возраста стали использовать ААС в дозировках, превышающих таковые даже у профессиональных спортсменов. При этом анаболические стероиды имеют ряд негативных побочных эффектов: гепатотоксичность, кардиотоксичность, полицитемия, дислипидемия, гипертензия, гинекомастия, атрофия яичек и бесплодие [5,6]. Зачастую многие из этих мужчин становятся пациентами клиник репродуктивного здоровья. Кроме того, следует отметить, что, помимо ААС, в мире фитнеса и спорта сейчас распространено употребление различных пищевых добавок. При этом, по данным M. Parr и соавт. [7], более 20% официально зарегистрированных спортивных пищевых добавок содержат ААС, не указанные в их составе. Все более возрастающее употребление ААС позволило выделить такое его последствие, как гипогонадизм, в особое состояние, с присущей только ему клинической картиной и подходами к лечению.
Принято считать, что ААС приводят к угнетению высвобождения гонадотропин-рилизинг-гормона из гипоталамуса по механизму отрицательной обратной связи и, как следствие, к прекращению выработки ЛГ и ФСГ. В результате снижается, а затем и полностью прекращается секреция эндогенного тестостерона клетками Лейдига и андрогенсвязывающего протеина клетками Сертоли, что приводит к остановке сперматогенеза. Более того, согласно данным S. Shokri и соавт. [8], полученным в экспериментах на мышах, экзогенные производные тестостерона вкупе с физическими нагрузками индуцируют апоптоз в клетках сперматогенеза и разрушают герминогенный эпителий в яичках. Некоторые исследователи полагают, что и сами по себе чрезмерные физические нагрузки могут приводить к нарушению сперматогенеза [9]. Отмечено, что при больших нагрузках уровень потребления кислорода возрастает в 10-20 раз, что увеличивает продукцию активных радикалов кислорода. Избыточная продукция таких радикалов является основой оксидативного стресса, повреждающего клетки и ткани.
В литературе существует совсем немного работ, посвященных лечению мужского бесплодия, вызванного приемом ААС. Так, M. Gazvani и соавт. [11] описали 4 клинических случая спонтанного восстановления фертильности у пациентов, употреблявших ААС в течение 18, 8, 13 и 5 мес соответственно, после отмены препаратов. Во всех случаях беременность у партнерш наступила самостоятельно в течение года после нормализации показателей спермограммы.
D. Turek и соавт. [12] сообщили об успешном лечении азооспермии у пациента, употреблявшего ААС, с помощью инъекций Х.Г. Беременность в паре наступила после 3 мес лечения.
D. Menon [13] описал случай успешного лечения гипогонадизма и азооспермии, обусловленных приемом ААС, с помощью инъекций ХГ и человеческого менопаузального гонадотропина (чМГ). ХГ вводили 2 раза в неделю по 10 000 МЕ вместе с ежедневными инъекциями чМГ в дозе 75 МЕ. В течение 3 мес показатели спермограммы пришли в норму, уровень тестостерона также нормализовался. Спустя 10 мес после начала лечения у партнерши наступила беременность, закончившаяся рождением здорового ребенка.
L. Lipshultz и соавт. [14] рекомендуют введение ХГ по 3000 МЕ через день в течение 3 мес и более. Так как большие дозы ХГ подавляют секрецию ФСГ, авторы советуют одновременное назначение кломифена цитрата для усиления секреции ЛГ и ФСГ в передней доле гипофиза. Сперматогенез, по мнению авторов, восстанавливается через 4-6 мес.
Итак, анализируя данные немногочисленных источников литературы, можно сказать, что единого подхода к лечению такой группы пациентов нет до сих пор. Препараты и дозировки подбираются, как правило, эмпирически на основании индивидуального опыта и предпочтений лечащего врача. Отсутствует также единое мнение о времени начала стимуляции функции яичек. Большинство авторов отводят на самостоятельное восстановление сперматогенеза от 4 до 12 мес, однако некоторые специалисты советуют придерживаться выжидательной тактики вплоть до 2 лет.
Клинический случай
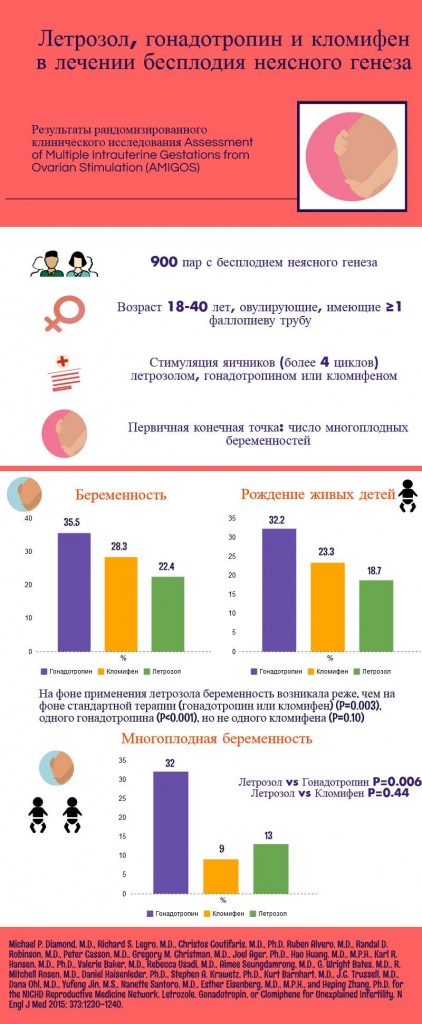
Летрозол, гонадотропин и кломифен в лечении бесплодия неясного генеза
Всероссийская Образовательная Интернет-Сессия
Информация и материалы, представленные на настоящем сайте, носят научный, справочно-информационный и аналитический характер, предназначены исключительно для специалистов здравоохранения, не направлены на продвижение товаров на рынке и не могут быть использованы в качестве советов или рекомендаций пациенту к применению лекарственных средств и методов лечения без консультации с лечащим врачом.
Лекарственные препараты, информация о которых содержится на настоящем сайте, имеют противопоказания, перед их применением необходимо ознакомиться с инструкцией и проконсультироваться со специалистом.
Мнение Администрации может не совпадать с мнением авторов и лекторов. Администрация не дает каких-либо гарантий в отношении cайта и его cодержимого, в том числе, без ограничения, в отношении научной ценности, актуальности, точности, полноты, достоверности научных данных представляемых лекторами или соответствия содержимого международным стандартам надлежащей клинической практики и/или медицины основанной на доказательствах. Сайт не несет никакой ответственности за любые рекомендации или мнения, которые могут содержаться, ни за применимость материалов сайта к конкретным клиническим ситуациям. Вся научная информация предоставляется в исходном виде, без гарантий полноты или своевременности. Администрация прикладывает все усилия, чтобы обеспечить пользователей точной и достоверной информацией, но в то же время не исключает возможности возникновения ошибок.
Гонадотропин или кломид что лучше
Период полувыведения ингибиторов ароматазы III поколения значительно короче (приблизительно 45 ч) по сравнению с кломифена цитратом, что допускает их быстрое выведение из организма. Поскольку не происходит подавления ЭР, нет и нежелательных эффектов на ткани-мишени эстрогенов, что нередко отмечают при лечении кломифена цитратом.
Таким образом, ингибиторы ароматазы представляют интерес в качестве альтернативы кломифена цитрату, особенно в случаях, когда лечение кломифеном не дало результатов (освещено выше в данной главе). Однако в случае резистентности к кломифена цитрату (невозможность овуляции) из-за высокой инсулинорезистентности или при ошибочном назначении кломифена цитрата (например, при гипоталамической аменорее или функциональной недостаточности яичников) применение ингибиторов ароматазы вряд ли даст хороший результат.
Коррекция инсулинорезистентности препаратами, повышающими чувствительность к нему, — логичный подход при лечении женщин с инсулинорезистентно-стью. Альтернативные методы лечения рассмотрены при других проблемах, например инъекции экзогенных гонадотропинов при гипоталамической ановуляции и донорство ооцита в случае истощения яичников.
В последние несколько лет накопились свидетельства в пользу ингибиторов ароматазы как метода лечения бесплодия. В большинстве исследований применяли летрозол. Однако существует также опыт применения анастрозола — другого ингибитора ароматазы III поколения, близкого к летрозолу. Пока неизвестно, есть ли клинически значимые фармакологические различия между летрозолом и анастрозолом. Недавно проведенные исследования безопасности препаратов выявили, что анастрозол не вызывает тератогенных или кластогенных эффектов на эмбриогенез у животных.
Ингибиторы ароматазы и гонадотропины
Ингибиторы ароматазы можно применять изолированно в качестве препарата для индукции овуляции, либо как дополнительный препарат в сочетании с экзогенным ФСГ или другими медикаментами для улучшения результатов индукции овуляции.
Важное преимущество изолированного применения ингибитора ароматазы — возможность восстановления монофолликулярной овуляции у женщин с ановуляторным бесплодием (например, при СПКЯ) при многократном или однократном режиме приема ингибитора ароматазы в начале менструального цикла. Преимущество режима однократного приема состоит в его удобстве, однако имеет потенциальный недостаток в виде возрастания побочных эффектов при приеме большей дозы. Впрочем, при однократном приеме доз, в несколько раз превышавших рекомендуемые для индукции овуляции, никаких нежелательных эффектов не отмечено.
Ингибиторы ароматазы можно применять и в сочетании с инъекциями ФСГ для увеличения количества развивающихся преовуляторных фолликулов и улучшения результата лечения. Прием ингибитора ароматазы совместно с ФСГ приводит к значительному сокращению дозы ФСГ, необходимой для оптимальной стимуляции яичников даже у женщин с бедным ответом. Дополнительный эффект ингибиторов ароматазы, заключающийся в нормализации содержания эстрогенов (если оно превышает физиологическую норму) и наблюдаемый при развитии нескольких овариальных фолликулов, также может улучшить результаты лечения.
Таким образом, применение ингибиторов ароматазы при изолированном использовании ведет к предсказуемой реакции (развитию одного или двух зрелых фолликулов) и значительно снижает риск гиперстимуляции яичников и многоплодной беременности. Для получения овуляции с большим количеством фолликулов, по-видимому, необходимо к лечению ингибитором ароматазы добавлять ФСГ.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Послекурсовая терапия (ПКТ)
Содержание
Дословно PCT означает терапия после цикла, однако для удобства были включены прочие компоненты, которые применяются с самого начала цикла и формально в состав ПКТ не входят.
Цели послекурсовой терапии
Основные компоненты PCT [ править | править код ]
Дополнительные компоненты [ править | править код ]

Протокол и дозировки ПКТ от sashan’а [ править | править код ]
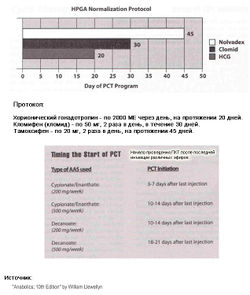
Послекурсовая терапия блокаторами эстрогена проводится всегда и только после выведения анаболических гормонов! По мнению Michael Scally MD, мирового специалиста по гормон-заместительной терапии, это ключевое условие для успешного восстановления дуги гипофиз-гипоталамус яички. Крайне желательно провести анализ на общий тестостерон, чтобы убедиться в низком уровне и только тогда начинать прием препаратов данной группы. По данным разных авторов продолжительность варьируется от 2 до 5 недель, в зависимости от степени подавления гипофиза.
Дозировки Кломифена (дни*дозировка).
Дозировки Торемифена (дни*дозировка)
ПКТ от Dr. Michael Scally [ править | править код ]
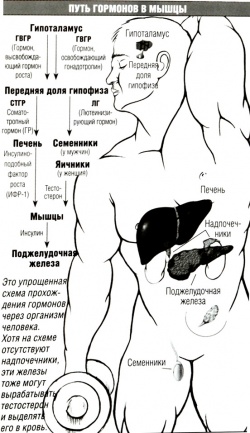
Послекурсовая терапия от Dr. Michael Scally, опубликованная в книге William Llewelly’s Anabolics 10th издание. Схема была разработана врачами Program for Wellness Restoration (PoWeR) и с успехом применяется для лечения гипогонадизма после андрогенной заместительной терапии. Эффективность подтверждается клиническим исследованием. [4] Данная терапия рекомендована после каждого «тяжелого» курса анаболических стероидов, если гонадотропин не применялся во время курса. Оригинальная схема была обновлена в 2010 году, но по заявлениям Dr. Michael Scally изменилась незначительно. Теперь предлагается использовать гонадотропин в дозе 2000 мг вместо 2500 на протяжении 20 дней и дозировка тамоксифена составляет 20 мг.

Лечение начинается после выведения анаболического препарата. Примерное время выведения указано на рисунке. Если ХГЧ вводился во время курса, то в составе ПКТ он не требуется, поскольку секреторная функция яичек будет сохранена. [6]
ПКТ от Южакова Антона [ править | править код ]
Слабый курс Один из двух препаратов.
Сильный курс или длинный Один из двух препаратов.
Очень сильный курс Все препараты.
Если на курсе был препарат повышающий пролактин тамоксифен использовать нельзя
Пример послекурсовой терапии [ править | править код ]
| Неделя | Тестостерон энантат | Тестостерон пропионат | Ингибитор ароматазы (Анастрозол) | Гонадотропин | Тамоксифен | Пептид или ГР |
|---|---|---|---|---|---|---|
| 1 | 500 мг/неделя | — | — | — | — | — |
| 2 | 500 мг/неделя | — | 0,5 мг через день | — | — | — |
| 3 | 500 мг/неделя | — | 0,5 мг через день | — | — | — |
| 4 | 500 мг/неделя | — | 0,5 мг через день | — | — | — |
| 5 | 500 мг/неделя | — | 0,5 мг через день | — | — | — |
| 6 | 500 мг/неделя | — | 0,5 мг через день | — | — | — |
| 7 | 500 мг/неделя | — | 0,5 мг через день | — | — | — |
| 8 | 500 мг/неделя | — | 0,5 мг через день | 250 МЕ, дважды в неделю | — | — |
| 9 | — | 100 мг через день | 0,5 мг через день | 250 МЕ, дважды в неделю | — | — |
| 10 | — | 100 мг через день | 0,5 мг через день | 250 МЕ, дважды в неделю | — | — |
| 11 | — | — | — | — | — | + |
| 12 | — | — | — | — | 20 | + |
| 13 | — | — | — | — | 20 | + |
| 14 | — | — | — | — | 10 | + |
| 15 | — | — | — | — | — | + |
Выше представлен классический курс тестостерона энантата с переходом в последние две недели на Тестостерон пропионат, чтобы поддерживать постоянный уровень тестостерона. Однако адекватное фармакологическое сопровождение позволяет снизить риск побочных эффектов и значительно повысить эффективность.
Если в конце курса используются короткие эфиры с быстрым периодом полувыведения (например, тестостерона пропионат), либо оральные препараты, то введение гонадотропина и блокаторов ароматазы прекращается вместе с употреблением анаболического препарата. ПКТ антиэстрогенами начинается через 3-4 дня, когда в организме концентрация перечисленных средств сокращается до минимума.
Прогестиновые курсы [ править | править код ]
Лучшие препараты [ править | править код ]
Международный рейтинг препаратов для послекурсовой терапии по версии Eroids.
Читайте также [ править | править код ]
Предупреждение [ править код ]