Гормон вазопрессин что это такое
Несахарный диабет
Несахарный диабет – это нарушение водно-солевого равновесия, происходящее либо из-за недостаточной выработки гормона вазопрессина (антидиуретического), либо из-за болезней почек, при которых канальцы становятся нечувствительными к этому гормону. Заболевание имеет также другое название – мочеизнурение. Это состояние полностью соответствующее клинической картине. При этой болезни человек выделяет ненормально обильное количество мочи, отчего происходит обезвоживание, пациент испытывает постоянную жажду. Это редкое заболевание, которое в настоящее время чаще всего встречается в качестве осложнений нейрохирургических операций и непременно требует обращения к эндокринологу.
Причины мочеизнурения
Причины подразделяются на такие группы:
Причины центрального характера – это чаще всего опухоли или заболевания, разрушающие мозговые структуры (гипоталамус, гипофиз), в которых синтезируется антидиуретический гормон. Кроме опухолей, деструктивное действие может оказывать сифилитический, малярийный или туберкулезный процесс, когда очаги поражения располагаются в гипоталамусе или гипофизе. Нормальное функционирование этих частей нарушается при черепно-мозговой травме, операциях на головном мозге. Иногда мочеизнурение развивается вслед за перенесенным менингоэнцефалитом.
Почечные формы мочеизнурения бывают врожденными и приобретенными. Их вызывают болезни почек – почечная недостаточность, амилоидоз, инфекции, передозировка препаратов лития, избыточное содержание кальция в крови (гиперкальциемия). Врожденные – это медленная потеря зрения, сопровождающаяся мочеизнурением или синдром Вольфрама (этот синдром включает также сахарный диабет и глухоту, но могут проявиться не все составляющие).
Аутоиммунные причины заболевания заключаются в образовании антител к клеткам, вырабатывающим АДГ, при этом его концентрация в крови снижается.
Провоцировать мочеизнурение может и беременность, однако, в этом случае болезнь носит временный характер. Развивается чаще у женщин, имеющих проблемы с почками. Спустя некоторое время после родов здоровье, как правило, приходит в норму.
Классификация
В соответствии с этиологией выделяют центральную и почечную формы болезни. При этом центральная подразделяется еще на 2 группы:
Идиопатическая форма – это врожденное снижение количества продуцируемого гормона. Повлиять на этот процесс никак нельзя, и выздороветь тоже невозможно.
Течение симптоматической формы более благоприятное, после прекращения основного заболевания может прекратиться и мочеизнурение. Такие случаи бывают достаточно часто.
Симптомы
Основных симптомов несахарного диабета два:
Эти симптомы являются обязательными, а все остальные – дополнительными.
В норме взрослый человек выделяет в сутки не более 3 литров мочи. Количество может сокращаться в неблагоприятных условиях (жара, недостаток воды, лихорадка), это нормальная приспособительная реакция, при этом концентрация солей и удельный вес пропорционально растут тоже. Увеличение же количества суточной мочи – всегда проявление болезни.
Человек, больной несахарным диабетом, может выделять от 4 до 20 или даже 30 литров мочи в сутки. Чем меньше вырабатывается антидиуретического гормона, тем тяжелее протекает болезнь, тем больше мочи выделяется. Моча больных людей не имеет характерного соломенного цвета, запаха, концентрация солей низкая. Удельный вес ее (относительная плотность или количество растворенных солей и мочевины) тоже низкий, не более 1003 (норма удельного веса мочи у взрослых – от 1012 до 1025).
В норме из первичной мочи в канальцах почек вода всасывается обратно, а при мочеизнурении этого не происходит, выделяется все количество. Постоянные позывы мешают работать, отдыхать и вообще жить. Из-за постоянных походов в туалет человек не высыпается, становится раздражительным, рассеянным, вспыльчивым, неуравновешенным. Жажда мучает больного человека постоянно, количество выпиваемой жидкости примерно равно количеству отделяемой мочи.
У детей начало болезни иногда проявляется энурезом (ночным недержанием мочи), что должно послужить поводом к обследованию.
Несмотря на огромное количество поглощаемой жидкости, человек страдает от обезвоживания. Образуется мало слюны, слез и пота, кожа сухая, волосы и ногти ломкие. Артериальное давление почти всегда понижено из-за уменьшения объема циркулирующей крови. Снижается аппетит, присоединяется рвота и головная боль. В запущенных случаях развивается гипофизарная недостаточность, когда страдает выработка всех остальных гормонов гипофиза, что влечет за собой полиорганные нарушения.
Страдает половая функция: у женщин нарушается менструальный цикл, у мужчин – потенция.
Если человек не получает лечения или не восполняет количество потерянной жидкости, то обезвоживание заканчивается сгущением крови и коллапсом со всеми вытекающими негативными последствиями.
Диагностика заболевания
Диагностика начинается с исследования свойств мочи: суточного количества, относительной плотности и осмолярности, по которой судят о концентрационной функции почек. Другие необходимые исследования, без которых невозможна полная диагностика:
Лечащий врач может назначить другие исследования, если подозревается недостаточность какого-либо органа. У детей желательно проводить психоневрологическое обследование, поскольку у них врожденные нарушения часто сочетаются с патологией этой сферы.
Для уточнения диагноза может быть назначено сухоядение на 10 или 12 часов. Если человек болен, то за это время вес тела может уменьшиться на 5% за счет потери жидкости.
Вазопрессин: механизм действия и клиническая физиология
Полный текст:
Аннотация
Статья посвящается вазопрессину, механизмам действия и клиничиским физиологиям.
Ключевые слова
Для цитирования:
Наточин Ю.В. Вазопрессин: механизм действия и клиническая физиология. Проблемы Эндокринологии. 2003;49(2):43-50. https://doi.org/10.14341/probl11534
For citation:
Natochin Yu.V. Vasopressin: mechanism of action and clinical physiology. Problems of Endocrinology. 2003;49(2):43-50. (In Russ.) https://doi.org/10.14341/probl11534
1 Работа поддержана Российским фондом фундаментальных исследований (гранты 99-04-49198 и 00-15-97803) и Програм мой президиума РАН. син, аргинин-вазотоцин, гидрин 2 [17, 54, 65]. Ва зопрессину посвящены оригинальные статьи, об зоры [4, 6, 63], монографии и сборники [54, 86]. Идентифицированы клинические синдромы, свя занные с неадекватной секрецией АДГ (синдром Швартца-Бартера), дефицитом секреции АДГ (не сахарный диабет), нечувствительностью клеток ка нальцев к этому гормону (нефрогенный несахар ный диабет) [3, 5]. Отсутствие реакции почки на АДГ может быть обусловлено дефектом многих элементов каскада, от которых зависит увеличение проницаемости для воды в ответ на прием гормона. Описаны формы диабета, обусловленные мутацией гена У2-рецептора [21, 83], гена аквапорина 2 [80]. В настоящей статье будет уделено внимание вопро сам механизма действия и клинической физиоло гии вазопрессина, в решении которых наш коллек тив принимал участие, и итоги исследований дали новое видение ряда этих проблем.
Функции вазопрессина
АДГ вырабатывается в ядрах гипоталамуса, его функция, начиная с бесхвостых амфибий, заклю чается в осмотической регуляции, в сохранении во ды в организме [17, 65]. У бесхвостых амфибий (ля гушки, жабы) АДГ повышает проницаемость для воды клеток эпителия кожи, мочевого пузыря, по чечных канальцев, усиливает транспорт ионов на трия, что обеспечивает осморегуляцию [17, 66]. Во да поступает во внутреннюю среду через покровы в пресной воде, всасывается в кровь в конечных от делах канальцев и в мочевом пузыре. Вазопрессин и соответственно агонисты V,- и У2-рецепторов да ют различные эффекты, они оказывают влияние на тонус сосудов [24, 29], антидиуретическое действие [46, 54], влияют на функцию кровяных пластинок [16], способствуют выделению VIII фактора свер тывания крови [54], оказывают инотропное дейст вие в мышце желудочка сердца [31], влияют на по ведение [35, 73, 81], модулируют вокальную функ цию [36], при введении в определенные участки мозга индуцируют гипергликемию [87], влияют на температуру тела [75], внутриглазное давление [34] и состав жидкостей внутреннего уха [47].
Если свести воедино многие из перечисленных эффектов вазопрессина в основное физиологиче ское назначение этого гормона, можно высказать мысль о том, что оно состоит в создании условий для стабилизации объема клеток в организме бла годаря поддержанию эуосмии и приведении объе ма крови в соответствие емкости сосудистого рус ла. Это во многом определяет эффективную работу физиологических систем организма, продуктив ность которых определяется высокой стабильно стью физико-химических показателей жидкостей внутренней среды, которые зависят от систем ос морегуляции и волюморегуляции. Только в усло виях постоянства состава околоклеточной среды клетки могут точно реагировать на приходящие к ним сигналы (нервные стимулы, гормоны, локаль но образующиеся физиологически активные веще ства).
Когда человек попадает в условия пустыни, ра ботает в горячем цехе, наступает дефицит воды в организме, появляется жажда. Желание пить воду возникает для компенсации потери жидкости, од новременно активируются системы сохранения во ды в теле. Сигнал об осмоляльности крови, воспри нятый осморецепторами [4, 55], передается к ней ронам ядер гипоталамической области головного мозга. При гиперосмии эти нейроны активируют ся, из окончаний аксонов в задней доле гипофиза в кровь человека секретируется аригин-вазопрессин, его концентрация в крови у человека возрастает с 1 до 5 пг/мл. Секреция вазопрессина растет при ги поволемии, стрессе [4].
Эффекты вазопрессина в почке «
Рецепторы вазопрессина имеются в плазматиче ских мембранах различных клеток почки. АДГ уве личивает проницаемость для воды клеток связую щего отдела нефрона и собирательных трубок [19], меняет соотношение объема фильтруемой жидко сти в клубочках различных популяций нефронов при переходе от водного диуреза к антидиурезу [6], в мембранах клетках толстого восходящего отдела петли Генле стимуляция У2-рецепторов приводит к образованию цАМФ и увеличению реабсорбции ионов Na, Са, Mg [37], в клетках собирательных трубок коры АДГ стимулирует транспорт ионов хлора [27], а в клетках собирательных трубок на ружного мозгового вещества почки, где имеется транспортер мочевины [18], АДГ усиливает ее ре абсорбцию. В постнатальном онтогенезе вазопрес син восстанавливает гетерогенность нефронов у крыс с наследственным несахарным диабетом (ли ния Браттлеборо) [85]. Вазопрессин влияет на гло мерулярную фильтрацию благодаря изменению то нуса сосудов и действию на клетки мезангия [6]. Их сокращение приводит к уменьшению поверхности капилляров, через стенку которых происходит ультрафильтрация жидкости в полость капсулы клубочка, снижается коэффициент гломерулярной ультрафильтрации. Этот эффект обусловлен обра зованием цАМФ и не зависит от секреции ренина. Все перечисленные эффекты вазопрессина направ лены на обеспечение максимальной реабсорбции осмотически свободной воды, осмотическое кон центрирование мочи. Для этого требуется увеличе ние осмоляльности мозгового вещества, повыше ние проницаемости плазматических мембран для воды.
Эффекты стимуляции различных типов рецепторов вазопрессина
Стимуляция У2-рецепторов вызывает увеличе ние проницаемости для воды клеток осморегули рующего эпителия, в том числе собирательных тру бок в почке [46, 54], выделение VIII фактора свер тывания крови. Это и определяет эффективность агониста этих рецепторов десмопрессина при неса харном диабете, ночном энурезе, болезни Виллеб- рандта, при сложных формах нарушения гемостаза (уремическое кровотечение, цирроз) и лечении по бочных эффектов действия лекарств и нарушении гемостаза (аспирин, тиклопедин) [68, 78]. Стиму ляция У2-рецепторов наряду с увеличением реаб сорбции воды в собирательных трубках мозгового вещества почки способствует возрастанию реаб сорбции мочевины, в клетках толстого восходяще го отдела петли Генле увеличивается реабсорбция ионов Na, Mg, К, Са.
Механизм антидиуретического действия вазопрессина
Чтобы избежать ошибки и «чужой» цАМФ из другой клетки или из крови не мог бы активировать процессы в данной клетке, плазматическая мем брана непроницаема для АТФ и цАМФ, последний оказывает действие внутри своей же клетки, инак тивируется в ней фосфодиэстеразой цАМФ. Удли нить время жизни цАМФ в клетке можно, если снизить активность фосфодиэстеразы цАМФ, к ингибиторам активности этого фермента относятся теофиллин, в меньшей степени кофеин.
Кроме цАМФ, имеются вторичные посредники иной химической природы, которые участвуют во внутриклеточной сигнализации при активации V.- рецепторов вазопрессином. В качестве вторичного посредника участвуют инозиттрифосфат, диацилг- лицерин, ионы Са [39]. Они в гранулярных клетках эпителия мочевого пузыря и в клетках почечных канальцев снижают эффект АДГ, связанный со стимуляцией транспорта ионов и воды [46].
Мысль о роли гиалуронидазы в механизме дей ствия вазопрессина и увеличении проницаемости для воды высказал А. Г. Гинецинский [32], острая дискуссия продолжалась многие годы, и до настоя щего времени вопрос о месте этого механизма в единой схеме действия АДГ остается дискуссион ным. В то же время до последних лет ведется поиск значения этого фермента в действии АДГ [30, 41, 42, 45].
Модуляция эффекта вазопрессина
Аутакоиды и восстановление водонепроницаемости клеток после действия АДГ
Биохимическая идентификация веществ, сни жающих проницаемость для воды, показала, что клетки мочевого пузыря лягушки выделяют эйко заноиды, в частности простагландин Е2 [64]. Они были выявлены в жидкости, взятой после инкуба ции мочевых пузырей в физиологическом раство ре, а после добавления простагландинов Е2, E.F2aK раствору у серозной оболочки возросшая прони цаемость мочевого пузыря для воды снижалась до нормальных низких значений [13].
Обычно большое внимание уделяют механизму увеличения проницаемости для воды при добавле нии АДГ [3, 5, 6], но мало разработан вопрос о ре гуляции перехода от состояния высокой проницае мости канальцев для воды при ее реабсорбции к во донепроницаемости канальцевой стенки, когда обеспечивается выделение воды из организма. По лагают, что достаточно прекратить секрецию и уда лить из крови АДГ и сама собой восстановится во донепроницаемость канальцевой стенки. Имеются данные об эндоцитозе аквапоринов [26], но важно выяснить, какая система регулирует этот процесс. Это имеет и важное клиническое значение, так как при ряде патологических состояний увеличение ре абсорбции воды приводит к гипоосмии, гипонат риемии, лечение которых представляет собой не простую задачу при отсутствии клинически доступ ных акваретиков, антагонистов У2-рецепторов или иных способов угнетения эффекта АДГ.
При отсутствии вазопрессина в крови почки вы деляют гипотоническую мочу. Наши данные пока зали, что поддержание низкой проницаемости, пе реход в состояние водонепроницаемости и сохра нение такого состояния оказались регулируемыми процессами, зависимыми от извне действующих на клетку веществ, заставляющих ее повиноваться приходящим к мембране клетки стимулам. Их осо бенность в том, что эти стимулы исходят отданной или соседней клетки, заставляют ее же подчинят- сья им и перестраивать свою работу. Оказалось, что увеличение осмотической проницаемости без АДГ связано с тем, что от мембран клетки удаляются синтезируемые ею простагландины [9, 74], а вос становление водонепроницаемости при удалении АДГ нуждается в присутствии простагландинов. В проведенных нами опытах с применением ингиби торов циклооксигеназы (вальторен, индометацин) и блокадой фосфолипазы А, с помощью кинакрина было показано, что уменьшение секреции простаг ландинов приостанавливает восстановление водо непроницаемости.
Синдром неадекватной секреции вазопрессина
Изменение концентрации вазопрессина в плазме крови при фи зиологических и патологических состояниях (изменено по [7])
Гормон вазопрессин что это такое
В нейрогипофизе не образуются, а лишь накапливаются и секретируются в кровь нейрогормоны супраоптического и паравентрикулярного ядер гипоталамуса — вазопрессин и окситоцин. Оба гормона находятся в гранулах в связанном состоянии со специальными белками — нейрофизинами. В процессе секреции содержимое гранул путем экзоцитоза поступает в кровь.
Регуляция секреции и физиологические эффекты вазопрессина
Секреция вазопрессина зависит от его синтеза в гипоталамических нейронах и регулируется тремя типами стимулов:
1) сдвигами осмотического давления и содержания натрия в крови, воспринимаемыми интероцепторами сосудов и сердца (осмо-, натрио-, волюмо- и механорецепторы), а также непосредственно гипоталамическими нейронами (центральные осморецепторы);
2) активацией гипоталамических ядер при эмоциональном и болевом стрессе, физической нагрузке,
3) гормонами плаценты и ангиотензином-II, как содержащимся в крови, так и образуемым в мозге.
В крови вазопрессин не связывается белками плазмы, но ассоциирован с тромбоцитами, выполняющими по отношению к гормону транспортную функцию.
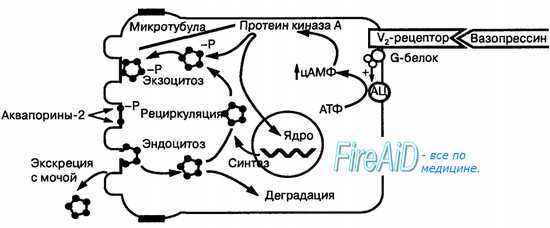
Связывание вазопрессина с V2-рецептором на базолатеральной мембране через мембранный G-белок активирует аденилатциклазу (АЦ), что ведет к образованию вторичного посредника — цАМФ. Последний через активацию протеинкиназы А вызывает фосфорилирование молекул аквапоринов в агрефорах, их взаимодействие с белками микротубул и путем экзоцитоза встраивание аквапоринов в апикальную мембрану. Протеинкиназа А путем активации генома повышает синтез агрефор с аквапоринами. Аквапорины из апикальной мембраны путем эндо-цитоза интернализуются и повергаются рециркуляции или деградации, особенно в отсутствие вазопрессина, а также экскретируются с мочой.
Эффекты вазопрессина реализуются за счет связывания пептида в тканях-мишенях с двумя типами мембранных рецепторов — V1 и V2.
Стимуляция V1-рецепторов, локализованных на мембране эндотелиальных и гладкомышечных клеток стенки кровеносных сосудов, через вторичные посредники инозитол-3-фосфат и кальций-кальмодулин вызывает сужение сосудов, что соответствует названию «вазопрессин». Это влияние в физиологических условиях выражено слабо из-за низких концентраций гормона в крови, но играет существенную роль в изменениях кровообращения при стрессе, шоке, артериальной гипертензии. Через v1-рецепторы вазопрессин повышает чувствительность механорецепторов в каротидных синусах к изменениям артериального давления и этим способствует баро-рефлекторной регуляции артериального давления.
Стимуляция V2-рецепторов базолатеральной мембраны клеток дистальных отделов почечных канальцев через вторичный посредник цАМФ вызывает повышение проницаемости стенки канальцев для воды, ее реабсорбцию и концентрирование мочи, что соответствует второму названию вазопрессина — «антидиуретический гормон». Вазопрессин является единственным гормоном, способным стимулировать канальцевую реабсорбцию воды без задержки натрия. Эффект вазопрессина на транспорт воды связан с особыми транспортными белками «аквапоринами». Только аквапорины 2-го типа являются вазопрессинозависимыми. При наличии в крови гормона вазопрессина (рис. 6.9), он связывается на базолатеральной мембране клеток эпителия почечного канальца с V2-рецептором, следствием чего является активация аденилатциклазы, образование цАМФ, активация протеинкиназы А. Последняя вызывает фосфорилирование молекул аквапори-на-2 в цитоплазматических пузырьках (агрефорах), их транспорт с помощью микротубулярных белков динеина, динактина и миозина-1 к апикальной мембране, где специальные рецепторные молекулы (синтаксин-4, рецепторы-мишени пузырьков и др.) обеспечивают встраивание молекул ак-вапорина-2 в мембрану и формирование водных каналов. Протеинкиназа А является также регулятором синтеза белка аквапорина 2 в ядре клеток эпителия. Поступающая в клетки через водные каналы молекул аквапори-на-2 вода по микротубулярной системе клеток перемещается к базолатеральной мембране, где постоянно встроены вазопресин-независимые белки аквапорины 3-го и 4-го типа. Через них вода выходит в интерстициаль-ную жидкость по осмотическому градиенту (рис. 6.10). В отсутствие вазопрессина молекулы аквапорина-2 подвергаются эндоцитозу (интернализа-ция) в цитоплазму, где вновь способны к рециркуляции, т. е. новому циклу активации, транспорта и встраивания в мембрану, или подвергаются разрушению. Вазопрессин стимулирует всасывание воды и в железах внешней секреции, в желчном пузыре.
Нейропептид вазопрессин поступает по аксонам экстрагипоталамической системы в другие отделы мозга (лимбика, средний мозг) и участвует в формировании жажды и питьевого поведения, механизмах терморегуляции, в нейрохимических механизмах памяти, формировании биологических ритмов и эмоционального поведения.
Вазопрессин стимулирует секрецию кортикотропина в аденогипофизе, подавляет выделение лютропина при стрессе. Метаболические эффекты вазопрессина заключаются в стимуляции гликогенолиза в печени, стимуляции секреции инсулина, повышении синтеза в печени антигемофиличе-ского глобулина А, продукции фактора Виллебрандта.
Недостаток вазопрессина проявляется резко повышенным выделением мочи низкого удельного веса, что называют «несахарным диабетом», а избыток гормона ведет к задержке воды в организме.
Вазопрессин: неклассические эффекты и роль в патогенезе ассоциированных с возрастом заболеваний
Согласно общепринятому мнению, вазопрессин (или антидиуретический гормон – АДГ) оказывает два важнейших классических физиологических эффекта – антидиуретический и вазопрессорный. Однако рецепторы к вазопрессину экспрессируются во многих органах и системах человеческого организма. Это означает, что физиологические эффекты данного гормона намного шире, чем можно предположить. В статье рассматриваются малоизвестные неклассические эффекты АДГ, свидетельствующие о его роли в регуляции гипоталамо-гипофизарно-адреналовой системы, костного метаболизма, углеводного и липидного обменов, системы гемостаза, эндотелиальной функции, механизмов стресса, хронического воспаления, инфекции и клеточной пролиферации. Кроме того, проанализированы недостаточно изученные на сегодняшний день физиологические эффекты АДГ, связанные с регуляцией болевой рецепции, когнитивной функции, социального поведения и участием в механизмах клеточного и системного старения.
Согласно общепринятому мнению, вазопрессин (или антидиуретический гормон – АДГ) оказывает два важнейших классических физиологических эффекта – антидиуретический и вазопрессорный. Однако рецепторы к вазопрессину экспрессируются во многих органах и системах человеческого организма. Это означает, что физиологические эффекты данного гормона намного шире, чем можно предположить. В статье рассматриваются малоизвестные неклассические эффекты АДГ, свидетельствующие о его роли в регуляции гипоталамо-гипофизарно-адреналовой системы, костного метаболизма, углеводного и липидного обменов, системы гемостаза, эндотелиальной функции, механизмов стресса, хронического воспаления, инфекции и клеточной пролиферации. Кроме того, проанализированы недостаточно изученные на сегодняшний день физиологические эффекты АДГ, связанные с регуляцией болевой рецепции, когнитивной функции, социального поведения и участием в механизмах клеточного и системного старения.
Вазопрессин (аргинин-вазопрессин, антидиуретический гормон – АДГ, аргипрессин) представляет собой пептидный гормон с очень коротким периодом полураспада – 16–24 минуты [1]. Он синтезируется в нейронах супраоптического и паравентрикулярного ядра гипоталамуса в виде предшественника – препроАДГ, который сначала там же трансформируется в проАДГ, а затем в составе нейросекреторных гранул по аксонам нейронов гипоталамуса поступает в нейрогипофиз. Во время транспортировки происходит так называемый процессинг: проАДГ расщепляется на зрелый АДГ (нонапептид молекулярной массой 1100 Да) и белок нейрофизин. Выброс АДГ и нейрофизина в кровь происходит путем экзоцитоза и опосредуется зависимыми от кальция механизмами. В крови и тканевой жидкости АДГ легко проникает сквозь стенки капилляров почечных клубочков.
Согласно общепринятому мнению, вазопрессин оказывает два важнейших физиологических эффекта – антидиуретический и вазопрессорный. Первый связан с удержанием воды в организме за счет увеличения ее реабсорбции в дистальных канальцах и собирательных трубочках нефронов почек, второй – с повышением периферического сосудистого сопротивления на фоне увеличения объема циркулирующей крови вследствие задержки жидкости в организме. При этом в физиологических условиях вазопрессорный эффект АДГ не превалирует, поскольку при увеличении секреции АДГ артериальное давление повышается не более чем на 5–10 мм рт. ст. [2].
Все эффекты вазопрессин оказывает через рецепторы V1 и V2. Вазопрессиновые рецепторы являются классическими мембранными рецепторами, связанными с гетеротримерными G-белками.
V1A- и V1B-рецепторы связаны с Gq-белками и стимулируют фосфолипазно-кальциевый механизм передачи гормонального сигнала. V1A(V1R)-рецепторы локализованы в гладких мышцах сосудов и в печени, а также в центральной нервной системе. V1B(V3)-рецепторы экспрессируются в передней доле гипофиза (аденогипофизе) и головном мозге, где вазопрессин выступает нейромедиатором.
V2-рецепторы связаны с Gs-белками и стимулируют аденилатциклазный механизм передачи гормонального сигнала, локализованы преимущественно в почках и служат мишенью для многих лекарственных средств, направленных на борьбу с несахарным диабетом [3].
Рецепторы к вазопрессину экспрессируются во многих клетках и тканях организма человека (табл. 1) [4].
Совершенно очевидно, что при таком распределении рецепторного аппарата вазопрессин характеризуется не только двумя указанными классическими эффектами. Кроме регуляции диуреза, объема циркулирующей крови и тонуса сосудистой стенки АДГ обладает и другими не менее важными неклассическими физиологическими эффектами (рисунок) [4–7].
Гипоталамо-гипофизарно-адреналовая система играет крайне важную роль в управлении гомеостазом организма в период стресса. Она реагирует на стресс резким увеличением секреции адренокортикотропного гормона (АКТГ), что в свою очередь приводит к выбросу из коркового вещества надпочечников в кровь огромного количества кортикостероидов, участвующих в обменных процессах.
Дисфункция гипоталамо-гипофизарно-адреналовой системы способствует развитию постоянного субклинического системного воспаления из-за длительного дефицита кортикостероидов при хроническом стрессе [4]. На секрецию АКТГ в основном влияет кортикотропин-рилизинг-гормон (КТРГ). Но и вазопрессин имеет значение для секреции АКТГ в стрессовой ситуации, поскольку непосредственно воздействует на V1В-рецепторы гипофиза и синергично усиливает эффекты гипоталамического КТРГ.
В экспериментах показано, что внутрибрюшинное или пероральное введение антагониста V1В-рецепторов к вазопрессину предотвращает рост уровня АКТГ в ответ на вводимый вазопрессин [8]. Кроме того, у мышей, лишенных V1В-рецепторов к вазопрессину, уровень АКТГ не повышался после введения вазопрессина. Предотвратить рост АКТГ у мышей можно было также введением антагонистов V1В-рецепторов к вазопрессину. Экспериментальные данные свидетельствуют о том, что КТРГ не может компенсировать блокаду V1В-рецепторов к вазопрессину. Вазопрессин повышает секрецию АКТГ в ответ на острый стресс и не играет существенной роли в регуляции уровней АКТГ и кортикостероидов в отсутствие стресса [8]. Это подтверждают эксперименты на крысах линии Brattleboro с врожденным отсутствием вазопрессина, у которых базальный уровень АКТГ и кортикостероидов не отличался от таковых у животных контрольной группы [8]. Однако при остром стрессе индуцированный уровень АКТГ у крыс линии Brattleboro оказался значительно ниже, чем у здоровых особей контрольной группы (результаты достоверны). В то же время при хроническом (длительном или повторном) стрессовом воздействии уровень АКТГ у крыс контрольной группы повышался в большей степени за счет вазопрессина, чем за счет КТРГ. Поэтому крысы, лишенные вазопрессина, были менее устойчивы как к острому, так и к хроническому стрессу [8].
Наряду с эффектом синергизма в отношении АКТГ вазопрессин продемонстрировал эффект регуляции секреции гормонов надпочечников за счет воздействия на V1А- и V1В-рецепторы (V1А-рецепторы расположены в коре надпочечников, V1В-рецепторы – в хромаффинных клетках мозгового вещества надпочечников). Существует предположение, что вазопрессин продуцируется и секретируется в хромаффинных клетках мозгового вещества надпочечников в ответ на воздействие ацетилхолина и стресс [9]. Вазопрессин действует на V1В-рецепторы хромаффинных клеток, секретирующих также адреналин и норадреналин в ответ на острый и хронический стресс (ауто- и паракринные механизмы). Значение V1В-рецепторов к вазопрессину в надпочечниках показано в эксперименте на мышах, лишенных V1В-рецепторов. Базальные уровни эпинефрина и норэпинефрина были одинаковыми у V1В-дефицитных мышей и здоровых особей контрольной группы. Тем не менее в условиях острого и хронического стресса уровни эпинефрина и норэпинефрина были значительно меньше у нокаутированных по V1В-рецепторам мышей [9].
Кроме того, вазопрессин воздействует на V1А-рецепторы коры надпочечников и стимулирует гипертрофию и гиперплазию клеток преимущественно клубочковой зоны. Как следствие – увеличиваются синтез и секреция альдостерона и кортикостероидов. Данный эффект вазопрессина может быть заблокирован на фоне применения антагонистов V1А-рецепторов к вазопрессину или выявлен у мышей, лишенных V1А-рецепторов. Крысы линии Brattleboro с врожденным дефицитом или полным отсутствием вазопрессина демонстрируют уменьшение секреции альдостерона [10].
Высказываются предположения о роли вазопрессина в патофизиологии синдрома Иценко – Кушинга. Этот синдром может развиться вследствие АКТГ-независимой опухоли или гиперплазии надпочечников. Показано, что в этих опухолевых клетках либо заметно выражена экспрессия V1А-рецепторов к вазопрессину, либо имеют место мутации V1А-рецепторов, что способствует увеличению чувствительности к вазопрессину и повышению секреции кортикостероидов [11].
Таким образом, вазопрессин не только регулирует функции гипоталамо-гипофизарно-адреналовой системы, но и характеризуется периферическими эффектами в отношении секреции гормонов надпочечников по механизмам ауто- и паракринных влияний.
Как известно, десмопрессин – синтетический аналог вазопрессина – первоначально использовали в лечении несахарного диабета. Позднее было показано, что десмопрессин можно применять при болезни Виллебранда и умеренной гемофилии, а также при операциях c большой потерей крови для уменьшения гемотрансфузий. Десмопрессин также используют при кровотечениях, вызванных тромбоцитопатией на фоне терапии аспирином, тиклопидином, при уремии и хронических заболеваниях печени [4]. Десмопрессин оказывает кровоостанавливающее действие за счет увеличения в сыворотке крови уровней фактора фон Виллебранда, фактора свертывания крови VIII и активатора тканевого плазминогена, которые синтезируются в эндотелиоцитах и хранятся в них в особых секреторных гранулах – тельцах Вейбеля – Паладе [12]. Эти особые цитоплазматические включения в эндотелиальных клетках были обнаружены в 1964 г. и названы по именам открывших их ученых – швейцарского анатома Эвальда Вейбеля и румынского физиолога Джорджа Эмиля Паладе (в 1974 г. стал лауреатом Нобелевской премии по физиологии за открытие секреторного клеточного пути). Тельца Вейбеля – Паладе служат для хранения синтезированных клеткой белков, которые могут быть быстро секретированы из клетки при ее активации (кроме указанных факторов свертывающей системы крови в них содержится мембранный белок Р-селектин, относящийся к белкам клеточной адгезии и служащий лигандом для секвестрации лейкоцитов на участке повреждения). Фактор фон Виллебранда оказывает кровоостанавливающее действие, связывая тромбоциты и, будучи белком-носителем для фактора свертывания крови VIII, восстанавливает его почечный клиренс и ферментативное расщепление.
Десмопрессин действует на эндотелиальные клетки и стимулирует не только синтез, но и активное высвобождение тканевого активатора плазминогена, фактора фон Виллебранда и фактора свертывания крови VIII из телец Вейбеля – Паладе. В результате в сыворотке крови резко повышается уровень указанных факторов гемостаза. При этом в клинической практике данный эффект развивается медленнее и выражен слабее, если вместо парентеральных форм десмопрессина используются интраназальные. Поэтому в чрезвычайной ситуации именно парентеральное введение десмопрессина может оказаться предпочтительным для управления системой гемостаза [13].
Десмопрессин воздействует на факторы свертывания крови также через активацию циклического аденозинмонофосфата (цАМФ) в экстраренальных V2-рецепторах, широко представленных в эндотелиальных клетках [14].
Десмопрессин ингибирует липополисахарид-индуцированную активацию NF-kappa B, препятствуя высвобождению провоспалительных цитокинов и снижая выраженность воспаления. Антагонисты V2-рецепторов к вазопрессину нивелируют его эффекты на воспаление, вызывая повышенную секрецию провоспалительных медиаторов и нейтрофилов. Не исключено, что вазопрессин участвует в модификации воспалительных реакций, существенно влияет на врожденный иммунитет и подавляет воспаление ткани почек.
Эксперименты показали, что у крыс, лишенных воды, значительно повышается риск пиелонефрита, а достаточный диурез способен ускорить выздоровление при Enterococcus-индуцированном пиелонефрите [16].
Пожилые пациенты склонны к обезвоживанию. Это может быть одной из причин высокой частоты развития у них пиелонефрита. Гипергидратация снижает уровень вазопрессина, что может усилить врожденный иммунитет при пиелонефрите.
Таким образом, гормональный контроль врожденного иммунитета со стороны, в частности, вазопрессина, способен в определенной степени объяснить различную предрасположенность к пиелонефриту [16].
Вазопрессин оказывает существенное влияние на восприятие боли посредством V1А- и V1В-рецепторов, расположенных в нейрональных клетках гипоталамуса, гиппокампа, миндалины и других структурах мозга [4, 17]. Исследования показали, что вазопрессин способен повышать болевой порог чувствительности, поскольку в ответ на стрессовое воздействие или боль центральный (гипоталамический) и периферический (плазменный и тканевой) уровни вазопрессина повышаются [17]. Однако считается, что обезболивающее действие вазопрессина не опосредовано периферическим вазопрессином, так как гематоэнцефалический барьер препятствует его обратному поступлению в головной мозг.
Например, в экспериментах показано, что инъекция вазопрессина не уменьшает болевой порог при болевых воздействиях на крыс, но на фоне применения вазопрессина удается изменить восприятие боли [17]. При введении вазопрессина непосредственно в желудочки мозга в экспериментальных работах на лабораторных животных болевой порог существенно повышался [17].
В эксперименте у крыс линии Brattleboro с врожденным дефицитом вазопрессина имела место выраженная реакция даже на незначительные болевые воздействия. Но после интравентрикулярного введения вазопрессина болевой порог значительно возрастал, что свидетельствовало о вазопрессин-зависимом обезболивающем эффекте. Кроме того, внутримозговые анальгетические эффекты вазопрессина блокировались после интравентрикулярного введения антисыворотки к вазопрессину [18].
D.K. Ahn и соавт. (2001) в экспериментальных работах продемонстрировали, что анальгетические эффекты вазопрессина могут блокироваться антагонистами V1А-рецепторов, но не антагонистами V2-рецепторов к вазопрессину. Это навело авторов на мысль, что вазопрессин оказывает обезболивающее действие исключительно за счет V1А-рецепторов [19].
L.R. Watkins и соавт. (1986) показали, что не только внутримозговые, но и подоболочечные инъекции вазопрессина дают антиноцицептивный эффект, который, возможно, распространяется и на спинной мозг [20].
При острых головных болях интраназальное введение вазопрессина оказывалось эффективным. У пациентов снижалась степень выраженности боли. Это скорее всего подтверждает существование пути, соединяющего обонятельный нейроэпителий и головной мозг и позволяющего вазопрессину миновать гематоэнцефалический барьер [21].
Гипофизарные гормоны, включая вазопрессин, воздействуют на костный метаболизм. Прямое влияние оказывают вазопрессин и окситоцин, косвенное (опосредованное) – тироксин, половые гормоны и гормоны надпочечников, синтез которых контролируется соответствующими гипофизарными тропными гормонами. Окситоцин влияет на активность остеобластов, а мутации гена рецептора окситоцина могут сопровождаться значительной остеопенией. Вазопрессин является ключевым регулятором костной ткани, контролируя активность как остеобластов, так и остеокластов посредством V1А- и V2-рецепторов, обильно представленных в обеих группах остеоцитов. Модулируя активность внутриклеточных ферментов киназ, вазопрессин способен стимулировать остеокласты, отвечающие за резорбцию кости и развитие остеопороза. В то же время антагонисты V1А- и V2-рецепторов к вазопрессину повышают активность остеобластов и способствуют новому синтезу костной ткани, блокируя активность остеокластов, механизмы которой пока не вполне понятны [22].
Кроме того, примерно 50% хронических синдромов гипонатриемии – следствие синдрома Пархона, связанного с неадекватной, обычно избыточной, секрецией вазопрессина. Как известно, около 30% натрия в организме хранится в костной ткани. То есть при хронической гипонатриемии вследствие синдрома Пархона могут наблюдаться ускоренная резорбция костной ткани остеокластами и избыточное выделение натрия из остеоцитов [23].
J. Barsony и соавт. (2011) показали, что гипонатриемия напрямую стимулирует остеокластогенез и остеокластную резорбцию костей у молодых крыс за счет непосредственной активации клеток-предшественников остеокластов [24]. Подобный эффект не обусловлен гипоосмолярностью плазмы, но всегда развивается на фоне гипонатриемии. Авторы также установили, что на фоне гипоосмолярности увеличивается концентрация внутриклеточного кальция, что приводит к апоптозу остеокластов. Таким образом, гипонатриемия ответственна за повышенный остеокластогенез и повышенную активность остеокластов. Увеличение остеокластогенеза можно выявить даже при легкой степени гипонатриемии [24].
Существует также предположение, что гипонатриемия повышает пролиферацию остеокластов за счет индукции окислительного стресса. Витамин С (аскорбиновая кислота) считается мощным антиоксидантом. Поступление витамина С в клетку является натрий-зависимым процессом и опосредуется натрий-зависимым транспортером аскорбиновой кислоты. Этот транспортер модулируется внеклеточным натрием, и даже незначительное снижение уровня внеклеточного натрия вызывает заметное снижение поглощения клеткой меченого витамина С. В результате уменьшения внутриклеточной концентрации витамина С содержание свободных радикалов кислорода в клетке увеличивается, а степень выраженности окислительного стресса становится прямо пропорциональной уровню гипонатриемии. При этом в остеоцитах обнаруживаются признаки окислительных повреждений ДНК [24].
В ряде исследований установлена связь между выполнением упражнений на выносливость и развитием остеопении [25]. В частности, спортсмены, которые употребляют большое количество гипотонической жидкости во время и после тренировок, склонны к гипонатриемии. Ее развитию способствует постоянная секреция вазопрессина. Костная ткань предположительно служит природным буфером для существенных изменений концентрации натрия в плазме. Результаты исследования показали, что у выносливых спортсменов как до, так и после тренировки уровни натрия в плазме были в пределах нормы. Правда, после тренировки абсолютный уровень натрия был ниже, чем до тренировки. Изменение уровня натрия до и после тренировки напрямую связано с изменением минерального состава кости. На основании полученных результатов был сделан вывод, что вазопрессин может быть связан с остеопенией непосредственно через воздействие на остеокласты и косвенно через развитие гипонатриемии, что способствует выведению натрия из остеоцитов [25].
У пациентов с хронической гипонатриемией имеет место повышенная заболеваемость остеопорозом. Кроме того, установлена связь гипонатриемии с падениями и переломами у пожилых пациентов. Так, у 9,1% пациентов, наблюдаемых в клинике экстренной медицинской помощи, отмечались гипонатриемические переломы костей [26].
Метаболический синдром – комплекс гормонально-метаболических нарушений, определяемый наличием тесно связанных компонентов, таких как ожирение, инсулинорезистентность, артериальная гипертензия, провоспалительные и протромботические факторы, дислипидемия (прежде всего повышение уровня триглицеридов и липопротеинов, содержащих аполипопротеин B, и снижение уровня липопротеинов высокой плотности, неалкогольная жировая болезнь печени, синдром апноэ сна. Метаболический синдром достоверно повышает риск сахарного диабета и сердечно-сосудистых заболеваний. Традиционные факторы риска метаболического синдрома хорошо известны. Тем не менее дискуссия, это точно определенный синдром или маркер многочисленных факторов риска сахарного диабета и ишемической болезни сердца, продолжается до сих пор. Биомаркерами метаболического синдрома являются инсулинорезистентность, лептин, изменения обмена эпинефрина и норэпинефрина, повышение уровня липопротеинов низкой плотности, мочевой кислоты, C-реактивного белка, ингибитора 1 активатора плазминогена и альдостерона [27].
Бытует мнение, что генетические, экологические и гормональные факторы, психологический стресс, нарушение регуляции гипоталамо-гипофизарной системы, дисфункция вегетативной нервной системы занимают далеко не последнее место в патогенезе метаболического синдрома [28].
Физиологические эффекты вазопрессина – вазоконстрикция, агрегация тромбоцитов, стимуляция гликогенолиза в печени, воздействие на липиды, регулирование секреции АКТГ в гипофизе и метаболизма инсулина и глюкагона – не исключают возможность его участия в развитии метаболического синдрома [27, 28].
Психологический стресс может быть этиологическим фактором метаболического синдрома. Как правило, КТРГ и вазопрессин, влияя на гипофиз, активируют секрецию АКТГ. Эффекты вазопрессина на секрецию АКТГ опосредованы V1В-рецепторами. В свою очередь повышение плазменного уровня АКТГ сопряжено с увеличением стимуляции коры надпочечников и повышением уровня кортизола в сыворотке крови, что приводит к ожирению, инсулинорезистентности и гипергликемии. АКТГ, стимулированный выбросом вазопрессина, не реагирует по механизмам отрицательной обратной связи на уровень плазменного кортизола в отличие от секреции АКТГ, индуцированной КТРГ. Кроме того, вазопрессин способен непосредственно участвовать в синтезе и секреции кортизола за счет V1А-рецепторов коры надпочечников [29].
Сложно точно измерить плазменный уровень вазопрессина из-за короткого периода полураспада (24 минуты), быстрого выведения из плазмы, а также адгезии к тромбоцитам. Копептин является суррогатным маркером вазопрессина, и его уровень коррелирует с уровнем вазопрессина в плазме крови. Измерить плазменный уровень копептина легко, поскольку его молекула достаточно стабильна, имеет длительный период полувыведения и не прикрепляется к тромбоцитам.
U. Saleem и соавт. (2009) отметили повышенный уровень копептина у пациентов с метаболическим синдромом [27]. Пациенты с самым высоким уровнем копептина (третий или четвертый квартиль плазменных референсных значений) в 70–100% имели шансы приобрести метаболический синдром по сравнению с теми, у кого уровень копептина находился в нижнем квартиле референсных значений. С увеличением числа компонентов метаболического синдрома плазменный уровень копептина неуклонно возрастал. Более высокий плазменный уровень копептина также продемонстрировал наличие достоверной положительной связи с более высоким уровнем триглицеридов и более низким уровнем липопротеинов высокой плотности и наличие достоверной отрицательной связи со степенью физической активности [27].
В исследовании, проведенном в Швеции в 1991–1994 гг., участвовали 2064 пациента. Период наблюдения составил 15,8 года [29]. По мнению авторов, уровень копептина в начале исследования служил важным прогностическим фактором в отношении риска развития абдоминального ожирения и сахарного диабета 2 типа – в течение всего периода наблюдения [29]. Исходный уровень копептина также позволил спрогнозировать риск развития сахарного диабета у пациентов без исходных нарушений метаболизма глюкозы. Таким образом, тест с копептином может быть использован в качестве теста-скрининга для выявления лиц с высокой степенью риска сахарного диабета, даже если у них исходно имелась нормогликемия. Выявлено также, что связь между базальным уровнем копептина и риском сахарного диабета не зависела от степени ожирения. Уровень копептина исходно был связан с выраженностью микроальбуминурии при долгосрочном наблюдении, что зависело от исходных компонентов метаболического синдрома. В эксперименте у крыс хроническая инфузия десмопрессина приводила к увеличению протеинурии, а блокада эффектов вазопрессина снижала степень выраженности протеинурии и улучшала функцию почек [29].
Рецепторы к вазопрессину представлены в поджелудочной железе и печени: V1А-рецепторы обнаружены в гепатоцитах, а V1В-рецепторы – как в альфа-, так и бета-клетках островков Ларгенганса поджелудочной железы. В печени вазопрессин усиливает гликолиз, что сопровождается повышением уровня глюкозы крови (глюкагоноподобный эффект). Данный эффект вазопрессина можно наблюдать, даже если рецепторы к глюкагону заблокированы (хотя рецепторы к глюкагону и вазопрессину в печени разные).
Инфузия вазопрессина вызывает достоверное и существенное повышение плазменного уровня глюкозы у лиц с нормогликемией, что доказано в клинико-экспериментальных исследованиях.
В эксперименте у мышей, нокаутированных по генам V1А- и V1В-рецепторов, нарушался метаболизм глюкозы и повышался катаболизм жирных кислот, что могло свидетельствовать о роли вазопрессина при метаболических заболеваниях [8].
У пациентов с мутацией гена AVPR1A, кодирующего экспрессию V1А-рецептора к вазопрессину, частота гипергликемии натощак в частности и сахарного диабета в целом выше, чем у лиц, не имеющих мутации указанного гена [30].
R. Roussel и соавт. (2011) установили обратную зависимость между потреблением жидкости и риском гипергликемии в течение девяти лет наблюдения. У пациентов, употреблявших более одного литра жидкости в сутки, риск сахарного диабета был на 27% ниже, чем у тех, кто выпивал менее 500 мл жидкости. Авторы сделали вывод, что при приеме небольшого количества жидкости риск сахарного диабета возрастает. Причем он ассоциируется с более высоким уровнем вазопрессина в плазме крови [31].
У пациентов с сахарным диабетом 1 типа наблюдается избирательное истощение бета-клеток поджелудочной железы, которое характеризуется нарушениями секреции инсулина при относительно сохранной секреции глюкагона альфа-клетками. Эффекты инсулина и глюкагона являются антагонистическими, но секреция инсулина вызывает ингибирование секреции глюкагона. Таким образом, у пациентов с сахарным диабетом 1 типа секреция глюкагона значительно увеличивается, что дает дополнительный гипергликемический эффект. При сахарном диабете 1 типа даже физиологические уровни вазопрессина способны вызывать значительное увеличение уровня глюкозы в крови, стимулируя секрецию глюкагона, усиливающего синтез глюкозы в печени (глюконеогенез) [32].
В отличие от интактной группы контроля у крыс со стрептозотоцин-индуцированным сахарным диабетом инфузия вазопрессина способствовала повышению в два раза секреции глюкагона. Более того, у крыс с лабораторной моделью сахарного диабета базальный уровень вазопрессина был выше. Таким образом, поджелудочная железа диабетических крыс более чувствительна к вазопрессину с точки зрения его влияния на секрецию глюкагона. Полученные результаты показали, что более низкие уровни вазопрессина способствуют повышению секреции глюкагона, а более высокие – увеличению секреции инсулина. На основании этого можно сделать вывод, что альфа-клетки поджелудочной железы более чувствительны к эффектам вазопрессина, чем бета-клетки. При базальных уровнях изучаемых гормонов вазопрессин в большей степени влияет на секрецию глюкагона, чем на секрецию инсулина. Не исключено, что в ближайшее время антагонисты V1В-рецепторов к вазопрессину, способные ингибировать секрецию глюкагона, будут рассматривать как препараты для лечения сахарного диабета [32].
У крыс с сахарным диабетом выявлена гипертрофия супраоптического и паравентрикулярного ядра гипоталамуса (место непосредственного синтеза вазопрессина). Это позволило некоторым исследователям высказать предположение, что при сахарном диабете возможна гиперактивность нейронов данной зоны, секретирующих вазопрессин [33]. Кроме того, концентрация вазопрессина в тканях поджелудочной железы человека и крыс значительно превосходит его концентрацию в сыворотке крови. При этом вазопрессин находится в периваскулярном пространстве поджелудочной железы, а не в островковых или ацинарных клетках. Вполне вероятно, что поджелудочная железа может независимо от гипофиза секретировать вазопрессин как локальный гормон, необходимый ей для синтеза глюкагона [32, 33].
У пациентов с ожирением при инфузии КТРГ и вазопрессина отмечается гиперактивный ответ гипофиза в виде резко повышенного выброса в кровь АКТГ. Как следствие – более высокий уровень кортизола в крови и гипергликемия. Это говорит о том, что вазопрессин может воздействовать на механизмы гипергликемии за счет влияния на островковые клетки поджелудочной железы, а также на V1В-рецепторы в гипофизе [27]. Локализация рецепторов к вазопрессину, влияющих на уровень глюкозы в крови, представлены в табл. 2 [4].
Влияние вазопрессина на липидный обмен обусловлено несколькими механизмами.
С одной стороны, вазопрессин стимулирует симпатическую нервную систему, активно участвующую в метаболизме жиров [34]. На фоне симпатической гиперактивности закономерно повышается секреция эпинефрина надпочечниками, что сопровождается активацией метаболизма триглицеридов в жировой ткани. Периферические нервные терминали, как и кровеносные сосуды, необходимы для функционирования клеток жировой ткани. В ряде исследований показано, что любое нарушение функции этих структур влияет на липидный обмен.
Так, при введении адреналина и норадреналина повышается уровень свободных жирных кислот, побочным продуктом метаболизма которых и являются триглицериды [35]. В опытах на крысах зафиксирован антилиполитический (липоаккумулирующий) эффект вазопрессина, опосредованный V1А-рецепторами и обусловленный способностью вазопрессина ингибировать тканевые липазы, что приводит к нарушению распада триглицеридов, усилению липолиза и повышению сывороточных уровней глицерина и кетоновых тел. Коме того, вазопрессин ингибирует эффекты изопротеренола. При введении изопротеренола V1А-вазопрессин-дефицитным мышам липолиз в бурой жировой ткани усиливался в три раза [35].
Как известно, стимуляция метаболизма липидов в бурой жировой ткани повышает температуру тела. После введения вазопрессина лабораторным животным температура тела снижалась за счет ингибирования метаболизма липидов. Даже у крыс с поражениями переднего отдела гипоталамуса введение вазопрессина вызывало аналогичный эффект [36].
С другой стороны, периферические механизмы регуляции обмена жиров вазопрессин осуществляет посредством регуляции метаболизма инсулина, глюкагона, глюкокортикоидов и эпинефрина. Вазопрессин также ингибирует тканевую липазу и активно влияет на уровень глюкозы крови – основного субстрата для сжигания жиров [8]. Инсулин является самым мощным липоаккумулирующим гормоном. Инсулинотерапия сахарного диабета закономерно приводит к ожирению за счет ингибирования метаболизма жиров, поскольку инсулин снижает концентрацию цАМФ в клетках [36]. Сигнальными молекулами для инсулина являются киназа Akt и p70S6-киназа, нарушения функции которых на фоне мутаций V1А-рецепторов к вазопрессину чреваты инсулинорезистентностью. Кроме того, вазопрессин стимулирует гликогенолиз в печени за счет стимуляции секреции глюкагона и адреналина. В итоге увеличивается уровень глюкозы крови. У мышей, дефицитарных по V1В-рецепторам к вазопрессину, происходит стимуляция липогенеза за счет увеличения чувствительности к инсулину [37].
Тесное взаимодействие симпатической нервной системы, ренин-ангиотензин-альдостероновой системы (РААС) и вазопрессина способствует повышению системного артериального давления. Однако в физиологических условиях от вазопрессина не зависит поддержание уровня артериального давления, хотя дефицит вазопрессина приводит к мощному расширению сосудов при септическом шоке [38, 39].
Представители негроидной расы характеризуются более высоким уровнем вазопрессина и более высоким уровнем артериального давления. Диурез у лиц негроидной расы ниже, а концентрация мочи выше, особенно в дневное время, чем у представителей европеоидной расы.
Как показали результаты исследований, даже когда артериальное давление в пределах нормы, пульсовое давление выше у лиц негроидной расы. Выявлена достоверная связь между высокой концентрацией мочи и уровнем пульсового давления у чернокожих мужчин. Чернокожие мужчины и женщины сравнимы друг с другом по объему мочи и концентрационной способности почек. Однако в отличие от женщин мужчины лучше удерживают солевой состав и концентрацию мочи [40].
У здоровых людей, которые употребляют меньше жидкости, натрий из организма выводится медленнее, чем у тех, кто принимает больше жидкости [41]. Выявлена связь между скоростью потока мочи и скоростью экскреции натрия с мочой у здоровых людей. Так, выведение натрия с мочой не зависело от скорости потока мочи до тех пор, пока поток мочи превышал 1 л. Как только поток мочи становился менее 1 л, экскреция натрия уменьшалась. Это говорит о том, что более высокий уровень вазопрессина необходим для адекватной абсорбции натрия в почках. Натрий абсорбируется, только когда уровень вазопрессина достигает определенного порогового значения.
Более высокий уровень вазопрессина у представителей негроидной расы в отличие от представителей европеоидной расы может быть связан с установкой гипоталамической системы осмостата на более низкие уровни сывороточной осмоляльности. Более высокий уровень вазопрессина у чернокожих помогает им выживать в неблагоприятных условиях засух, дефицита воды и голода. Подобная адаптация позволяет снизить экскрецию натрия. Очевидно, поэтому ингибиторы ангиотензинпревращающего фермента не так эффективны у чернокожих пациентов с артериальной гипертензией, как у европейцев [40].
Вазопрессин также может влиять на повышение чувствительности к солям при хронических заболеваниях почек. Высокий уровень вазопрессина вызывает активацию прегломерулярных рецепторов типа V1А и V2 в почках [42]. Кроме того, при уровне вазопрессина в крови, более высоком, чем требуется для поддержания антидиуретического ответа, может иметь место сокращение гладких мышц, опосредованное V1А-рецепторами. Тем не менее такая реакция быстро нивелируется неповрежденной вегетативной нервной системой и интактными сердечно-сосудистыми рефлексами, вызывающими активацию блуждающего нерва и брадикардию.
При нарушении вегетативной нервной системы после острой инфузии вазопрессина значительно повышается уровень среднего артериального давления. Результаты клинических исследований показали, что для увеличения этого уровня на 10 мм рт. ст. пациентам с вегетативными нарушениями (по сравнению со здоровыми лицами) необходима в 1000 раз более высокая концентрация вазопрессина. Эти данные свидетельствуют о том, что более высокий уровень вазопрессина способен существенно влиять на сердечно-сосудистую систему при первичной артериальной гипертензии и одновременном нарушении функции вегетативной нервной системы [43, 44].
Хроническая болезнь почек
Традиционные факторы риска прогрессирования хронической болезни почек, такие как сахарный диабет, артериальная гипертензия и альбуминурия, хорошо известны. Тем не менее данные ряда исследований позволяют предположить, что при увеличении уровня вазопрессина ухудшается клиническое течение хронической болезни почек. Как известно, количество употребляемой воды и уровень вазопрессина находятся в обратной зависимости. Низкий 24-часовой объем мочи и недостаточное потребление воды коррелируют с ухудшением течения хронической болезни почек и связаны с высокими уровнями вазопрессина. Повышение мочевого осмотического давления обусловлено не только прогрессированием хронической почечной недостаточности, но и началом хронического гемодиализа в течение 72 месяцев после ее формирования [45].
В экспериментах показано, что непрерывное введение десмопрессина ухудшает течение альбуминурии и хронической болезни почек, а селективная блокада V2-рецепторов к вазопрессину оказывает противоположный эффект. Кроме того, повышенные уровни копептина – суррогатного маркера вазопрессина – связаны с альбуминурией и уменьшением скорости клубочковой фильтрации у больных после трансплантации почки [46]. Таким образом, стимуляция V2-рецепторов к вазопрессину ассоциируется с ухудшением функции почек.
Алкоголь и табак по-разному влияют на скорость клубочковой фильтрации: алкоголь блокирует V2-рецепторы, а табак стимулирует их [47, 48].
Вазопрессин также способен ухудшить течение хронической болезни почек за счет стимуляции РААС посредством V2-рецепторов. Данный эффект десмопрессина может быть заблокирован ингибитором ангиотензинпревращающего фермента. Увеличение активности РААС вызывает сужение эфферентных артериол клубочков, что чревато развитием гиперфильтрации и гломерулопатии с протеинурией [49, 50]. Такой неблагоприятный эффект в большей степени актуален для лиц с высоким потреблением белка, мужчин и представителей негроидной расы [51, 52].
Воспалительные состояния, такие как пневмония, энцефалит, малярия и респираторный дистресс-синдром у взрослых, обусловлены повышенным образованием воспалительных цитокинов (интерлейкинов 1 и 6), которые, как стало известно, связаны с вазопрессином [53]. Интерлейкин 6 стимулирует вазопрессин-секретирующие нейроны, что способствует повышению плазменного уровня вазопрессина и потенциально развитию гипонатриемии, хотя механизм остается неясным. Тем не менее существует предположение, что интерлейкин 6 диффундирует через гематоэнцефалический барьер или активно секретируется мозговыми перицитами [54].
С одной стороны, вазопрессин предположительно оказывает иммуномодулирующее действие, которое наиболее активно проявляется в легких и состоит в способности вазопрессина снижать тканевую концентрацию интерлейкина 6 [55]. Противовоспалительные эффекты вазопрессина могут быть опосредованы через его участие в регуляции секреции АКТГ, который стимулирует кору надпочечников и выбрасывает в кровь подавляющие воспаление кортикостероиды. Нарушения этих взаимоотношений чреваты хроническим субклиническим воспалением. Подобный механизм, в частности, описан у пациентов с ревматоидным артритом, протекающим на фоне низкого уровня кортизола в крови. С другой стороны, вазопрессин является и провоспалительным пептидом, который может стимулировать, например, избыточную секрецию усугубляющего воспаление пролактина [56].
Вазопрессин может играть существенную роль в регуляции гипоталамо-гипофизарно-адреналовой системы в ответ на психологический стресс.
Вазопрессин вместе с окситоцином влияет на психологические и когнитивные функции: эндогенный вазопрессин усиливает тревогу, а эндогенный окситоцин оказывает анксиолитическое действие [57]. Таким образом, с этими нейропептидами связаны разные психологические реакции. Баланс между ними определяет социальные и эмоциональные реакции. Нарушение баланса описано при депрессии, тревоге, шизофрении, аутизме, расстройствах личности и обсессивно-компульсивном расстройстве [57]. У пациентов, страдающих этими заболеваниями, уровни вазопрессина в плазме и паравентрикулярном ядре гипоталамуса значительно повышены.
В эксперименте при введении инъекций гипертонического раствора наблюдались симптомы паники. Поэтому высказано предположение, что вазопрессин способен индуцировать панические симптомы [58].
Во время острого приступа шизофрении плазменный уровень вазопрессина повышается, а нейролептики (галоперидол) снижают его, что ассоциируется с улучшением контроля психиатрических симптомов. Фенциклидин может вызвать серьезные симптомы шизофрении из-за повышения уровня вазопрессина в плазме, а также изменения церебральной экспрессии и распределения рецепторов к вазопрессину.
При аутизме нередко выявляются мутации гена V1А-рецептора к вазопрессину, что повышает вероятность возможного участия вазопрессина в нарушениях социального поведения при аутизме [59].
Внутримозговые инъекции вазопрессина у животных вызывали агрессивное поведение и повышенную тревожность. Микроинъекция антагониста V1А-рецептора, отвечающего за выражение повышенной тревожности к вазопрессину, снижала беспокойство у крыс. Эксперименты показали, что на фоне блокады V1А-рецептора ухудшается память. У самцов грызунов вазопрессин отвечает за предпочтения партнеров и отеческую заботу после спаривания, а антагонисты вазопрессиновых рецепторов кардинально изменяют это поведение [60].
Когнитивные функции могут зависеть от степени гидратации и дегидратации мозговой ткани [61]. Обезвоживание мозга способно привести к серьезным нарушениям и смерти. Но даже умеренное обезвоживание и потеря 1–2% массы тела может вызвать сбои когнитивной функции [62].
Пожилые пациенты с сахарным диабетом и дети в большей степени склонны к обезвоживанию. Можно предположить у них возникновение поведенческих проблем из-за обезвоживания. Умеренное обезвоживание может произойти в процессе ежедневной деятельности и быть связано с ухудшением когнитивных функций, зрительной бдительности, ростом напряженности, тревоги и усталости [63].
Имеются данные о возможной связи вазопрессина с головой болью [64, 65].
Влияние вазопрессина на пролиферацию и рост клеток обусловлено способностью через V1А-рецепторы непосредственно стимулировать синтез белка и клеточных факторов роста [65]. Такие эффекты вазопрессина описаны в отношении эпителия кишечника, почек и некоторых клеток и тканей [67–69].
Между тем установлено, что опухолевые клетки также содержат рецепторы к вазопрессину. Например, клетки мелко-клеточного рака легкого имеют V1А-рецепторы и секретируют нейропептиды [70].
Вазопрессин играет определенную роль в регенерации органов, в частности печени, а также в образцах неонатальных кардиомиоцитов мыши [8].
Вазопрессин может регулировать процессы старения в результате взаимодействия с трансмембранным белком KLOTHO, который широко экспрессируется в организме и выступает в качестве гормона, но в основном влияет на почки и центральную нервную систему. Этот белок является основным фактором, определяющим продолжительность жизни [71]. Он циркулирует в крови и связывается с рецепторами в различных клетках, повышая их устойчивость к окислительному стрессу, ускоряющему процесс старения. Связывание KLOTHO с рецепторами подавляет внутриклеточный каскад инсулина, что также повышает устойчивость к окислительному стрессу.
Лабораторные крысы с дефицитом белка KLOTHO имеют меньшую продолжительность жизни, преждевременно стареют и умирают менее чем за пять месяцев [71]. Помимо этих эффектов дефицит белка KLOTHO вызывает мышечную дистрофию, остеопению, сосудистую кальцификацию, потерю слуха, другие возрастные расстройства [71, 72].
Согласно последним данным, плотность белка KLOTHO существенно снижена у обезвоженных мышей. Вследствие обезвоживания повышаются осмолярность, плазменный уровень вазопрессина, альдостерона и 1,25(OH)D. Таким образом, вазопрессин способствует снижению плотности белка KLOTHO. Пожилые пациенты с сахарным диабетом склонны к обезвоживанию и могут подвергаться повышенному риску повреждения почек, ускоренного старения и ранней смерти, возможно в связи с вторичным повышением уровня вазопрессина и его влиянием на белок KLOTHO – маркер продолжительности жизни [73–75].
Cогласно общепринятому мнению, вазопрессин характеризуется двумя важнейшими классическими физиологическими эффектами – антидиуретическим и вазопрессорным. Однако рецепторы к вазопрессину представлены во многих органах и системах человеческого организма. Это позволяет говорить о том, что физиологические эффекты данного гормона намного шире, чем можно предположить.
Результаты клинико-экспериментальных исследований, которые легли в основу этой статьи, показывают, как мало известно об этом уникальном гормоне, который принимает активное участие в регуляции многих биологических функций в организме человека и обладает широким спектром неклассических физиологических эффектов. Среди них регуляция гипоталамо-гипофизарно-адреналовой системы, костного метаболизма, углеводного и липидного обменов, системы гемостаза, эндотелиальной функции, механизмов стресса, хронического воспаления, инфекции и клеточной пролиферации, а также участие в механизмах регуляции боли, мнемо-когнитивной функции, обеспечении социального поведения, реализации механизмов клеточного и системного старения. Вполне возможно, что очень скоро многие из этих неклассических физиологических эффектов вазопрессина найдут практическое применение в клинической медицине.