мантийноклеточная лимфома что это такое
Мантийноклеточная лимфома: причины, симптомы, стадии, диагностика, лечение, прогноз
Мантийноклеточная лимфома (МКЛ) — злокачественная опухоль из В-лимфоцитов, клеток иммунной системы. Относится к так называемым неходжкинским лимфомам, когда злокачественная опухоль возникает не только в лимфоузлах, но и миндалинах, селезенке и других органах нашей иммунной системы.
МКЛ составляет 6-10% от всех диагностированных неходжкинских лимфом. Данный вид рака характеризуется высокой агрессивностью. Встречается чаще всего у мужчин старше 60 лет. МКЛ может поражать отдельные лимфатические узлы, селезенку, органы (костный мозг, оболочки головного мозга, желудочно-кишечный тракт), или быть генерализованной, распространяясь по всему организму с током крови.
Главной причиной развития мантийноклеточной лимфомы считают генные мутации, приводящие к повышенной экспрессии (активности) ядерного белка циклина D1, участвующего в регуляции клеточного деления. Повышение синтеза этого белка приводит к ускорению деления клеток и способствует развитию опухоли.
Симптомы лимфом из клеток мантии
Клиническая картина МКЛ не отличается от таковой при других типах лимфомы и будет зависеть от локализации и стадии процесса. На начальных этапах опухоль может протекать бессимптомно, или же могут проявляться общие симптомы:
• Необъяснимое повышение температуры тела в вечернее или ночное время.
• Снижение массы тела без видимых на то причин.
• Слабость и быстрая утомляемость.
• Усиленная потливость в ночное время.
• Кожный зуд.
Если опухоль локализуется в селезенке, наблюдается её увеличение и как следствие тяжесть в левом подреберье. О вовлечении в опухолевый процесс лимфатических узлов свидетельствует их безболезненное увеличение. Опухоль, развивающаяся в слизистой оболочке желудка или кишечника, может выглядеть как полип на начальных этапах и протекать бессимптомно. При прогрессировании опухоли появляются симптомы диспепсии, боли в животе и даже кишечная непроходимость (тошнота, рвота, задержка стула, вздутие и схваткообразные боли в животе). При поражении миндалин наблюдается увеличение их размеров, заложенность носа, нарушение глотания и дыхания. При локализации опухоли в ЦНС развиваются расстройства слуха и зрения, головные боли, парезы и параличи. По мере прогрессирования опухоли, проявления будут усиливаться, и клиническая картина будет формироваться из симптомов, характерных для пораженного органа.
Стадии мантийноклеточной лимфомы
Стадия 1 — опухолевое поражение одной группы лимфоузлов.
1Е — опухолевое поражение одного экстранодального (вне лимфатических узлов) органа.
Стадия 2 — вовлечение в опухолевый процесс двух групп лимфоузлов по одну сторону диафрагмы.
2Е — вовлечение одного экстранодального органа и одной группы лимфоузлов по одну сторону диафрагмы.
Стадия 3 — опухолевое поражение лимфоузлов по обе стороны диафрагмы, сочетающееся с:
3Е — поражением экстранодального органа;
3S — опухолевым поражением селезенки;
3E+S — поражением экстранодального органа и селезенки.
Стадия 4 — многофокусное поражение одного или нескольких экстранодальных органов с или без вовлечения лимфатических узлов.
Диагностика мантийноклеточной лимфомы
1) Сбор анамнеза. Уточняются наличие у близких родственников опухолевых процессов, наличие у пациента хронических заболеваний, ранее перенесенных инфекций.
2) Физикальное обследование. Обращают на себя внимание бледность кожных покровов, увеличение в размерах селезенки и лимфоузлов при пальпации.
3) Лабораторная и инструментальная диагностика.
• Общий анализ крови с подсчетом лейкоцитарной формулы (в том числе определение количества ретикулоцитов и тромбоцитов).
• Биохимический анализ крови (общий белок, альбумин, мочевина, креатинин, мочевая кислота, электролиты, АЛТ, АСТ, щелочная фосфатаза, ЛДГ, глюкоза).
• Общий анализ мочи.
• Коагулограмма (фибриноген, АЧТВ, протромбиновый индекс, Д-димеры).
• Иммунохимическое исследование мочи и крови с измерением концентрации b2-микроглобулина.
• Биопсия с патогистологическим и иммуногистохимическим исследованиями опухолевой ткани.
• Трепанобиопсия костного мозга с подсчетом миелограммы.
• Цитогенетическое исследование или FISH-исследование опухолевой ткани или костного мозга.
• Люмбальная пункция с цитологическим исследованием ликвора по показаниям.
• ПЦР и ИФА для диагностики инфекций.
• УЗИ органов брюшной полости.
• КТ органов шеи, грудной клетки, брюшной полости и полости малого таза.
• КТ и МРТ костей лицевого скелета и головного мозга по показаниям.
• Позитронно-эмиссионная томография (позволяет выявить распространенность опухолевого процесса).
• ФГДС и колоноскопия с обязательным проведением биопсии, даже при неимении визуальных признаков поражения.
• ЭКГ и ЭХоКГ.
Лечение мантийноклеточной лимфомы
Лечение МКЛ подбирается в каждом случае индивидуально, зависит от стадии лимфомы, ее морфологического строения, возраста и общего состояние пациента.
У пациентов с 1-2 стадией опухоли преимущественно используется комбинация химиотерапии и лучевой терапии, что дает возможность достичь ремиссии в 95% случаев.
Пациентам с 3-4 стадией до 65 лет при отсутствии противопоказаний проводится 6-8 курсов интенсивной полихимиотерапии в сочетании с препаратами из группы моноклональных антител (таргетных препаратов) и последующей аутотрансплантацией гемопоэтических стволовых клеток (аутоТГСК — трансплантация пациенту собственных гемопоэтических стволовых клеток). В течение года после проведения аутоТГСК каждые три месяца проводятся контрольные исследования, в том числе трепанобиопсия. В последующие пять лет исследования проводятся каждые 6 месяцев. В случае рецидива назначается курс таргетных препаратов или полихимиотерапия.
Пациенты с 3-4 стадией в возрасте старше 65 лет получают 6-8 курсов полихимиотерапии с последующей поддерживающей терапией таргетными препаратами. Поддерживающая терапия назначается каждые 2 месяца в течении двух лет.
Прогноз мантийноклеточной лимфомы
МКЛ является агрессивным видом рака. До недавнего времени медиана выживаемости составляла 3 года. Однако современные схемы высокодозной химиотерапии и аутоТГСК у молодых пациентов, появление большого числа эффективных альтернативных схем химиотерапии для последовательного применения при рецидивах МКЛ или при резистентности к лечению, появление новых таргетных препаратов для лечения МКЛ и развитие стратегий поддерживающей терапии привели к улучшению показателей выживаемости. В последние годы медиана выживаемости больных со впервые диагностированной МКЛ увеличилась с 3 до 6 лет.
Следует отметить, что в 15% случаев болезнь протекает благоприятно и прогноз продолжительности жизни составляет 10 лет и более.
Лимфомы клеток мантийной зоны. Новые возможности диагностики и лечения (эпидемиологическое исследование)
Полный текст:
Аннотация
Введение. Лимфома клеток мантийной зоны — редко встречающийся вариант В-клеточной неходжкинской лимфомы. По статистике из 100 000 человек заболевает 2–3, что составляет примерно 6 % от общего количества больных неходжкинскими лимфомами. Известно, что различные молекулярно-генетические характеристики пациентов с лимфомой мантийной зоны могут обеспечить персонифицированный подход при определении прогноза болезни и тактики лечения.
Материалы и методы. Проведен ретроспективный анализ 45 пациентов с лимфомой зоны мантии, наблюдавшихся в ГАУЗ РКОД Минздрава в период с 2015 г. по настоящее время. При анализе учитывались данные клинико-лабораторного обследования, позитронно-эмиссионная томография, цитологическое, гистологическое и иммуногистохимическое исследования биоптата опухоли и костного мозга. Проанализированы эпидемиологические данные, клинические характеристики пациентов, терапевтические подходы, непосредственные и отдаленные результаты лечения.
Результаты и обсуждение. Установлено, что наиболее часто в патологический процесс вовлекается костный мозг (44 %) и селезенка (41 %). Распределение MIPI: высокий у 14 (30 %), средний у 20 (45 %), низкий у 11 (25 %). Ki67 в 4 случаях менее 30 %, в остальных более 30 %. Пациентам c 2015 по 2017 г. в первой линии проводилась химиотерапия в режиме R-CHOP с последующей поддержкой ритуксимабом. Средняя БПВ составила 20 месяцев, 8 (17 %) пациентов в статусе длительной ремиссии (с 2015 г.). С 2017 г. в первой линии терапии начали применяться режимы R-BAC (схема с высокодозным цитарабином для кандидатов на ТСК) и R-B (для пожилых и коморбидных). С 2018 г. 8 пациентам проведена аутоТСК (в 1-м позднем рецидиве) как этап консолидации лечения. На данный момент обследование на del17p и мутацию TP53 проведено 13 пациентам в федеральных центрах.
Заключение. Продемонстрирована необходимость и варианты терапии в зависимости от результатов молекулярно-генетического анализа лимфомы клеток мантийной зоны.
Ключевые слова
Для цитирования:
Канкумашева Э.И., Валиахметова Ч.Х. Лимфомы клеток мантийной зоны. Новые возможности диагностики и лечения (эпидемиологическое исследование). Креативная хирургия и онкология. 2019;9(4):261-265. https://doi.org/10.24060/2076-3093-2019-9-4-261-265
For citation:
Kankumasheva E.I., Valiakhmetova Ch.Kh. Mantle Zone Cell Lymphomas. New Opportunities for Diagnosis and Treatment (Epidemiological Research). Creative surgery and oncology. 2019;9(4):261-265. (In Russ.) https://doi.org/10.24060/2076-3093-2019-9-4-261-265
Введение
Лимфома клеток мантийной зоны (ЛКМЗ) — это редко встречающийся вариант В-клеточной неходжкинской лимфомы. По статистике из 100 000 человек заболевает 2-3, что составляет примерно 6 % от общего количества больных неходжкинскими лимфомами. Среди впервые выявленных случаев соотношение между мужчинами и женщинами составляет 4:1, а медиана возраста — 65 лет. В Западной Европе, Скандинавии и США частота ЛКМЗ варьирует от 0,5 до 0,7 на 100 000 населения, у людей старше 65 лет заболеваемость возрастает до 3,9 на 100 000 [1,2]. Таким образом, различные молекулярно-генетические характеристики у пациентов с лимфомой мантийной зоны могут обеспечить персонифицированный подход при определении прогноза болезни и тактики лечения. В этой связи основной целью данного исследования является анализ эпидемиологической ситуации в Республике Башкортостан, диагностических и терапевтических подходов у пациентов с лимфомой зоны мантии в период от 2015 г. по настоящее время с оценкой возможностей внедрения новых методов диагностики и лечения ЛКЗМ.
Материалы и методы
В ретроспективный анализ были включены 45 пациентов с лимфомой зоны мантии, наблюдавшихся в ГАУЗ РКОД Минздрава в период с 2015 г. по настоящее время. При анализе учитывались данные клинико-лабораторного обследования (100 % обследованных), позитрон- но-эмиссионная томография (100 % обследованных), цитологическое, гистологическое и иммуногистохимическое исследования биоптата опухоли и костного мозга (100 %). Проанализированы эпидемиологические данные: распределение по полу, возрасту и местности проживания. Проанализированы клинические характеристики пациентов: зоны поражения, распространенность, лабораторные показатели, имму- ногистохимические особенности. Проанализированы терапевтические подходы (режимы химиотерапии, использованные в дебюте заболевания и в рецидивах), непосредственные и отдаленные результаты лечения.
Результаты и обсуждение
В основном ЛКМЗ является агрессивно протекающей лимфомой, при которой поражаются лимфатические узлы, кольцо Вальдейера, селезенка, костный мозг, печень, желудочно-кишечный тракт, орбита и другие экс- транодальные органы. Лишь в 10 % случаев ЛКМЗ обладает индолентным течением.
Из года в год лимфома клеток мантийной зоны привлекает к себе пристальное внимание, что связано с особенностью патогенеза и, как следствие, диагностики и лечения.
С целью диагностики и адекватного стадирования ЛКМЗ используются практически все методы инструментального исследования. Наряду с ПЭТ/КТ крайне важны методы эндоскопического исследования: фиброларингоскопия, фибробронхоскопия, фиброгастродуоденоскопия, фиброколоносокпия, т.к. при ЛКМЗ поражаются любые органы и системы. Морфологическая верификация возможна благодаря иммуногистохимическому и молекулярно-генетическому методам. Современные исследования показали, что ЛКМЗ характеризуется гиперэкспрессией ядерного белка циклин D1 и хромосомной транслокацией t(11;14)(q13;q32). Имеет 6 морфологических вариантов: моноцитоидоподобный, с плазмоцитарной дифференцировкой, пролимфоцитоидный, классический, мелкоклеточный, бластоидный (плеоморфный).
Таким образом, основным моментом в патогенезе ЛКМЗ считается транслокация t(11; 14)(q13; q32). Оптимальным способом определения t( 11; 14)(q13; q32) является флуоресцентная гибридизация in situ (FISH): частота выявления транслокации этим методом при ЛКМЗ достигает 99 %. В результате мутаций гена CCND1, находящегося в 13-м локусе длинного плеча 11-й хромосомы, происходит гиперэкспрессия белка-регулятора клеточного цикла циклина D1. Установление факта избыточной экспрессии циклина D1 является одним из основных молекулярных и иммунологических маркеров ЛКМЗ [3, 5-7].
Нейрональный фактор транскрипции SOX11 напрямую регулирует несколько онкогенных путей, включая пролиферацию, контроль клеточного цикла и апоптоз, дифференцировку В-клеток, ангиогенез, и микроокружение опухоли. В зависимости от экспрессии SOX11 выделяют 2 варианта ЛКМЗ: SOX11 позитивный, характеризующийся агрессивным течением и неблагоприятным прогнозом, и SOX11 негативный, для которого характерна стабильность генома, индолентное течение и более благоприятный исход [4, 8-10]. Пролиферативный индекс Ki-67 может быть сопряжен со степенью клинической агрессивности ЛКМЗ, т. е. низкий пролиферативный индекс обычно соответствует более благоприятному клиническому течению, в то время как высокий пролиферативный индекс сопряжен с меньшей продолжительностью выживания после установления диагноза [1].
ЛКМЗ характеризуется нестабильностью кариотипа и значительным количеством вторичных хромосомных аберраций. В последнее время описано большое количество случаев ЛКМЗ, сопровождающихся наличием однородительских дисомий, способствующих инактивации генов-супрессоров опухоли. Например, одна из наиболее часто обнаруживаемых однородительских дисомий включает участок короткого плеча 17-й хромосомы и способствует инактивации гена TP53, кодирующий белок 53, транскрипционного фактора, регулятора клеточного цикла. Р53 выполняет функцию супрессора, соответственно ген TP53 является антионкогеном. Известно, что пациенты с данной мутацией относятся к группе с крайне неблагоприятным прогнозом с медианой общая выживаемость (ОВ) не более 1,5 года даже после проведения высокодозной химиотерапии [3, 5, 7, 11-13].
В связи с такими молекулярно-генетическими особенностями современные подходы к лечению ЛКМЗ меняются. И описанные выше факторы необходимо учитывать при выборе терапии. Так, если в предыдущие десятилетия стандартом лечения считался режим R-СНОР, то основными тенденциями в терапии ЛКМЗ за последнее десятилетие являются: интенсификация индукционной терапии высокими дозами цитарабина для пациентов моложе 60 лет; проведение аутоТГСК в качестве консолидации первой ремиссии у пациентов моложе 60-65 лет; применение комбинаций средних доз цитарабина с бендамустином, платиносодержащими препаратами, бортезомибом; а также добавление бортезомиба к CHOP-подобным режимам для пациентов старше 60-65 лет; а пациентам, у которых выявлена делеция короткого плеча хромосомы 17 или мутации TP53, применение ингибиторов тирозинкиназы Брутона — ибрутиниба [6, 12-16].
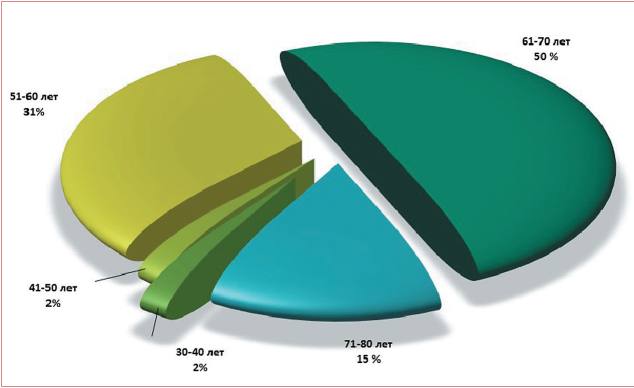
По результатам нашего анализа установлено, что пациенты с лимфомой зоны мантии в Республике Башкортостан составляют около 7 % от общего числа пациентов с неходжкинскими лимфомами, что практически сопоставимо с данными по России и с мировыми данными, где на долю лимфомы зоны мантии приходится 6-7 % от общего числа всех неходжкинских лимфом [1]. Увеличения заболеваемости в зависимости от пола не выявлено, т. е. количество женщин и мужчин в исследуемой группе было одинаково, что, в свою очередь, отличается от данных мировой статистики, где описывают, что болеют преимущественно мужчины и отношение М:Ж — (2-4):1. Медиана возраста пациентов с ЛКМЗ в исследуемой группе составила 64 года, что сопоставимо с данными литературы (рис. 1) [1]. Около 40 % пациентов на момент постановки диагноза имели распространенные стадии, что объясняется агрессивным течением ЛКМЗ.
Рисунок 1. Распределение ЛКМЗ по возрасту в Республике Башкортостан
Figure 1. MCL patients by age, Republic of Bashkortostan
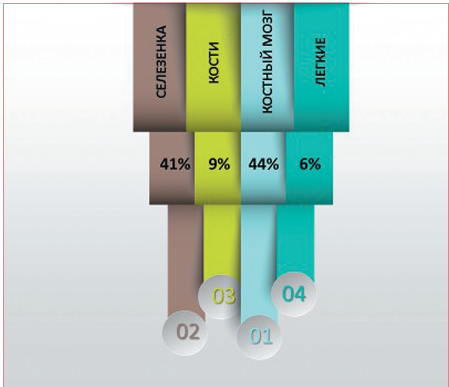
Среди проанализированных случаев жители городской местности составили большую часть (65 % против 35 %). При изучении частоты вовлечения в патологический процесс органов и систем установлено: поражение костного мозга — у 20 (44 %), селезенки — у 18 (41 %), костей — у 4 (9 %), легких — у 3 пациентов (6 %) (рис. 2). Распределение MIPI: высокий у 14 (30 %), средний у 20 (45 %), низкий у 11 (25 %). Ki67 в 4 случаях менее 30 %, в остальных более 30 %.
Рисунок 2. Частота поражения органов и систем при ЛКМЗ в РБ
Figure 2. Incidence of lesions in organs and systems in patients with MCL in RB
Ретроспективный анализ показал, что пациентам с 2015 по 2017 г. в большинстве случаев в первой линии проводилась химиотерапия в режиме R-CHOP с последующей поддержкой ритуксимабом до 2 лет. Средняя беспрогрессивная выживаемость (БПВ) составила 20 месяцев, 8 (17 %) пациентов в статусе длительной ремиссии (с 2015 г.). С 2017 г. в первой линии терапии ЛКЗМ начали применяться режимы R-BAC (схема с высокодозным цитарабином для кандидатов на ТСК) и R-B (для пожилых и коморбидных). С 2018 г. 8 пациентам проведена аутоТСК (в 1-м позднем рецидиве) как этап консолидации лечения. На данный момент обследование на del17p и мутацию TP53 проведено 13 пациентам с ЛКМЗ в федеральных центрах. С ноября 2019 года, впервые в Республике Башкортостан, 2 пациентам с ЛКМЗ начали терапию ингибиторами тирозинкиназы Брутона — ибрутинибом.
Заключение
За последние годы во всем мире значительно поменялись подходы к терапии пациентов с лимфомой зоны мантии. Наряду с гистологическим и иммуногистохи- мическим исследованиями опухолевых тканей в практику все больше внедряется метод молекулярно-генетического исследования, что дает больше возможностей в выборе тактики лечения пациентов.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Информация о спонсорстве. Данная работа не финансировалась.
Список литературы
1. Поддубная И.В., Савченко В.Г. (ред.) Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний. М.; 2018.
2. Поддубная И.В., Савченко В.Г. (ред.) Алгоритмы диагностики и протоколы лечения заболеваний системы крови. Т. 1. М.; 2018.
3. Лимфомы из клеток мантии у взрослых: Клинические рекомендации. М.; 2018.
4. Bernstein S.H., Epner E., Unger J.M., Leblanc M., Cebula E., Burack R., et al. A phase II multicenter trial of HyperCVAD MTX/Ara-C and rituximab in patients with previously untreated mantle cell lymphoma; SWOG 0213. Ann Oncol. 2013;24(6):1587–93. DOI: 10.1093/annonc/mdt070
5. Hilal T., Wang Z., Almader-Douglas D., Rosenthal A., Reeder C.B., Jain T. Rituximab maintenance therapy for mantle cell lymphoma: A systematic review and meta-analysis. Am J Hematol. 2018;93(10):1220–6. DOI: 10.1002/ajh.25226
6. Lokvenc M., Kalinova M., Forsterova K., Klener P., Trneny M., Fronkova E., et al. Cyclin D1 mRNA as a molecular marker for minimal residual disease monitoring in patients with mantle cell lymphoma. Ann Hematol. 2018;97(3):467–74. DOI: 10.1007/s00277-017-3210-8
7. Dreyling M., Campo E., Hermine O., Jerkeman M., Le Gouill S., Rule S., et al. Newly diagnosed and relapsed mantle cell lymphoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28(Suppl. 4):62–71. DOI: 10.1093/annonc/mdx223
8. Rule S., Dreyling M., Goy A., Hess G., Auer R., Kahl B., et al. Outcomes in 370 patients with mantle cell lymphoma treated with ibrutinib: a pooled analysis from three open-label studies. Br J Haematol. 2017;179(3):430–8. DOI: 10.1111/bjh.14870
9. Воробьев В.И., Гемджян Э.Г., Дубровин Е.И., Нестерова Е.С., Капланов К.Д., Володичева Е.М., и др. Риск-адаптированная интенсивная индукционная терапия, аутологичная трансплантация стволовых кроветворных клеток и поддерживающая терапия ритуксимабом позволяют достигнуть высоких показателей 7-летней выживаемости у больных лимфомой из клеток мантийной зоны. Терапевтический архив. 2019;91(7):41–51. DOI: 10.26442/00403660.2019.07.000322
10. Swerdlow S.H., Campo E., Harris N.L., Jaffe E.S., Pileri S.A., Stein H., et al. (eds) WHO classification of tumours of haematopoietic and lymphoid tissues. Lyon: IARC; 2017.
11. Romaguera J.E., McLaughlin P.W. Mantle cell lymphoma. In: Lichtman M.A., Kipps T.J., Seligsohn U., et al. (eds) Williams hematology. New York: McGraw-Hill; 2014.
12. Dabaja B.S., Zelenetz A.D., Ng A.K., Tsang R.W., Qi S., Allen P.K., et al. Early-stage mantle cell lymphoma: a retrospective analysis from the International Lymphoma Radiation Oncology Group (ILROG). Ann Oncol. 2017;28(9):2185–90. DOI: 10.1093/annonc/mdx334
13. Wang Y., Ma S. Risk factors for etiology and prognosis of mantle cell lymphoma. Expert Rev Hematol. 2014;7(2):23343. DOI: 10.1586/17474086.2014.889561
14. Ruan J., Martin P., Christos P., Cerchietti L., Tam W., Shah B., et al. Five-year follow-up of lenalidomide plus rituximab as initial treatment of mantle cell lymphoma. Blood. 2018;132(19):2016–25. DOI: 10.1182/blood-2018-07-859769
15. Malcikova J., Pavlova S., Kozubik K.S., Pospisilova S. TP53 mutation analysis in clinical practice: lessons from chronic lymphocytic leukemia. Hum Mutat. 2014;35(6):663–71. DOI: 10.1002/humu.22508
16. Воробьев В.И., Лорие Ю.Ю., Мангасарова Я.К., Кравченко С.К., Кременецкая А.М. Возможности терапии рецидивов и резистентного течения лимфомы из клеток мантийной зоны. Гематология и трансфузиология. 2011;(1):34–7.
Об авторах
Канкумашева Эльза Ильдаровна — врач-онколог
450054, Уфа, пр-т Октября, 73/1
Валиахметова Чулпан Хусаеновна — к.м.н., врачонколог, зав. онкологическим отделением противоопухолевой лекарственной терапии
450054, Уфа, пр-т Октября, 73/1
Для цитирования:
Канкумашева Э.И., Валиахметова Ч.Х. Лимфомы клеток мантийной зоны. Новые возможности диагностики и лечения (эпидемиологическое исследование). Креативная хирургия и онкология. 2019;9(4):261-265. https://doi.org/10.24060/2076-3093-2019-9-4-261-265
For citation:
Kankumasheva E.I., Valiakhmetova Ch.Kh. Mantle Zone Cell Lymphomas. New Opportunities for Diagnosis and Treatment (Epidemiological Research). Creative surgery and oncology. 2019;9(4):261-265. (In Russ.) https://doi.org/10.24060/2076-3093-2019-9-4-261-265
Лимфомы из клеток мантии у взрослых. Клинические рекомендации.
Лимфомы из клеток мантии у взрослых
Оглавление
Ключевые слова
лимфома из клеток мантийной зоны;
терапия 1-й, 2-й линий;
аутологичная трансплантация гемопоэтических клеток крови;
высокие дозы цитозара;
Список сокращений
ЛКМ – лимфома из клеток мантии
аутоТГСК – аутологичная трансплантация гемопоэтических стволовых клеток
ПР – полная ремиссия
БСВ – бессобытийная выживаемость
ЖКТ – желудочно-кишечный тракт
ЦНС – центральная нервная система
Термины и определения
Доказательная медицина – подход к медицинской практике, при котором решения о применении профилактических, диагностических и лечебных мероприятий принимаются исходя из имеющихся доказательств их эффективности и безопасности, а такие доказательства подвергаются поиску, сравнению, обощению и широкому распространению для использования в интересах пациентов.
Заболевание – возникающее в связи с воздействием патогенных факторов нарушение деятельности организма, работоспособности, способности адаптироваться к изменяющимся условиям внешней и внутренней среды при одновременном изменении защитно-компенсаторных и защитно-приспособительных реакций и механизмов организма.
Инструментальная диагностика – диагностика с использованием для обследования больного различных приборов, аппаратов и инструментов.
Лабораторная диагностика – совокупность методов, направленных на анализ исследуемого материала с помощью различного специализированного оборудования.
Уровень достоверности доказательств – положение, истинность которого должна быть доказана аргументом, или опровергнута антитезисом.
Хирургическое вмешательство – инвазивная процедура, может использоваться в целях диагностики и\или как метод лечения заболевания.
Терапия 1-й, 2-й и 3-й линии – очередность схем лечения ЛКМ.
1. Краткая информация
1.1 Определение
Лимфома из клеток мантии (син.: из мантийных клеток) – это В-клеточная лимфома из мелких клеток с, как правило, агрессивным течением [1].
1.2 Этиология и патогенез
Одним из ключевых событий в патогенезе ЛКМ считается транслокация t(11;14)(q13;q32). Ген CCND1, находящийся в 13 локусе длинного плеча 11 хромосомы, переносится в область энхансера конституционально гиперэкспрессированных в В-лимфоцитах генов IgVH. В результате развивается гиперэкспрессия белка-регулятора клеточного цикла циклина D1. Установление факта избыточной экспрессии циклина D1 является одним из основных молекулярных и иммунологических маркеров ЛКМ. Анализ точек разрыва в 11q13 и 14q32 показал, что транслокация происходит во время первичной перестройки генов иммуноглобулинов в костномозговой клетке-предшественнице В-лимфопоэза между одним из D- и J-сегментов генов иммуноглобулинов. Около 50% перестроек в 11q13 происходят в регионе, обозначенным как главный кластер транслокации. Оптимальным способом определения t(11;14)(q13;q32) является флуоресцентная гибридизация in situ (FISH): частота выявления транслокации этим методом при ЛКМ достигает 99%. Партнером для гена, кодирующего циклин D1, могут стать и локусы легких цепей иммуноглобулинов: t(2;11)(p11;q13) и t(11;22)(q13;q11). Вариантные транслокации встречаются менее чем в 1% случаев ЛКМ. Циклин D1 в комплексе с циклин-зависимыми киназами 4 и 6 (CDK4/6) является регулятором перехода клеток из G1 в S-фазу клеточного цикла. Активный комплекс циклин D1/CDK4(6) фосфорилирует ретинобластомный протеин (RB), белок-блокатор транскрипционного фактора E2F. Комплекс циклин D1/CDK4 имеет и киназанезависимые функции, связываясь, в частности, с белком-блокатором клеточного цикла p27kip, который, в свою очередь, титрует из ядра комплекс циклина Е/CDK2. Это дополнительно способствует ускорению клеточного цикла.При ЛКМ циклин-зависимые киназы CDK4 и CDK6, необходимые для реализации циклина D1a, часто гиперэкспрессированы. В случае CDK4 это достигается за счет амплификации гена CDK4, а в случае CDK6 отмечается снижение экспрессии микроРНК-29. Это ведет к стабилизации транскрипта CDK6 и способствует гиперэкспрессии белка, что ассоциируется с более короткой выживаемостью больных. В цитоплазме циклин D1 полиубиквитинируется через Е3 лигазу SKp1-Cul1-F (SCF; FBX4-?B Crystallin) и деградируется через протеасому. Мутации Т268А и мутации в Е3 убиквитино-лигазном комплексе увеличивают ядерную экспрессию циклина D1. Несмотря на отсутствие описаний таких мутаций при ЛКМ, PI3K/Akt-зависимое ингибирование GSK3? имеет схожий эффект и создает вклад в дисрегуляцию циклина D1 при ЛКМ.[7]
Таким образом, транскрипция, трансляция, включение в комплексы, расположение в клетке и деградация циклина D1a подвергаются очень тонкой регулировке. Сама по себе гиперэкспрессия циклина D1а не способствуют развитию опухоли у мышей с удаленным тимусом и отсутствием Т-лимфоцитов. Только наличие дополнительных событий, способствующих увеличению внутриядерной концентрации и времени экспозиции циклина D1, а также, что важно, и циклинзависимых киназ 4 и 6 позволяет реализоваться их онкогенному потенциалу.
ЛКМ характеризуется нестабильностью кариотипа и значительным количеством вторичных хромосомных аберрацийВ последнее время описано большое количество случаев ЛКМ, сопровождающихся наличием однородительских дисомий, способствующих инактивации генов-супрессоров опухоли. Например, одна из наиболее часто обнаруживаемых однородительских дисомий, включает участок короткого плеча 17 хромосомы и способствует инактивации гена TP53. Приобретенные хромосомные аберрации в генах контроля повреждений ДНК и в генах, относящихся к контролю динамики микротрубочек, могут дополнительно увеличить генетическую нестабильность. Вторичные генетические нарушения, которые затрагивают пути восстановления поврежденной ДНК находятся под особым интересом, так как могут быть причиной рефрактерности к химиотерапии. Мутации, ведущие к инактивации гена ATM (ataxia-telangiectasia mutated) встречается при ЛКМ в 40-75% случаев. ATM-киназа в норме играет ключевую роль в ответе на повреждения ДНК, являясь геном-супрессором опухоли и входит в состав ATM-p53 пути. Повреждение ДНК индуцирует активацию киназ ATM и ATR, которые вместе с белками p53 и p14/ARF могут индуцировать арест клеточного цикла, восстановление ДНК или апоптоз. E3-убиквитин-лигаза MDM2, нацеленная на p53 для его протеасомной деградации ингибируется ARF, который в свою очередь ингибируется BMI1. CHK1 и CHK2 активируются ATR и ATM, соответственно. Это ведет к фосфорилированию ключевых субстратов p53, CDC25A, CDC25B и аресту клеточного цикла. Подавление экспрессии CHK1 (cell checkpoint kinase 1), CHK2 и 2-серин-треонин киназы, участвующих в ответе на повреждение ДНК вместе с белками ATM и p53, снижает контроль за S-фазой клеточного цикла и выявляется в случаях ЛКМ с высокой генетической нестабильностью.[14,17,18]
1.3 Эпидемиология
Лимфома из клеток мантии (ЛКМ) составляет около 6% от всех вновь диагностированных случаев неходжкинских лимфом. В Западной Европе, Скандинавии и США её частота варьирует от 0,5 до 0,7 на 100.000 населения, причем у людей старше 65 лет заболеваемость возрастает до 3,9 на 100.000. Болеют преимущественно мужчины старше 60 лет (медиана возраста 65-75 лет, М:Ж – 2-4:1). В США ежегодно заболевают от 5.000 до 6.000 человек, что косвенным образом свидетельствует о том, что в РФ ежегодно должно выявляться не менее 2.500 новых случаев.[1]
1.4 Кодирование по МКБ 10
С85.7 – другие неуточненные типы неходжкинской лимфомы
1.5 Классификация
Стадирование ЛКМ по Ann-Arbor
Стадия I Вовлечение одной группы лимфатических узлов (ЛУ) — I
или локализованное поражение одного экстралимфатического органа
или локализованное поражение одного экстралимфатического органа
Стадия III Вовлечение групп ЛУ по обе стороны диафрагмы с/без локализованного
поражения экстралимфатического органа или ткани — III Е, селезенки –
III S, или того и другого — III S + Е
Стадия IV Диффузное или диссеминированное поражение экстралимфатического
органа или ткани с/без вовлечения ЛУ
Для стадировании ЛКМ используется такая же модифицированная классификация по стадиям Ann Arbor, как при лимфоме Ходжкина и большинстве других лимфопролиферативных заболеваний. Принимая во внимание вовлечение периферической крови и костного мозга в большинстве случаев, стадирование по Ann Arbor не имеет прогностического значения. [2]
1.6 Клинические признаки
В 90 % случаев диагноз устанавливается в III или IV стадии. Часто имеются B-симптомы— лихорадка (гипертермию), ночные поты, потерю массы тела более 10% за последние полгода. Спленомегалия (увеличение размеров селезёнки наблюдается более чем у 50 % пациентов. Часто выявляется лейкоцитоз с наличием клеток МКЛ в крови. Наиболее распространённой экстранодальной локализацией при МКЛ является поражение желудочно-кишечного тракта: лимфоматозные полипы толстой кишки или желудка. Следует помнить, что даже при отсутствии явных полипов или видимых изменений слизистой оболочки при гистологическом исследовании биоптатов могут выявляться участки опухолевой инфильтрации. Может наблюдаться также поражение мочеполовой системы, лёгких и мягких тканей, в том числе мягких тканей головы и шеи, периорбитальных тканей глаза. Поражение центральной нервной системы может развиться у больных с ЛКМ, в связи с прогрессированием заболевания. Также у небольшой части больных, особенно с бластоидным вариантом МКЛ, встречаются изолированные ЦНС-рецидивы после первоначально успешного лечения. Частота возникновения ЦНС-рецидивов увеличилась в последнее время в связи с появлением более эффективной системной терапии и увеличением продолжительности выживания больных с МКЛ. [3,4,5]
2. Диагностика
2.1 Жалобы и анамнез
Жалобы пациентов при ЛКМ не отличаются от таковых при других видах лимфом. Пациенты отмечают увеличение размеров лимфоузлов, чувство тяжести в левом подреберье, нарастающую слабость, частые инфекционные заболевания.
Рекомендуется при сборе анамнеза заболевания и семейного анамнеза выяснять следующее: установление предшествующих развитию заболевания факторов: (бактериальная или вирусная инфекция, стресс, сопутствующие заболевания, пересадка органов в анамнезе); семейный анамнез: болезни системы кроветворения у кровных родственников.[3,4]
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2++)
Комментарии: сбор жалоб и анамнеза позволит определить объем обследования больного.
2.2 Физикальное обследование
Рекомендуется обращать внимание на следующие факторы: гипертермия, снижение массы тела и симптомы интоксикации, гепато- и спленомегалия, лимфаденопатия, патология молочных желез, сердца, вен нижних конечностей, врожденные аномалии.[3,4].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2++)
Комментарии: позволяет отдифференцировать реактивную лимфаденопатию от системного заболевания крови.
2.3 Лабораторная диагностика
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1+)
Комментарии: список обязательных лабораторных тестов включает общий анализ крови (ОАК), мазок периферической крови, биохимический анализ крови, ВИЧ, вирусы гепатитов В и С, количественный иммунохимический анализ крови, исследование костного мозга (цитологическое и гистологическое), иммногистохимическое исследование костного мозга, биопсия опухолевого лимфоузла или образования (цитологическое и гистологическое), иммуногистохомическое исследование опухолевого образца.
Рекомендуется выполнить развернутый клинический анализ крови с определением гемоглобина, эритроцитов, тромбоцитов, лейкоцитов, подсчетом лейкоцитарной формулы. [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: объем исследования включает в себя дифференциальный подсчет клеток крови с использованием автоматического анализатора; обязателен оптический подсчет количества тромбоцитов (по Фонио), исследование морфологии эритроцитов, тромбоцитов, нейтрофилов по мазку, СОЭ;
Рекомендуется выполнить биохимический анализ крови [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: для оценки функционального состояния внутренних органов и выявления сопутствующей патологии.
Рекомендуется выполнить общий анализ мочи [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Рекомендуется выполнить коагулограмму [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: для оценки функционального состояния тромбоцитов и свертывающей системы, в том числе для исключения синдрома диссеминированного внутрисосудистого свертывания крови (ДВС).
Рекомендуется исследование крови на вирус иммунодефицита человека (ВИЧ), антител к вирусам гепатитов В и С и проведение полимеразной цепной реакции (ПЦР) на эти вирусы. [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: для исключения ВИЧ и гепатит ассоциированных лимфатических заболеваний; определения степени активности инфекционного процесса при его наличии
Рекомендуется количественный иммунохимический анализ крови. [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: для исключения иммунодефицитных состояний, наличия моноклональной секреции патологических белков.
Рекомендуется выполнить определение группы крови, резус-фактора [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: определение группы крови обязательно всем больным для подбора компонентов крови для переливания при развитии панцитопении.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: диагноз лимфомы устанавливают только на основании морфологического исследования биоптата. Морфологическое исследование проводится с помощью гистологического и иммуногистохимического методов. В части случаев необходимо проведение цитологического, молекулярно-биологических и генетических тестов. Одно цитологическое исследование пунктатов или мазков-отпечатков лимфатических узлов или других опухолевых очагов не является достаточным основанием для нозологической верификации лимфом. В исключительных случаях (локализация опухоли в труднодоступных анатомических зонах) объектом исследования может быть тканевой материал, полученный с помощью «пистолетной» («кор»-) биопсии.
Рекомендуется обязательное выполнение иммуногистохимического [3,4]
исследования биоптата опухоли с обязательным определением экспрессии
следующих антигенов: CD3,CD5,CD10,CD20,CD23, cyclinD1 и Ki67, при
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Рекомендуется при наличии лимфоцитоза выполнение иммунофенотипирования (ИФТ) методом проточной цитометрии. [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: выполнение ИФТ обязательно при наличии лимфоцитоза в общем анализе крови (независимо от числа лейкоцитов), или в миелограмме, а также при преобладании лимфоидных клеток, атипичных лимфоцитов или клеток с бластной морфологией в плевральной, асцитической или других биологических жидкостях. Выполнение ИФТ позволяет быстро провести дифференциальную диагностику опухолевого и реактивного лимфоцитоза, что важно для определения дальнейшей тактики обследования пациента. Материалом для ИФТ могут служить клетки крови, костного мозга, выпотных жидкостей, бронхоальвеолярного смыва, ликвора, гомогенизированные образцы тканей (селезенка, лимфатические узлы и т.д.), клеточная суспензия, полученная при аспирационной тонкоигольной пункции лимфатических узлов.
Рекомендуется выполнять цитогенетическое исследование для определения t(11;14)(q13;q32). При невозможности выполнения стандартного цитогенетического исследования или его отрицательном результате желательно определение t(11;14)(q13;q32) методом FISH на отпечатках лимфоузла, срезах с парафиновых блоков, в клетках крови или костного мозга.[3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: Во всех иммунологически сомнительных случаях (например, отсутствие CD5, наличие CD23 или слабая экспрессия CD20) проведение цитогенетического исследования особо целесообразно.
Рекомендуется цитологическое и гистологическое исследование костного мозга. [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: миелограмма и трепанобиопсия костного мозга обязательна всем больным для определения объема поражения.
Рекомендуется при отсутствии гистологических признаков определение вовлечения костного мозга с использованием метода FISH, проточной цитофлюориметрии или определение В-клеточной клональности методом ПЦР на основании анализа реарранжировок генов тяжелых цепей иммуноглобулинов. [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: Морфологическое исследование пунктата костного мозга (стернального или др.) не заменяет гистологическое исследование трепанобиоптата. Отсутствие морфологических признаков поражения костного мозга не исключает наличие минимального поражения костного мозга, что выявляется с помощью ПЦР метода.
Рекомендуется во всех ситуациях и обязательно при наличии показаний (бластоидный вариант ± гиперлейкоцитоз, общемозговая симптоматика) выполнение люмбальной пункции с цитологическим исследованием ликвора для исключения нейролейкемии. Профилактическое интратекальное введение цитостатиков на усмотрение лечащего врача. [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Рекомендуется выполнение эзофагогастродуоденоскопии и фиброколоноскопии с обязательными биопсиями слизистых желудка, двенадцатиперстной кишки, сигмовидной кишки, поперечной ободочной и слепой кишки, даже при отсутствии визуальных признаков вовлечения органа («слепые» биопсии). Эндоскопическое исследование является обязательным для больных с локальными стадиями. [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Рекомендуется рассмотрение вопроса об использовании антипневмококковой вакцины, особенно у пациентов старше 60 лет, кому планируется длительная поддерживающая терапия ритуксимабом. [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Рекомендуется проведение биопсии дополнительных очагов поражения. [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: при определении стадии опухолевого процесса может потребоваться биопсия других очагов поражения, если нельзя исключить их опухолевую природу другими способами.
Рекомендуется обязательное выполнение повторной биопсии и морфологического исследования пораженных лимфатических узлов или очагов, расположенных экстранодально при рецидиве или прогрессировании заболевания. [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: повторная биопсия позволит уточнить морологический вариант рецидива/прогрессии, исключить неопухолевое поражение (например, туберкулез, грибковая инвазия, вторая опухоль). Повторная биопсия также показана при наличии резидуальных очагов для подтверждения ремиссии.
Рекомендуется повторная аспирация и трепанобиопсия костного мозга для плановой оценки результатов лечения (при исходном поражении костного мозга) и при появлении клинически немотивированных цитопении и лихорадки (вне зависимости от наличия исходного поражения). [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: аспират костного мозга может быть информативен для оценки регенерации и диспластических изменений миелопоэза. У больных с поражением костного мозга цитологическое исследование пунктата для оценки изменений объема опухолевой инфильтрации не всегда информативно.
2.4 Инструментальная диагностика
Рекомендуется выполнить КТ шеи, грудной клетки, органов брюшной полости и малого таза (по возможности с внутривенным контрастированием). [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: позволяют выявить очаги опухолевого поражения. [3,4]
Рекомендуется выполнить рентгенографию органов грудной клетки в двух проекциях (при невозможности выполнения КТ) [3,4]
Уровень убедительности рекомендаций D (уровень достоверности доказательств – 3).
Рекомендуется выполнение УЗИ периферических лимфатических, внутрибрюшных и забрюшинных узлов и органов брюшной полости [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарий: УЗИ может использоваться для определения исходного объема поражения и контроля за лечением.
Рекомендуется выполнение эндоскопического исследования желудка [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Рекомендуется выполнения ПЭТ при сохранении остаточных образований после завершения высокодозной терапии и аутоТГСК с целью решения вопроса о проведении локальной лучевой терапии. [37]
Уровень убедительности рекомендаций D (уровень достоверности доказательств – 3).
Комментарии: Роль ПЭТ недостаточно определена из-за большой вероятности получения ложноотрицательных результатов у больных ЛКМ. Это связанно с тем, что уровень пролиферативной активности опухолевых клеток в значительной части случаев близок к нормальному и повышенного накопления радиофармпрепарата не происходит. Исходная чувствительность метода достигает только 67%, особенно много ложноотрицательных результатов при вовлечении ЖКТ.
2.5 Дополнительные исследования, консультации специалистов
При наличии показаний могут выполняться дополнительные методы исследования:
Рекомендуется исследование прямой пробы Кумбса [3,4]
Комментарий: выполняется при наличии клинических или лабораторных признаках гемолиза
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Рекомендуется выполнение рентгенографии костей скелета, сцинтиграфия костей скелета [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: при необходимости исключения поражения костей
Рекомендуется консультация гинеколога (у женщин) [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Рекомендуется консультация смежных специалистов при показаниях (исключение туберкулеза, оказание ЛОР-пособия и т.п.) [3,4]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
2.6. Стадирование, формулирование диагноза
Для стадировании ЛКМ используется такая же модифицированная классификация по стадиям Ann Arbor, как при лимфоме Ходжкина и большинстве других лимфопролиферативных заболеваний. Принимая во внимание вовлечение периферической крови и костного мозга в абсолютном большинстве случаев, стадирование по Ann Arbor не имеет прогностического значения. [2]
Клинической системой прогноза ЛКМ является международный прогностический индекс лимфомы из клеток мантии – MIPI (Mantle cell lymphoma International Prognostic Index). Его модификациями являются упрощенный индекс (sMIPI) и комбинированный биологический индекс (MIPIb), учитывающий количество клеток экспрессирующих Ki-67. [26]
? Низкий риск по шкале MIPI – 5-летняя общая выживаемость (ОВ) составляет 60%.
? Промежуточный риск по шкале MIPI – медиана ОВ составляет 51 месяц.
? Высокий риск по шкале MIPI – медиана ОВ составляет 29 месяцев.
Расчет упрощенного варианта международного прогностического индекса лимфомы из клеток мантии sMIPI.
Баллы Возраст ECOG ЛДГ/ВН ЛДГ Лейкоциты 109/л
Каждый прогностический фактор оценивается от 0 до 3 баллов, которые потом суммируются (максимально 11 баллов). Пациенты, набравшие от 0 до 3 баллов, относятся в группу низкого риска; 4-5 баллов – в группу промежуточного риска; 6-11 баллов – в группу высокого риска. При статусе по шкале ECOG >=2 больному присваивается 2 балла. Влияние концентрации ЛДГ оценивалось путем деления концентрации ЛДГ сывротки больного на значение верхней нормы лаборатории (например, у больного концентрация ЛДГ на момент установления диагноза 390 Е/л, а лабораторные нормы составляют 250-480 Е/л; тогда проводится деление 390/480=0,81, что соответствует 1 баллу).
Расчет комбинированного биологического варианта международного прогностического индекса лимфомы из клеток мантии MIPIb: [48]
MIPIb = 0,03535 х возраст(годы)
+ 1,367 х log10(ЛДГ/ВГН ЛДГ)
+ 0,9393 х log10(число лейкоцитов)
Группы риска при расчете MIPIb:
Применение индекса MIPIb позволяет избежать случаи включения молодых больных с бластоидным вариантом заболевания в группу низкого риска. Для расчета MIPI и MIPIb возможно использование одного из специализированных медицинских калькуляторов, например QxMD Calculate (qxmd.com).
3. Лечение
Особенностью заболевания является рецидивирующее течение, несмотря на различные режимы терапии. Применение (R)CHOP-подобных курсов эффективно только в достижении общего ответа (ОО): полные ремиссии (ПР) достигаются в трети случаев, а медиана бессобытийной выживаемости (БСВ) составляет 16-20 месяцев. [6]
Основными тенденциями в терапии ЛКМ за последнее десятилетие являются:
Основываясь на результатах различных исследований использование терапевтических моноклональных антител, высокодозной индукционной терапии и аутологичной трансплантации стволовых кроветворных клеток (аутоТГСК) превратились в наиболее эффективный способ достижения полных ремиссий, длительной бессобытийной и общей выживаемости у больных моложе 65 лет. [12,14,16]
Введение высоких доз цитарабина в схемы индукционной терапии позволяет достигать ОО в 90-95%, а ПР не менее чем в половине случаев. Целью высокодозной консолидации с поддержкой аутоТСКК является достижение молекулярной ремиссии, что коррелирует с более длительной безрецидивной выживаемостью (БРВ). Плато на кривой БСВ не регистрируется, но около половины больных после высокодозной терапии переживают 10-летний рубеж. [46]
Использование высоких доз цитарабина** и метотрексата** сопряжено с развитием гематологической токсичности IV степени, высоким риском тяжелых инфекционных осложнений и острой почечной недостаточности. Медиана возраста больных ЛКМ, которым предполагается проведение интенсивной индукционной полихимиотерапии (ПХТ), колеблется от 50 до 60 лет, что приводит к невыполнению высокодозной ПХТ в полном объеме у 30-50% больных. В результате редукции объема терапии у меньшего числа больных достигаются ПР, укорачивается БСВ и ОВ.
Снижение дозы цитарабина** в индукционной ПХТ с 12 до 4 г/м2 ведет к уменьшению сроков медианы БСВ с 5 до 3 лет, хотя ПР достигаются в 89 и 84% случаев, соответственно. Это подталкивает на поиск оптимальной по переносимости и эффективности индукционной ПХТ у больных с сопутствующей патологией в возрасте 55-65 лет. Альтернативой высоким дозам цитарабина** и метотрексата** могут быть курсы ПХТ, включающие средние дозы цитарабина** с цисплатином** (R-DHAP), бендамустином (R-BAC) и/или бортезомибом (R-HAD+B); различные комбинации гемцитабина** и оксалиплатина**. Их высокая эффективность продемонстрирована не только в терапии рецидивов и резистентных форм, но и у первичных больных. [54]
Медиана возраста больных ЛКМ колеблется около 65 лет, что ограничивает проведение интенсивной терапии не менее чем в половине случаев. Постоянный поиск новых схем иммунополихимиотерапии не позволяет выделить «золотой» стандарт, однако любая интенсификация сопряжена с токсичностью. Например, добавление средних доз цитарабина к схеме ритуксимаб-бендамустин (R-BAC) позволяет значительно улучшить результаты индукционной терапии, но только у соматически сохранных больных в возрасте до 75 лет. При невозможности применения среднедозных режимов терапии (R-CHOP или R-B) у пациентов с неудовлетворительным соматическим статусом возможно использование кладрибина с ритуксимабом или метрономной терапии, такой как R-PEPC. В ряде случаев возможно использование лучевой терапии, особенно при I-II стадиях заболевания. Неудовлетворительные результаты среднедозной терапии подталкивают к активному внедрению в клиническую практику новых таргетных препаратов, таких как ингибиторы тирозинкинзы Брутона (ибрутиниб) и ингибиторы PI3K, механизм действия которых направлен на блокирование передачи сигнала от В-клеточного рецептора к ядру клетки. [65]
Высокая токсичность флударабина**, связанная в первую очередь с развитием гипоплазии и аплазии костномозгового кроветворения, привела к исключению данного препарата из терапии первой линии как у молодых пациентов, так и у больных старшей возрастной группы.
Важной особенностью терапии ЛКМ является медленное достижение ответа и, как следствие, необходимость в проведении от 6 до 8 курсов индукционной терапии. Таким образом, выбор терапии, в первую очередь, зависит от возраста больного и его соматического статуса.
3.1 Локальные (I-II) стадии
С появлением высокочувствительных методов диагностики I-II стадия у пациентов с ЛКМ устанавливается исключительно редко (в 1-3% случаев). Стандартная терапия не разработана. В ретроспективных исследованиях показано преимущество комбинированного химиолучевого лечения над химиотерапией, ремиссии достигаются у 95% больных. Медианы ОВ и выживаемости без прогрессирования составили 6,4 и 3,2 года, соответственно.
Рекомендуется в качестве варианта терапии может явиться применение 4-6 курсов ПХТ по схеме R-CHOP и локальной лучевой терапии в СОД 30 Гр при достижении полной ремиссии или СОД 36-40 Гр при частичном ответе.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Рекомендуется у пациентов моложе 60 лет при вовлечении более одного лимфатического узла/локуса целесообразно проводить интенсивную индукционную терапию. При определении стадии заболевания обязательно исключение вовлечения ЖКТ и костного мозга, желательно выполнение ПЭТ.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
3.2 Больные моложе 60-65 лет с сохранным соматическим статусом, являющиеся кандидатами для проведения высокодозной терапии и аутоТСКК.
3.2.1 Первая линия терапии.
Целью терапии является достижение полной ремиссии, в т.ч. молекулярной, что соотносится с длительными БСВ и ОВ.
Рекомендуется проведение индукционной терапии с использованием высоких доз цитарабина.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: Принимая во внимание медиану возраста больных старше 50 лет, необходимость в проведении 6-8 циклов терапии длительностью 21-28 дней, высокодозные режимы чередуются (альтернируются) с CHOP-подобными схемами: R-HyperCVAD/R-HMA, R-MaxiCHOP/R-HD-AraC, R-CHOP/R-DHAP. Однако, принимая во внимание отсутствие значимой эффективности курсов HyperCVAD и MaxiCHOP над курсом CHOP в терапии ЛКМ, а также превышающую токсичность над эффективностью метотрексата, схемой выбора в терапии молодых и соматически сохранных пациентов может служить R-CHOP/R-HAD (6-8 курсов, в зависимости от времени достижения ремиссии).[38,43]
При высоком риске развития синдрома лизиса опухоли, особенно при гиперлейкоцитозе более 50,0 х 109/л, возможно исключение из первого курса терапии ритуксимаба или проведение предфазы циклофосфамидом** и дексаметазоном**. Ряд европейских исследователей придерживаются схем индукционной терапии, включающих средние дозы цитарабина** в комбинации с цисплатином** (R-CHOP/R-DHAP). Однако снижение дозы в индукционной терапии нивелируются добавлением цитарабина** к тотальному облучению тела (ТОТ) во время предтранслплантационного кондиционирования. К настоящему времени большинство исследователей склоняется к исключению из схем ПХТ высокодозного метотрексата** из-за его высокой токсичности и отсутствия значимой эффективности.
Рекомендуется при достижении ЧР или ПР выполняется сбор аутологичных стволовых кроветворных клеток с очисткой трансплантата in vivo от возможной контаминации CD20+ клетками ритуксимабом**. [46]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
В качестве кондиционирования (высокодозной консолидации) при ЛКМ в используются ТОТ в дозе 12-14 Гр со снижением дозы над легкими до 8 Гр в комбинации с цитостатическими препаратами (циклофосфамид**, этопозид, ** мелфалан**, цитарабин**) или высокодозные схемы ПХТ, например, BEAM. [21,46,61]
Рандомизированных исследований различных режимов кондиционирования не существует. При анализе регистра EBMT (Европейского общества трансплантации костного мозга) преимущество ТОТ продемонстрировано только у пациентов с частичной ремиссией заболевания. При достижении полной ремиссии лучшей эффективностью и безопасностью обладает кондиционирование по схеме BEAM±R. В реальной клинической практике в России тотальное облучение тела на сегодняшний день практически не используется. В связи с нерегулярностью поставок кармустина** в режиме кондиционирования возможно использование ломустина** или бендамустина** 140-200 мг/м2 однократно. [43]
Необходимость в применении поддерживающей терапии ритуксимабом** после выполнения интенсивной индукционной терапии и аутоТГСК на сегодняшний день не определена.[28] В рандомизированном исследовании Le Gouill с соавт. в группе больных, получавших поддерживающую терапию ритуксимабом** после аутоТГСК, отмечено статистически достоверное улучшение БСВ по сравнению с больными без поддерживающей терапии. Однако при анализе ОВ в обеих группах различий при медиане наблюдения 2 года не получено. Кроме того, длительное использование антиCD20 антител после интенсивной индукционной терапии приводит к необходимости массивной заместительной терапии иммуноглобулинами.
Рекомендуется контрольные обследования в течение первого года после аутоТГСК выполняются каждые 3 месяца и включают КТ (при необходимости УЗИ), желателен контроль минимальной остаточной болезни в костном мозге.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: молекулярный рецидив может быть купирован монотерапией ритуксимабом**. Эндоскопические методы исследования, особенно фиброколоноскопию, целесообразно выполнять у больных с вовлечением ЖКТ 1 раз в 6 месяцев. Большинство рецидивов возникают в течение первых трех лет после аутоТГСК. Динамическое наблюдение после аутоТГСК проводится не менее 5 лет с интервалом 3-6 месяцев.
Сочетание высокого риска, определяемого по шкале MIPIb, гиперлейкоцитоза более 40-50 х 109/л и бластоидного варианта является фактором крайне неблагоприятного прогноза, даже при выполнении интенсивной индукционной терапии и аутоТГСК. Это делает возможным рассмотрения вопроса о выполнении трансплантации аллогенного костного мозга в первой ремиссии болезни («тандемная» трансплантация). [61]
Рекомендуется выполнять люмбальную пункцию у больных с бластоидным вариантом заболевания и наличием опухолевого гиперлейкоцитоза.
Комментарии: Четких рекомендаций по профилактике нейролейкемии нет
3.2.2. Терапия рецидивов.
Противорецидивная терапия определяется схемой индукционной терапии и продолжительностью ремиссии.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: среди нецитостатических препаратов наибольшей эффективностью обладает ибрутиниб. Назначение ибрутиниба возможно у пожилых и соматически ослабленных больных уже в первом рецидиве при невозможности проведения адекватной ПХТ. При развитии раннего рецидива также целесообразно рассмотреть возможность назначения ибрутиниба.
Рекомендуется аутоТГСК может рассматриваться в качестве консолидации второй линии терапии при химиочувствительном рецидиве после длительной (более 3-5 лет) ремиссии у пациентов моложе 65 лет, ранее не получавших высокодозную терапию.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Рекомендуется при развитии рецидива после интенсивной индукционной терапии включающей высокодозный цитарабин и аутоТГСК возможно применение платиносодержащих режимов и бендамустина** (в т.ч. с повторным использованием цитарабина** – схема R-BAC).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Рекомендуется у больных моложе 50-55 лет рассмотрение вопроса о выполнении аллоТКМ с немиелоаблативным режимом кондиционирования.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: аллоТКМ является единственным методом, позволяющим вылечить больного ЛКМ. Возможность ее проведения определяется химиочувствительностью опухоли, возрастом и коморбидностью пациента, а также наличием донора. Длительная ОВ после аллоТКМ достигает 40-50%. Ранние рецидивы после интенсивной индукционной терапии и аутоТгсК фактически некурабельны. Выполнение аллоТКМ в этой группе больных не позволяет достигнуть ремиссии, в первую очередь, из-за отсутствия достаточного времени для развития реакции трансплантат против опухоли. Возможно эффект будет достигнут после включения в схемы противорецидивной терапии новых препаратов, например, ибрутиниба.
3.3. Распространенные стадии у больных старше 60-65 лет и пациентов, не являющихся кандидатами для проведения интенсивной терапии.
3.3.1. Первая линия терапии.
Целью терапии в этой группе является достижение ремиссии и ее поддержание нехимиотерапевтическими агентами. Выбор тактики, в первую очередь, определяется соматическим статусом пациента, наличием сопутствующей патологии и признаков почечной недостаточности. Проводится 6-8 курсов индукционной ПХТ с последующей поддержкой ритуксимабом**. В ряде случаев, у соматически сохранных больных в возрасте до 70 лет возможно выполнение аутоТГСК (режим кондиционирования BEAM-R).[29]
Рекомендуется: в настоящее время базовыми режимами терапии соматически сохранных больных старше 65 лет являются комбинации R-B** и R-CHOP.[47]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: в проспективном рандомизированном исследовании эффективность режима R-B оказалась выше R-CHOP при более благоприятном профиле токсичности – медиана беспрогрессивной выживаемости составила 35,4 месяцев против 22,1 месяцев, соответственно. Однако при более длительном наблюдении эффективность обоих режимов оказалась схожей. Применение флударабина** в первой линии терапии нецелесообразно из-за высокой токсичности. К более интенсивным вариантам индукции можно отнести схему R-BAC (ритуксимаб** 375 мг/м2 в 0 или 1 дни, бендамустин** 70 мг/м2 в 1-2 дни и цитарабин ** 500 мг/м2 в 1-3 дни 1 р/д). Применение более интенсивных режимов терапии сопряжено с высокой токсичностью и невыполнимостью плана терапии, что негативно сказывается на возможности достижения ЧР и ПР.Другим, довольно интенсивно применяемым в Европе режимом терапии является комбинация RiBVD – ритуксимаб** 375 мг/м2 в 1 день, бендамустин ** 90 мг/м2 в 1-2 дни, бортезомиб** 1,3 мг/м2 в 1, 4, 8 и 11 дни и дексаметазон ** 40 мг во 2 день однократно, шесть 28-дневных циклов. Частота достижения полных ремиссий составляет 75%, а беспрогрессивная выживаемость достигает 70% в течение 2 лет.Менее интенсивные схемы для больных с наличием тяжелой сопутствующей патологии: R-CVP, комбинации аналогов пуринов (кладрибин**) с ритуксимабом** и алкилирующими препаратами, метрономная терапия R-PEPC. Возможно участие в клинических исследованиях первой линии терапии, т.к. применение новых малотоксичных таргетных препаратов позволит, по всей видимости, увеличить общую выживаемость в этой группе больных.
Рекомендуется: поддерживающая терапия ритуксимабом достоверно увеличивает безрецидивную выживаемость пожилых пациентов ЛКМ, достигших ремиссию после среднедозной индукционной терапии. Проводится каждые 2 месяца в дозе 375 мг/м2 в течение 2 лет или до прогрессирования болезни. Профилактика нейролейкемии проводится пациентам с бластоидным вариантом заболевания, гиперлейкоцитозом и при наличии симптомов вовлечения ЦНС.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
3.3.2. Терапия рецидивов.
Рекомендуется : применение средних доз цитарабина (R-HAD±B), платиносодержащих курсов (R-DHAP(Ox), R-GIDOX) различных комбинаций бендамутстина с цитарабином и/или бортезомибом**, кладрибином** после использования в первой линии терапии CHOP-подобных или флударабин** содержащих схем. [50,61]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Рекомендуется: у пациентов с наличием сопутствующей патологии или при втором рецидиве возможно применение таких схем как R-бортезомиб, R-PEPC, ибрутиниб ±ритуксимаб**.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: использование ибрутиниба целесообразно начинать на более ранних этапах противорецидивной терапии. При их неэффективности во втором рецидиве выполняются альтернативные противорецидивные схемы лечения или рассматривается возможность участия в клинических исследованиях. [55,62,67,65,64]
Терапия больных с ЛКМ в зависимости от возраста и соматического статуса
60-65 лет, не кандидаты для ВДХТ и аутоТСКК
Кладрибин+R или R-PEPC при тяжелом соматическим статусе
R-HAD±B (AraC 1-2 г/м2 х 4 ± бортезомиб)
АллоТКМ (при достижении ответа)
АутоТГСК (при отсутствии на более раннем этапе и достижении ответа)
Бортезомиб (лучше в комбинации)
Лучевая терапия (особенно при локальном рецидиве)
R-HAD±B (AraC 1 г/м2 х 4± бортезомиб)
R-B, R-BAC (после CHOP)
Лучевая терапия (особенно при локальном рецидиве)
4. Реабилитация
Специальных методов реабилитации при ЛМЗ не существует. Реабилитация при возникновении осложнений в течение заболевания и лечения проводится в рамках соответствующих нозологий. Рекомендуется вести здоровый образ жизни, исключить избыточную инсоляцию и тепловые физиопроцедуры.
5. Профилактика и диспансерное наблюдение
Уровень убедительности рекомендаций D (уровень достоверности доказательств – 4).
Комментарии: Методов профилактики ЛМЗ в настоящее время не существует, поскольку неизвестен этиологический факторы, ведущие к развитию заболевания. Диспансерное наблюдение гематологом или онкологом осуществляется в период лечения и после достижения ремиссии лимфомы.
6. Дополнительная информация, влияющая на течение и исход заболевания
6.1 Ошибки и необоснованные назначения
Не рекомендуется выполнение пункции лимфоузла (очага поражения)
Уровень убедительности рекомендаций D (уровень достоверности доказательств – 4).
Комментарии: диагноз лимфомы не может быть установлен по пунктату, без полноценного гистологического и гистохимического исследования
6.2 Лимфомы и беременность
Рекомендуется со всеми больными детородного возраста обоих полов обсуждать вопрос о возможности криоконсервации спермы или ткани яичника перед началом терапии.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
Комментарии: химиотерапия и облучение области таза могут привести к необратимой стерильности пациента
Рекомендуется с женщинами детородного возраста обсуждать вопрос о необходимости гормональной защиты от беременности, а также о методах возможной гормональной защиты яичников при проведении интенсивных программ лечения.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++).
6.3 Прогноз
Прогноз определяется в соответствии со шкалой MIPI. Прогноз также напрямую зависит от полноценной и своевременной диагностики, и применения адекватной тактики лечения.
Критерии оценки качества медицинской помощи
Критерии качества
Оценка выполнения
Уровень достоверности доказательств
Уровень убедительности рекомендаций
Выполнена биопсия лимфоузла (очага поражения) с цитологическим, морфологическим, иммуногистохимическим иследованиями
Выполнен клинический анализ крови (гемоглобин, эритроциты, тромбоциты, лейкоциты, лейкоцитарная формула)
Выполнен Биохимический анализ крови (общий белок, альбумин, мочевина, креатинин, мочевая кислота, АЛТ, АСТ, общий и прямой билирубин, холестерин, ЛДГ, щелочная фосфатаза, электролиты, кальций)
Выполнено КТ/УЗИ/МРТ грудной полости, брюшной полости, малого таза, дополнительных очагов поражения
Выполнена трепанобиопсия с гистологическим исследованием костного мозга