меднение металла зачем нужно
Меднение
Свойства и область применения медных покрытий
Медные покрытия не рекомендуются для защиты железа и стали от коррозии. Омедненные изделия могут быть защищены от атмосферной коррозии лишь! в том случае, когда медные покрытия совершенно свободны от пор даже микроскопических размеров. При наличии пор изделия не только не будут защищены от коррозии, но, напротив, в присутствии корродирующего агента, между железом и медью начнет работать коротко замкнутый гальванический элемент, в котором железо будет играть роль анода и его коррозия будет протекать более интенсивно, чем неомедненного железа.
Медные покрытия не могут также рассматриваться как защитно-декоративные. Хотя химическая стойкость меди больше, чем железа, но в наружной атмосфере с небольшой относительной влажностью медные покрытия тускнеют в результате окисления, которое протекает по параболическому закону. При повышенной влажности в порах медных покрытий происходит ржавление стали (анода). На беспористых медных покрытиях в наружной атмосфере с повышенной влажностью постепенно образуется зеленая патина, которая, по некоторым данным, представляет собой основной сульфат меди CuSO43Cu(OH)2; на морском побережье может образоваться основной хлорид меди. Устойчивость патины в различной атмосфере, по-видимому, объясняется образованием закиси меди. При анодном окислении в соответствующих электролитах можно искусственно получать патину.
Довольно широко распространен процесс меднения участков стальных деталей, подлежащих обработке резанием после термической обработки — цементации. Стальные детали иногда подвергают меднению с последующим химическим или электрохимическим окрашиванием в различные цвета. Однако наиболее широко медные покрытия используют в качестве промежуточных слоев при защитно-декоративном хромировании стальных и цинковых деталей. Широкое применение электролитических осадков меди в качестве промежуточных слоев при нанесении различных гальванических покрытий в известной мере определяется хорошим сцеплением электроосажденной меди с различными металлами. В отличие от горячих методов нанесения металлических покрытий, при которых между основным металлом и покрытием образуется промежуточный диффузионный слой, при электролитическом осаждении меди на сталь не удается обнаружить промежуточный диффузионный слой. Решающую роль для обеспечения прочного сцепления в данном случае играет тщательная подготовка поверхности основного металла — обезжиривание и травление, причем в случае химического или электрохимического удаления деформированного слоя часто наблюдается продолжение структуры основного металла в электроосажденном металле. Прочность сцепления между основным металлом и покрытием при этом приближается по величине к прочности связи между отдельными атомами в твердом металле.
Продолжение микроструктуры основного металла в электролитическом осадке, по-видимому, обеспечивается в тех случаях, когда основной металл имеет относительно крупнокристаллическую структуру и электролиз протекает при условиях, соответствующих образованию кристаллов примерно таких же размеров. При включении посторонних ионов, атомов или молекул осадки получаются мелкокристаллическими и продолжения структуры основного металла не наблюдается (рис. 82).
Рис. 82. Продолжение структуры основного металла электроосажденной меди (снизу вверх): серебра (а), никеля (б) (нет продолжения), в — катаной меди
При защитно-декоративном хромировании стальных и цинковых деталей роль медного слоя сводится к максимальной экономии стратегического никеля при сохранении защитных свойств суммарных покрытий (Cu+Ni+Cr) и снижению трудоемкости операций механической подготовки поверхности стальных деталей.
Как известно, медь значительно пластичнее стали и в процессе ее полировки удается получать гладкую, блестящую поверхность, на которую легко наносить блестящие никелевые покрытия. Здесь необходимо оговорить, что в последнее время достигнуты большие успехи в получении блестящих покрытий, не требующих полировки, но эта задача решена еще не полностью. При нанесении относительно тонких слоев из цианистых или пирофосфатных электролитов на стальные или цинковые детали удается получать блестящие или полублестящие медные покрытия, поверх которых после промывки можно наносить блестящие никелевые покрытия.
Процесс меднения стали – гальваническая мастерская на дому
Чтобы изменить внешний вид какого-либо предмета или улучшить его физические свойства, этот предмет особым способом покрывают тонким слоем меди, хрома, серебра. Иногда это делают для улучшения токопроводящих свойств металла (например, меднение стали), иногда для имитации старины какого-либо предмета (например, статуэтки), иногда просто для придания изделию более эстетического вида.
Меднение материалов и его применение в быту
Меднением называют покрытие поверхности какого-либо изделия тончайшим слоем меди. Слой этот может быть толщиной от одного до 300 или более микрометров. В быту этот процесс используется в самых различных обстоятельствах. Меднение в домашних условиях придаст изделию «старинный» вид, превратит стальную полосу в отличный проводник, подготовит предмет к нанесению другого покрытия.
Разновидности процессов меднения
Покрытие поверхностей слоем меди – процесс, который может выполняться не только на промышленных установках, но и в домашней мастерской. Меднение металла в домашних условиях может быть выполнено на самом высоком уровне. Нужно только изучить основные особенности технологии и соблюдать технику безопасности. Существует две технологии меднения поверхности предметов.
Первая технология – «погружная», с применением электролитного раствора. По этой технологии обрабатываемая деталь погружается в электролит между двумя медными электродами. После этого на электроды и на заготовку подается напряжение. Через некоторое время деталь покрывается тонким слоем меди. Чем дольше будет выдерживаться изделие под напряжением, тем толще будет медный слой на ее поверхности.
Вторая технология – без погружения обрабатываемого предмета в электролит. Этот технологический процесс более сложный, чем меднение стали или любого другого металла погружным способом, но, тем не менее, дает отличное качество покрытия поверхности медной пленкой.
Особенности процесса меднения стали в домашних условиях
Чтобы производить меднение в домашних условиях, необходимо выполнить ряд требований, вытекающих из самого технологического процесса, поскольку погружной метод подразумевает использование электролита. Раствор этот едкий, подвержен испарению, а так как во время работы он будет еще и нагреваться, то испарения будут интенсивными. Для проведения гальваники в домашних условиях следует позаботиться о защитных средствах и хорошей вентиляции.
Гальваническое покрытие медью в домашних условиях, несмотря на достаточно примитивное оборудование, дает, тем не менее, отличные результаты. Из всех металлов сталь обеспечивает наиболее прочное соединение с медной пленкой, поэтому именно при меднении стали получаются прекрасные прочные проводники тока. Покрытие стального изделия медной пленкой придаст предмету более привлекательный вид.
Меднение стали с погружением в электролит
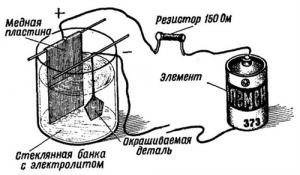
Прежде чем начать процесс меднения, следует подготовить домашнее помещение, рабочее место, необходимые материалы и средства индивидуальной защиты для проведения этих работ. После этого следует подготовить заготовку. С ее поверхности тонким наждаком и мелкой металлической щеткой должна быть удалена окисная пленка. После удаления пленки деталь промывается, обезжиривается в теплой мыльной воде и еще раз промывается чистой водой под сильным напором.
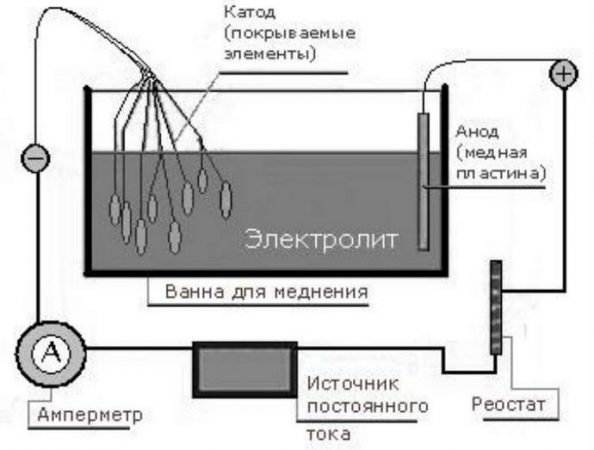
В емкость (желательно стеклянную) помещаются две медные пластины, электрически соединенные между собой. Эти пластины являются анодами, и подключаются проводником к плюсу источника тока. К минусу источника подключается проводник, соединенный с обрабатываемой заготовкой, которая является катодом в этой цепи. В цепь анода включается реостат для регулировки силы тока и амперметр для контроля.
В емкость заливается подготовленный раствор электролита, в состав которого входят медный купорос, дистиллированная вода и кислота. Раствор заливается в количестве, достаточном для того, чтобы полностью покрыть электроды и обрабатываемую деталь. На схему подается напряжение, реостатом устанавливается ток из расчета 15 мА на один квадратный сантиметр площади детали.
Через полчаса напряжение снимается, покрытая медью деталь извлекается из раствора, освобождается от проводника, тщательно промывается, обсушивается. Процесс завершен. Необходимое замечание: все операции следует проводить в респираторе, в резиновых перчатках и при включенной вентиляции.
Приготовление раствора для домашнего меднения
Для выполнения гальваники в домашних условиях, кроме электрического оборудования (источник постоянного тока, реостат, амперметр), необходимо приготовить раствор электролита, в котором будет проходить процесс. Для приготовления такого раствора понадобятся:
В зависимости от требуемого количества электролита готовится раствор в пропорции на 100 миллилитров дистиллированной воды:
Для получения большего количества раствора количество ингредиентов пропорционально увеличивается.
Необходимые оборудование, инструменты, средства защиты
Для меднения в домашних условиях необходимо подготовить соответствующее оборудование, инструменты, средства индивидуальной защиты. В состав оборудования входит, прежде всего, источник постоянного тока. Таким источником могут быть батарейки КБС с напряжением в 4.5 вольта или девятивольтовые батарейки «Крона». Следует учитывать, что при меднении деталей с большой площадью поверхности мощности этих батареек может не хватить.
В таком случае нужно задействовать несколько таких батареек. Можно использовать автомобильный аккумулятор или небольшой выпрямитель с напряжением в 12 вольт. Также понадобится небольшой реостат или мощный силовой переменный резистор. Из приборов понадобится амперметр или обычный тестер. Понадобится также вентилятор для вытяжки.
Из инструментов понадобятся наждак, пассатижи, зажимы типа «крокодил» с подпаянными проводниками для захвата анодов и обрабатываемой детали, мелкая металлическая щетка.
Непосредственно для меднения должна быть подготовлена емкость из нейтрального материала, не вступающего в реакцию с раствором. Должна быть также подготовлена емкость для приготовления раствора.
Из средств индивидуальной защиты следует приготовить резиновые перчатки, респиратор и нейтральные очки.
Процесс меднения без применения раствора
Домашнее меднение стали можно произвести, не погружая деталь в раствор электролита, хотя небольшое количество раствора все-таки понадобится. Этот способ эффективен не только для стали, но и для изделий, изготовленных из других металлов. Подготовка к меднению и сам процесс происходят следующим образом.
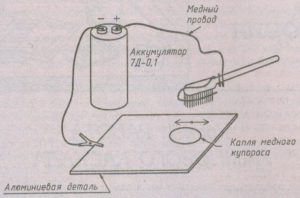
Обрабатываемая деталь очищается от окисной пленки, обезжиривается, к ней зажимом «крокодил» подсоединяется проводник, соединенный с минусом источника тока.
Медный провод диаметром в полтора миллиметра зачищается от изоляции и продевается в щетину зубной щетки так, чтобы он находился внутри щетины. Второй конец подключается к плюсовой клемме источника тока. Включается ток, щетка смачивается в растворе, после чего щеткой водят по поверхности обрабатываемого изделия.
Периодически щетку снова смачивают в растворе. Операцию проводят до тех пор, пока предмет полностью не покроется медью.
Видео по теме: Гальваническое меднение стали. промышленный способ в домашних условиях
Простой способ покрыть металл медью для декорирования и защиты от коррозии
Меднение — один из популярных способов изменения физических свойств металлов. Например, после покрытия стали слоем меди основа улучшает токопроводящие качества, а также обретает более привлекательный, декоративный вид. Чтобы покрыть сталь медью самостоятельно и без лишних затрат, можно воспользоваться недорогими средствами с применением простейших методик.
Зачем проводится меднение металлов
Меднением называют нанесение на разные материалы и изделия тончайшего слоя меди. Обычно толщина этого слоя составляет 1-300 мкм. Именно медь обладает рядом свойств, которые делают ее пригодной для данной манипуляции. Она пластична, отлично поддается полировке. Гальванический пласт на стали после выполнения меднения почти не имеет пор.
Кроме того, медь характеризуется высокой электропроводностью и легко паяется. При использовании высокочастотных сигналов наибольшая плотность тока приходится на медный слой (скин-эффект), а общее сопротивление снижается.
Области применения технологии меднения обширны:
Новые свойства стали после меднения
Выполнение меднения повышает коррозионную стойкость стали и усиливает ее прочность. Особенно надежным будет многослойное покрытие, которое также включает прослойки хрома или никеля поверх меди. Если меднение произвести первым, то вся поверхность будет пластичной и несклонной к истиранию. Нельзя не отметить и улучшенные декоративные свойства изделий после меднения — они обретают красивый блеск и вид «под старину».

Медь надежно сцепливается со стальной поверхностью, но без проведения дополнительных защитных мер не удерживается надолго. Разрушение медного слоя происходит под влиянием температурных перепадов, атмосферных факторов. Снизить риск растрескивания поможет нанесение на изделие специального лака.
Основные методики меднения
Покрытие медью может осуществляться двумя способами — химическим и гальваническим. Для работы проще всего применять медный купорос, причем он подходит для выполнения обеих методик. В первом случае медь из купороса будет осаждаться на стальном изделии в ходе химической реакции, а во втором — под действием электрического тока.
В растворе электролитов
Гальваническая методика предполагает погружение в раствор электролитов, потому не подходит для габаритных предметов. Частицы меди во время процесса отсоединяются от анода и перемещаются к катоду. В результате действия электроэнергии меднение происходит довольно быстро. Заранее нужно правильно подготовить стальную поверхность — очистить и обезжирить ее.

Без раствора электролитов
Основой химического меднения является движение медных частиц вследствие разницы в электроотрицательности со сталью. Готовое покрытие будет иметь меньшую толщину, нежели при гальванической методике, зато наносится проще, без лишних затрат. Кроме того, методика подходит и для обработки пластика, керамики, стекла.
Для работы нужно положить предмет в раствор купороса или нанести его на поверхность кисточкой. Медь «прилипает» к стали даже при условии некачественной подготовки основания, хотя результат будет не столь долговечным.
Меднение своими руками
Основной реагент — медный купорос (сернокислая медь 97-98%) — реализуется во всех хозяйственных магазинах. Важно, чтобы процентное содержание основного вещества было не ниже указанного, потому медный купорос из садово-огородных отделов может не подойти для меднения. Водопроводная вода для этой цели также не годится из-за присутствия соединений хлора. Придется подготовить кипяченую или дистиллированную воду. В роли емкости для раствора используют любую удобную тару из стекла или пластика. Источником тока послужит телефонная зарядка, 2 батарейки или иной источник питания на 6-8 В. Также надо приготовить:
Вначале готовят раствор из 150 мл воды с температурой около +40 градусов и 100 г медного купороса. Состав тщательно перемешивают до растворения кристаллов, вводят в него 50 мл спирта. Отдельно отмеряют 250 мл серной кислоты и разбавляют водой в пропорции 60:40. Обе составляющие электролитного раствора соединяют в одной емкости. Действуют предельно осторожно, чтобы не получить ожог. Для этой цели неподалеку должна быть сода: ее сразу посыпают на поврежденный участок кожи, если туда попал раствор.
Отдельно готовят две промывочные емкости, в каждую из которых вливают по литру чистой воды, причем в одной из них также разводят 2 ложки соды, а во второй — 2 ложки порошкового моющего средства. После предпринимают следующее:
Чтобы усилить сияние меди, в электролитный состав можно добавить блескообразующие компоненты — декстрин, желатин в количестве 1 г/л. Со временем медный слой может позеленеть, поэтому целесообразно сразу покрыть его защитным лаком.
Техника безопасности
Медный купорос не является сильнодействующим и опасным для здоровья веществом, но при касании кожи может вызвать аллергическую реакцию. Зато довольно опасна в работе серная кислота, поэтому трудиться нужно только с применением средств индивидуальной защиты — перчаток, респиратора, очков.
В окончание работы нейтрализуют раствор содой, а потом утилизируют его. При соблюдении указанных мер процесс проходит быстро, без особых трудностей и с получением отличного результата.
Меднение металла | Технология и механизм гальванического процесса | Структура и свойства меди в покрытии.
Содержание:
1. Что такое меднение? Назначение и обозначение медного покрытия.
Медные покрытия широко применяются в основном в качестве подслоя при нанесении многослойных покрытий, а также для улучшения пайки, создания электропроводных слоёв, уплотнения резьбовых соединений, местной защиты стальных деталей при цементации. В редких случаях используются для придания декоративного внешнего вида.
Стандартный потенциал меди по отношению к ее одновалентным нонам +0,52 В, двухвалентным ионам +0,34 В.
В жестких условиях эксплуатации медь и ее сплавы не должны контактировать с хромом, оловом, сталями, цинком, кадмием, алюминием и магнием.
6-100мкм (оптимально, но возможно осадить большую толщину)
590-1470 МПа (60-150 кгс/мм 2 )
Удельное электрическое сопротивление при 18 о C
Допустимая рабочая температура
2. Кинетика процесса гальванического меднения.
Для электролитического осаждения меди разработано большое количество электролитов, которые, обычно, разделяют на две группы: кислые и щелочные. Существуют как простейшие, так и достаточно сложные композиции для меднения.
Катодные поляризационные кривые для некоторых из них приведены на рисунке 1.
2.1 Процессы в кислых электролитах меднения.
Из кислых электролитов наиболее распространен сульфатный электролит. Основными компонентами сульфатных электролитов являются сульфат меди и серная кислота. Электропроводность нейтральных растворов сульфата меди невелика, поэтому в них добавляют серную кислоту, которая значительно повышает электропроводность растворов температуры перемешивания.
Предполагается, что на катоде разряд двухвалентных ионов меди протекает в две стадии:
Выход меди по току около 100 %, так как выделения водорода на катоде не происходит, поскольку потенциалы выделения меди имеют более положительные значения, чем потенциалы выделения водорода.
Вблизи анодов наряду с ионами Cu 2+ в растворе могут находиться в незначительном количестве ионы одновалентной меди, образующиеся в результате протекания реакции:
При накоплении в растворе ионов Cu + равновесие будет сдвигаться влево, и металлическая медь будет выпадать в виде осадка.
При недостаточной кислотности раствора сульфат одновалентной меди будет гидролизоваться с образованием Сu(ОН)2 или СuО2
Присутствие серной кислоты способствует протеканию реакций окисления одновалентной меди:
Таким образом, серная кислота прежде всего нужна для предупреждения накопления ионов Cu + и гидролиза ее солей.
В сульфатные электролиты меднения иногда вводят поверхностно-активные вещества. Эти вещества вводят для повышения катодной поляризации, что способствует получению более мелкозернистых плотных, иногда блестящих, осадков. Благоприятное действие этих добавок сказывается в том, что они предупреждают образование наростов на краях и выступающих частях деталей. Наилучшими добавками являются декстрин (не более 1 г/л) и фенол или его сульфосоединения (1-10 г/л).
Для получения блестящих медных покрытий предложено большое количество блескообразующих добавок, обеспечивающих зеркальный блеск покрытий, придающих им пластичность и снижающих внутренние напряжения.
При работе с электролитами для получения блестящих медных покрытий особое внимание следует уделять анодам. Анодный процесс растворения меди достаточно сложен и подробно описан в статье.
Взвешенные частицы шлама обычно являются причиной грубого шероховатого осадка. Вообще, медное покрытие особенно склонно к дендритообразованию при меднении с нарушением технологического процесса, к которому относится и присутствие шлама в растворе. Частички шлама становятся при этом центрами кристаллизации и ток, вместо того, чтобы идти на зарождение новых зерен меди, расходуется на обрастание и разрастание этих частиц. Дендриты могут появляться и по другим причинам, одной из которых также является превышение допустимой плотности тока на выступающих частях деталей. Примеры дендритов на медном покрытии приведены на рисунке 2. Пример дендрита на циллиндрическом катоде и поперечный рез такого дендрита приведены на рисунке 3.
Вредными примесями в медных сульфатных электролитах являются мышьяк, сурьма, некоторые органические вещества, образующие коллоидные растворы, анодный шлам.
Кроме сульфатных, используют фторборатные электролиты. Эти электролиты обладают высокой устойчивостью; получающиеся покрытия плотные и мелкокристаллические, рассеивающая способность электролитов примерно такая же, как у сульфатных. Большая растворимость фторбората меди позволяет применять повышенные плотности тока. Из этих электролитов меднить стальные детали напрямую нельзя; необходим подслой никеля или меди из цианидных электролитов.
2.2 Процессы в щелочных электролитах меднения.
К щелочным электролитам относятся цианидные, пирофосфатные и этилендиаминовые электролиты. Основные достоинства: высокая рассеивающая способность, получение мелкокристаллических осадков, возможность непосредственно меднить стальные детали.
2.2.1 Цианистое меднение.
Довольно распространены цианидные электролиты. Условия осаждения меди из цианидных электролитов существенно отличаются от условий осаждения в кислых электролитах.
В цианидных электролитах медь находится в составе комплексных ионов, степень диссоциации, а, следовательно, и активность ионов меди очень мала. Поэтому потенциал выделения меди в них примерно на 0,9-1,2 В отрицательнее, чем в сульфатных растворах.
Содержание меди в электролите во время работы обычно уменьшается вследствие недостаточной растворимости анодов. Снижение концентрации ионов меди в электролитах приводит к образованию пористых осадков. Кроме того, работая с малоконцентрированными медными электролитами, можно применять только пониженные плотности тока.
Постоянным компонентом цианидных электролитов является карбонат. Он накапливается в результате окисления цианида кислородом воздуха, особенно при нагревании:
Введение в электролит депассиваторов, в качестве которых применяют сегнетову соль KNaC4H4O6•4H2O и роданид калия KCNS, позволяет повысить рабочую плотность тока и устранить пассивацию анодов, но при этом следует одновременно повышать температуру электролита.
Высококонцентрированные по меди электролиты, содержащие депассиваторы, позволяют применять высокие плотности тока (до 10 А/дм 2 ) при повышенной температуре и перемешивании. При этом возможно получить выход по току, близкий к 100 %.
Для замены ядовитых цианидных электролитов применяют пирофосфатные и этилендиаминовые электролиты.
2.2.2 Пирофосфатное меднение.
Из пирофосфатных электролитов получают медные осадки с мелкозернистой структурой. При нанесении тонких слоев осадки получаются гладкими, блестящими или полублестящими. Преимущества пирофосфатных электролитов перед кислыми заключаются в высокой рассеивающей способности и возможности непосредственно проводить меднение стальных деталей в разбавленном пирофосфатном электролите.
В пирофосфатные электролиты вводят NH4NO3, который способствует повышению допустимой катодной и анодной плотностей тока и улучшает качество осадков. Из пирофосфатных электролитов можно получать блестящие осадки. В качестве блескообразующих добавок вводят Na2SeO3 совместно с лимонной или триоксиглутаровой кислотой, 2-меркаптотиазол и другие вещества.
При повышенных плотностях тока может происходить пассивация анодов за счет образования на их поверхности труднорастворимой оксидной или солевой пленки.
Катодный потенциал меди в пирофосфатных электролитах имеет более отрицательное значение, чем в кислых. Большая катодная поляризация объясняется пассивированием поверхности катода вследствие адсорбции ионов Р2О7 4- или образования оксидных (Сu2О8) и труднорастворимых соединений (Сu2Р2О7) в виде фазовой пленки.
Предполагают, что выделение меди на катоде из пирофосфатных растворов происходит в результате восстановления двухзарядных комплексов:
образующихся при диссоциации шестизарядных комплексов:
С повышением температуры ускоряется выделение меди, что связано как с ускорением диффузии комплексных анионов к катоду, так и с облегчением их разряда.
Структура осадков меди из пирофосфатного электролита более мелкая, по сравнению с сернокислымирастворами, с ростом плотности тока она укрупняется (рисунок 4)
Для предотвращения пассивации анодов должно быть достаточное количество свободных анионов Р2О7 4- и достаточно высокое рН раствора. Повышение температуры способствует отводу продуктов реакции и, следовательно, уменьшению пассивации анодов. Для этой же цели в электролиты вводят депассиваторы, которые способствуют снижению активности ионов Cu 2+ в прианодном слое.
Особенностью этилендиаминовых электролитов меднения является возможность непосредственного меднения стальных деталей. Детали в ванну загружают под током плотностью в 3-5 раз превышающей рабочую.