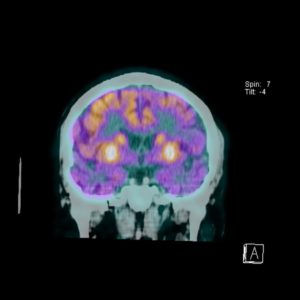
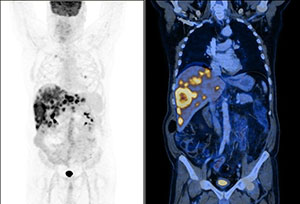
метаболическая активность рфп что это такое
Метаболическая активность рфп что это такое

Что такое ПЭТ/КТ?
Компьютерная томография (КТ) позволяет точно позиционировать выявленные при ПЭТ патологические очаги в организме.
ПЭТ с 18F-фтордезоксиглюкозой (ФДГ)
18F-фтордезоксиглюкоза (18F-ФДГ-18F-2-фтор-2дезокси-D-глюкоза), широко используется в клинических целях как РФП для ПЭТ. 95% всех ПЭТ-исследований проводятся именно с этим РФП.
18F-ФДГ с химической точки зрения является аналогом природной глюкозы и позволяет оценивать гликолитическую активность тканей. При внутривенном введении 18F-ФДГ интенсивно накапливается в органах и тканях, в которых активно протекает процесс гликолиза (головной мозг, миокард, желудок и кишка, печень, мышцы).
Принцип применения 18F-ФДГ в детской онкологии основывается на разнице дифференциальных скоростей метаболизма глюкозы в доброкачественных и злокачественных тканях. Известно, что интенсивность накопления 18F-ФДГ может быть связана с размером опухоли и может значительно варьироваться при различных типах злокачественных опухолей.
Многие злокачественные опухоли характеризуются повышенным метаболизмом глюкозы и, следовательно, применение ПЭТ с 18F-ФДГ у них имеет высокую диагностическую эффективность. Интенсивность накопления 18F-ФДГ в различных злокачественных опухолях отображает их биологическую агрессивность.
В процессе противоопухолевого лечения объем жизнеспособных злокачественных клеток значительно сокращается и, следовательно, количественная оценка изменений накопления 18F-ФДГ в опухолях позволяет использовать этот РФП в качестве чувствительного маркера эффективности противоопухолевой терапии.
Подготовка к исследованию
Если у ребёнка сахарный диабет, это должен учесть лечащий врач, назначающий ПЭТ/КТ. Исследование возможно выполнять при уровне глюкозы в крови непосредственно перед исследованием не более 8,0 ммоль/л.
Необходимо рассказать докторам отделения ПЭТ/КТ о лекарственных препаратах, которые принимает ребёнок. В случае необходимости кратковременной их отмены перед исследованием, нужно обсудить это с лечащим врачом.
Противопоказанием могут служить аллергические реакции на препараты йода или обезболивающие средства. Необходимо максимально сократить физические нагрузки ребёнка за 1-2 дня до исследования. Накануне перед исследованием ребёнку разрешается легкий ужин без продуктов, содержащих в больших количествах углеводы (кондитерские и мучные изделия, фрукты). После ужина можно пить только теплую воду без сахара и газа.
Исследование проводится строго натощак, необходимо выпить теплую воду без сахара и газа в количестве 150-500 мл.
В холодное время года необходимо, чтобы на ребёнке была надета теплая одежда – это позволит минимизировать возможность накопления РФП в буром жире. Исследование занимает от двух до трех часов. Маленьким детям его проводят под наркозом.
ПЭТ с фторэтилтирозином
Опухолевые клетки активно делятся, для этого процесса необходим синтез белка из аминокислот. Для жизнедеятельности большинства опухолевых клеток характерно повышение интенсивности транспорта аминокислот из внеклеточного пространства в клетку и обратно.
18F-ФЭТ отражает уровень активности транспорта аминокислот в клетке и имеет высокую диагностическую точность в определении объема опухолевого поражения и достоверной оценке границ образования при планировании как хирургического, так и лучевого лечения.
Транспортировка тирозина и 18F-ФЭТ в организме происходит посредством L-аминокислотных транспортеров. Слабое физиологическое накопление РФП в неизмененном веществе головного мозга значительно повышает чувствительность в выявлении образований. Длительный период полураспада позволяет проводить динамические или многоэтапные исследования.
Показания к ПЭТ/КТ исследованию с 18F-ФЭТ
Исследование проводится строго натощак. Пить воду можно (несладкую, негазированную). Необходимо исключить продукты, богатые тирозином – орехи, бобовые, пряности, включая травы, за одну неделю до исследования.
ПЭТ с холином
Исследование с 18F-фторметилхолином (18F-Fch). Этот препарат применяется прежде всего для диагностики опухолей головного мозга, опухолей печени, а именно ГЦР.
Если у ребёнка есть какие-либо аллергические реакции на препараты йода или обезболивающие средства, родители должны сообщить об этом врачам.
Что показывает ПЭТ КТ
В этой статье коротко коснемся нормы и патологий, которые показывает метод ПЭТ КТ. Пройдемся по распространенным формулировкам, которые радиологи употребляют в заключениях по снимкам, и дадим трактовку.
Об информативности метода в общих чертах
В общих чертах, кроме нормы исследование ПЭТ КТ показывает качество клеток, очаг распространения “плохих” клеток, реакцию “плохих” клеток на лечение, замедление обменных процессов на клеточном уровне.
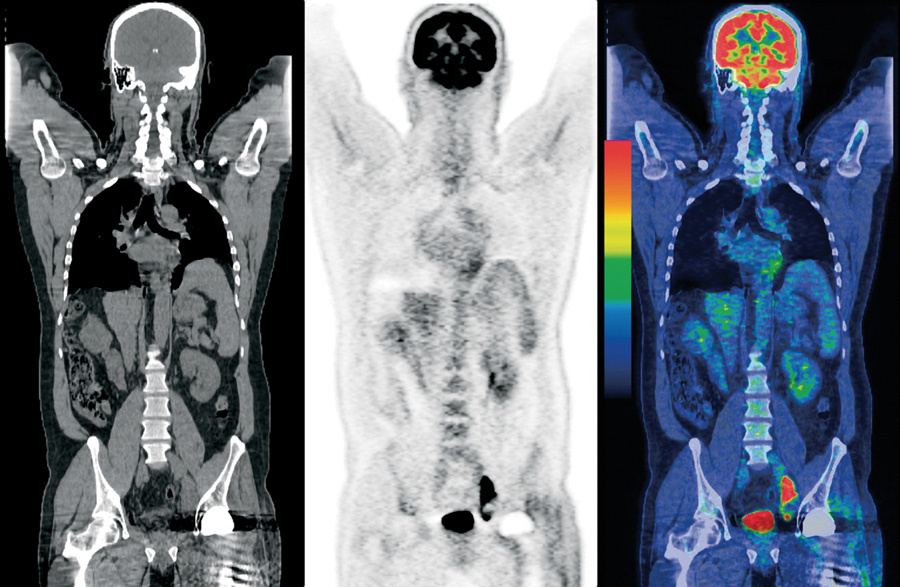
Рис. 1: Пример снимка ПЭТ КТ
Что и как выявляет ПЭТ КТ, и какие заболевания диагностируют этим методом исследования, разбираем далее.
Метаболизм клеток как индикатор
Что означает физиологическое накопление РФП
Некоторые ткани нашего организма в норме поглощают больше глюкозы. К таким относится головной мозг, скелетная мускулатура, миокард, желудочно-кишечный тракт, почки. Кроме этого, так называемая гиперфиксация наблюдается в местах скопления жировой ткани, в особенности, бурого жира.
То есть, под физиологической гиперфиксацией РФП понимают норму.
Естественное накопление препарата несколько отличается от патологического. Распределение РФП в этом случае мягкое диффузное. В норме снимки не содержат ярких вкраплений и угасаний. Препарат распределяется равномерно.
Что показывает метод
Рис 3: Гибернация миокарда на ПЭТ КТ (участки выделены синим)
Опухоли нервной системы визуализируются на ПЭТ КТ по принципу других опухолей, то есть, в форме повышенного накопления препарата.
Кроме гибернации миокарда посредством ПЭТ КТ диагностируют формы ишемической болезни сердца, не требующие неотложного вмешательства. То есть, выявляют заболевание на ранней стадии развития, неопасной для жизни пациента.
Что показывает ПЭТ КТ всего тела при онкологии
Опухолевые клетки характеризуются склонностью к бесконтрольному быстрому делению и росту. Эти процессы требуют постоянного поступления питательных веществ, в том числе, глюкозы, что позволяет увидеть на ПЭТ КТ малейшие очаги патологии. Если другие визуализационные методы малоэффективно отражают морфологические изменения и степень активности процесса, особенно при малых размерах опухолей; то ПЭТ КТ позволяет диагностировать рак на сверхранних стадиях, когда никак иначе болезнь обнаружить нельзя.
Рис. 4: Метастазы в печени на ПЭТ КТ
На снимке Рис. 4 видны метастазы опухоли в печень. Обратите внимание, что на изображении визуализируются даже небольшие по размерам узлы, расположенные на периферии.
Еще одно специфическое свойство ПЭТ КТ в онкологии – это дифференцировка между лучевым некрозом окружающей опухоль ткани и прогрессированием опухоли. На КТ разница заметна не всегда. На ПЭТ КТ некроз выглядит, как снижение накопления РФП, тогда как ткани прогрессирующей опухоли выражаются в виде увеличенной площади накопления. Эта разница в отображении помогает доктору сделать правильный вывод.
Распространенные формулировки в заключении
ПЭТ КТ, как другие виды исследования, описывают по протоколу. То есть, по установленному порядку описания отделов и органов. Заключение в зависимости от области исследования содержит разные формулировки, но существуют устоявшиеся определения и показатели, которые встречаются чаще остальных и применяются ко всем отделам тела.
Разберем основные формулировки из заключений ПЭТ КТ, которые часто вызывают вопросы на практике у наших пациентов.
Что такое suv max при ПЭТ КТ
Suv расшифровывается, как Standardized Uptake Value, что в переводе на русский язык означает “стандартизированный уровень захвата”. Показатель отражает интенсивность накопления РФП и рассчитывается для каждого конкретного участка автоматически программой аппарата ПЭТ. Единица измерения Suv зависит от модели томографа.
Показатель характерен только для метода ПЭТ КТ, Suv max не имеет строго установленной нормы. Его величина важна, главным образом, в исследовании динамики.
Значение Suv max при ПЭТ КТ в онкологии обозначает метаболический ответ опухоли на проведенное лечение. Что это значит? Показатель отражает то, как реагируют злокачественные клетки на лучевую или химиотерапию. Поэтому в заключении ПЭТ КТ степень накопления РФП в виде значения Suv max несет важнейшее значение для лечащего врача.
Различают несколько вариантов метаболического ответа патологического очага.
При положительной динамике наблюдается (уменьшение накопления препарата на 25% и более) или (повышенное накопление отсутствует).
В отрицательной динамике различают (РФП накапливается на 25% больше, или диагностированы новые очаги патологии) и (изменения показателя менее 25%, расцениваются как недостоверные данные).
Метаболическая активность на ПЭТ КТ: что это такое
Еще одна формулировка, которая часто употребляется в заключении радиологов при диагнозе “онкология” и вызывает вопросы пациентов.
Роль позитронно-эмиссионной томографии с 18F-ФДГ в комплексном обследовании пациентов методами лучевой диагностики: достоинства и недостатки
Внедрение в России в клиническую практику позитронно-эмиссионной томографии сопровождалось дискуссиями об актуальности новой методики. До сих пор в научных кругах звучат крайние суждения о ПЭТ как о диагностической панацее с одной стороны, так и о ее крайне низкой целесообразности с другой. Основной причиной разночтений, по нашему мнению, является самостоятельное, оторванное от других методов медицинской визуализации, развитие в России радиоизотопной диагностики в целом и ПЭТ в частности.
Внедрение в России в клиническую практику позитронно-эмиссионной томографии (ПЭТ) сопровождалось дискуссиями об актуальности новой методики. До сих пор в научных кругах звучат крайние суждения о ПЭТ как о диагностической панацее с одной стороны, так и о ее крайне низкой целесообразности с другой.
Основной причиной разночтений, по нашему мнению, является самостоятельное, оторванное от других методов медицинской визуализации, развитие в России радиоизотопной диагностики в целом и ПЭТ в частности.
В федеральном государственном бюджетном учреждении «Клиническая больница №1» Управления делами Президента Российской Федерации (Волынская больница ) два ПЭТ томографа ECAT EXACT 47 фирмы Siemens были инсталлированы в 2001 г.
Таким образом, Волынская больница первой в системе Главного медицинского управления внедрила методику позитронно-эмиссионной томографии и имеет максимальный опыт ее применения.
Все эти годы лаборатория радиоизотопной диагностики и позитронно-эмиссионной томографии функционировала в составе единого отделения лучевой диагностики. Основной идеологией работы отделения является принцип полимодальности. Врач лучевой диагностики на рабочих станциях изучает изображения, полученные при всех ранее проведенных методах медицинской визуализации. Результатом такого подхода являются наиболее достоверные диагностические заключения. Ежедневно в отделении проводится коллегиальное обсуждение результатов с участием рентгенологов, врачей ультразвуковой диагностики, компьютерной и магнитно-резонансной томографии, что дает объективность и преемственность диагностического процесса, расширяет кругозор врачей.
За время работы лаборатории нами было обследовано 3746 пациентов. Из них 85% составили онкологические, 10% неврологические и 5% кардиологические. Такое распределение пациентов соответствует литературным данным, обобщающим опыт работы на ПЭТ с фторглюкозой в других странах.
Волынская больница стала первым учреждением в стране, которое ввиду отсутствия своего циклотрона, отработало, лицензировало и внедрило в практику сателлитный принцип организации ПЭТ лаборатории.
Ввиду отдаленности от циклотрона ФГБУ «Клиническая больница №1» ограничена в выборе РФП и вынуждена использовать только дезоксиглюкозу, меченую 18F, с периодом полураспада в 110 мин. В конце прошлого века за свою универсальность и диагностическую ценность фтордезоксиглюкоза была названа «Молекулой века».
Многолетний опыт работы лаборатории, ретроспективный анализ полученных данных, сравнение результатов ПЭТ с заключениями других методов лучевой диагностики выявил следующие клинические особенности методики.
Первой из них мы назвали бы кажущуюся и обманчивую простоту диагностического процесса. Это обусловлено недостаточно точной привязкой к морфологическим ориентирам, скудностью семиотических признаков и отсутствием строгих количественных критериев накопления ФДГ в различных образованиях.
Проблемы интерпретации результатов ПЭТ исследований иногда связаны с особенностями физиологического выведения ФДГ через мочевыводящую систему, всегда визуализируется чашечно-лоханочная система как очаги гиперфиксации радиофармпрепарата различной степени выраженности.
У пациента Е. при ПЭТ видны множественные очаги гиперфиксации ФДГ в проекции обеих почек. Оценить заинтересованность почек не представляется возможным. При магнитно-резонансной томографии визуализируются пакеты увеличенных лимфоузлов, интимно прилежащих к почкам, без их поражения. Затруднения также вызывает широкая вариабельность физиологического накопления фторглюкозы. Часто визуализируется различной степени гиперфиксация препарата по ходу желудочно-кишечного тракта, а так же в различных группах скелетных мышц при их напряжении.
Так у пациента К. в проекции толстой кишки определяется протяженная гиперфиксация фторглюкозы. Данные ирригоскопии и колоноскопии позволили исключить наличие пораженных участков.
А у пациента Н. выявлялись очаги гиперфиксации фторглюкозы в шейно-надключичной области, подозрительные на пораженные лимфоузлы. При ультразвуковом исследовании подозрение о поражении лимфоузлов было снято.
В некоторых случаях имеют место ложноотрицательные результаты ПЭТ исследований, связанные с одной стороны с относительно низкой разрешающей способностью ПЭТ томографов и с другой стороны с особенностями метаболизма некоторых опухолей, таких как почечно-клеточная карцинома, рак простаты, карциноид и др., часто не поглощающих ФДГ в избыточных количествах. Так же на оценке результатов исследования сказывается уровень глюкозы в крови. При гипергликемии ухудшается качество получаемого изображения и повышается количество ложноотрицательных результатов.
Как пример, при ультразвуковом исследовании почек у пациента Б. было выявлено кистозно-солидное образование в левой почке, которое после проведения компьютерной томографии с внутривенным болюсным контрастным усилением было расценено как доброкачественное.
При ПЭТ исследовании в проекции выявленного объемного образования захвата фторглюкозы не наблюдалось, что тоже говорило в пользу его доброкачественности.
При операции была выявлена умеренно дифференцированная почечно-клеточная карцинома.
Так же встречаются и ложноположительные результаты, связанные с инфекционными и воспалительными процессами, напряжением мышц, состоянием после лучевой и химиотерапии, послеоперационными изменениями и пр.
Так, у пациентки Д. с резекцией левой молочной железы по поводу рака в анамнезе, при ПЭТ исследовании в проекции базальных отделов правого легкого были выявлены очаги гиперфиксации фторглюкозы, подозрительные на метастатический процесс. При проведении компьютерной томографии предположен диагноз туберкулеза правого легкого, который в последующем подтвердили в специализированном учреждении.
Тем не менее, не смотря на вышеперечисленные особенности и ограничения, позитронно-эмиссионная томография заняла достойное место в комплексном обследовании пациентов, так как является методом функциональным и позволяет изучать биохимические процессы организма на молекулярном уровне в томографическом режиме.
Частным примером такого применения является использование позитронно-эмиссионной томографии в неврологии. У пациента М. по клиническим признакам была заподозрена болезнь Альцгеймера. При магнитно-резонансной томографии головного мозга были выявлены только признаки умеренной энцефалопатии, а при ПЭТ исследовании визуализируется двухстороннее уменьшение накопления фторглюкозы в теменной, височной и лобной долях, что характерно для болезни Альцгеймера.
В кардиологии позитронно-эмиссионная томография тоже заняла свою нишу. В мировой практике ПЭТ уже давно является «золотым стандартом» оценки жизнеспособности миокарда в зонах ишемии, определяя целесообразность кардиохирургического вмешательства.
Так, у пациента с зоной выраженного снижения перфузии в задней части перегородки, с гипокинезом и выраженным стенозом правой коронарной артерии при ПЭТ исследовании выявляется сохранный уровень углеводного метаболизма в этой области, что свидетельствует о наличии жизнеспособного миокарда и целесообразности реваскуляризации, после проведения которой функция миокарда восстановилась, состояние пациента улучшилось.
Но наиболее востребована позитронно-эмиссионная томография в онкологической практике. Своевременная диагностика злокачественных опухолевых процессов является одной и актуальных проблем современной медицины. От полноты и объективности оценки первичной опухоли и вторичных изменений зависит определение стадии опухолевого процесса и выбор адекватной тактики лечения.
В отличие от других методов лучевой диагностики (УЗИ, РКТ, МРТ), являющихся анатомо-топографическими, ПЭТ позволяет оценить биологическую активность опухолевой ткани, динамику ее изменений в процессе лечения, определить регионарное и отдаленное метастазирование в организме за одно исследование.
Принцип регистрации опухолей с использованием ФДГ основан на явлении повышенного гликолиза в злокачественных опухолях, причем скорость потребления глюкозы находится в прямой зависимости от степени злокачественности новообразования. Кроме того, злокачественные опухоли характеризуются относительно низкой активностью фосфотазы и высокой активностью гексокиназы. Образующийся в результате биохимических реакций 18F-ФДГ-6-фосфат не вступает в дальнейшие реакции гликолиза и тем самым формируется «метаболическая ловушка», что приводит к повышенному содержанию 18F-ФДГ-6-фосфата в ткани опухоли и способствует ее выявлению.
Так, у пациента с клиникой поражения печени при УЗИ были выявлены изменения диффузного характера. При компьютерной томографии с внутривенным болюсным контрастным усилением выявлено объемное образование печени без четких данных о его характере, а при позитронно-эмиссионной томографии визуализируется огромное злокачественное образование с метастазами в ворота печени и средостение, что позволило правильно скорректировать тактику ведения пациента.
Исходя из возможностей позитронно-эмиссионной томографии, были сформулированы показания к исследованию:
• оценка распространенности опухолевого процесса (стадирование опухолей).
• поиск первичного очага при выявленных метастазах.
• оценка эффективности лечения.
• выявление рецидивов и продолженного роста новообразований.
• первичный поиск при наличии клинических проявлений
• дифференциальная диагностика злокачественных и доброкачественных образований.
Отвечая на поставленные вопросы, позитронно-эмиссионная томография способствует установке более точного диагноза, изменению стадирования опухолевого процесса в сторону повышения или понижения и тем самым позволяя скорректировать проводимую терапию.
Таким образом, можно смело сказать, что позитронно-эмиссионная томография имеет большое значение в диагностическом процессе, является важным диагностическим инструментом и чрезвычайно перспективным методом визуализации злокачественных опухолевых образований.
Зубанов А.Г., Радкевич Л.А., Родченко З.П., Зайцева А.Ю.
Статья добавлена 11 марта 2015 г.
Метаболическая активность рфп что это такое
Исследование «всего тела» заключается в сканировании пациента от макушки до кончиков пальцев ног.
Вопрос №2. Что такое радиофармпрепарат?
Радиофармпрепарат (РФП) – это соединение, состоящее из специального вещества и радионуклида (изотопа, радионуклидной метки). Специальное вещество отвечает за то, в каком органе накопится РФП, а радионуклидная метка позволяет врачу-диагносту увидеть это накопление на изображении.
В настоящее время в основном используются соединения меченые 99m Tc (технеций-99), а также 123 I (йод-123).
Вопрос №3. Что такое физиологическое накопление РФП?
Физиологическое накопление (гиперфиксация) РФП – это повышенное накопление РФП, определяющееся в различных органах и системах в норме.
Например, большинство РФП выводятся почками, поэтому самое частое физиологическое накопление РФП определяется в мочевом пузыре.
Вопрос №4. Что такое патологическое накопление радиофармпрепарата (РФП)?
Повышенное накопление РФП в очаге по отношению к здоровым тканям, противоположной области (например, в ребре с противоположной стороны, суставе).
Вопрос №5. Как следует себя вести после введения радиофармпрепарата (РФП)?
В целях ограничения возможного облучения окружающих Вас людей следует придерживаться следующих правил:
Помните! При соблюдении этих правил и рекомендаций Вы не представляете радиационной опасности для Ваших близких и окружающих.
Вопрос №6. Кому показана ангионефросцинтиграфия с капотеном?
Данное исследование показано пациентам со средним или высоким риском вазоренальной (почечной) гипертензии. Критерии отбора для теста: внезапная или выраженная гипертензия; гипертензия стойкая к медикаментозной терапии у послушного пациента; шумы при аускультации в брюшной полости или в боку; повышение уровня азота или ухудшение почечной функции во время терапии ингибиторами АПФ; окклюзионное поражение в других сосудистых бассейнах; гипертензивная ретинопатия 3 или 4 степени (поражение глаз); начало гипертензии до 30 или после 55 лет.
О радионуклидной ВИЗУАЛИЗАЦИИ (сцинтиграфии) для врача общей практики
Первое применение радиоактивных индикаторов относят к 1911 году и связывают с именем Дьердя де Хевеши. Молодой ученый, живший в дешевом пансионе, начал подозревать, что остатки пищи, которые он не доел, подавали ему вновь на следующий день.
Первое применение радиоактивных индикаторов относят к 1911 году и связывают с именем Дьердя де Хевеши. Молодой ученый, живший в дешевом пансионе, начал подозревать, что остатки пищи, которые он не доел, подавали ему вновь на следующий день. Он добавил радиоизотопный индикатор к несъеденной порции и с помощью детектора излучения доказал своей хозяйке, что дело обстояло именно так. Хозяйка выгнала молодого ученого из пансиона. Он же продолжал начатую работу, результатом которой стала Нобелевская премия за использование радионуклидов в качестве индикаторов в биологии Радионуклидная (радиоизотопная) диагностика охватывает все виды применения открытых радиоактивных веществ в диагностических и лечебных целях.
Клиническое применение радиоиндикаторов вошло в практику в 50-х годах. Развиваются методы, позволяющие детектировать наличие (радиометрия), кинетику (радиография) и распределение (сканирование) радиоиндикатора в исследуемом органе. Принципиально новый этап радиоизотопной визуализации связан с разработкой устройств широкого поля зрения (сцинтилляционные гамма-камеры) и метода визуализации — сцинтиграфии. Нередко термином «сцинтиграфия» обозначают исследования, проведенные с использованием как линейного сканера, так и сцинтиляционной гамма-камеры. С этим терминологическим стереотипом связано формирование неверных представлений о диагностических возможностях методов.
Сканирование и сцинтиграфия — это различные методы радиоизотопной визуализации. Сцинтиграфия существенно превосходит сканирование по объему и точности диагностической информации. Современные сцинтилляционные камеры представляют собой компьютеро-сцинтиграфические комплексы, позволяющие получать, хранить и обрабатывать изображения отдельного органа и всего тела в широком диапазоне сцинтиграфических режимов: статическом и динамическом, планарном и томографическом. Независимо от типа получаемого изображения оно всегда отражает специфическую функцию исследуемого органа. По сути, это картирование функционирующей ткани. Именно в функциональном аспекте заключается принципиальная отличительная особенность сцинтиграфии от других методов визуализации. Попытка взглянуть на результаты сцинтиграфии с анатомических или морфологических позиций — еще один ложный стереотип, влияющий на предполагаемую результативность метода.
Диагностическая направленность радиоизотопного исследования определяется используемым радиофармацевтическим препаратом (РФП). Что же такое РФП? Радиофармацевтический препарат — это химическое соединение с известными фармакологическими и фармакокинетическими характеристиками. От обычных фармацевтических средств он отличается не только радиоактивностью, но и еще одной важной особенностью — количество основного вещества настолько мало, что при введении в организм не вызывает побочных фармакологических эффектов (например, аллергических). Специфичность РФП по отношению к определенным морфофункциональным структурам определяет его органотропность. Понимание механизмов локализации РФП служит основой для адекватной интерпретации радионуклидных исследований. Введение РФП связано с небольшой дозой облучения, неспособной вызвать какие-либо неблагоприятные специфические эффекты. В этом случае принято говорить об опасности переоблучения, однако при этом не учитываются темпы развития современной радиофармацевтики.
Лучевая нагрузка определяется физическими характеристиками радиоиндикатора (период полураспада) и количеством введенного РФП. Сегодняшний день радионуклидной диагностики — использование короткоживущих радионуклидов. Наиболее популярным из них является технеций-99m (период полураспада — 6 часов). Этот искусственный радионуклид получают непосредственно перед исследованием из специальных устройств (генераторов) в форме пертехнетата и используют для приготовления различных РФП. Величины радиоактивности, вводимые для проведения одного сцинтиграфического исследования, создают уровни лучевой нагрузки в пределах 0,5-5% допустимой дозы. Важно подчеркнуть — длительность сцинтиграфического исследования, количество получаемых изображений или томографических срезов уже не влияют на «заданную» дозу облучения.
l Клиническое применение
Коротко остановимся на реальных диагностических возможностях наиболее распространенных («рутинных») сцинтиграфических исследований.
Визуализация костной системы (остеосцинтиграфия) — наиболее точный метод выявления участков нарушенного костного метаболизма. Остеотропные РФП (Тс-фосфонаты) обладают высоким сродством к кристаллам фосфата кальция, поэтому они связываются преимущественно с минеральным компонентом костной ткани. Уровень накопления РФП в различных типах костей и участках скелета обусловлен степенью остеобластической и метаболической активности, величиной кровотока, что необходимо учитывать при дифференциации нормального и патологического накопления РФП. В частности, повышенное накопление РФП наблюдается в метаэпифизарных отделах трубчатых костей, в областях с постоянной физической нагрузкой.
Заболевания костей сопровождаются патологической перестройкой костной ткани, реактивным или опухолевым костеобразованием — основными механизмами, обусловливающими изменение костного метаболизма и накопление остеотропных РФП в пораженных отделах. В зависимости от сочетания указанных процессов возрастает уровень накопления остеотропных РФП при опухолевых, воспалительных, дегенеративных, травматических заболеваниях.
Основная и наиболее ответственная задача остеосцинтиграфии — поиск метастатических и оценка распространенности опухолевых поражений скелета. Сцинтиграфическая манифестация патологии может проявиться на 3-12 месяцев раньше, чем появятся рентгенологические признаки. Связано это с тем, что локальное изменение обмена остеотропных РФП возникает на ранних фазах развития патологии, еще до появления не только рентгенологической, но и клинической симптоматики. По этой причине радионуклидное исследование обладает наибольшей эффективностью в до- и послеоперационном обследовании больных опухолями с высокой частотой метастазирования в кости (молочная железа, легкие, предстательная железа, почки).
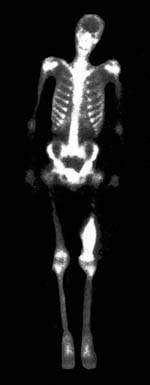 |
| Рисунок 1. Остеогенная саркома бедра. Обширная область высокого накопления РФП в дистальном отделе левого бедра |
Сцинтиграфическая манифестация метастатических поражений — множественные и реже одиночные локальные зоны высокого накопления РФП («горячие» очаги). Наиболее высокие концентрации РФП отмечаются в остеобластических и смешанных метастазах, низкие — в остеолитических. Ложноположительные ошибки чаще всего связаны с выраженными остеодистрофическими изменениями, а также с травматическими повреждениями ребер и позвоночника. Опухоли костей остеогенного происхождения отличаются наиболее высокой кумуляцией РФП. Например, остеогенная саркома отличается выраженной гиперфиксацией РФП не только в элементах самой опухоли, но и в окружающих мягких тканях за счет реактивной гиперемии (рис. 1). В опухолях неостеогенного происхождения накопление РФП более низкое. Однако практически не представляется возможным дифференцировать отдельные виды опухолей по степени накопления в них РФП. Некоторые опухоли, так же как и их метастазы, могут быть накоплением РФП. К таким опухолям относится, в частности, ретикулосаркома и множественная миелома. Визуализация почек (динамическая реносцинтиграфия) — простой и точный метод одновременной оценки функционального и анатомотопографического состояния мочевыводящей системы. В основу положена регистрация транспорта нефротропного РФП и последующий расчет параметров, объективизирующих два последовательных этапа.
Анализ сосудистой фазы (ангиофазы) направлен на оценку симметричности прохождения «болюса» по почечным артериям и относительных объемов крови, поступающих к каждой почке в единицу времени. Анализ паренхиматозной фазы предусматривает характеристику относительной функции почек (вклад в суммарную очистительную способность) и времени прохождения РФП через каждую почку или ее отделы. Клиническая интерпретация в значительной степени определяется механизмом элиминации РФП. В методах динамической визуализации могут быть использованы два вида РФП:
l гломерулотропные (производные ДТПА), практически полностью фильтруются клубочками и отражают состояние и скорость клубочковой фильтрации;
l тубулотропные (аналоги гиппурана) секретируются эпителием проксимальных канальцев и отражают состояние канальцевой секреции, а также эффективного почечного кровотока. Показания к исследованию включают урологическую и нефрологическую патологию, а также заболевания, где почки являются органами-мишенями.
При различных клинических ситуациях может меняться как форма кривых, так и их количественные характеристики. Следует, однако, подчеркнуть, что характер и величины изменений малоспецифичны для конкретной патологии и прежде всего отражают тяжесть патологического процесса. Наибольшая информативность реносцинтиграфии проявляется при дифференциации одно- или двустороннего поражения почек.
Ведущий признак, определяющий сторону поражения, — асимметрия амплитудно-временных характеристик ангионефросцинтиграмм. Асимметрия сосудистых параметров, и прежде всего выраженная разница времени поступления РФП в почечные артерии, — один из критериев стеноза почечной артерии. Симметричность изменений паренхиматозной функции более характерна, в частности, для гломерулонефрита; асимметрия — довольно постоянный признак пиелонефрита не только при одно-, но и при двустороннем процессе. Аналогичные изменения могут сопровождать различные варианты аномалий почек и верхних мочевых путей (нефроптоз, удвоение собирательной системы, гидронефроз).
В основе метода визуализации печени (гепатосцинтиграфии) лежит использование меченых коллоидов, которые после внутривенного введения фагоцитируются и распределяются в морфофункциональных структурах, содержащих клетки РЭС в соответствии с локальными значениями органного кровотока. В норме в печени локализуется более 90%, в селезенке — около 5%, а в костном мозге — менее 1% введенного радиоколлоида. В зависимости от характера и тяжести патологии эти соотношения меняются. Наиболее общим показанием к гепатосцинтиграфии является гепато- и/или спленомегалия неясного генеза. Основная задача исследования — дифференциация характера и уточнение тяжести поражения печени.
Диффузные заболевания печени манифестируются изменением размера и формы изображения, распределения радиоколлоида в печени и его внеорганного накопления, параметров фагоцитарной способности РЭС и печеночного кровотока. Следует подчеркнуть, что исследование не позволяет дифференцировать клинические или клинико-морфологические формы заболевания печени (например, хронический гепатит). Наибольшая информативность метода проявляется в возможности выявления синдрома портальной гипертензии (СПГ).
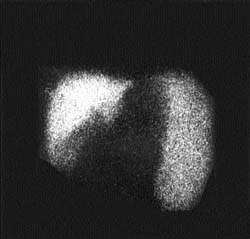 |
| Рисунок 2. Внепеченочная блокада портального кровообращения. Синдром портальной гипертензии манифестируется высоким захватом радиоколлоида увеличенной селезенкой |
Независимо от причин повышенного давления в системе воротной вены (внутри- или внепеченочные формы), сцинтиграфически СПГ манифестируется высоким захватом радиоколлоида и увеличенной селезенкой. Сочетание указанных признаков позволяет выявить СПГ с точностью до 98% (рис. 2). Очаговые поражения печени в зависимости от их распростаненности проявляются наличием одиночных или множественных дефектов накопления РФП в пределах одной или обеих долей печени (рис. 3). В практике нередко выявление участков, где отсутствует накопление РФП («холодные» очаги), прочно ассоциируют с объемными процессами, чаще всего опухолевого генеза. Это представление ложно. Достаточно широкий спектр заболеваний, связанных с вовлечением печени в патологический процесс, сцинтиграфически может манифестировать очаговыми изменениями как следствием локальных гемодинамических или функциональных нарушений (цирроз печени, амилоидоз, гистиоцитоз). Необходимо также помнить, что некоторые органные структуры (аномально расположенный желчный пузырь, молочная железа) могут «экранировать» изображение печени и формировать сцинтиграфический феномен «псевдоопухоли». Именно поэтому по характеру дефекта накопления РФП без учета клинической информации практически невозможно дифференцировать специфику очагового поражения.
A. | B.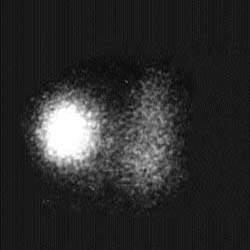 |
| Рисунок 3. Сцинтиграфические варианты узловых поражений щитовидной железы. «Холодный» узел нижнего отдела левой доли — коллоидная киста (А), «горячий» узел правой доли — тиреотоксическая аденома (Б) | |
Возможность выявления очаговой патологии зависит и от разрешающей способности гамма-камеры. Очаги менее 1 см, как правило, сцинтиграфически не манифестируются.
Визуализация желчевыделительной системы (гепатохолесцинтиграфия) основана на использовании серии гепатотропных РФП, аналогичных по своей фармакокинетике красителям (бромсульфалеин, вофавердин). После внутривенного введения они связываются с белками крови, поглощаются полигональными клетками печени и выводятся в составе желчи. Основным преимуществом гепатохолесцинтиграфии является непрерывность визуальной и количественной регистрации процесса кинетики РФП.
Визуальный анализ серии изображений позволяет выявить некоторые органические изменения желчных протоков (расширение), желчного пузыря (деформации), а также функциональные изменения двенадцатиперстной кишки.
Анализ кривых позволяет получить количественные критерии, характеризующие поглотительно-выделительную функцию печени, наполнение желчного пузыря, длительность латентного периода после желчегонного завтрака, скорость опорожнения желчного пузыря. Дискинезии желчного пузыря дифференцируются на основе изменения скорости его опорожнения (гипо- или гипермоторная дискинезия). Следует подчеркнуть, что точность радиологической оценки двигательной функции желчного пузыря превышает рентгенологическую или эхографическую. Это связано с тем, что при сравнении площадей изображения органа до и через фиксированное время после желчегонного завтрака практически невозможно учесть длительность латентного периода желчеотделения и выделить собственно фазу опорожнения желчного пузыря.
Гепатохолесцинтиграфия имеет ограниченное значение в диагностике воспалительной патологии и камней желчного пузыря. Первоочередная задача заключается в оценке тяжести нарушения проходимости шеечно-протоковой зоны и наполнения желчного пузыря. При полной обтурации пузырного протока возникает сцинтиграфический феномен «отключенного желчного пузыря».
Визуализация щитовидной железы (тиреосцинтиграфия) проводится с использованием Тс-пертехнетата и основывается на сходстве в поведении ионов йода и пертехнетата. Однако это сходство прослеживается только на начальной неорганической фазе внутритиреоидного транспорта. Пертехнетат, в отличие от йода, не переходит в органическую фазу, то есть не включается в состав тиреоидных гормонов. Эта особенность исключает возможность его использования при послеоперационном поиске метастазов рака щитовидной железы (последнее проводится только с радиоактивным йодом).
Узловые поражения щитовидной железы и дифференциальная диагностика выявленных клинически или эхографически узловых образований шеи — наиболее частое показание к тиреосцинтиграфии. Основная задача исследования — оценить степень функционирования узлов, идентифицировать солитарные или множественные образования, установить связь узлов с тиреоидной тканью. В зависимости от функциональной активности и степени накопления радиопертехнетата узлы традиционно разделяют на «горячие», «теплые» и «холодные». Однако такое деление относится только к их сцинтиграфической оценке.
Под термином «горячий» узел подразумевают ситуацию, когда РФП накапливается почти исключительно в области узла и не накапливается в других отделах органа. Подобные находки характерны для автономной тиреоидной ткани, токсической аденомы, аутоиммунного тиреоидита, врожденной аплазии доли. Отсутствие накопления РФП в окружающий узел ткани объясняется продукцией автономным узлом тиреоидных гормонов, уменьшающих выделение ТТГ и обусловливающих подавление функции нормальной ткани.
Функционально неактивные («холодные») узлы характеризуются отсутствием или резким снижением накопления радиопертехнетата. Эта менее специфическая находка сопровождает широкий спектр патологии: узловой зоб, коллоидные кисты, аденому, неспецифический струмит, в 15-25% случаев — рак щитовидной железы (рис. 3).
Наибольшие затруднения представляет идентификация «теплых» узлов. Эти узлы рассматривают как разновидность «горячих», но в отличие от последних в них отсутствует или слабо выражено функциональное подавление нормальной тиреоидной ткани. В силу этого накопление РФП в узлах может не отличаться от окружающей паренхимы и приводить к ложноотрицательным трактовкам данных сцинтиграфии.