микробиота что это такое у человека
Микробиота кишечника: что это такое и в чём её роль в организме человека
Микробиота кишечника: что это такое и в чём её роль в организме человека
В нашем организме около 30 триллионов клеток и почти столько же бактерий.
Что такое микробиота?
По нашему телу микроорганизмы распределены неравномерно, и в местах обитания бактерий – нишах – формируется свое особенное микробное сообщество: на коже, в полости рта, дыхательных путях и кишечнике.
***Разная микробиота: собственные наборы бактерий для кожи, полости рта, лёгких, влагалища, кишечника.
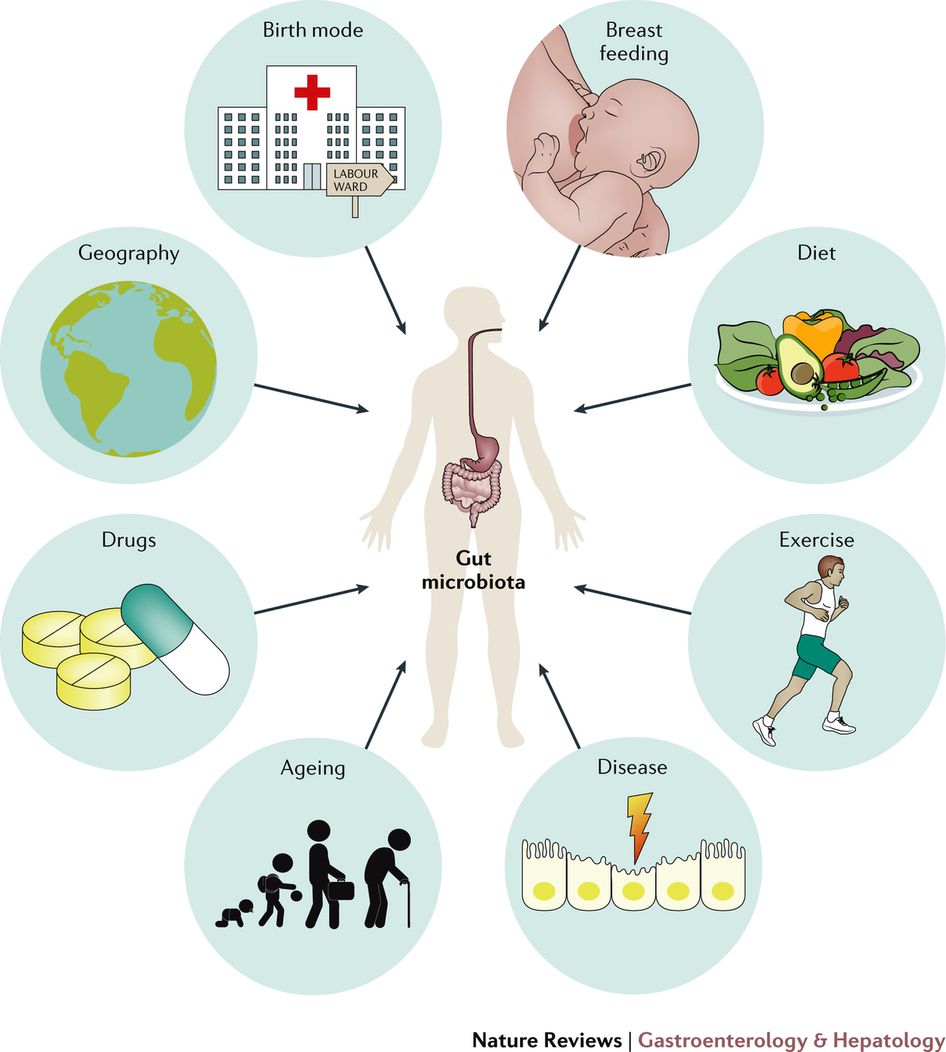
Человек не приходит в этот мир с уже сформировавшейся микробиотой — она развивается и до, и после рождения.
Примерно к трем годам у ребенка полностью формируется микробиота [2]. В течение всей жизни она будет меняться незначительно [3], а в пожилом возрасте ее состав станет менее разнообразным из-за процессов старения и влияния привычной пищи [4].
Микробиом, микробиота, микрофлора — в чем разница?
Термины «микробиом» и «микробиота» часто используются как синонимы, но различия между ними все-таки есть.
Микробиота — это совокупность микроорганизмов определенной экосистемы (наше тело — тоже своего рода макроэкосистема для различных микроорганизмов). Ее составляют не только бактерии — она включает еще и дрожжи, вирусы, археи и другие виды микроорганизмов.
Микробиом — это совокупность генов микробиоты, ее коллективный геном.
Кто населяет наш кишечник?
Условно-патогенные (оппортунистические) бактерии для здорового человека обычно безвредны. Но они резко размножаются при негативном воздействии на организм. Если человек получил травму, произошел сбой в иммунной системе или нарушился баланс в составе микробиоты, нейтральные микробы могут стать патогенными. Например, из-за стресса на фоне приема антибиотиков растет число оппортунистических бактерий [8,9].
Функции кишечной микробиоты
Работа, которую выполняют бактерии кишечника, трудна и незаметна — по крайней мере, на первый взгляд. Однако именно микробиота нужна для выполнения нескольких важных функций организма [10]:
• Поддержка иммунитета. Микробиота нужна для эффективной работы иммунной системы: бактерии кишечника выступают в роли своеобразного «тренажера». А главное, обитатели микробиома постоянно конкурируют между собой, занимая свободное пространство, и места для патогенных микробов уже не остается.
• Синтез витаминов (К, группы В и других), которые всасываются в кишечнике вместе с пищей.
Этим перечнем функции микробиоты не исчерпываются. Исследования показывают [11], что бактерии в ее составе влияют на настроение, на работу нейромедиаторов и на уровень главного гормона стресса — кортизола.
Все эти функции — пищеварение, помощь иммунной системе, синтез витаминов — выполняют далеко не все бактерии. Микробиота — это целая экосистема, где каждая часть микроорганизмов отвечает за свою задачу. Фактически, это орган в органе со своими особенностями и функциями. Мы получаем его при рождении и растем вместе с ним, формируя свой собственный, уникальный профиль микробиома.
Что может влиять на микробиоту
Что же влияет на микробиоту?
Как улучшить микробиом кишечника
Вопросы и ответы о микробиоте
Различается ли микробиота толстого и тонкого кишечника?
Да, различается — и по составу (количественному и качественному), и по функциям. Микробиота тонкого кишечника отвечает за защиту слизистой оболочки, принимает активное участие в усвоении питательных веществ, участвует в иммунной защите нашего организма.
Микробиом толстого кишечника — это настоящий центральный реактор всего ЖКТ. От него зависит наше самочувствие. К тому же, в толстом кишечнике микробиоты в разы больше, чем в тонком. Поэтому мы чаще говорим о микробиоте толстого кишечника.
Как узнать состояние своей микробиоты?
Если исследование нужно для лечения, назначить его и интерпретировать полученные результаты должен только лечащий врач.
Связаны ли микробиоты разных органов?
Тем не менее, микробиоты могут влиять друг на друга. Например, продолжительный прием определенных лекарств может привести к тому, что микробы желудка будут попадать в кишечник и там размножаться, приводя к дисбиозу.
Что такое «пересадка микробиоты»?
Это еще один способ восстановить баланс микроорганизмов, когда бактерии доставляются не стандартным способом, через весь ЖКТ, а сразу в нужную часть кишечника. Так микробы оказываются на нужном месте быстрее, но пересадка весьма трудоемка, и используют ее редко, только при очень тяжелых заболеваниях. Чаще всего достаточно классических методов лечения.
Микробиота человека
МИКРОБИОТА
Современные представления о микробиоте человека
1. Введение
С момента первых исследований бактерий кишечника, описанных более 300 лет назад в работах Антони ван Левенгука, а впоследствии Л. Пастера, Р. Коха, И.И. Мечникова, представления о роли микроорганизмов, составляющих внутреннюю среду организма человека, за последние годы во многом изменились. Прежде всего, прогресс в понимании микробного сообщества человека стал возможным благодаря исследованиям в области состава генома. В работах Нормана Пэйса была выдвинута идея выделения ДНК из океанической среды, в 1991 г. он с коллегами опубликовал работу о выделении и идентификации последовательностей гена 16S рРНК из образца воды Тихого океана [1, 2]. Следующей исторической вехой в развитии метагеномики стала 2-летняя Глобальная океаническая экспедиция по сбору метагеномных образцов (GOS) в 2003 г., учрежденная Крэйгом Вентером. Состав собранных образцов был определен по результатам секвенирования генов 16S рРНК, и в одном только Саргассовом море было найдено свыше 2000 новых видов бактерий [3].
По мере изучения генов в условиях современного окружения человека, формирующегося под влиянием научно-технического прогресса, стереотипов в питании, гигиене, общекультурных ценностей, накапливается все больше данных, многие из которых имеют высокодостоверные доказательства [4, 5], что биологическая среда человека изменчива и представлена различными типами микроорганизмов, заселяющих все экологические ниши организма. Микробиом, сформировавшийся в процессе эволюции, имеет огромное значение как для контроля оптимального уровня метаболических процессов в организме, так и для создания высокой колонизационной резистентности к условно-патогенным микроорганизмам. Микробные элементы человека становятся барьером на пути экзогенной инфекции — участвуют в обеспечении реакций обезвреживания токсинов, ограничивают патогенную активность бактерий и их колонизацию в различных органах и системах [6].
2. Микробиота как отдельный орган в организме человека
(эволюция представлений, терминология)
Бактерии, обитающие в одной экологической нише, образуют сложную систему межвидового обобщенного метаболизма, наиболее эффективно используют имеющиеся ресурсы питательных веществ, кислород, свет. Кожа, полость рта, влагалище и желудочно-кишечный тракт обеспечивают среду жизнедеятельности для колоссального числа микробных единиц. Даже легкие и плацента, ранее считавшиеся стерильными, предполагают определенную колонизационную активность, что было показано в результате изучения микросред у здорового человека [1].
Понятие « микробиом » было впервые внедрено в 2001 г. для обозначения коллективных геномов микробных популяций человека. Микробиом человека состоит не только из бактерий, но также из археев и эукариот, таких как простейшие, грибов и нематод, вирусов, коллективно называемых virome [7]. Изучают микробиом на метагеномном уровне с использованием методик, основанных на секвенировании не только последовательности генов 16S рРНК, но и всех генов и некодирующих участков (так называемое шотган-секвенирование, англ.: shotgun sequencing). Вследствие этого стало возможным получать информацию о таксономическом составе микробиоты различных локусов организма, ее функциональном потенциале — через определение относительной представленности генов, кодирующих те или иные белки, в частности гены ферментов метаболических путей. Количество работ по метагеномике постоянно растет, появляетс я все больше данных о значении микробиоты различных локусов организма в норме и патологии [8].
Широкое распространение генные исследования микроорганизмов получили только в первом 10-летии XXI века благодаря появлению высокопроизводительных приборов для секвенирования. Первая работа по метагеному кишечника человека была опубликована американскими учеными в 2006 г., в ней был проведен функциональный анализ двух наборов метагеномных прочтений, полученных из образцов кала. Вслед за ней вышла статья группы ученых из Японии с описанием уже 13 новых образцов. В обоих исследованиях применялось полногеномное шотган-секвенирование с последующей de novo сборкой контигов и предсказанием открытых рамок считывания, а таксономическая принадлежность определялась путем поиска ближайшего сходства этих контигов с базой геномных последовательностей NCBI, в частности посредством построения генных карт и последовательностей [10].
Изучение микробиоты различных сообществ имеет фундаментальное значение. Исследования общих и частных взаимосвязей внутри микробиоты в различных организмах и средах, значение и вклад различных типов микроорганизмов в поддержание гомеостаза, механизмы ответа на раздражители внешней среды необходимы для оптимизации исследований в области экологии и молекулярной биологии [11].
Медицинские и клинические аспекты изучения микробиоты затрагивают, прежде всего, уточнение взаимосвязи вариативности микроорганизмов с риском развития заболеваний — сердечно-сосудистых, аллергических, онкологических и т.д. Предметом наибольшего числа работ является микробиота кишечника человека как наиболее многочисленная и разнообразная по сравнению с другими локусами организма [12].
Хотя изучение микробиоты человека стало возможным только за последние 20 лет благодаря развитию геномных исследований, биоинформатики, термин «микробиота» был использован еще в середине 40-х годов прошлого века при описании микробной контаминации бактериями полости рта, а «микробиомом» обозначили коллекцию микробных генов в конкретной экосистеме [12, 13].
Было установлено, что связанная с человеком микробиота состоит из не менее чем 40 000 бактериальных штаммов в 1800 родах, которые содержат до 10 млн отличающихся от человека генов [10]. Современное описание микробиоты как генетического сообщества микроорганизмов человека принадлежит нобелевскому лауреату Joshua Lederberg (1925—2008) и рассматривается как единый организм с индивидуальными генетически признаками. Микробиота стала предметом интенсивного изучения в области протеомики и метаболомики, близких направлений современной биомедицины, связанных с расшифровкой нарушений синтеза и структуры белков, липидов, активности ферментов. Это создает перспективы для индивидуального подбора лекарственной терапии и раннего прогнозирования развития заболеваний [14].
Сейчас идентифицировано более 5000 видов микроорганизмов, из них 90% не культивируемы в лабораторных условиях [http://www.ensembl.org]. С этих позиций человек вместе с живущими в его кишечнике генетически совместимыми микроорганизмами представляет единый «суперорганизм» с организованной работой ферментов, кодируемых не только геномом собственно человека, но и геномами всех симбиотических микроорганизмов. Суммарная масса бактерий, ассоциированных с желудочно-кишечным трактом (ЖКТ) здорового человека, достигает 2,5—3 кг [15] и сравнима с массой головного мозга у взрослого человека (около 1,5 кг). При этом кишечник является первым органом иммунной системы организма, он содержит 80% всех иммуноглобулинов и 10 6 лимфоцитов в 1 г лимфоидной ткани (M. Sun, 2015). В этой экосистеме существуют разнообразные механизмы и типы взаимоотношений как между бактериями, так и между бактериями и клетками хозяина (комменсализм, мутуализм, паразитизм).
В состав микробиоты кишечника входит более 3 млн генов. Треть микробиоты кишечника человека является общей для большинства людей, в то время как 2/3 индивидуальны, создавая своеобразное «удостоверение личности» [16]. Разнообразие микробиоты кишечника определяет генетическую вариацию среди индивидуумов, повышая толерантность к негативным факторам окружающей среды [17]. Считают, что недостаточная вариативность микробиоты кишечника у матери неблагоприятно сказывается на риске заболеваний у новорожденных детей [18].
В то же время появились данные о том, что вариации генома макроорганизма могут влиять на видовой состав кластеров бактерий. Данная закономерность была выявлена для 15 областей тела человека включая поверхностные и глубокие слои кожи, ротовую полость, кишечник, легкие и влагалище [19]. Таким образом наблюдается взаимное влияние генетического материала макроорганизма на микробиоту, и наоборот. Микробиота человека включает облигатные возбудители, постоянно присутствующие в организме человека и выполняющие важную роль в метаболизме хозяина и защите его от возбудителей инфекционных заболеваний. Вторая составляющая нормальной микрофлоры — транзиторная микрофлора (аллохтонная, случайная). Представители факультативной части микрофлоры достаточно часто встречаются у здоровых людей, но их качественный и количественный состав непостоянен и время от времени меняется. Количество характерных видов относительно невелико, зато численно они всегда представлены наиболее обильно.
Функции нормальной микрофлоры кишечника:
Важнейшей функцией нормальной микрофлоры является ее участие в создании колонизационной резистентности (сопротивляемость, устойчивость к заселению посторонней микрофлорой). Механизм создания колонизационной резистентности комплексный. Колонизационная резистентность обеспечивается способностью некоторых представителей нормальной микрофлоры адгезироваться на эпителии слизистой оболочки кишечника, образуя на ней пристеночный слой и тем самым препятствуя прикреплению патогенных и условно-патогенных возбудителей инфекционных заболеваний. Другой механизм создания колонизационной резистентности связан с синтезом микроорганизмами ряда веществ, подавляющих рост и размножение патогенов, прежде всего органических кислот, перекиси водорода и других биологически активных субстанций, а также с конкуренцией с патогенными микроорганизмами за источники питания.
Состав микрофлоры и размножение ее представителей контролируются прежде всего макроорганизмом (колонизационная резистентность, связанная с организмом хозяина) с помощью следующих факторов и механизмов [26]:
3. Деятельность международных организаций и научных объединений по изучению микробиоты человека
(основные проекты в разных странах мира, базы данных)
Значительный прогресс в области изучения микробиоты и биологии стал возможным благодаря внедрению метода секвирования генов с использованием консервативной 16S рРНК. Эти исследования раскрыли перспективы для обнаружения некультивируемых бактерий, и уже сегодня значительно продвинули понимание кишечного микробиома (бактерии и их геном. Фундаментальные исследования были инициированы в рамках создания двух крупнейших консорциумов по изучению микробиоты человека: MetaHIT (Metagenome of Human Intestinal Tract) в Европе и HMP (Human Microbiome Project) в США. В 2008 г. Национальный институт здравоохранения США начал финансирование проекта «Микробиом человека» (Human Microbiome Project — НМР http://hmpdacc.org/).
Целями проекта стали:
Параллельно инициирована программа MetaHIT, продолжающаяся до настоящего времени, целью которой является «создать взаимодействия между генами микробиоты кишечника человека у здоровых и больных» (http://www.metahit.eu/) [7]. Ученые, участвующие в рамках проекта MetaHIT совместно с BGI (Beijing Genomics Institute, Китай), установили каталог из 3,3 млн преобладающих бактериальных генов в метагеноме кишечника человека [15].
В 2007 г. проект «Микробиом человека» получил статус приоритетного пути к открытиям в науке, активно поддерживается и сегодня, продолжается до настоящего времени. Изучение человеческого микробиома также проводится на международном уровне под эгидой Международного консорциума микробиомов человека в других странах. Канадские институты исследований здоровья через Институт инфекционных заболеваний и иммунитета возглавляют «Канадскую инициативу по анализу и характеристикам микробов», которые колонизируют организм человека и потенциально влияют на изменение микробиоты при хронических заболеваниях.
В системе проекта «Микробиом человека» первоначально участвовали около 200 ученых из 80 мультидисциплинарных исследовательских институтов. Общая стоимость исследований составила 173 млн долларов. Изучены образцы тканей из 15 мест на теле 129 мужчин и 18 мест у 113 женщин. Все добровольцы — здоровые люди в возрасте от 18 до 40 лет — предоставили по три образца слизистой с внутренней стороны щек, носа, кожи за ухом и локтевого сгиба, а также фекальные пробы. Результаты опубликованы в ведущих по рейтингу журналах — Nature и др.
По результатам генетического анализа биоматериала было установлено, что в человеческом организме обитает свыше 10 тыс. видов различных микробов. Так, если в геноме человека содержится 22 тыс. генов, кодирующих белки для регуляции метаболизма, микробиом добавляет еще около 8 млн уникальных бактериальных генов. В это же время исследователями из США был опубликован список секвенированных геномов бактерий и архей, найденных в микробиоте человека. Эти две работы стали отправными пунктами для дальнейших исследований, в частности высокозатратных и трудоемких методов шотган-секвенирования для качественной и количественной характеристики метагенома.
На веб-сайте проекта «Микробиом человека» за период с июня 2009 г. по август 2012 г. зарегистрировано более 190 рецензируемых публикаций по геномным исследованиям. В настоящее время информационное поле постоянно наполняется новыми базами данных. К ним относятся IMG, база данных Integrated Microbial Genomes и система сравнительного анализа IMG/M, связанная система, которая объединяет наборы метагеномных данных с изолированными микробными геномами из системы IMG; CharProtDB, база данных экспериментально охарактеризованных аннотаций белка и базы данных Genomes OnLine (GOLD) для мониторинга состояния геномных и метагеномных проектов во всем мире и связанных с ними метаданных. В России также ведутся исследования, но главным образом в составе международных групп.
Информационные базы связаны с биомедицинскими технологиями передачи и хранения информации, активно разрабатываются инструменты для сравнительного анализа, которые облегчают выявление общих моделей, основных тем и тенденций в сложных наборах данных. К ним относятся RAPSearch2, быстрый и эффективный с точки зрения памяти метод поиска сходства с белком для данных секвенирования следующего поколения; Boulder Alignment Editor (ALE), инструмент для выравнивания РНК; WebMGA — настраиваемый веб-сервер для быстрого анализа метагеномной последовательности и DNACLUST, инструмент для точной и эффективной кластеризации филогенетических маркерных генов, разработки новых методов и систем для сбора массивных наборов данных последовательности. Ни один алгоритм сборки не разрешает все известные проблемы сборки коротких последовательностей, поэтому программы сборки следующего поколения, такие как AMOS, являются модульными, предлагая широкий набор инструментов для сборки. Разработаны новые алгоритмы для улучшения качества и практической значимости проектов геномов.
Сборка каталога секвенированных эталонных геномов чистых бактериальных штаммов производилась из нескольких участков тела, с которыми можно сравнивать метагеномные результаты. Первоначально целью было определение 600 геномов. В настоящее время планируется определение 3000 геномов и создание упорядоченного каталога, по крайней мере в черновом варианте. По состоянию на март 2012 г. было зарегистрировано 742 генома. Создан Центр анализа данных и координации (DACC), который служит в качестве центрального хранилища для всех данных Проекта. Изучаются юридические и этические вопросы, связанные с целыми исследованиями секвенирования генома.
4. Основные концепции и тренды научных и клинических исследований в изучении микробиоты
Основными концептуальными положениями, позволяющими сформулировать тренды научных и клинических исследований (согласно проекту «Микробиом человека»), следует считать [7]:
5. Заключение
Таким образом, за последние 10 лет достигнут значительный прогресс в понимании микробиоты человека как экосистемы, выполняющей функции отдельного органа в макроорганизме.
Микробиом — это совокупность генов микроорганизмов в организме человека, тогда как микробиота — экосистема с генетическими признаками, сформировавшимися в определенное время на определенной географической территории. Микробиота взаимодействует с остальными органами и системами, определяя функционирование организма в целом как у здорового человека, так и при заболеваниях. Изучением микробиоты занимаются крупнейшие консорциумы («Микробиом человека» — США, МetaHIT — Европа). Доказана генетическая гетерогенность, или вариативность микробиоты у здорового человека, определяющая устойчивость к неблагоприятным факторам, инфекциям, изучается участие микробиоты кишечника как наиболее генетически разнообразной и многочисленной в раннем формировании иммунного ответа как у здоровых людей различного возраста, так и при заболеваниях. Накапливается все больше данных о значении применения пробиотиков и трансплантатов микробиоты в лечении иммуноопосредованных заболеваний и при метаболическом синдроме, заболеваниях полости рта, синдроме раздраженной толстой кишки и синдроме избыточного бактериального роста (СИБР).
Наиболее перспективными для изучения эффективности пробиотиков в настоящее время следует считать следующие направления:
«Метагеномика и кишечный микробиом»
Дополнительно см.:
Список литературы
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
Микробиота человека: как бактерии влияют на вес тела
Все населяющие организм человека бактерии — хорошие и плохие — называются микробиотой. В одном только кишечнике живет до 100 триллионов микробов, которые находятся в симбиотических, то есть, взаимовыгодных, отношениях со своим хозяином. Благодаря исследованиям, проводимым по всему миру (и проекту Human Microbiome Project), теперь мы знаем, что их коллективный геном, по крайней мере, в 100-150 раз больше нашего (1, 2, 8).
Связь между кишечной микрофлорой и здоровьем известна уже более века (3), но ученые долгое время не имели возможности выделить и описать всю популяцию кишечных бактерий. Только недавно были разработаны методы прямого секвенирования микробиома, благодаря чему мы узнали, что бактерии могут влиять на разные процессы в организме, в том числе — на потребление энергии и ее траты (4).
Микрофлора кишечника может сильно отличаться по размеру и составу как между разными людьми, так и у одного человека в течение жизни: на это может влиять возраст, питание, лекарства, изменения веса и общее метаболическое здоровье. В свою очередь, разные субпопуляции кишечной микрофлоры вырабатывают сигнальные молекулы, которые могут влиять на энергетический баланс, метаболизм и вес тела (5, 6). Уже накопилось много исследований на грызунах, которые показывают: микробиота кишечника — чувствительный энтероэндокринный «орган», который может участвовать в развитии ожирения и сопутствующих заболеваний вроде диабета, и когда-нибудь сможет использоваться в терапевтических целях.
Микрофлора кишечника очень разнообразна, не все еще изучено, но основными бактериями, выраженными в процентном отношении к общей популяции, являются:
Все вместе, эти типы составляют более 97% популяции кишечных микробов.
Раньше считалось, что внутриутробная среда стерильна, и колонизация новорожденного бактериями начинается только в момент его рождения. Но сегодня известно, что создание микробной популяции кишечника у новорожденного — сложный процесс взаимодействия между генотипами матери и плода, его внутриутробной жизнью, питанием матери, наличием у нее аллергии, приемом антибиотиков, типом родов (естественными или через кесарево сечение), питанием матери и ребенка после родов (12).
Например, прием антибиотиков женщиной во втором и третьем триместрах беременности связан со снижением бактериального разнообразия стула новорожденного, уменьшением количества лактобацилл и бифидобактерий в кишечнике и, согласно наблюдательным исследованиям, даже повышенным риском ожирения в будущем (13, 14, 15).
Дети, рожденные естественным образом, колонизируются вагинальными и кишечными бактериями матери, а дети, родившиеся с помощью кесарева сечения, первоначально колонизируются бактериями с кожи матери (16, 14).
У недоношенных детей первоначально развивается менее разнообразная микробиота, с преобладанием Proteobacteria и Firmicutes по сравнению с Bacteroidetes (17, 18). И независимо от срока родов, рожденные через кесарево сечение дети имеют менее разнообразную микрофлору, которая содержит абсолютно и относительно меньшие популяции Bacteroides и Bifidobacteria (19), что сохраняются от нескольких месяцев до нескольких лет (20). Схожую микробную картину имеют взрослые люди с ожирением (21), поэтому ученые предполагают, что микрофлора рожденных через кесарево детей может быть причиной увеличения рисков ожирения в будущем на ±40% (14, 22, 23). Но нужно помнить, что это результат наблюдательных исследований, которые показывают связь двух переменных, без причин и следствий.
Хотя генетика и может влиять на микробиоту человека, особенно первые годы жизни (это показывают исследования на близнецах), дальше это играет совсем небольшую роль, по сравнению с тем, как на микрофлору влияет окружающая среда — питание, климат, география и другие факторы (22, 23, 24). Например, есть исследования, которые используют многомерный анализ для сравнения индустриальных обществ, таких как США или Европа, с традиционными обществами, такими как охотники-собиратели хадза из Танзании (25) или аборигены Папуа-Новой Гвинеи (26). Они показывают, что индустриализация связана с меньшим разнообразием фекальных бактерий внутри отдельных индивидуумов и бОльшим разнообразием между людьми.
Энергетический гомеостаз
В нормальных условиях поступление энергии с едой и ее траты в течение дня подстраиваются друг под друга — это позволяет сохранять относительно постоянный уровень запасенной в жире энергии (27, 28). Недоедание/голодание и поддержание сниженной массы тела заставляют организм включать механизмы адаптации и экономии. Во-первых, снижаются траты энергии в течение дня: становится более активной парасимпатическая нервная система, что проявляется замедлением сердечного ритма, снижением артериального давления и расхода энергии в покое за счет снижения выработки гормонов щитовидной железы (29, 30).
Во-вторых, человек чувствует голод острее, получает больше удовольствия от еды, дольше не чувствует насыщения и хуже оценивает количество съеденного. Все это толкает есть больше, чтобы восстановить запасы энергии — и краткосрочные, и долгосрочные в виде жира. Исследования показывают, что эти сигналы не снижаются со временем даже у однажды похудевших людей, которые стараются поддерживать новый вес. Как результат, многие набирают его обратно (31, 32, 33, 34, 35, 36, 37, 38, 39, 40).
Все эти адаптации находятся под управлением гормона лептин, который вырабатывается жировыми клетками и действует непосредственно на рецепторы в головном мозге через вегетативную нервную и нейроэндокринную системы.

Исследования на грызунах
У нас есть много исследований влияния микрофлоры кишечника на энергетический баланс, но практически все контролируемые исследования проведены на грызунах.
Два наиболее распространенных типа бактерий в кишечнике — Bacteroidetes и Firmicutes. У генетически страдающих ожирением мышей относительная доля Bacteroidetes снижена, а Firmicutes — увеличена (7), в отличие от стройных мышей. Это показывает, что ожирение само по себе изменяет состав бактерий. Потеря веса так же влияет на разнообразие и соотношение бактерий в кишечнике.
Питание влияет и на состав, и на разнообразие бактерий в кишечнике. Так, диета с высоким содержанием полисахаридов приводит к большему разнообразию бактерий (8). А диета с большим количеством жиров у обычных мышей, а так же устойчивых к ожирению при помощи генной инженерии, приводит к значительному снижению Bacteroidetes, независимо от скорости набора веса (9).
Изменения микрофлоры влияют и на энергетический гомеостаз у грызунов. Например, лабораторные мыши, лишенные с самого рождения бактерий в кишечнике, хуже усваивают еду и хуже получают из нее энергию. Заселение их кишечника бактериями от «обычных» мышей (в сочетании с обычной мышиной диетой без перекармливания или недокармливания) приводит к набору веса тела до того же уровня, что имеют мыши-доноры (10).
А мыши, получившие микрофлору от доноров с ожирением, содержащую более высокие абсолютные и относительные количества Firmicutes, набрали в два раза больше жира, чем мыши, получившие бактерии от «нормальных» доноров. Интересно, что в обоих вариантах мыши ели примерно одинаково, и никакой значительной разницы в потреблении энергии между ними не было, поэтому ученые предполагают, что причина — в повышении эффективности извлечения энергии из еды (11).
Другие исследования показывают, что роль играет и состав диеты. Стерильные мыши, получившие бактерии от мышей с ожирением, набирали больше веса, чем те, кто получил бактерии от устойчивых к ожирению доноров, но эффект этот был только при питании с высоким содержанием жиров.
Прежде чем переносить результаты исследований на людей, важно понимать, что системы энергетического гомеостаза у людей и мышей в некоторых моментах принципиально разные.
Во-первых, отличается типичная диета: в мышиной больше углеводов и меньше жира. Во-вторых, отличаются ночные и суточные биоритмы, связанные с потреблением энергии и ее расходом. В-третьих, самые серьезные различия — в количестве бурого и белого (обычного) жира в теле: у мышей намного больше бурого, и на него приходится >50% их метаболизма, а у людей — менее 5% (41, 42). У мышей на количество бурого жира и его метаболизм влияет как состав рациона, так и бактерии кишечника (43, 44), вот почему на мышиный энергетический гомеостаз микрофлора влияет намного больше. Об этом нужно помнить, прежде чем переносить результаты исследований по бактериям напрямую на человека.
А что у людей?
Сегодня мы знаем, что состав микрофлоры кишечника и ее разнообразие реагируют на:
Но пока неясно, что влияет больше всего (50). В будущем исследования изменений в микрофлоре кишечника после липосакции ответят на вопрос более точно, ведь при этой операции человек худеет без диеты и без отрицательного энергетического баланса.
Как микрофлора кишечника влияет на вес
Ученые предлагают несколько механизмов, с помощью которых бактерии потенциально могут влиять на вес тела.
1. Усвоение энергии из еды (energy harvest)
Заселение кишечника стерильных мышей обычными мышиными бактериями приводит к увеличению веса, несмотря на то, что эти мыши начинают меньше есть и больше двигаться (51, 52, 53). Предполагается, что дело — в повышении эффективности усвоения энергии из еды.
Пока точно не ясно, что именно позволяет стерильным мышам поддерживать более низкий вес (и более низкий уровень запасов энергии), чем тот, который организм будет «защищать» после заселения кишечника бактериями и набора веса. Интересно, что заселение толстых мышей бактериями худых доноров не только приводит к потере веса, но еще и, по-видимому, не включает адаптацию организма на потерю запасов энергии. При обычном похудении, как было написано выше, именно это и происходит, а при заселении толстых мышей бактериями от худых и похудении в результате этого — нет. Когда мы точно поймем механизмы, это можно будет использовать для разных манипуляций с питанием, лекарствами и другими вмешательствами, которые повлияют на микробиом и снизят усвоение энергии из еды у людей (54, 55).
Пока известно, что более эффективное извлечение энергии из еды связано с увеличением Firmicutes и уменьшением Bacteroidetes (53). В одном исследовании изучали влияние диеты с дефицитом калорий (2400 ккал/день) и переедания (3400 ккал/день) на микрофлору 12 стройных людей и 9 человек с ожирением. И при переедании, и при ожирении в кишечнике было больше Firmicutes и меньше Bacteroidetes. При недоедании, а так же у стройных людей — наоборот (50). То же исследование показало, что увеличение количества Firmicutes на 20% и соответствующее уменьшение Bacteroidetes связано с увеличением усвоения энергии из еды на
5% от потребляемых калорий.
Механизмы, с помощью которых микрофлора может влиять на усвоение энергии из еды, остаются пока гипотетическими. Из исследований на грызунах известно, что на это влияет длительность воздействия еды на слизистую оболочку кишечника: сокращение или увеличение времени прохождения еды по кишечнику приводило, соответственно, к увеличению численности Bacteroidaceae и Porphyromonadaceae (56).

Про пересадку бактерий
Учитывая, что толстых мышей можно сделать худыми, а худых — толстыми, изменив их микробиоту, появилась гипотеза, что пересадка бактерий стройного человека людям с ожирением может помочь в снижении веса, как это происходит у мышей. Предыдущие исследования таких пересадок людям показали улучшение инсулинорезистентности в печени у пациентов с метаболическим синдромом (это заболевание — частый спутник ожирения). Но недавно появилось первое контролируемое исследование людей с ожирением, не имеющих параллельно сопутствующих ожирению болезней. Оно было представлено на Digestive Disease Week в 2019 году.
«В нашей клинике мы видим пациентов, которые не имеют никаких других медицинских проблем и просто не могут похудеть. Это очень важная популяция, которой мы хотели уделить внимание и попытаться помочь понять причины», — сказала Джессика Аллегретти, доктор медицинских наук, ведущий автор исследования и директор программы трансплантации фекальной микробиоты.
В этом исследовании приняли участие 22 пациента с ожирением, но без диабета, проблем с печенью и других сопутствующих ожирению заболеваний. Во время 12-недельного исследования половина принимала капсулы, содержащие фекалии стройного донора, а другая половина — плацебо (пустышку) в виде идентичных по виду капсул. Кроме потери веса, ученые искали изменения в глюкагоноподобном пептиде 1 (GLP1) — гормоне, который вырабатывается в кишечнике и связан с ощущением сытости, а через это — с увеличением или потерей веса.
По окончании исследования разницы в гормоне GLP1 и потере веса в обеих группах не было. Но ученые обнаружили другие изменения в микробиоте участников, получивших фекалии в капсулах. Среди них — снижение специфической желчной кислоты и бактериальные изменения в образцах стула, которые стали более схожи со стройными донорами.
И хотя формально исследование по пересадке микрофлоры стройных людей не показало никаких значимых результатов, ученые не унывают. «Наше исследование делает обнадеживающий первый шаг в попытке понять роль микрофлоры кишечника в ожирении метаболически здоровых людей. Мы надеемся, что в будущем это поможет более целенаправленной терапии». Дальше ученые планируют делать более чувствительные измерения GLP1, проводить дополнительные исследования с разными дозами фекального материала и искать другие механизмы, чтобы лучше понять роль микробиоты в ожирении. «Данные о желчной кислоте, безусловно, интригуют и показывают, что, возможно, есть несколько разных путей, ведь ожирение — сложное, многофакторное заболевание», — говорит доктор Аллегретти.
2. Улучшение чувствительности к лептину
Грызунам с дефицитом лептина давали пробиотики для снижения количества Firmicutes и увеличения Bacteroidetes, что привело к повышению чувствительности мозга к лептину (57). Это позволяет предположить, что кишечная микрофлора может влиять на передачу сигналов лептина в гипоталамус. При этом, ситуация может быть и обратная: вырабатываемые бактериями сигнальные молекулы могут подавлять пути, с помощью которых мозг реагирует на лептин. Дефицит лептина или плохая чувствительность рецепторов головного мозга к нему приводит к набору веса, потому что человек начинает чувствовать постоянный голод, плохо насыщается и становится менее активным физически.
3. Уменьшение системного воспаления
Повышение циркулирующих в крови воспалительных цитокинов было предложено в качестве механизма, с помощью которого высокожировая диета приводит к ожирению (58, 59). Это может быть связано с повышенной экспрессией в толстой и подвздошной кишке липополисахаридов, которые также могут выделяться и кишечными бактериями (NF-kB и TNFa) (60, 61).
Еще ученые предпологают, что выработка бактериями кишечника, а также клетками подвздошной и толстой кишки эндотоксинов приводит к метаболической эндотоксемии, которая действует на гипоталамус и вызывает переедание, а также увеличивает проницаемость кишечника для питательных веществ (62, 63). Было обнаружено, что ситуация улучшается при лечении антибиотиками.
4. Выработка жирных кислот с короткой цепью
Пищевые волокна овощей, фруктов, круп и бобовых являются пребиотиками — питанием для полезных бактерий, поддерживающим их рост и активность (64). Например, небольшие количества фруктоолигосахаридов инулинового типа, вводимых человеку, стимулируют рост Bifidobacterium, Lactobacillus, Roseburia и Faecalibacterium, особенно полезных для здоровья (65).
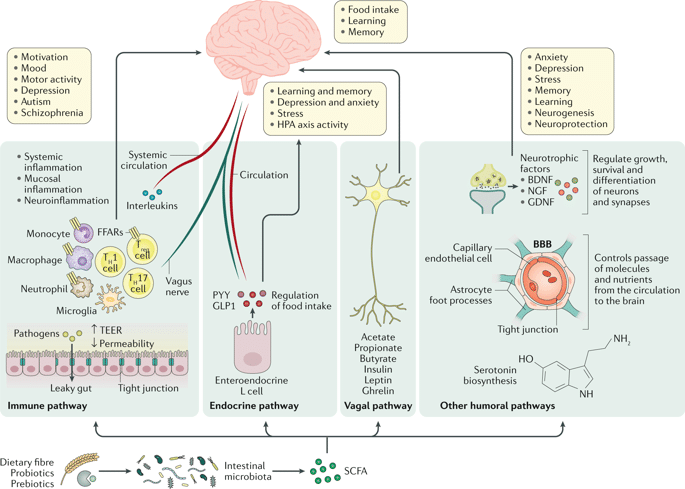
Бактерии метаболизируют (ферментируют) волокна, поступающие с углеводами, в короткоцепочечные жирные кислоты (SCFA, short chain fatty acids) — ацетат, бутират и пропионат. Они служат источником энергии для эпителия толстой кишки (бутират), гепатоцитов (пропионат) и других периферических тканей (67), и могут влиять на энергетический баланс. Например, при участии SCFA уменьшается высвобождение воспалительных цитокинов (68), что может косвенно повышать чувствительность гипоталамуса к лептину (69, 70).
Разные SFCA влияют на вес по-разному. Например, бутират улучшает насыщение, что связывают с повышением уровня «гормонов сытости» — глюкагоноподобного пептида 1 и пептида YY, которые вырабатываются в кишечнике и действуют на центр насыщения в гипоталамусе, а еще принимают участие в гомеостазе глюкозы (66). Пропионат так же влияет на метаболизм глюкозы, а у мышей он снижает потребление пищи и повышает двигательную активность (72). Введение ацетата увеличивает высвобождение лептина жировыми клетками, а так же имеет анорексигенный (снижающий аппетит) эффект, что может быть заметно на высокоуглеводной диете.
Кроме того, SCFA способны преодолевать гематоэнцефалический барьер и проникать в головной мозг, взаимодействуя напрямую с центром насыщения в гипоталамусе. Ученые обнаружили, что они увеличивают синтез и высвобождение глутамата, гамма-аминомасляной кислоты и проопиомеланокортина и снижают выработку повышающих аппетит пептидов в гипоталамусе (71).
Выводы
Исследования на грызунах показывают, что бактерии кишечника влияют на потребление энергии, ее усвоение из еды и ее расход. Предполагается, что-то похожее может быть и у человека, и что манипуляции микрофлорой могут стать потенциальным терапевтическим вмешательством для лечения ожирения. Но пока данных мало, и нужны дальнейшие исследования на людях с манипуляциями пребиотиками (волокнами), пробиотиками (самими бактериями) и составом диеты. А пока еще рано давать какие-либо рекомендации по «микробной терапии» при ожирении.
Так же нужны исследования изменений микрофлоры с помощью прямой пересадки, питания, приема про- или пребиотиков у людей с разными соматотипами (с ожирением, похудевшими или никогда не имевшими лишнего веса). Это поможет найти специфические поведенческие, микробные и метаболические фенотипы, которые смогут предсказывать реакцию людей на разные подходы к похудению — поведенческие, лекарственные, про- и пребиотические или хирургические.
Все усложняет еще и то, что микрофлора кишечника влияет на другие системы, вовлеченные в ожирение, включая гомеостаз глюкозы и липидов, системное воспаление и прочее (74), поэтому, опять же, нужно больше исследований на людях.
Пока все гипотезы о влиянии бактерий на вес человека основаны на:
Источник: Handbook of Obesity Treatment, Second Edition, by Thomas A. Wadden, George A. Bray (2018).
Перевод: fitlabs.ru
Так что никаких конкретных рекомендаций по лечению ожирения с помощью микрофлоры ученые не дают, хотя и признают, что область очень перспективная, а мы пока просто мало знаем. Из тех советов, что они могут дать сейчас: следите за весом и ешьте больше овощей, что вроде бы и не новость.