миофибробластическая опухоль что это такое
Воспалительная миофибробластическая опухоль мочевого пузыря
А.С. Попко, К.Л. Локшин, Л.А. Шестакова, В.Н. Ширшов
Клинический госпиталь Лапино, ГК «Мать и дитя»; Москва, Россия
Клиническое течение ВМО весьма вариабельно. Иногда опухоль может медленно расти и никак не проявляться клинически. В некоторых ситуациях возможен быстрый инфильтративный рост в окружающие ткани и отдаленное метастазирование. На начальных этапах развития опухоли клиническая картина может проявляться потерей массы тела, лихорадкой, анемией и повышением в сыворотке крови концентрации белков острой фазы воспаления. В дальнейшем появляются симптомы сдавления тех органов и тканей, в которых она возникла. Лечение ВМО преимущественно оперативное. В случае технической невозможности выполнения операции при прогрессировании заболевания возможно применение лучевой или химиотерапии.
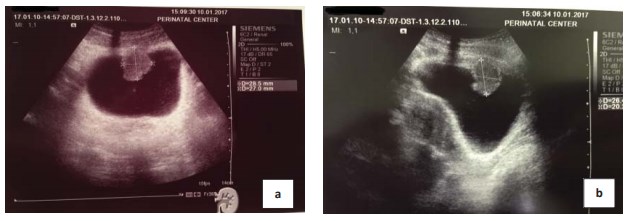
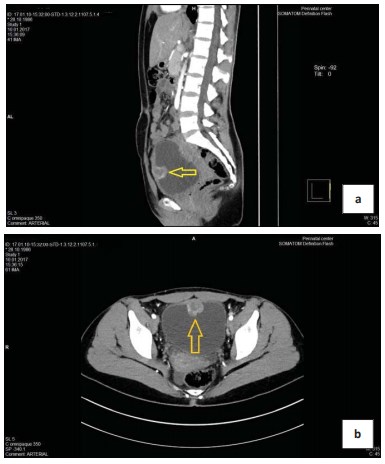
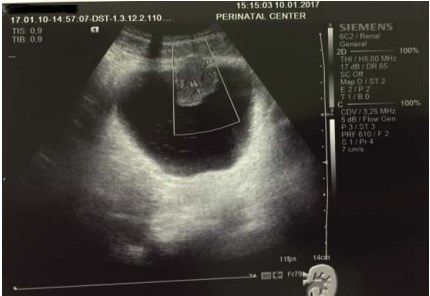
Пациентка К., 30 лет, обратилась к урологу в январе 2017 г. по поводу тотальной безболевой макрогематурии без сгустков (моча цвета мясных помоев), возникшей около 10 дней назад. При УЗИ (рис. 1) и КТ (рис. 2) было выявлено образование передней стенки мочевого пузыря, размерами до 29 мм. Образование обильно васкуляризировано (рис. 3). В общем анализе мочи: лейкоциты > 100 в поле зрения, эритроциты > 100 в поле зрения. В анализах крови и соматическом статусе — без отклонений от нормы. 18.01.17 выполнена цистоскопия, трансуретральная резекция (ТУР) мочевого пузыря с опухолью. При эндоскопическом исследовании опухоль расположена на передней стенке мочевого пузыря, плотная, бугристая на широком основании, покрыта ярко-розовой слизистой. При ТУР отмечается повышенная кровоточивость сосудов опухоли. Выполнена «холодная» щипковая биопсия стенки мочевого пузыря из ложа удаленной опухоли. Осложнений не было.
Рисунок 1. УЗИ мочевого пузыря a) поперечное сканирование b) продольное сканирование
Рисунок 2. Компьютерная томография a) мультипланарная реконструкция b) поперечный скан (стрелкой указана опухоль)
Рисунок 3. УЗИ мочевого пузыря, допплерография
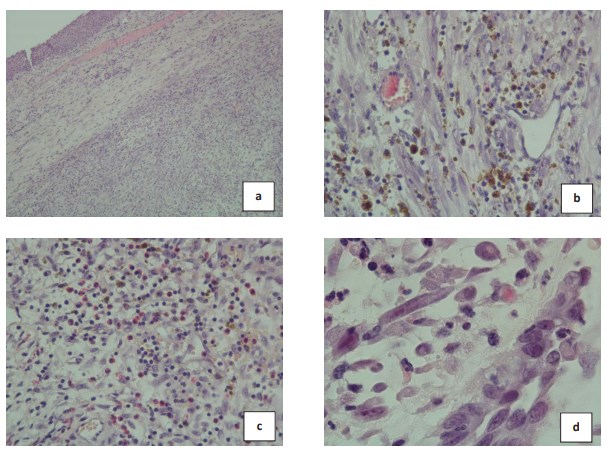
При морфологическом исследовании удаленной ткани выявлены множественные фрагменты опухоли из переплетающихся пучков мономорфных веретеновидных клеток с низкой митотической активностью, участкамимиксоматоза и отека, с зонами эрозий и изъязвлений, частично выстланные уротелием с реактивными изменениями. Отмечается диффузно-очаговая лимфо-плазмоцитарная инфильтрация с примесью большого количества нейтрофилов и эозинофилов. Морфологическая картина соответствует воспалительной миофибробластической опухоли мочевого пузыря (рис. 4). В биопсии из зоны основания опухоли элементов опухоли не обнаружено.
Рисунок 4. Воспалительная миофибробластическая опухоль мочевого пузыря. Окраска гематоксилином и эозином: a) фрагмент опухоли, выстланный уротелием. х40; b) среди клеток воспалительного инфильтрата определяются скопления гранул гемосидерина. х200; c) пролиферация миофибробластов сопровождается диффузно-очаговой лимфо-плазмоцитарной инфильтрацией, с примесью большого количества нейтрофилов и эозинофилов. х100; d) мономорфные веретеновидные миофибробласты с везикулярными ядрами, вперемешку с клетками воспалительного инфильтрата, расположены в рыхлой и миксоидной строме. х400
При контрольной цистоскопии через 3 и 9 месяцев данных за рецидив опухоли не получено, слизистая мочевого пузыря без патологических изменений. В анализах мочи без патологических сдвигов. В последующем планируется проведение динамического наблюдения, как и за больными с уротелиальной карциномой низкой степени злокачественности.
Заключение
В представленном клиническом наблюдении описан опыт успешного эндоскопического лечения пациентки с редким заболеванием — воспалительной миофибробластической опухолью мочевого пузыря.
Литература
Статья опубликована в журнале «Вестник урологии» №4 2017, стр. 79-83
Миофибробластическая опухоль что это такое
1. Аббревиатура:
• Воспалительная миофибробластическая опухоль (ВМО)
2. Синонимы:
• Воспалительная псевдоопухоль, плазмоклеточная гранулема, плазмоклеточная псевдоопухоль, воспалительная миофиброгистиоцитарная пролиферация, брыжеечно-сальниковая миксоидная гамартома, ксантоматозная псевдоопухоль, псевдосаркоматозная миофибробластная пролиферация, миофибробластома
3. Определение:
• Опухоль, состоящая из миофибробластных веретеновидных клеток и воспалительного инфильтрата, представленного плазматическими клетками, эозинофилами, лимфоцитами и гистиоцитами
1. Общая характеристика:
• Локализация:
о Образование может быть обнаружено в различных областях тела, чаще всего в легких и глазницах
о В 43% случаев внелегочные образования располагаются в брыжейке и сальнике
о Мягкие ткани, средостение, желудочно-кишечный тракт, мочевой пузырь, кожные покровы, нервы, кости, поджелудочная железа, надпочечники, молочные железы, полость рта, головной мозг, желудочки, мозговые оболочки, позвоночник, предстательная железа, мочеиспускательный канал, мошонка, лимфатические узлы
• Размер: 2-20 см (в среднем 6 см)
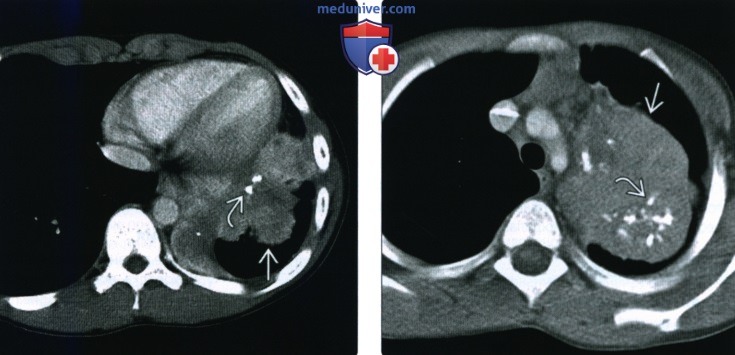
(Справа) У другого пациента при КТ с контрастным усилением в аксиальной плоскости в верхней доле левого легкого визуализируется крупная воспалительная миофибробластная опухоль, прилежащая к верхней границе средостения и содержащая множественные крупнозернистые кальцификаты. 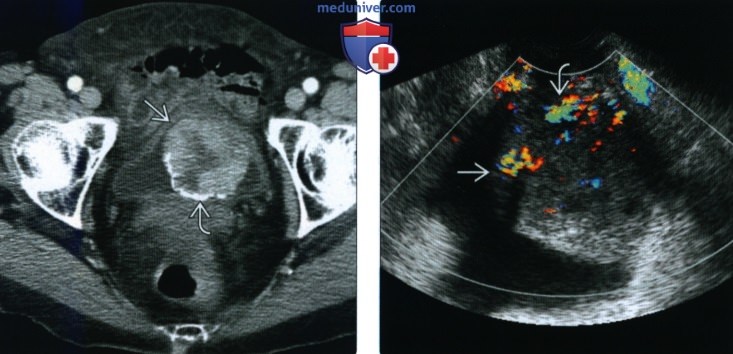
(Справа) При допплерографии малого таза по длинной оси в мочевом пузыре визуализируется крупное образование, с умеренно выраженной васкуляризацией. Дообследование позволило подтвердить отсутствие признаков инвазии стенки мочевого пузыря и лимфаденопатии. 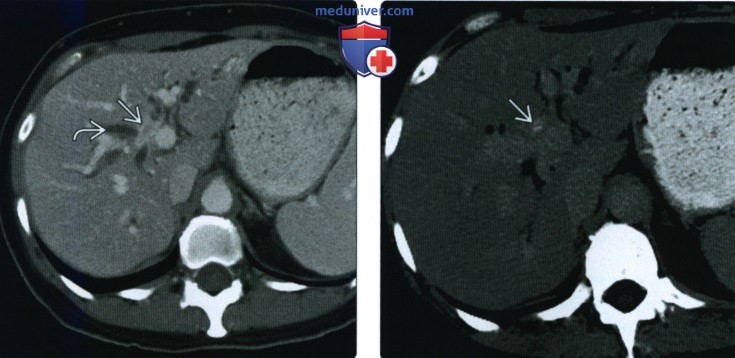
(Справа) У этого же пациента при КТ с контрастным усилением в аксиальной плоскости в отсроченной фазе сохраняется повышенное накопление контрастною препарата в выявленном образовании. Это образование было расценено как опухоль Клацкина, однако при хирургическом вмешательстве было подтверждено наличие воспалительной миофибробластной опухоли.
2. Рентгенография при воспалительной миофибробластической опухоли:
• Мягкотканное образование без специфических отличительных особенностей ± кальцификаты
3. КТ при воспалительной миофибробластической опухоли:
• Структура образования может быть гомогенной или гетерогенной
• Контур может быть инфильтрирующим
• Интенсивное контрастирование, сохраняющееся в отсроченной фазе исследования
4. МРТ при воспалительной миофибробластической опухоли:
• Мягкотканное образование как гомогенной, так и негомогенной структуры
• На Т1 ВИ характеризуется, как правило, изоинтенсивным сигналом по сравнению с мышцами или головным мозгом
• На Т2 ВИ в зависимости от выраженности фиброза может характеризоваться гипоинтенсивным сигналом
• Интенсивное контрастирование, сохраняющееся и в отсроченной фазе исследования
в) Дифференциальная диагностика воспалительной миофибробластической опухоли:
1. Воспалительная лейомиосаркома:
• При росте опухоли в виде пучка может иметь сходное гистологическое строение
• Сопровождается развитием паранеопластических синдромов
• Может быть обнаружена в различных областях тела
2. Гастроинтестинальная стромальная опухоль:
• По гистологическим особенностям может быть сходна с ВМО, если последняя локализуется в желудочно-кишечном тракте
• Положительная реакция на CD117 и CD34
• Отрицательная реакция на ALK
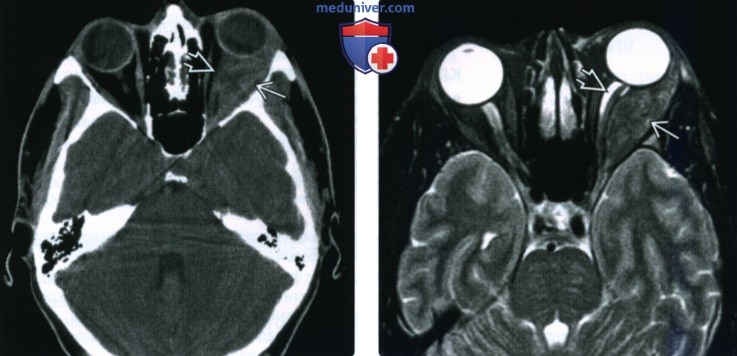
(Справа) У этого же пациента при МРТ в аксиальной плоскости в режиме STIR визуализируется поражение латеральной прямой мышцы глаза. Выявленное образование характеризуется относительно гипоинтенсивным сигналом, что указывает на наличие гиперклеточного инфильтрата или фиброза. Вследствие сдавливания влагалища зрительного нерва наблюдается скопление в нем ликвора. 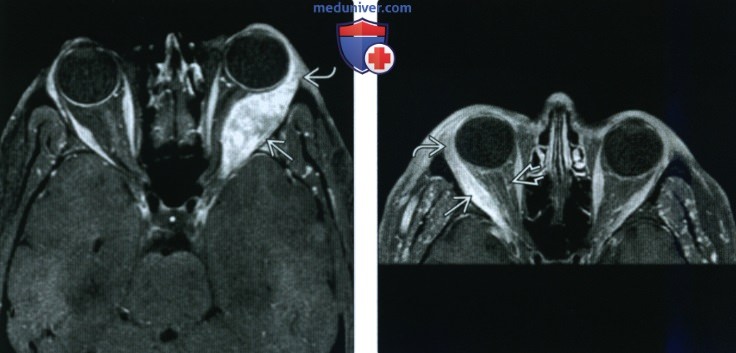
(Справа) При МРТ с контрастным усилением в аксиальной плоскости на Т1ВИ визуализируется изолированное утолщение латеральной прямой мышцы правого глаза, сопровождающееся поражением передних отделов ее сухожилия. Слабо выраженное неравномерное контрастирование области вдоль влагалища зрительною нерва указывает на воспалительный процесс в мышечной воронке глазницы. 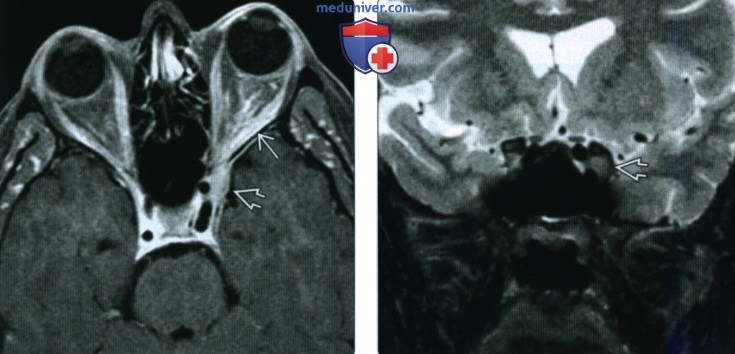
(Справа) У этого же пациента при МРТ в коронарной плоскости на Т2 ВИ выявленная в кавернозном синусе опухоль характеризуется гипоинтенсивным сигналом. Типоинтенсивный сигнал на Т2 ВИ в сочетании с контрастированием на Т1ВИ характерен для обызвествленной менингиомы и внутричерепной воспалительной миофибробластной опухоли.
1. Общая характеристика:
• Этиология:
о Не установлена
2. Макроскопические и хирургические особенности:
• Дольчатая опухоль от беловато-серого до коричнево-желтого или красного цвета:
о В центре может выявляться рубец
• Вариабельные плотность и структура поверхности опухоли на срезе: твердая, зернистая, эластичная, мясистая или миксоидная
д) Клинические особенности:
1. Проявления:
• Типичные признаки/симптомы:
о Лихорадка, ночная потливость, потеря веса
о Симптомы, возникающие при сдавливании органов:
— Боли в груди, одышка, кишечная непроходимость, увеличение окружности живота, обструкция выходного отверстия мочевого пузыря, частое мочеиспускание, гематурия
• Другие симптомы:
о Повышение СОЭ, анемия, тромбоцитоз, поликлональная гиперглобулинемия
о Аменорея при локализации опухоли в надпочечнике
о Тромбоз синусов твердой мозговой оболочки
о В редких случаях дерматомиозит или облитерирующий флебит
2. Демография:
• Возраст:
о Обычно встречается у лиц молодого возраста, в том числе и детей:
— Как правило, диагностируется в возрасте до 20 лет
— Образование может быть выявлено в любом возрасте
• Пол:
о Некоторое преобладание женского пола
3. Течение и прогноз:
• 15-25% внелегочных образований рецидивируют:
о Вероятность рецидива опухолей, располагающихся в головном мозге, составляет до 40%
• Метастазы выявляют менее чем в 5% случаев
• После удаления опухоли системные симптомы исчезают
4. Лечение:
• Радикальная резекция
• В редких случаях регистрируется положительный ответ на лечение нестероидными противовоспалительными препаратами и глюкокортикоидами
• Если после лечения возникают системные симптомы, необходимо дообследование для исключения рецидивирования или метастазирования
е) Список использованной литературы:
1. Cheng KJ et al: A case report of an inflammatory myofibroblastic tumor of the neck: A focus on the computed tomography and magnetic resonance imaging findings. Oncol Lett. 10(1):518-522, 2015
2. Chung EM et al: Solid tumors of the peritoneum, omentum, and mesentery in children: radiologic-pathologic correlation: from the radiologic pathology archives. Radiographics. 35(2):521-46, 2015
3. Hohne S et al: Inflammatory pseudotumor (IPT) and inflammatory myofibroblastic tumor (IMT): a representative literature review occasioned by a rare IMT of the transverse colon in a 9-year-old child. Tumori. 101(3):249-56, 2015
Редактор: Искандер Милевски. Дата публикации: 9.5.2021
Миофибробластическая опухоль что это такое
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Случайный выбор
данная функция, случайным образом выбирает информацию для Вашего изучения,
запустите выбор нажав кнопку ниже
Случайный выбор
Обратная связь
Напишите нам
Сообщение об ошибке
Что улучшить?
Enter the password to open this PDF file:
Полный текст статьи:
Воспалительная миофибробластическая опухоль (IMT, inflammatory myofibroblastic tumor) — редкое пролиферативное заболевание неясной этиологии, характеризующееся пролиферацией веретенообразных или эпителиоидных миофибробластов, смешанных преимущественно с мононуклеарными воспалительными клетками. IMT обычно считается доброкачественным поражением, хотя в некоторых случаях агрессивно ведет себя с точки зрения местного рецидива и метастазирования.
Исследователями из Италии[1] описан случай лечения пациентки с IMT поперечной ободочной кишки и синхронной гастроинтестинальной стромальной опухолью (GIST) желудка.
59-летняя женщина с десятилетним язвенным колитом и эпизодом цитомегаловирусной инфекции в анамнезе, а также сопутствующими патологиями (артериальная гипертензия, мерцательная аритмия) была госпитализирована в клинику с симптомами острого рецидива язвенного колита — болью в животе, диареей, гематохезией и ректальными тенезмами. Выявлены микроцитарная гипохромная анемия и нейтрофильный лейкоцитоз.
При эндоскопическом исследовании толстая кишка имела вид трубы с диффузной гиперемией, эрозиями слизистой и двухсантиметровым полипоидным поражением с нерегулярной формой на уровне поперечной ободочной кишки. Гистопатологическое исследование биоптатов выявило мезенхимальное новообразование с неопределенными признаками злокачественности. В ходе рентгенокомпьютерной томографии органов брюшной полости с болюсным усилением обнаружено неоднородное гиподенсированное образование 2,5 × 1,6 см в диаметре с интенсивным усилением в артериальной фазе, локализованное в поперечной ободочной кишке (рис. 1).
Из-за тяжести воспалительных заболеваний кишечника, устойчивых к иммуносупрессивному и стероидному медикаментозному лечению, пациентка оперирована. Было решено выполнить тотальную колэктомию с терминальной илеостомией. При ревизии органов брюшной полости выявлено новообразование на передней стенке желудка, оно было удалено. Послеоперационных осложнений не отмечалось. Пациентка выписана через 7 дней после операции. Через некоторое время выполнена проктэктомия и формирование J-резервуара. Илеостома ликвидирована через месяц после последней операции.
При патоморфологическом исследовании обнаружено язвенное полипоидное поражение 2 × 2,8 см в диаметре в окружении слизистой оболочки с бархатистостью (рис. 2).
Микроскопическое исследование новообразования показало мезенхимальную пролиферацию, состоящую из веретенообразных клеток — мономорфных и без значительной атипии, организованных в пучки, ассоциированных с диффузной лимфоцитарной инфильтрацией, плазматическими клетками и эозинофилами, распространяющимися на слизистую оболочку и инфильтрирующими подслизистую оболочку (рис. 3, 4).
При иммуногистохимическом исследовании: положительно для SMA, отрицательно для цитокератина, десмин, S-100, Мелан-А, CD34, CD117, DOG-1, CD21, CD23, CD1a и ALK. На основании этих результатов диагноз IMT был подтвержден.
Патоморфология удаленного новообразования желудка показала GIST. При КТ-исследовании через 6 месяцев после операции признаков рецидива заболевания не выявлено.
Миофибробластическая опухоль что это такое
Кафедра госпитальной хирургии ГБОУ ВПО «Волгоградский государственный медицинский университет» Минздрава России
Кафедра госпитальной хирургии ГБОУ ВПО «Волгоградский государственный медицинский университет» Минздрава России
Воспалительные миофибробластические опухоли пищеварительного тракта
Журнал: Онкология. Журнал им. П.А. Герцена. 2014;3(6): 72-76
Маскин С. С., Карсанов А. М. Воспалительные миофибробластические опухоли пищеварительного тракта. Онкология. Журнал им. П.А. Герцена. 2014;3(6):72-76.
Maskin S S, Karsanov A M. Inflammatory tumors of the digestive tract. P.A. Herzen Journal of Oncology. 2014;3(6):72-76.
https://doi.org/10.17116/oncolog2014672-76
Кафедра госпитальной хирургии ГБОУ ВПО «Волгоградский государственный медицинский университет» Минздрава России
Рассмотрены вопросы этиологии, морфологической и иммуногистохимической характеристики, клинических проявлений, диагностики, лечения воспалительных миофибробластических опухолей органов пищеварительного тракта. Приведены данные о причинах рецидивов и консервативных методах лечения. Показано, что основная трудность лечения заключается в выборе адекватного объема резекции и непредсказуемом течении послеоперационного периода, а в качестве перспективного направления для прогноза исхода лечения предполагается поиск достоверных критериев дифференциации между агрессивными и неагрессивными формами воспалительных опухолей.
Кафедра госпитальной хирургии ГБОУ ВПО «Волгоградский государственный медицинский университет» Минздрава России
Кафедра госпитальной хирургии ГБОУ ВПО «Волгоградский государственный медицинский университет» Минздрава России
С современных позиций под воспалительными миофибробластическими опухолями (inflammatory myofibroblastic tumors) (ВМО) понимают гетерогенную группу очень редких, преимущественно доброкачественных, мезенхимальных новообразований с широким спектром биологического поведения и непредсказуемым прогнозом. Среди висцеральных интраабдоминальных локализаций ВМО чаще всего выявляют в печени, затем в желудке, кишечнике и селезенке [1]. Впервые ВМО была описана в печени G. Pack и H. Baker в 1953 г. [2]. ВМО чаще всего диагностируют в легких, но возможна их локализация в любой анатомической области [3—5].
Настоящий обзор посвящен ВМО полых органов пищеварительной системы, поскольку поражение паренхиматозных органов не только встречается значительно чаще, но и по целому ряду объективных причин не может быть корректно систематизировано в когорте с опухолями пищеварительного тракта [6, 7].
Авторство термина «воспалительные псевдоопухоли» принадлежит W. Umiker и L. Iverson, применившим его в 1954 г. для описания опухоли легкого, схожей по отдельным клинико-диагностическим характеристикам со злокачественными опухолями [8]. Для обозначения данного новообразования использовали множество терминов: воспалительная псевдоопухоль, плазмоклеточная гранулема, плазмоклеточная псевдоопухоль, воспалительный миофибробластический пролиферат, сальниково-брыжеечная миксоидная гамартома, ксантоматозная псевдоопухоль, воспалительная фибросаркома [9].
Согласно гистологической классификации ВОЗ по патологии и генетике опухолей мягких тканей, изданной в 2013 г., ВМО (код 8825/1) отнесены к промежуточным (редко метастазирующим) фибробластическим/миофибробластическим опухолям [10]. Характерной особенностью этого класса опухолей является местно-агрессивный характер роста, обусловливающий высокую частоту местных рецидивов при недостаточном хирургическом клиренсе, и способность формировать редкие (до 2%) отдаленные метастазы в лимфатических узлах и легких, предсказать которые по характеру первичной опухоли обычно крайне затруднительно [4].
Макроскопически ВМО чаще бывают представлены одним или несколькими (до 20% случаев) четко отграниченными и даже инкапсулированными опухолевыми узлами с разным соотношением фиброзных и некротических компонентов [5]. Микроструктурно ВМО преимущественно сформированы плохо организованными пучками веретеновидных миофибробластов (реже — фибробластов) и полиморфными воспалительными клетками (плазматическими, лимфоцитами, макрофагами и эозинофильными гранулоцитами), локализованными в массиве опухоли среди коллагенизации разной степени выраженности в виде очаговых либо пучковых пролифератов [9, 11].
В ранней работе C. Coffin и соавт. [11] выделяют три основных гистологических варианта ВМО:
а) миксоидный с сосудистым и воспалительным компонентами, напоминающий узловой фасцит;
б) компактный веретеноклеточный с непостоянными воспалительными клетками (лимфоциты, плазматические клетки и эозинофилы), напоминающий фиброзную гистиоцитому;
в) коллагенизированный (фиброзный), напоминающий десмоид или келлоид.
При иммуногистохимическом (ИГХ) исследовании ВМО проявляют выраженную иммунопозитивность к виментину, очаговую иммунопозитивность к гладкомышечному актину (Smooth Muscle Actin — SMA), анапластической лимфомной киназе (Anaplastic Lymphoma Kinase — ALK) и еще более редкую к десмину. При этом они иммунонегативны к панцитокератину, протеину S-100, CD21, CD34, CD35, CD68, CD117, Ki-67, p53 [5, 11—16]. Присутствие лимфоплазмоцитарной инфильтрации отмечают в 100% случаев, в том числе и в заинтересованных лимфатических узлах [3, 9, 13, 16].
ВМО чаще встречаются у детей и лиц молодого возраста [9, 17—19], но могут быть диагностированы у лиц любого пола и в любом возрасте [5, 9]. Этиология ВМО до сих пор остается неизвестной [9, 11]. В качестве причин ВМО приводятся травмы и воспаления после хирургических вмешательств, иммунные и аутоиммунное заболевания, перенесенное лечение по поводу некоторых видов сарком, имеющих воспалительный компонент и сопровождающихся системной воспалительной реакцией и цитокинемией [20, 21]. Гипотетически ВМО рассматриваются как морфологическое выражение реактивных, репаративных, инфекционных и неопластических, в первую очередь лимфопролиферативных, процессов [9, 14, 16, 18]. S. Lee и соавт. [22] верифицировали ВМО желудка, индуцированную радиочастотной термоабляцией гепатоцеллюлярной карциномы.
Диагностика ВМО
У ВМО не были выявлены какие-либо эксклюзивные физические и анатомические (перфузионные) свойства, позволяющие использовать это в визуализационных методах дифференциальной диагностики от сарком и иных злокачественных опухолей [1, 9, 20]. При магнитно-резонансной томографии (МРТ) ВМО обычно имеют низкую интенсивность сигнала на Т1 и гиперинтенсивны на Т2-взвешенных изображениях, что соответствует их фиброзному характеру [9, 23]. При контрастной компьютерной томографии (КТ) ВМО выявляются как гомо-, так и гетерогенные поражения с задержкой элиминации контраста, обусловленной наличием фиброза [9, 17].
Формальное морфологическое сходство опухолей различных гистогенетических групп, их кругло-, веретено- или полиморфно-клеточное строение, степень коллагенизации и миксоидной трансформации стромы в большинстве случаев не дают возможность патологоанатому установить уверенный морфологический диагноз. Окончательная диагностика должна базироваться на результатах ИГХ-биоптатов с помощью моно- и поликлональных антител [1, 11, 12, 16, 18]. Однако избирательность экспрессии цитоспецифичностных маркеров (гладкомышечный актин) и белков промежуточных филаментов (десмин) как критерий, характерный для данной конкретной гистогенетической группы или нозологической формы, относительная, так как оба этих маркера применимы и для ИГХ-диагностики лейомиосаркомы [1, 4].
ВМО глотки
Сообщения о поражении глотки ВМО не превышают десятка наблюдений исключительно взрослых пациентов [24, 25]. Проявлялись ВМО этой локализации в виде внешней обструкции дыхательных путей [26]. Несмотря на то что после хирургического лечения в четверти случаев имел место рецидив, вариант с адъювантной терапией авторами не рекомендуется [24].
ВМО пищевода
ВМО пищевода являются казуистикой. Сочетание стойкой, усугубляющейся в динамике дисфагии, длительного рефлюкс-эзофагита (возможный этиологический фактор), инструментальных признаков подслизистой структурирующей солидной опухоли, является основанием для включения в дифференциальный ряд помимо саркомы и ВМО [27, 28], особенно при наличии системной воспалительной реакции [29], в детском возрасте, при большом размере опухоли, как в наблюдении, описанном китайскими коллегами, когда ВМО пищевода достигала 20 см в длину и 6 см в диаметре [30]. При эффективной дооперационной диагностике и благоприятных анатомических условиях возможна эндоскопическая энуклеации опухоли [31]. Однако большинство авторов сходятся во мнении, что операцией выбора является субтотальная резекция пищевода [27—30].
ВМО желудка
Общее число описанных в литературе ВМО желудка (ВМОЖ) не превышает 40, причем у взрослых на момент настоящей публикации в англоязычной литературе приведены сведения о 15 случаях в мире [12—18, 32], большинство из которых являются единичными [12, 13, 15, 17, 18] либо небольшими сериями наблюдений [11, 16].
Среди особенностей желудочных ВМО от других отмечают отсутствие клеточной атипии или некроза. Митотическая активность ВМОЖ слабая: от 1 до 2 митозов в каждом из 10 полей зрения [12—16].
Симптомами первичных ВМОЖ являются периодическая боль в животе, потеря аппетита, изжога, тошнота, рвота, лихорадка, потеря массы тела, пальпируемая опухоль в брюшной полости, желудочное кровотечение, анемия, тромбоцитоз, гипергаммаглобулинемия, лабораторные признаки воспалительного процесса, повышенная СОЭ [12—16]. Они могут проявляться в течение нескольких месяцев или лет. Уникальное в своем роде осложнение ВМОЖ в виде гемоперитонеума описали S. Park и соавт. [13] у взрослой пациентки 55 лет, а А. Mirshemirani и соавт. [18] у 8-летней девочки.
Дифференцировать ВМОЖ следует с гастроинтестинальной стромальной опухолью (GIST), полипом, опухолью мышечной оболочки (лейомиомой, лейомиосаркомой), шванномой и саркомой [12, 13, 15, 18].
При ВМО, как правило, опухоль поражает все слои стенки желудка, при большом размере имеет тенденцию к распространению на связки желудка [13] и далее, имитируя диагностические признаки злокачественной опухоли [13, 17]. При трансабдоминальном УЗИ чаще выявляется гипоэхогенная, реже гиперэхогенная, четко отграниченная опухоль в эпигастральной области по срединной линии, расположенная кпереди от аорты, интактная по отношению к крупным сосудистым структурам, иногда с микрокальцинатами в толще [17, 32]. В среднем размер опухоли варьирует от 3 до 8 см, но может достигать 18 см в наибольшем измерении [12—18].
В диагностике ВМО, как и других неэпителиальных опухолей желудка, важное значение имеет эндоскопическое и особенно эндосонографическое исследование (ЭУЗИ) с тонкоигольной пункционной аспирационной биопсией [32]. Эндоскопически, наряду с изъязвлением слизистой оболочки над опухолью [12, 15], может быть выявлен гнойный свищ [14]. При ЭУЗИ ВМО обычно дифференцируются как овальные гипоэхогенные массы, исходящие из разрушенного мышечного слоя желудка [12, 32].
ВМО двенадцатиперстной кишки
При локализации ВМО в двенадцатиперстной кишке (ДПК), чаще выявляемой в детском возрасте, превалируют симптомы дуоденальной обструкции, а при локализации в большом дуоденальном сосочке (БДС) [33] или головке поджелудочной железы [34] манифестируют признаки билиарной и панкреатической гипертензии, в связи с чем ВМО не были отличимы от локализованного рака головки поджелудочной железы.
Наиболее частыми клиническими проявлениями ВМО ДПК являются пальпируемая опухоль, потеря массы тела, лихорадка, гипохромная анемия, спленомегалия, симптомы высокой кишечной непроходимости [18, 35]. Однако в наблюдении, описанном британскими коллегами, у 16-летнего подростка показанием к обследованию были непостоянная боль в эпигастральной области, ночная потливость, общее недомогание [36].
При ВМО ДПК дооперационная морфологическая верификация часто недостижима, но при стойком опухолевом обструктивном синдроме необходимо выполнение резекционного вмешательства без нее [34]. Порой лишь после панкреатодуоденальной резекции может быть установлен истинный диагноз [35].
Значение адъювантной химиотерапии и лучевой терапии в лечении ВМО ДПК не изучено и спорно [34]. Так, Р. Mattei и соавт. [37] наблюдали быстрый регресс ВМО ДПК на фоне внутривенного лечения кеторолаком у ребенка 13 лет. При рецидиве ВМО после сегментарной резекции верхне-горизонтальной части ДПК G. Wynn и соавт. [36] эффективно применили иммуносупрессивную терапию. Редкое наблюдение успешного лечения ВМО БДС путем эндоскопической папиллэктомии (размер опухоли 2,5×2 см) описали J. Kwak и соавт. [33].
ВМО тонкой кишки
В силу понятных причин те редкие случаи ВМО тонкой кишки, которые описаны, выявляются только после исследования препарата после хирургического лечения кишечной непроходимости, в основном у детей первых лет [18, 38] и даже месяцев жизни [39]. В одном случае наряду с абдоминальным синдромом была описана клиническая картина увеита [40]. ВМО может быть причиной инвагинационной тонкокишечной непроходимости [41, 42]. При комплексном применении всего арсенала современных методов визуализации (трансабдоминальное УЗИ, цветовая допплерография, КТ) возможно выявление опухолевого генеза илеуса [42] при неспецифических, расплывчатых клинических данных (боль в животе, тошнота и рвота).
При подтверждении с помощью КТ бластомогенного характера обтурации проблемы дифференциальной диагностики ВМО тонкой кишки обычно вторичны, так как степень обструкции неизбежно диктует необходимость неотложного оперативного вмешательства [38]. Хотя резекционный клиренс радикальности при ВМО тонкой кишки достижим всегда, рекомендуется длительное наблюдение на предмет рецидива, особенно за детьми [39].
ВМО толстой кишки
Число случаев описания ВМО толстой кишки (ТК) в специальной литературе последнего десятилетия не превышает десятка у пациентов от 32-месячного до 79-летнего возраста, преимущественно мужского пола [7, 18, 43]. Семиотика ВМО ТК не является специфичной и складывается из анемии, боли в животе или грудной клетке, рвоты, лихорадки, потери массы тела, наличия скрытой (явной) крови в кале, проявлений кишечной инвагинации [18, 41, 44].
Лечение ВМО пищеварительного тракта
Дооперационно в большинстве случаев невозможно дифференцировать, является ли опухоль злокачественной или доброкачественной. Поэтому, по мнению большинства авторов [11—14, 18, 34], расширенное хирургическое удаление является наиболее оправданным методом лечения ВМО пищеварительного тракта.
ВМО абдоминальной локализации имеют повышенную склонность к агрессивному течению с множественными рецидивами, инвазией в соседние структуры [17], что в немалой степени связано с наличием факторов, исключающих полное хирургическое удаление — вовлечение жизненно важных структур и мультифокальный рост [1, 9, 11]. В этих случаях следует проводить симптоматическую терапию, а при прогрессировании заболевания либо его симптомов — более агрессивные методы: химиотерапию или лучевое лечение [14, 18]. По сборной статистике адъювантную химиотерапию или лучевую терапию применяют не более чем в 6% случаев [11].
Паллиативные резекции либо симптоматические операции оправданны при осложненном течении ВМО пищеварительного тракта в виде геморрагического или обструктивного синдрома, когда радикальные, в первую очередь мультиорганные, резекции не показаны пациентам по тяжести соматического статуса. При этом могут быть применены: высокодозная кортикостероидная терапия, лучевая терапия, химиотерапия (циклоспорин, метотрексат, азатиоприн и циклофосфамид) [14], таргетная терапия — Infliximab и Xalkori (Crizotinib) [6]. Y. Tao и соавт. [45] при нерезектабельной забрюшинной ВМО успешно применили комбинацию полихимиотерапиии (ПХТ) (метотрексат/цисплатин) в средних дозах с пероральным приемом нестероидных противовоспалительных препаратов (НПВП). Период безрецидивного незавершенного наблюдения составил более 3 лет.
Говоря о новых возможностях лекарственного лечения рецидивных ВМО, K. Johnson и соавт. [46] из клиники Мейо сообщили об обнадеживающих результатах включения НПВП (ингибитора циклооксигеназы-2 целекоксиба) в стандартный режим ПХТ сарком (винкристин, ифосфамид, доксорубицин) у 5-летнего ребенка с мультфокальными метастазами по плевре ВМО легкого, выявленными через 11 мес после хирургического лечения, добившись 4-летней продолжающейся ремиссии, что согласуется с результатами иранских педиатров [18]. Единичные наблюдения иллюстрируют эффективность монотерапии НПВП в лечении нерезектабельных первичных ВМО печени [47, 48], нерезектабельных абдоминальных [49] и повторных рецидивных ВМО легких [50].
Факторы рецидива ВМО
Вероятность рецидива и метастазов ВМО может прямо коррелировать с размером опухоли, ALK-реактивностью [5]. Так, C. Coffin и соавт. [5] из университета штата Юта в США на основании целенаправленного анализа множества потенциальных факторов агрессивности 59 ВМО различных локализаций выявили в 85% вероятность рецидива при их висцеральной локализации. Если ALK-позитивный характер опухоли был ассоциирован только с местным рецидивом, то все случаи с развившимися отдаленными метастазами отмечены у пациентов с ALK-негативными ВМО. По другим данным, высокий резидуальный потенциал ВМОЖ был сопряжен с иммунологической либо молекулярно-генетической позитивностью по гену ALK-1 либо ALK-TPM-3 [12]. После хирургического лечения первичных ВМО локальные, в том числе мультифокальные, рецидивы выявляются с интервалом в 1—24 мес (в среднем 6 мес, при медиане 10 мес) в 15—37% случаев [9, 11, 16, 17]. Повторное оперативное вмешательство позволяет рассчитывать на выздоровление [16].
Стандартизированный подход применительно к ВМО в мире отсутствует, за исключением Франции, где существует «Руководство по лечению локализованных воспалительных миофибробластических опухолей у детей» [19], постулирущее, что ВМО могут с одинаковой вероятностью возникать у детей в любом возрасте, с повсеместной локализацией, чаще в верхних и нижних дыхательных путях. Гистологически ВМО состоят из массы веретенообразных миофибробластов и воспалительного инфильтрата. Диагноз ВМО должен быть подтвержден отсутствием молекулярных и иммуногистохимических маркеров саркомы. Дифференцировка между ВМО и саркомой необходима в связи с различной тактикой лечения. Лечение ВМО включает операцию с нео- или адъювантной кортикостероидной терапией. При нерезектабельной опухоли химиотерапия может быть оправданна, чтобы избежать калечащей операции.
Заключение
ВМО ДТ являются чрезвычайно редкими мезенхимальными опухолями. Дифференциальная диагностика ВМО ДТ сложна, обширна, зависима от клинико-морфологических особенностей конкретной опухоли, объема диагностического комплекса, качества забора биоптата. Основная трудность их лечения заключается в выборе адекватного объема резекции и непредсказуемом течении послеоперационного периода, так как до сих пор нет достоверных и убедительных клинических, гистопатологических или генетических критериев прогнозирования рецидива или метастазов. Предметом особого интереса исследователей должно быть изучение достоверных критериев дифференциации между агрессивными и неагрессивными формами ВМО.