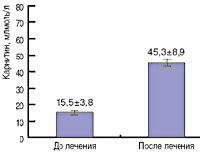
недостаток карнитина что это такое
Карнитин
Описание
Карнитин (L-карнитин) относится к витаминоподобным веществам. Присутствует в животных тканях, растениях, микроорганизмах (дрожжах). Особенно высоко его содержание в мышцах, где он впервые был обнаружен В.Г.Гулевичем.
Животные и человек способны к собственному синтезу карнитина. Наиболее вероятным его предшественником служит глютаминовая кислота.
Источники карнитина
Традиционными пищевыми источниками карнитина являются мясо, рыба, птица, молоко, сыр, творог. Также вещество может быть получено путем химического синтеза.
Физиологическое значение
Таким образом, L-карнитин влияет на эффективность энергетического обмена с участием жиров, активирует жировой обмен, мобилизует жир из жировых депо, способствует повышению выносливости, повышению переносимости физических нагрузок, восстановлению работоспособности после длительных физических нагрузок. Способствует снижению уровня холестерина и триглицеридов в крови, избыток которых является потенциальным фактором риска развития ряда сердечно-сосудистых заболеваний.
Показана роль карнитиновой недостаточности в развитии синдрома хронической усталости (СХУ). Основные проявления этой распространенной патологии представлены немотивированной выраженной слабостью, трудностью концентрации внимания, головокружением, сонливостью; большую роль играют дефицит макро- и микронутриентов, пищевая аллергия, чрезмерные психические и физические нагрузки, инфекции. Установлена четкая связь между уровнем L-карнитина в плазме крови и риском развития СХУ. Степень дефицита L-карнитина прямо связана со степенью выраженности симптомов СХУ: чем меньше L-карнитина содержится в плазме крови человека, тем ниже его работоспособность и хуже самочувствие.
Ряд исследователей указывают на эффективность ацетил-L-карнитина при лечении пациентов со старческой депрессией и возрастными нарушениями памяти.
Карнитин находит применение при тяжелых физических или спортивных нагрузках.
Признаки недостаточности
Специфических признаков недостаточности карнитина нет.
Неспецифически дефицит карнитина может проявляться:
Суточная потребность в карнитине
Адекватный уровень потребления карнитина для взрослых составляет 300 мг в сутки. Верхний допустимый уровень потребления карнитина для взрослых составляет 900 мг в сутки («Единые санитарно-эпидемиологические и гигиенические требования к товарам, подлежащим санитарно-эпидемиологическому надзору (контролю)» Таможенного союза ЕврАзЭС).
Коррекция недостаточности карнитина у детей с наследственными заболеваниями обмена веществ
Опубликовано в:
Педиатрическая фармакология 2003 №1(4) Е.А.Николаева, А.Н.Семячкина, Е.С.Воздвиженская, М.Н.Харабадзе, П.В.Новиков
Московский НИИ педиатрии и детской хирургии Министерства здравоохранения РФ
Представлен анализ собственных данных и сведений литературы о формах и причинах недостаточности карнитина у детей. Выявлен низкий уровень общего карнитина в крови у 16 пациентов с наследственной патологией обмена веществ, в том числе впервые установлена недостаточность карнитина у детей с синдромом Марфана и аутоиммунным полиэндокринным синдромом I типа. Продемонстрирована эффективность использования Элькара ® для коррекции дефицита карнитина у детей.
Ключевые слова: карнитин, митохондриальные болезни, органические ацидемии, синдром Марфана, аутоиммунный полиэндокринный синдром I типа
Влияние карнитина на жировой обмен осуществляется также его участием в цитоплазматическом синтезе жирных кислот путем обратного переноса необходимых для этого ацетильных групп митохондриального ацетил-КоА через ми-тохондриальную мембрану в цитоплазму [3].
Значение для организма карнитинзависимых процессов транспорта и окисления жирных кислот становится очевидным в условиях высокого расходования энергетических ресурсов, требующих повышенного катаболизма, то есть при интеркуррентных заболеваниях, усиленных физических или эмоциональных нагрузках, а также при недостаточном питании. После истощения запасов углеводов липиды становятся главным источником синтеза АТФ в организме [2, 4].
Помимо перечисленного, карнитин регулирует отношение ацил-КоА/свободный КоА в митохондриях. Путем связывания ацильного радикала он высвобождает КоА и тем самым активирует интенсивность энергетического метаболизма [5, 6].
Следующая важная функция карнитина заключается в его способности образовывать соединения с различными органическими кислотами, являющимися промежуточными
продуктами окислительных процессов. Данные вещества, которые накапливаются в митохондриях, цитоплазме клеток и в сыворотке крови, оказывают мембранотоксическое действие и ингибируют активность ряда ферментов. Выведение этих токсичных органических соединений из организма происходит через почки в виде ацилкарнитинов [7].
Эндогенное образование карнитина осуществляется в основном клетками печени и почек путем трансформации лизина; донатором метильных групп служит метионин [8]. Источником аминокислот служат белки пищевых продуктов, а также собственные протеины мышечной ткани. Однако эндогенный синтез обеспечивает суточную потребность в кар-нитине лишь приблизительно на 25%. Остальное количество должно поступать с пищей животного происхождения: мясом, рыбой, птицей и молочными продуктами; грудное молоко также содержит карнитин. Подсчитано, что потребность в карнитине у взрослых составляет от 200 до 500 мг/сут, при этом обычное меню обеспечивает поступление около 100-300 мг/сут [9].
Благодаря наличию в своей структуре асимметрического атома углерода, молекула карнитина может существовать в двух изомерных формах: D- или L-стереоизомеров. В природных источниках обнаружен L-карнитин, и только он биологически эффективен. На важность понимания существенных различий между природным L-карнитином, D-карнити-ном и рацемическим D,L-карнитином (карнитина хлорид) было указано в ряде экспериментальных и обзорных работ. На основании многочисленных исследований было сделано два важных вывода:
1) только L-карнитин проявляет биологическую активность
2) D-карнитин негативно влияет на различные стороны метаболизма.
Так, установлено, что D-карнитин препятствует окислению жирных кислот в митохондриях и образованию энергии, конкурентно ингибирует активное усвоение L-карнитина органами и тканями, а также вызывает нарушение биосинтеза L-карнитина в печени, что приводит к его недостаточности в организме, особенно, в скелетных и сердечной мышцах, вызывая миастению и сердечную аритмию. Следовательно, D-карнитин представляет собой не просто неэффективное или биологически инертное вещество, а скорее вредную и потенциально опасную примесь. Именно поэтому уже в середине 80-х годов перестали применять рацемический карнитина хлорид, и в настоящее время во всем мире используются только препараты на основе L-карнитина.
Выделяют первичный и вторичный дефицит карнитина [7, 10].
Первичный дефицит, обусловленный дефектом транспорта карнитина в клетки и ткани, является генетическим детерминированным заболеванием с аутосомно-ре-цессивным типом наследования [2, 11]. Системная форма характеризуется резкой мышечной слабостью и гипотонией, тяжелой кардиомиопатией, жировой дистрофией печени и почек. При мышечной форме у больных наблюдается миопа-тия с накоплением липидов.
Низкое содержание карнитина в тканях у детей с синдромом Ретта, повидимому, обусловлено нарушением процессов биоэнергетики, что проявляется повышенным уровнем лактата и пирувата в крови, активацией перекисного окисления липидов [14, 15]. При синдроме Рейе, манифестирующем на фоне вирусной инфекции, и у больных с эпилептическими синдромами на фоне лечения препаратами вальпроевой кислоты недостаточность карнитина, вероятно, вызвана расстройством метаболизма жирных кислот, высокой почечной экскрецией накапливающихся ацилкарнитинов [16]. Резко выраженный дефицит карнитина характерен для многих форм заболеваний сердца: гипертрофической, дилатационной, гистиоцитарной, диабетической кардиомиопатии, фиброэластоза эндокарда и др., что связано с высокой зависимостью миокардиальных энергетических процессов от липидного метаболизма [9].
Дети раннего возраста особенно чувствительны к недостаточности карнитина. Эндогенные запасы у них быстро истощаются при различных стрессовых ситуациях (инфекционные заболевания, желудочно-кишечные расстройства, нарушения вскармливания). Биосинтез карнитина резко ограничен в связи с небольшой мышечной массой, а поступление с обычными пищевыми продуктами не способно поддержать достаточный уровень в крови и тканях. Недоношенные и дети с малой массой особенно зависят от дополнительного получения карнитина [17].
У детей, страдающих расстройствами питания, рахитом, различными гастроинтестинальными заболеваниями (в том числе целиакией, муковисцидозом и др.) и болезнями почек, отмечается нарушение усвоения карнитина и его потеря через желудочно-кишечный тракт и почечные канальцы. Недостаточность карнитина отмечена у некоторых категорий пациентов, получающих специализированную диетотерапию, ограничивающую прием белковых продуктов, особенно животного происхождения (например, у больных с фенилкетонурией), а также у лиц, придерживающихся вегетарианской диеты [18].
Пациенты и методы
В отделе наследственных и врожденных заболеваний Московского НИИ педиатрии и детской хирургии МЗ РФ было обследовано 16 детей, страдающих различными формами наследственной патологии: в том числе митохондриальными синдромами Кернса-Сейра (3 ребенка) и Барта (1), нарушением окисления жирных кислот (4), изовалериановой ациде-мией (1), синдромом Марфана (4) и аутоиммунным полиэндокринным синдромом I типа (3). Возраст больных колебался от 3 до 14 лет.
Результаты исследования и их обсуждение
Результаты проведенного обследования позволили выявить у детей комплекс клинических и лабораторных признаков, которые могли быть обусловлены имеющейся кар-нитиновой недостаточностью. В клиническом статусе у всех пациентов обращала внимание низкая толерантность к физической нагрузке, мышечная слабость и гипотония. У большинства больных отмечались снижение умственной работоспособности, головная боль, нарушение внимания и памяти, поражение сердца (в том числе кардиомиопатия), координа-торные и эндокринные расстройства. У половины пациентов было выявлено отставание физического развития, повторные приступы тошноты и рвоты, нарушение зрения (в том числе пигментный ретинит). У отдельных больных наблюдалось увеличение размеров и нарушение функции печени, тугоухость. Повышенный уровень лактата в крови (2,1-4,4 ммоль/л, норма 1,0-1,7 ммоль/л) был установлен у всех детей.
Таблица. Уровень общего карнитина в крови у больных с генетически детерминированной патологией обмена веществ (n = 16)
Рисунок. Динамика уровня общего карнитина в крови у больных с генетически детерминированной патологией обмена веществ через 4 нед после начала приема Элькара (n = 10).
Таким образом, у всех 16 пациентов с наследственной патологией содержание общего карнитина в крови было низким, хотя степень дефицита оказалась различной. Так, у 1 из 3 больных с митохондриальным синдромом Кернса-Сейра уровень карнитина в крови был лишь немного ниже границы нормы, а у другого ребенка с тем же заболеванием содержание карнитина было резко снижено (см. таблицу).
Помимо оценки клинического статуса больных у 10 детей через 4 нед после назначения Элькара был осуществлен контроль за изменением уровня карнитина в крови (см. рисунок), который показал достоверное его увеличение (в среднем в 3 раза). Среднее содержание общего карнитина в сыворотке крови у больных превысило нижнюю границу нормы, а у отдельных пациентов приблизилось к параметрам контрольной группы.
Увеличение уровня карнитина в крови сочеталось с улучшением состояния и самочувствия детей, снижением утомляемости, уменьшением выраженности миопатического синдрома, улучшением походки и координации движений, прекращением приступов метаболической декомпенсации.
Результаты обследования детей с болезнями обмена жирных кислот, органической ацидемией и митохондриальной патологией, таким образом, подтвердили имеющиеся в литературе сведения о недостаточности карнитина при перечисленных заболеваниях.
Результаты клинического обследования детей с аутоиммунным полиэндокринным синдромом I типа, наличие у них резко выраженной утомляемости, миопатических проявлений, мультисистемный характер поражения с вовлечением эндокринной системы, повышенный уровень молочной кислоты в крови заставили проводить дифференциальный диагноз с митохондриальной патологией. Однако у всех 3 больных окончательный диагноз аутоиммунного полиэндокринного синдрома был доказан обнаружением характерной для него генной мутации в локусе 21q22.3.
Таким образом, проведенные исследования доказали наличие недостаточности карнитина при ряде форм наследственных метаболических заболеваний и продемонстрировали высокую эффективность отечественного медикаментозного средства Элькар для коррекции дефицита карнитина. Несомненным достоинством препарата является простота применения, практическое отсутствие противопоказаний и побочных действий. Полученные результаты свидетельствуют, однако, что при большинстве форм генетически детерминированной патологии обмена веществ ликвидация карнитиновой недостаточности требует более длительного применения препарата и наблюдения за больными.
Первичный системный дефицит карнитина
Первичный системный дефицит карнитина – генетическое заболевание, обусловленное нарушением метаболизма этого вещества, приводящим к увеличению его потери организмом с мочой. Проявления зависят от формы патологии – у больных могут обнаруживаться нарушения аппетита, гепатомегалия, поражения центральной нервной системы и сердца. Диагностика первичного системного дефицита карнитина производится биохимическими исследованиями плазмы крови, методами медицинской визуализации (рентгенография, УЗИ), молекулярно-генетическими анализами. Лечение этого заболевания осуществляется путем назначения перорального приема карнитина для восполнения его дефицита (заместительная терапия).
Общие сведения
Первичный системный дефицит карнитина (дефицит транспортера карнитина) – наследственная патология, характеризующаяся выраженными расстройствами метаболизма по причине нарушения процессов усвоения карнитина поступающего с пищей. Это заболевание было впервые описано в 1975-м году Карпати, которому удалось доказать взаимосвязь наблюдаемых у 11-тилетнего мальчика симптомов (мышечная слабость, поражение печени и головного мозга) с недостатком карнитина. Лишь в 1998-м году врачи-генетики смогли идентифицировать ген, дефекты которого приводят к развитию первичного системного дефицита карнитина. Механизм наследования заболевания аутосомно-рецессивный, половое распределение не имеет каких-либо особенностей, патология с одинаковой частотой поражает как мужчин, так и женщин. Особенностью первичного системного дефицита карнитина является неодинаковая встречаемость у разных этнических групп – если у европейцев она составляет 1:100 000, то, например, у японцев – 1:4 000, а у жителей Фарерских островов – 1:500.
Причины первичного системного дефицита карнитина
Первичный системный дефицит карнитина обусловлен мутациями гена SLC22A5, который расположен на 5-й хромосоме. Он кодирует последовательность белка под названием натрий-зависимый транспортер карнитина (OCTN2), который выделяется главным образом в скелетной мышечной ткани, миокарде и отчасти в почках. Большинство разновидностей дефектов гена SLC22A5 становится причиной того, что вышеуказанный протеин перестает выделяться вовсе (нонсенс-мутации), иногда образование этого фактора производится, но его структура не позволяет присоединять карнитин. В последние годы были выявлены мутации, приводящие к нарушению образования натрий-зависимого транспортера карнитина только в сердце – именно в этом кроется причина одной из клинических форм первичного системного дефицита карнитина. Всего на сегодняшний день описано свыше ста различных дефектов данного гена, все они наследуются по аутосомно-рецессивному механизму.
Результатом мутаций гена SLC22A5 является отсутствие или нарушенная структура белка OCTN2. По этой причине карнитин, поступающий в организм с пищей, не усваивается должным образом, возникает его дефицит. Это соединение играет центральную роль во внутриклеточном транспорте жирных кислот (так называемый карнитиновый челнок), доставляя их к месту окисления – митохондриям. В условиях его недостатка транспорт жирных кислот, служащих для большинства тканей важным источником питания, нарушается, что резко замедляет процессы их окисления. Практически весь патогенез первичного системного дефицита карнитина сводится к энергетическому голоду тканей и органов, особенно тех, в которых происходят бурные биохимические процессы. В первую очередь это печень, почки, скелетные мышцы и миокард. В отсутствие окисления жиров резко возрастает потребление углеводов (глюкозы) для компенсации дефицита энергии, поэтому в большинстве случаев первичный системный дефицит карнитина сопровождается гипогликемией, мышечной слабостью, поражением печени и сердца. Неврологические симптомы заболевания обусловлены тем, что единственным источником энергии для нейронов также служит глюкоза.
Симптомы и классификация первичного системного дефицита карнитина
Кардиомиопатическая форма первичного системного дефицита карнитина характеризуется более доброкачественным течением, чаще развивается у лиц старше 50-ти лет. При этой разновидности заболевания поражается исключительно сердце, возникает кардиомегалия, способная перерасти в дилатационную кардиомиопатию. Больные жалуются на повышенную утомляемость, одышку при физической нагрузке, давящие боли в области сердца (кардиалгии). При отсутствии лечения данной формы первичного системного дефицита карнитина постепенно нарастают признаки сердечной недостаточности, что обычно и становится причиной смерти больных. Однако ее развитие происходит в течение многих лет, причем в первые 3-6 лет какие-либо симптомы заболевания отсутствуют, поэтому данная разновидность патологии позволяет сохранять удовлетворительное качество жизни.
Диагностика
Определение первичного системного дефицита карнитина производят посредством изучения наследственного анамнеза больного, биохимического исследования крови и мочи, рентгенографии, УЗИ, а также молекулярно-генетического анализа. Признаками метаболической формы заболевания являются детский возраст, низкий уровень глюкозы (гипогликемия), плазменного карнитина и кетоновых тел крови на фоне гипераммониемии и незначительного повышения креатинфосфокиназы. Также отмечаются отставание в психофизическом развитии, расстройства памяти, мышечная слабость, родители больных указывают на частые приступы рвоты и простудные заболевания у ребенка. При рентгенологических или ультразвуковых исследованиях внутренних органов у больных метаболической формой первичного системного дефицита карнитина часто выявляют гепатомегалию и кардиомиопатию.
При кардиомиопатической форме заболевания присутствуют только признаки поражения миокарда – кардиомегалия или дилатационная кардиомиопатия. Кроме того, при этой разновидности первичного системного дефицита карнитина определяется пониженный уровень данного соединения в плазме крови. Методы современной генетики позволяют производить прямое автоматическое секвенирование последовательности гена SLC22A5, которое определяет наличие или отсутствие мутаций. Наличие подобного заболевания у близких родственников дает основания для проведения генетического определения гетерозиготного носительства дефектного гена. Если оба родителя являются носителями мутаций SLC22A5, имеет смысл провести пренатальную диагностику первичного системного дефицита карнитина у их будущего ребенка.
Лечение первичного системного дефицита карнитина
Необходимость ранней диагностики этого заболевания обусловлена тем, что чем раньше начинается лечение, тем более благоприятным становится прогноз. В тех случаях, когда наличие первичного системного дефицита карнитина было выявлено еще до рождения ребенка, своевременное назначение лекарственных средств позволяло избежать практически всех тяжелых симптомов болезни. Терапия сводится к пероральному приему препаратов карнитина для восполнения его дефицита.
При различных осложнениях заболевания или при его поздней диагностике также показано симптоматическое лечение. Осуществляют капельное вливание растворов глюкозы при гипогликемии, назначают гепатопротекторы и средства для улучшения аппетита. Аналогично производят лечение кардиомиопатической формы первичного системного дефицита карнитина.
Прогноз и профилактика
Прогноз этого заболевания зависит от множества факторов: клинической формы, своевременности лечения, соблюдения рекомендаций врача. Более тяжелой является метаболическая форма первичного системного дефицита карнитина – довольно часто она выявляется лишь при наличии выраженных и во многом необратимых поражений сердца, печени и нервной системы, что значительно ухудшает прогноз. Даже при ранней или пренатальной диагностике данной разновидности патологии больные дети должны проходить регулярное обследование у гастроэнтеролога и кардиолога. Кардиомиопатическая форма характеризуется неспецифической симптоматикой, поэтому при ней часто назначают традиционные препараты для улучшения трофики миокарда, которые в этом случае обладают лишь частичным эффектом. Профилактика первичного системного дефицита карнитина возможна лишь в рамках пренатальной диагностики данного состояния.
Дефицит карнитина
, MB, BCh, Saint Louis University School of Medicine
Аминокислота карнитин необходима для транспорта длинноцепочечных жирных кислот посредством кофермента (коэнзима) А в митохондрию миоцита, где они окисляются для получения энергии. Карнитин содержится в пищевых продуктах животного происхождения, а также синтезируется в организме.
Причины дефицита карнитина:
неадекватное поступление, например, из-за модных диет, недоступности продуктов, полного парентерального питания
неспособность усвоения из-за дефицита ферментов (например, дефицит карнитин-пальмитоилтрансферазы, метилмалоновая ацидурия, пропионатацидемия, изовалериатемия);
сниженный эндогенный синтез карнитина при тяжелом поражении печени;
Избыточная потеря карнитина при поносе, избыточном диурезе, гемодиализе;
Наследственные патология почек, при которой карнитин усиленно экскретируется из почечных канальцев;
Увеличение потребности в карнитине при кетоцидозе, возрастание потребностей организма в окислении жирных кислот (при таких клинических состояниях, как сепсис или выраженные ожоги, после обширных хирургических вмешательств на желудочно-кишечном тракте)
Снижение уровня карнитина в мышцах из-за нарушения работы митохондрий (например, из-за применения зидовудина)
Использование вальпроата натрия
Дефицит карнитина может быть генерализованным (системным) или может затрагивать главным образом мышцы (миопатический).
Симптомы
Симптомы дефицита карнитина и возраст, в котором появляются симптомы, зависят от причины.
Дефицит карнитина может привести к некрозу мышц, миоглобинурии, так называемой липидной миопатии, гипогликемии, жировой болезни печени и гипераммониемии, сопровождающейся болями в мышцах, слабостью, спутанностью сознания и кардиомиопатией.
Диагностика
У новорожденных: масс-спектрометрия
У взрослых: уровень ацилкарнитина
У новорожденных детей дефицит карнитин-пальмитоилтрансферазы диагностируется методом масс-спектрометрии. Пренатальный диагноз может быть установлен путем анализа амниотической жидкости (амниотических ворсинчатых клеток).
У взрослых окончательный диагноз дефицит карнитина устанавливается на основании определения уровня ацил-карнитина в сыворотке крови, моче и тканях (в мышцах и печени для системного дефицита; только в мышцах – для миопатической формы дефицита).
Лечение
Избегание продолжительного голодания и физических нагрузок
Диета, направленная на причину заболевания
Дефицит карнитина, который развивается из-за неадекватного поступления с пищей, увеличения потребности в нем, избыточных потерь, уменьшения синтеза и (иногда) из-за дефицита ферментов, можно лечить посредством назначения l-карнитина из расчета 25 мг/кг перорально каждые 6 часов.
Все пациенты должны избегать голодания и физических нагрузок. Потребление сырого кукурузного крахмала перед сном препятствует возникновению утренней гипогликемии.
Была ли страница полезной?
Также интересно
Компания MSD и Справочники MSD
Компания «Мерк энд Ко. Инкорпорейтед», Кенилворт, Нью-Джерси, США (известная под названием MSD за пределами США и Канады) является мировым лидером в области здравоохранения и работает над оздоровлением мира. От разработки новых терапевтических методов для лечения и профилактики заболеваний — до помощи нуждающимся людям, мы стремимся к улучшению здоровья и благосостояния во всем мире. Справочник был впервые опубликован в 1899 году в качестве общественной инициативы. Теперь этот ценный ресурс приносит пользу в качестве руководства MSD за пределами Северной Америки. Узнайте больше о наших обязательствах в рамках программы Глобальная база медицинских знаний.