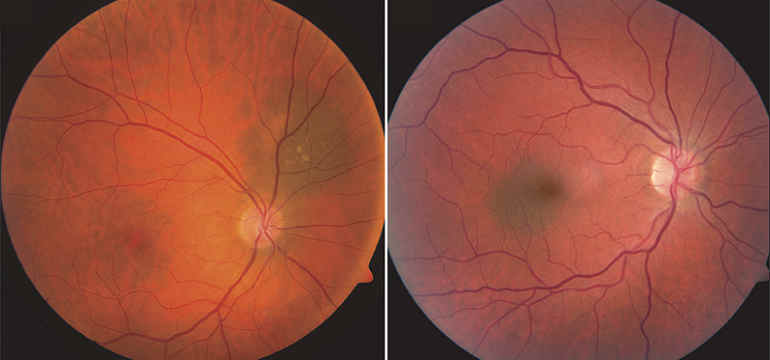
невус хориоидеи пр глаза что такое
Пигментный невус хориоидеи глаза
Автор:

Невус хориоидеи – это пигментное образование скопления меланоцитов (пигментных клеток). Как правило, невусы образуются с рождения, однако, их пигментация проявляется позже, в препубертатный период. Поэтому, обнаруживают их, в большинстве случаев, уже у людей взрослых. У женщин и у мужчин невусы встречаются с одинаковой частотой.
Обычной локализацией для невуса хориоидеи является область заднего отдела глазного дна, за экватором. Однако, иногда, он встречается в преэкваториальной зоне и даже непосредственно в зоне экватора.
На ранних этапах своего развития, подобные невусы локализуются на поверхностных слоях сосудистой оболочки, с возрастом, распространяясь в ее глубжележащие ткани.
Видео нашего специалиста о невусе
Классификация невусов
В офтальмологии принято подразделять невусы на стационарные и прогрессирующие. Кроме того, среди хориоидальных невусов, выделяют типичные, атипичные и подозрительные.
Отличительной особенностью, прогрессирующего невуса хориоидеи, является увеличение в объеме. Претерпевать изменения может его форма, нарушается однородность окраски, наблюдается нечеткость границ. В прилегающих областях сетчатки возникают дистрофические изменения, хориоидальные сосуды могут быть сдавленными. В ряде случаев иногда наблюдается серозная отслойка сетчатки. Нередко снижается зрение, с появлением перед глазами пятен и искажением изображений. Прогрессирующие невусы относят к группе высокого риска озлокачествления. При этом, прогрессирующим, невус считается при выявлении его изменений в динамике. Выявление у пациента первичного невуса хориоидеи с вышеописанными признаками, дает повод считать его «подозрительным».
Атипичными называют невусы не имеющие окраски (беспигментные), а также «гало-невусы», окруженные зоной более бледной сосудистой оболочки (признак атрофии). Гистологически они состоят из клеток с дистрофическими явлениями, что считается одним из признаков злокачественного роста.
Диагностика
Лечение невусов
Для типичного стационарного невуса хориоидеи, специального лечения или длительного наблюдения, не требуется, так как риск злокачественной трансформации его клеток, крайне низок. Однако, эти образования подлежат обязательной документальной регистрации.
На каком этапе начинается озлокачествление невуса, предсказать невозможно. Поэтому залогом здоровья пациента, является тщательное выполнение рекомендаций врача, регулярные повторные визиты к специалисту и. как можно раньше начатое лечение, при наличии показаний.
В офтальмологическом центре «Московская Глазная Клиника» можно пройти полное обследование на новейшей аппаратуре при подозрении на невус сосудистой оболочке и дальнейшее лечение (при необходимости) у ведущих специалистов по сетчатке в Москве.
Уточнить стоимость той или иной процедуры, записаться на прием в нашу клинику можно по телефону в Москве 8(499)322-36-36 или номеру 8(800)777-38-81 (звонок бесплатный с мобильных и для регионов РФ) ежедневно с 9:00 до 21:00. Вы можете так же воспользоваться формой онлайн-записи.
Невус хориоидеи пр глаза что такое
Источником опухолей в сосудистую оболочку чаще всего являются элементы нервного гребня или вторая пигментная система глаза. В центральном отделе сосудистой оболочки расположено максимальное количество меланоцитов, где и локализуется большая часть меланом. Основную долю новообразований хориоидеи составляют пигментированные опухоли сосудистой оболочки. К доброкачественным опухолям второй пигментной системы относятся невусы хориоидеи. Микроскопически невус представляет собой очаговое скопление меланоцитов, тесно связанных между собой, с различной степенью пигментации. В начальных стадиях развития клеточный пролиферат связан с поверхностными слоями хориоидеи, далее он распространяется во все слои сосудистой оболочки, выравнивая хориокапиллярный слой в этой зоне. Клеточный пролиферат имеет форму линзы с четкими границами, с максимальной толщиной в центральной части. Новообразованные сосуды отсутствуют, а собственные сосуды хориоидеи в этой зоне имеют щелевидную форму. При крупных невусах наблюдаются дистрофические изменения в мембране Бруха и клетках пигментного эпителия, формируются друзы, нарушается структура межклеточных связей. Клетки невуса могут быть веретенообразными, полигональными с дендритическими или короткими утолщенными отростками. Строение клетки сходно с нормальными меланоцитами сосудистой оболочки. Цитоплазма клеток хорошо выражена, содержание меланиновых гранул различно, ядро небольшого размера. Чаще невусы состоят из одного вида клеток, преобладает веретеноклеточный вариант.
Цель исследования: провести анализ клинической картины новообразований хориоидеи в совокупности с современными методами функциональной диагностики для правильной постановки диагноза невуса хориоидеи.
Клиника. Невус хориоидеи ‑ самая часто встречаемая доброкачественная внутриглазная опухоль. При биомикроскопическом осмотре невус выглядит как пигментированное образование, при стационарном невусе окраска равномерная, однородная от светло-серого до серо-аспидного цвета с четким переходом к нормальному рисунку здоровой ткани. Также контуры невусов могут быть нечеткими, размытыми, перистыми. Пигментация при стационарном невусе однотонная, серая, без дополнительных включений. Форма невуса чаще овальная или округлая, без видимой проминенции, размер различный ‑ от 0,5 до 5 диаметров диска зрительного нерва. Могут наблюдаться множественные формы невусов, как вблизи друг от друга, так и в разных секторах; или невусы в заднем отрезке глаза могут сочетаться с пигментными пятнами в радужке [1, 2].
В конце XX в. в литературе появился термин «прогрессирующий невус», который занимает промежуточное место по офтальмологической картине между типичным невусом и меланомой хориоидеи [3]. По данным литературы, риск трансформации в меланому хориоидеи составляет от 0,78% до 7% [4, 5].
При прогрессирующем невусе появляются или увеличиваются дистрофические изменения в мембране Бруха и пигментном эпителии сетчатки. Увеличивается количество друз, могут появляться плоские отслойки пигментного и нейроэпителия, возможно возникновение незначительного количества субретинального экссудата. Может наблюдаться ореол желтоватого цвета вокруг невуса. Также описаны случаи появления на поверхности невуса микрогеморрагий и зерен оранжевого пигмента [6]. Меняется окраска невуса как в сторону неравномерного усиления, так и ослабления пигментации. Необходимо обращать внимание на появление признаков прогрессирования: увеличение размера невуса; размытые контуры вокруг новообразования, изменение окраски, увеличение количества друз, появление экссудативного компонента, геморрагической активности [4, 6, 7].
Если проводить дифференциальную диагностику с гемангиомой хориоидеи, то эта доброкачественная сосудистая опухоль в 62% случаев локализуется с височной стороны от диска зрительного нерва. Ее отграниченная форма представляет собой проминирующее образование округлой или овальной формы с размытыми контурами розово-оранжевого или темно-красного цвета. Характерным диагностическим признаком является побледнение опухоли при компрессии глаза во время биомикроофтальмоскопии [8].
Метастатическая опухоль хориоидеи может быть первым признаком онкологического заболевания. Локализуются метастазы в основном в центральной зоне. Офтальмоскопически имеют вид белого или желтоватого цвета рыхлого очага с небольшой проминенцией и размытыми контурами. Опухоль быстро увеличивается в диаметре, в каждом третьем случае это многоочаговый процесс с тенденцией к слиянию. Рано появляется экссудативная реакция, что приводит к развитию зрительных нарушений.
По данным Шилдса, невус хориоидеи с диаметром 5 мм и толщиной 1,5 мм может стать злокачественным в течение 1 года у 2%, в течение 5 лет ‑ у 9%, а через 10 лет ‑ у 13% пациентов [4]. Поэтому выявление первых признаков озлокачествления или проведение дифференциальной диагностики с меланомой хориоидеи очень важны для дальнейшей тактики ведения больных.
Дифференциальная диагностика опухолей хориоидеи исключительно важна для правильного выбора тактики лечения. Так, многообразие первичных симптомов меланомы хориоидеи, их различное сочетание маскируют клиническую картину, приводя к диагностическим ошибкам. А.Ф. Бровкина предлагает разделить заболевания на 2 группы, которые требуют проведения дифференциальной диагностики с увеальной меланомой: 1-я группа ‑ другие опухоли; 2-я группа ‑ опухолеподобные заболевания. В процессе работы офтальмологи пополняют перечень этих заболеваний. 1-я группа: опухоли, маскирующиеся под меланому, невус, гемангиома хориоидеи, гемангиома сетчатки, меланоцитома, ангиоматоз сетчатки, остеома хориоидеи, злокачественная лимфома, нейрофиброма, метастаз рака, ретинобластома. 2-я группа: опухолеподобные заболевания и пороки развития: хроническая гранулема, субретинальное кровоизлияние, реактивный глиоз сетчатки, центральный серозный хориоидит, первичная и реактивная гиперплазия пигментного эпителия, серозная и регматогенная отслойка сетчатки, прогрессирующая форма сенильного шизиса и другие заболевания [9].
Для дифференциальной диагностики меланомы хориоидеи и невуса хориоидеи применяют следующие методы диагностики: ультразвуковое исследование (УЗИ) с допплеровским режимом, флюоресцентную ангиографию (ФАГ), спектральную оптическую когерентную томографию (СОКТ), оптическую когерентную томографию с ангиографическим режимом (ОКТ-А) [10]. Однако вышеуказанные методы не равнозначны по диагностической точности. Так, при выполнении УЗИ с допплеровским режимом не всегда можно отдифференцировать хориоидальную и патологическую опухолевую сосудистую сеть.
Также для оценки хориоидальной и ретинальной васкуляризации применяют ФАГ, однако эта методика имеет много противопоказаний по общему состоянию пациента: бронхиальная астма, инфаркт миокарда в анамнезе, инсульт, аллергия, варикозное расширение вен нижних конечностей. По данным различных авторов, ценность методики неоднозначна. Так, по данным С.В. Саакян, Е.Б. Мякошиной и иных в 42,6% случаев пигментированная форма меланомы аваскулярна [11], а по данным А.Ф. Бровкиной, Н.В. Скляровой и иных возможно выявление сосудистой сети во всех случаях меланомы хориоидеи в начальной стадии при беспигментной форме [12].
Наличие субретинального экссудата затрудняет визуализацию сосудистой сети. Однозначно нельзя различить картину исследования начальных стадий меланомы хориоидеи и прогрессирующего невуса, поскольку ангиографические признаки сходны: выявляется мелкопятнистая гиперфлюоресценция с расширенными по периферии сосудами хориоидеи. А при стационарном невусе определяется стойкая гипофлюоресценция во всех фазах исследования [13].
Одним из современных методов диагностики и дифференциальной диагностики является СОКТ. Она позволяет выявить различную внутриглазную патологию сетчатки, хориоидеи. При СОКТ в режиме EDI (enhanced depth imaging ‑ режим глубокого изображения) выявлены следующие изменения при прогрессирующем невусе: гиперрефлективность на уровне хориокапилляров, веретенообразное изменение профиля хориоидеи, эффект тени подлежащих структур. Также возможна отслойка нейроэпителия и пигментного эпителия, в некоторых случаях ‑ появление интра- и субретинального экссудата в виде единичных кист, дезорганизация пигментного эпителия сетчатки. Однако вышеуказанные изменения могут выявляться и при начальной стадии меланомы хориоидеи [14].
При исследовании стационарного невуса отмечены следующие особенности: гиперрефлективность на уровне хориокапилляров, эффект тени подлежащих структур, ровный хориоидальный профиль.
В настоящее время самым информативным для диагностики и дифференциальной диагностики патологических состояний в хориоидее является ОКТ-А, которая позволяет неинвазивно изучать сосудистые структуры глаза, выявлять патологическую сосудистую сеть на ранних стадиях заболевания. По литературным данным, при начальной меланоме хориоидеи в наружном ядерном слое сетчатки и слое хориокапилляров формируется патологическая крупноячеистая сосудистая сеть, напоминающая паутину, сосуды которой имеют неравномерный калибр [15].
Также изучена сосудистая сеть при меланоме хориоидеи в макулярной зоне. В отличие от невуса, при меланоме происходят следующие изменения: уменьшается плотность васкуляризации хориокапилляров; увеличивается толщина сетчатки макулы, увеличивается площадь поверхностной и глубокой фовеолярной аваскулярной зоны [16, 17].
В исследованиях С.В. Саакян с соавт. была изучена ангиоархитектоника 128 больных с невусами хориоидеи и меланомой. Авторы отмечают наличие изорефлективных хориокапилляров в зоне стационарного невуса, гиперрефлективное расширение хориокапиллярной сети при прогрессирующем невусе и появление патологических извитых сосудов на фоне гиперрефлективных хориокапилляров при начальной меланоме хориоидеи. Также при невусах хориоидеи нет деформации сосудистой сети и скорость кровотока одинакова с парным глазом [11].
В отличие от меланомы хориоидеи, при прогрессирующих невусах отслойка нейроэпителия наблюдается в центральной проминирующей зоне, не распространяясь на периферические отделы. Появление субретинальной жидкости, динамика ее распространения точно определяются с помощью метода ОКТ, он помогает расширить дифференциально-диагностические возможности, особенно при аваскулярных хориоидальных новообразованиях с небольшой элевацией (до 3 мм) [18].
Отечественными офтальмологами В.В. Нероевым, С.В. Саакян, Е.Б. Мякошиной и иными определены томографические признаки хориоидальных новообразований: при стационарном невусе наблюдается утолщение сетчатки I степени за счет увеличения ее толщины на уровне пигментного эпителия гиперрефлективного слоя. При прогрессирующем невусе появляется ретинальный отек I степени в центральной зоне опухоли; изменяется хориоидальный профиль I степени, появляются друзы.
А при начальной меланоме появляется распространенная серозная отслойка нейроэпителия I степени, могут наблюдаться множественные кисты мелкого и среднего размера, возникают локальная отслойка пигментного эпителия I степени, неравномерное увеличение гиперрефлективного слоя на уровне пигментного эпителия, утолщение сетчатки в зоне плоской серозной отслойки нейроэпителия. Наблюдается дугообразное изменение хориоидального профиля II‑III степени, в зоне ретинального пигментного эпителия отмечается дезорганизация пигмента [14, 19].
Для диагностики различных новообразований хориоидеи применяется ангиография с индоцианином зеленым. Впервые в медицинской практике краситель индоцианин зеленый применили в 1970 г. для изучения гемодинамики мозга обезьяны. Индоцианин зеленый является трикарбоцианиновым красителем, не проникает через фенестрированные капилляры, связывается с белками плазмы до 98%, хорошо проникает через пигментный эпителий, ксантофилл макулярной зоны и большинство тканей глазного яблока, так как имеет pH 5,5‑6,5, длительно персистируется в кровотоке, пик поглощения 835 нм (инфракрасный диапазон). Данные преимущества позволяют детально визуализировать собственные и новообразованные сосуды хориоидеи. Так, при выявлении меланомы хориоидеи с помощью ангиографии с индоцианином зеленым можно изучить особенности ангиоархитектоники патологической сосудистой сети и выявить васкулогенную мимикрию, что позволяет прогнозировать метастатический процесс [20].
И.Е. Панова с соавт. провели исследование по идентификации собственной сосудистой сети при новообразованиях хориоидеи с применением ангиографии с индоцианином зеленым и ультразвуковой допплерографией (УЗДГ). В исследовании участвовали 46 пациентов: диагноз меланомы хориоидеи установлен у 27 пациентов, невуса хориоидеи ‑ у 10, гемангиомы ‑ у 5, метастазов в хориоидею ‑ у 4. На момент исследования средняя проминенция опухоли ‑ 1,87±0,637 мм, средний диаметр ‑ 8,38±2,45 мм. При проведении ангиографии с индоцианином зеленым был исследован хориоидальный сосудистый рисунок в основании опухоли, определен тип сосудистой сети.
Невус хориоидеи характеризуется диффузной гипофлюоресценцией во всех фазах ангиографии, с четкой границей. Сосуды хориоидеи в зоне невуса были размыты по сравнению с окружающей сосудистой оболочкой. Если невус прогрессирует и возникают отслойка нейроэпителия, отложения на пигментном эпителии, то при ангиографии характерно отсутствие патологических сосудов, а появление в поздние фазы очагов гипо- и гиперфлюоресценции соответствует дегенеративным изменениям в пигментном эпителии. Также у пациентов данной группы кровоток по данным ультразвуковой допплерографии не выявляется. По данным авторов, при меланоме собственная сосудистая сеть в ткани опухоли визуализировалась у 77,8% больных (у 21 пациента из 27). Превалировали пациенты с меланомой малых размеров (высота до 3 мм). На фоне гипофлюоресценции определялись собственные сосуды в опухоли уже в раннюю фазу (до 15 секунд) с последующим усилением гиперфлюоресценции. Атипичные ангиографические паттерны регистрировались в виде прямых линий с анастомозами. При УЗДГ патологический кровоток выявлен в 18 случаях из 27 [21].
В диагностический арсенал современной медицины входят генетические исследования. Наличие мутаций в генах GNAQ и GNA11 является патогномоничным признаком у пациентов с меланомой хориоидеи, частота встречаемости данных мутаций достигает до 96% случаев [22].
Данные маркеры могут быть исследованы после ликвидационного лечения или при тонкоигольной аспирационной биопсии. Как альтернативный метод дифференциальной диагностики возможно определение специфических онкогенов GNAQ и GNA11 в опухолевых ДНК периферической крови [23].
С.В. Саакян с соавт. провели исследование по выявлению генетических предикторов опухолевой трансформации при меланоцитарных внутриглазных новообразованиях. Изучение мутаций в генах GNAQ/GNA11 осуществляли с помощью анализа кривых плавления и метода определения полиморфизма длины рестрикционных фрагментов (ПЦР-ПДРФ-анализ) [24].
В исследовании принял участие 81 пациент. I группу составили пациенты со стационарным невусом (23 глаза), II группу ‑ с прогрессирующим невусом (24 глаза), III группу ‑ с начальном меланомой (36 глаз). У пациентов I группы частота встречаемости мутаций в генах GNAQ и GNA11 в циркулирующих опухолевых ДНК периферической крови составила 37,5%, у пациентов II и III групп ‑ 87,5% и 86,0% соответственно. Отсутствие значимых различий у пациентов с начальной меланомой и прогрессирующим невусом свидетельствует о высоком риске трансформации прогрессирующего невуса в меланому [25].
Заключение. Знание клинических проявлений различных новообразований хориоидеи в совокупности с современными диагностическими методиками позволяет провести дифференциальный диагноз между невусом хориоидеи и меланомой хориоидеи, что определяет дальнейшую тактику ведения пациента.
Невус хориоидеи – диагностика и лечение в Наро-Фоминске
Невус хориоидеи – пигментное новообразование из очагового скопления определенных клеток-меланоцитов, представляет собой доброкачественную опухоль сосудистой оболочки.
Невусы, в большинстве своем, присутствуют уже при рождении человека, однако пигментация образований проявляется несколько позже. Обычно, они начинают окрашиваться в подростковый период, поэтому обнаруживают невусы, как правило, уже у взрослых мужчин и женщин. Причем, у тех и других одинаково часто.
Типы и виды невусов
Для прогрессирующего невуса сосудистой оболочки характерен рост и увеличение в объеме. С его формой и границами постепенно происходят изменения, может нарушаться и однородность окраса. Прогрессирующие невусы нередко вызывают сдавления сосудов хориоидеи и дистрофические изменения прилежащей сетчатой оболочки. Иногда процессы дистрофии осложняются серозной отслойкой сетчатки. Образования серьезно ухудшают качество зрения: может снижаться его острота, искажаться видимые изображения, возникать слепые пятна перед глазами. Специалисты Центра коррекции зрения относят прогрессирующие невусы к группе повышенного риска перерождения в злокачественное новообразование. Хориоидальный невус с описанными выше признаками, выявленный впервые, считается «подозрительным». Прогрессирующие невусы выявляются при динамическом наблюдении.
Лишенные пигмента невусы хориоидеи, как и «гало-невусы», расположенные в внутри зоны ее атрофии с более бледной окраской, признаются атипичными. Такие образования включают клетки с признаками дегенерации, что относится к симптомам злокачественного роста новообразования.
Диагностика
Выявление невуса, в большинстве случаев, происходит при офтальмологическом исследовании глазного дна – офтальмоскопии. С целью постановки окончательного диагноза, в Глазной клинике на Курзенкова, невусы берутся под контроль и динамически наблюдаются при регулярных осмотрах.
Особенно информативны для врача осмотры глазного дна с применением цветных фильтров. При этом, наиболее четко невус хориоидеи определяется в красном свете, а в зеленом, напротив, стационарный невус «пропадает». В слоях сетчатой оболочки выявляются лишь изменения, которые указывают на невус прогрессирующего типа.
Лечение
Лечебная тактика специалистов Центра коррекции зрения при невусах сосудистой оболочки, выглядит следующим образом. Типичный стационарный хориоидальный невус подвергается обязательной документальной регистрации, хотя при его обнаружении, ни специфического лечения, ни длительного наблюдения не требуется, ведь риск его перехода в злокачественное образование крайне низок.
Как подозрительные, так и атипичные невусы хориоидеи проходят специальную фоторегистрацию. Для контроля ситуации, проводятся регулярные офтальмологические осмотры глазного дна (2-3 раза год) и повторные УЗ-исследования.
На каком этапе невус хориоидеи станет превращаться в злокачественное новообразование предсказать невозможно, поэтому залогом здоровья пациента может стать только строгое следование рекомендациям врача, обязательное прохождение запланированных осмотров и раннее начало лечения, при необходимости.
Стоимость лечения пигментных невусов в Наро-Фоминске
Цены на лечение невусов хориоидеи глаза в нашей клинике определяются, исходя из индивидуального состояния глаз пациента и выбранной тактики лечения. С расценками Вы можете ознакомиться в разделе ЦЕНЫ.
Обращайтесь к профессионалам и мы сохраним Ваше зрение!
Невус хориоидеи пр глаза что такое
а) Клиническая картина. Хотя невус хориоидеи может быть врожденным, он редко встречается у маленьких детей (1). Клетки-предшественники невуса могут присутствовать с рождения, но до пубертатного периода они клинически никак не проявляют себя, возможно, отчасти из-за того, что в этот период происходит накопление пигмента в изначально беспигментном новообразовании. Невус хориоидеи обычно впервые выявляется во взрослом возрасте, он может быть пигментным или амеланотическим, плоским или минимально выступать в стекловидную камеру. На основании результатов популяционного исследования Синей горы (Blue Mountain population-based study), Sumich et al. (3) установили, что невус хориоидеи был диагностирован у 7% европеоидов старше 49 лет, размеры невуса состав ляли в среднем 1,5 мм. В большом клиническом исследовании, выполненном Shields et al. (1), средний возраст пациентов с невусом хориоидеи, направлявшихся в центр онкологии глаза, составил 60 лет, средний размер невуса составил 5,5 мм. Большинство невусов хориоидеи имеют толщину менее 2 мм.
Со временем на поверхности невуса появляются друзы. Приблизительно в 10% случаев развивается отслойка пигментного эпителия сетчатки (26, 27), хориоидальная неоваскуляризация на поверхности невуса встречается менее чем в одном проценте случаев (1, 36-39). Некоторые невусы хориоидеи имеют крупные размеры (> 10 мм в диаметре), но не сопровождаются другими факторами риска и поэтому классифицируются как гигантские невусы хориоидеи (14). Другим интересным симптомом является наличие вокруг невуса беспигментного кольца («halo», гало), встречающегося в 5% случаев невуса хориоидеи (13). Выявлена связь беспигментного кольца (гало) вокруг невуса с ранее диагностированной меланомой кожи, таким образом, не исключено, что гало развивается в результате аутоиммунной реакции. Кроме того, гало вокруг невуса является благоприятным прогностическим признаком, снижающим вероятность озлокачествления новообразования.
Несколько работ посвящены оценке частоты роста или перерождения невуса в меланому (2-7). Математически частота развития меланомы из невуса хориоидеи оценивается как 1 на 8845 (7). Основные статистические факторы риска, позволяющие выявить подозрительную с точки зрения перерождения в меланому опухоль, включают в себя толщину опухоли более 2 мм, скопление субретинальной жидкости, наличие жалоб, появление на поверхности невуса оранжевого пигмента и локализация невуса в 3 мм от диска зрительного нерва или ближе (1, 4-6, 10). Недавно были выявлены дополнительные факторы, повышающие вероятность роста опухоли, в том числе акустическая пустота при ультразвуковом исследовании, отсутствие гало и друз (6).
Считается, что увеличение размеров невуса хориоидеи с высокой вероятностью указывает на его озлокачествление и развитие меланомы. Однако некоторые невусы в течение многих лет могут демонстрировать медленный рост, около 1 мм или менее, и все же оставаться доброкачественными (12).
Клинические примеры невуса хориоидеи:
КЛИНИЧЕСКИЕ ВАРИАНТЫ НЕВУСА ХОРИОИДЕИ
б) Диагностика. В последнее время в диагностике невуса хориоидеи были достигнуты заметные успехи. Изменения, наблюдаемые при флюоресцентной ангиографии, варьируют от гипофлюоресценции более мелких и более темных новообразований до более интенсивной гиперфлюоресценции более крупных менее пигментированных невусов. Диагностическое значение ультразвукового исследования невелико, но с его помощью можно измерять толщину невуса при первичном обследовании и позже в процессе наблюдения. Все шире применяется оптическая когерентная томография с увеличенной глубиной проникновения (enhanced depth imaging optical coherence tomography-EDI-OCT), она позволяет на ранней стадии заболевания выявлять такие факторы риска, как скопление субретинальной жидкости, кистозный отек сетчатки и отложения оранжевого пигмента на поверхности невуса (24-28). Исследование аутофлюоресценции чаще выполняется с целью выявления на поверхности невуса отложений оранжевого пигмента, которые также являются одним из прогностических факторов малигнизации (29-32).
в) Патологическая анатомия. Гистологически невус хориоидеи образован высокодифференцированными веретеновидными, овоидными или округлыми меланоцитами с различной степенью выраженности пигментации цитоплазмы (33). Специфический клинико-гистологический вариант невуса-меланоцитома- обсуждается ниже. Вторичные изменения прилегающих структур (34) также описаны ниже в разделе, посвященном патологической анатомии меланомы заднего отдела сосудистой оболочки.
д) Список использованной литературы:
1. Shields CL, Furuta М, Mashayekhi A, et al. Clinical spectrum of choroidal nevi based on age at presentation in 3422 consecutive eyes. Ophthalmology 2008; 115(3): 546-552.
2. Ganley JP, Comstock GW. Benign nevi and malignant melanomas of the choroid. Am J Ophthalmol 1973;76:19-25.
3. Sumich P, Mitchell P, Wang JJ. Choroidal nevi in a white population. Arch Ophthalmol 1998; 116:645-650.
4. Shields CL, Shields JA, Kiratli H, et al. Risk factors for metastasis of small choroidal melanocytic lesions. Ophthalmology 1995;102:1351-1361.
5. Shields CL, Cater JC, Shields JA, et al. Combination of clinical factors predictive of growth of small choroidal melanocytic tumors. Arch Ophthalmol 2000; 118:360-364.
6. Shields CL, Furuta M, Berman EL, et al. Choroidal nevus transformation into melanoma: analysis of 2514 consecutive cases. Arch Ophthalmol 2009; 127(8):981-987.
7. Singh AD, Kalyani P, Topham A. Estimating the risk of malignant transformation of a choroidal nevus. Ophthalmology 2005; 112:1784-1789.
8. Hale PN, Allen RA, Straatsma BR. Benign melanomas (nevi) of the choroid and ciliary body. Arch Ophthalmol 1965;74:532-538.
9. Brown GC, Shields JA, Augsburger 1J. Amelanotic choroidal nevi. Ophthalmology 1981 ;88:1116-1120.
10. Augsburger JJ, Schroeder RP, Territo C, et al. Clinical parameters predictive of enlargement of melanocytic choroidal lesions. Br J Ophthalmol 1989;73: 911-917.
11. Shields CL, Furuta M, Mashayekhi A, et al. Visual acuity in 3422 consecutive eyes with choroidal nevus. Arch Ophthalmol 2007; 125(11): 1501-1507.
12. Mashayekhi A, Siu S, Shields CL, Shields JA. Slow enlargement of choroidal nevi: a long-term follow-up study. Ophthalmology 2011;118(2):382—388.
13. Shields CL, Maktabi AM, Jahnle E, et al. Halo nevus of the choroid in 150 patients: the 2010 Henry van Dyke Lecture. Arch Ophthalmol 2010;128(7):859 864.
14. Shields CL, Shields JA. Clinical features of small choroidal melanoma. Curr Opin Ophthalmol 2002;13:135-141.
15. Li HK, Shields CL, Mashayekhi A, et al. Giant choroidal nevus clinical features and natural course in 322 cases. Ophthalmology 2010:117(2):324-333.
16. Mims J, Shields JA. Follow-up studies on suspicious choroidal nevi. Ophthalmology 1978;85:929-943.
17. Pro M, Shields JA, Tomer TL. Serous detachment of the fovea associated with presumed choroidal nevi. Arch Ophthalmol 1979;96:1374-1377.
18. Zografos L, Mantel 1, Schalenbourg A. Subretinal choroidal neovascularization associated with choroidal nevus. Ear J Ophthalmol 2004;14:123-131.
19. Gonder JR, McCarthy EF, Augsburger JJ, et al. Visual loss associated with choroidal nevi. Ophthalmology 1982;89:961-965.
20. Shields CL, Ramasubramanian A, Kunz WB, et al. Choroidal vitiligo masquerading as large choroidal nevus: a report of four cases. Ophthalmology 2010; 117(1): 109-113.
21. Shields CL, Nickerson S, Al-Daamash S, et al. Waardenburg syndrome: iris and choroidal hypopigmentation: findings on anterior and posterior segment imaging. JAMA Ophthalmol 2013;131:1167-1173.
22. You QS, Xu L, Jonas JB, et al. Change in choroidal nevi during a 5-year follow-up study: the Beijing Eye Study. Br J Ophthalmol 2010;94(5):575-578.
23. Johnson RN, McDonald HR, Ai E, et al. Camera artifacts producing the false impression of growth of choroidal melanocytic lesions. Am J Ophthalmol 2003;135:711-713.
24. Muscat S, Parks S, Kemp E, et al. Secondary retinal changes associated with choroidal naevi and melanomas documented by optical coherence tomography. Br J Ophthalmol 2004;88:120-124.
25. Espinoza G, Rosenblatt B, Harbour JW. Optical coherence tomography in the evaluation of retinal changes associated with suspicious choroidal melanocytic tumors. Am J Ophthalmol 2004;137:90-95.
26. Shields CL, Mashayekhi A, Materin MA, et al. Optical coherence tomography of choroidal nevus in 120 consecutive patients. Retina 2005;25:243-252.
27. Shah SU, Kaliki S, Shields CL, et al. Enhanced depth imaging optical coherence tomography of choroidal nevus in 104 cases. Ophthalmology 2012;119(5): 1066—1072.
28. Shields CL, Kaliki S, Rojanaporn D, et al. Enhanced depth imaging optical coherence tomography of small choroidal melanoma: comparison with choroidal nevus. Arch Ophthalmol 2012;130(7):850-856.
29. Lavinsky D, Belfort RN, Navajas E, et al. Fundus autofluorescence of choroidal nevus and melanoma. Br J Ophthalmol 2007;91( 10):1299 1302.
30. Shields CL, Pirondini C, Bianciotto C, et al. Autofluorescence of choroidal nevus in 64 cases. Retina 2008;28(8):1035-1043.
31. Gbndbz K, Pulido JS, Ezzat K, et al. Review of fundus autofluorescence in choroidal melanocytic lesions. Eye (bond) 2009;23(3):497-503.
32. Parodi MB. Transpupillary thermotherapy for subfoveal choroidal neovascularization associated with choroidal nevus. Am J Ophthalmol 2004;138:1074-1075.
33. Naumann GO, Hellner K, Naumann LR. Pigmented nevi of the choroid. Clinical study of secondary changes in the overlying tissue. Trans Am Acad Ophthalmol Otolaryngol 1971;75:110-123.
34. Shields JA, Rodrigues MM, Sarin LK, et al. Lipofuscin pigment over benign and malignant choroidal tumors. Trans Am Acad Ophthalmol Otolaryngol 1976;81:871-881.
35. Shields, JA, Shields CL, Peairs R, et al. Laser photocoagulation of small melanocytic choroidal lesion. Sixteen year follow up and rationale for treatment. Ophthalmic Lasers Surg 2006;37:79-81.
36. Almeida A, Kaliki S, Shields CL. Autofluorescence of intraocular tumors. Curr Opin Ophthalmol 2013;24:222-232
37. Stanescu D, Wattenberg S, Cohen SY. Photodynamic therapy for choroidal neovascularization secondary to choroidal nevus. Am J Ophthalmol 2003;136:575-576.
38. GarcHa-Arum H J, Amselem L, Gunduz K, et al. Photodynamic therapy for symptomatic subretinal fluid related to choroidal nevus. Retina 2012;32(5):936-941.
39. Chiang A, Bianciotto С, Maguire JI, et al. Intravitreal bevacizumab for choroidal neovascularization associated with choroidal nevus. Retina 2012;32(1):60—67.
40. Naseripour M, Shields CL, Shields JA, et al. Pseudohypopyon of orange pigment overlying stable choroidal nevus. Am J Ophthalmol 2001; 132: 416-417.
41. Sarici AM, Shah SU, Shields CL, et al. Cutaneous halo nevi following plaque radiotherapy for uveal melanoma. Arch Ophthalmol 2011;129(11): 1499— 1501.
42. Hashmi F, Rojanaporn D, Kaliki S, et al. Orange pigment sediment overlying small choroidal melanoma. Arch Ophthalmol 2012;130:937-938.
Редактор: Искандер Милевски. Дата публикации: 2.6.2020