Во что превращаются белки
Как происходит обмен белков в организме человека?
Мы подошли к наиважнейшему аспекту в планировании питания спортсмена. Тема нашей статьи – белковые обменные процессы. В новом материале вы найдёте ответы на вопросы: что такое обмен белков, какую роль протеины и аминокислоты играют в организме и что бывает, если нарушается белковый метаболизм.
Общая суть
Из белка (протеина) состоит большая часть наших клеток. Это основа жизнедеятельности организма и его строительный материал.
Белки регулируют следующие процессы:
Примечание: наличие белка напрямую связано с синтезом инсулина. Без достаточного количества аминокислот, из которых синтезируется этот элемент, повышение сахара в крови становится лишь вопросом времени.
И еще десятки различных функций. Фактически белок – это мы. Поэтому люди, которые отказываются от употребления мяса и других животных продуктов, все равно вынуждены искать альтернативные источники белка. В противном случае, их вегетарианская жизнь будет сопровождаться дисфункциями и патологическими необратимыми изменениями.
Как бы это странно не звучало, но небольшой процент белка есть во многих продуктах. Например, крупы (все, за исключением манной) имеют в своем составе до 8% белка, пусть и с неполным аминокислотным составом. Это частично компенсирует дефицит белка, если вы хотите сэкономить на мясе и спортивном питании. Но помните, что организму нужны разные белки – одной гречкой не удовлетворить потребности в аминокислотах. Не все белки расщепляются одинаково и все по разному влияют на деятельность организма.
В пищеварительном тракте белок расщепляется под воздействием специальных ферментов, которые тоже состоят из белковых структур. Фактически, это замкнутый круг: если в организме есть длительный дефицит белковых тканей, то и новые белки не смогут денатурировать до простых аминокислот, что вызовет еще больший дефицит.
Важный факт: белки могут участвовать в энергетическом обмене наравне с липидами и углеводами. Дело в том, что глюкоза – необратимая и самая простейшая структура, которая превращается в энергию. В свою очередь белок, пускай и со значительными энергетическими потерями в процессе окончательной денатурации, может быть превращен в гликоген. Другими словами, организм в критической ситуации способен использовать белок в качестве топлива.
В отличие от углеводов и жиров, белки усваиваются ровно в том количестве, которое необходимо для функционирования организма (включая поддержание постоянного анаболического фона). Никаких протеиновых излишков организм не откладывает. Единственное, что может изменить этот баланс – это прием тестостероновых стимуляторов и аналогов гормона тестостерона (анаболических стероидов). Первичная задача таких препаратов – вовсе не повышение силовых показателей, а увеличение синтеза АТФ и белковых структур, за счет чего и растут мышцы.
© edesignua — depositphotos.com. Расщепление белков
Этапы белкового обмена
Белковые обменные процессы гораздо сложнее углеводных и липидных. Ведь если углеводы – это всего лишь энергия, а жирные кислоты поступают в клетки практически в неизменном виде, то главный строитель мышечной ткани претерпевает в организме целый ряд изменений. На некоторых этапах по белок и вовсе может метаболизироваться в углеводы и, соответственно, в энергию.
Рассмотрим основные этапы обмена белков в организме человека, начиная с их поступления и запечатывания слюной денатурата будущих аминокислот и заканчивая конечными продуктами жизнедеятельности.
Примечание: мы поверхностно рассмотрим биохимические процессы, которые позволят понять сам принцип переваривания белков. Для достижения спортивных результатов этого будет достаточно. Однако при нарушениях белкового обмена лучше обратится к врачу, который определит причину патологии и поможет устранить её на уровне гормонов или синтеза самих клеток.
| Этап | Что происходит | Суть |
| Первичное попадание белков | Под воздействием слюны расщепляются основные гликогеновые связи, превращаясь в простейшую глюкозу, остальные фрагменты запечатываются для последующей транспортировки. | На этом этапе основные белковые ткани в составе продуктов питания выделяются в отдельные структуры, которые затем будут перевариваться. |
| Переваривание белков | Под воздействием панкреатина и других ферментов происходит дальнейшая денатурация до белков первого порядка. | Организм настроен таким образом, что может получать аминокислоты только из простейших цепочек белков, для чего он воздействует кислотой, чтобы сделать белок более расщепляемым. |
| Расщепление на аминокислоты | Под воздействием клеток внутренней слизистой оболочки кишечника, денатурированные белки всасываются в кровь. | Уже упрощенный белок организм расщепляет на аминокислоты. |
| Расщепление до энергии | Под воздействием огромного количества инсулиновых заменителей и ферментов для переваривания углеводов белок распадается до простейшей глюкозы | В условиях, когда организму не хватает энергии, он не денатурирует белок, а при помощи специальных веществ расщепляет его сразу до уровня чистой энерги. |
| Перераспределение аминокислотных тканей | Циркулируя в общем кровотоке, белковые ткани под воздействием инсулина транспортируются по всем клеткам, отстраивая необходимые аминокислотные связи. | Белки, путешествуя по организму, восстанавливают недостающие части, как в мышечных структурах, так и в структурах связанных с гормоностимуляцией, мозговой активностью или последующей ферментацией. |
| Составление новых белковых тканей | В мышечных тканях аминокислотные структуры, связываясь с микроразрывами, составляют новые ткани, вызывая гипертрофию мышечных волокон. | Аминокислоты в нужном составе превращаются в мышечную-белковую ткань. |
| Вторичный белковый обмен | При наличии переизбытка белковых тканей в организме, они под вторичным воздействием инсулина снова попадают в кровоток для превращения их в другие структуры. | При сильном мышечном напряжении, долгом голоде или во время болезни организм использует мышечные белки для компенсации аминокислотного недостатка в других тканях. |
| Транспортировка липидных тканей | Свободно циркулирующие белки, соединенные в фермент липазу, помогают транспортировать и переваривать вместе с желчью полинасыщенные жирные кислоты. | Белок участвует в транспортировке жиров и синтезе холестерина из них. В зависимости от аминокислотного состава белка синтезируются как полезный, так и вредный холестерин. |
| Выведение окисленных элементов (конечных продуктов) | Отработанные аминокислоты в процессе катаболизма выводятся с продуктами жизнедеятельности организма. | Мышечные ткани, поврежденные в результате нагрузок, транспортируются из организма. |
Нарушение метаболизма белков
Нарушения белкового обмена опасны для организма не менее, чем патологии метаболизма жиров и углеводов. Белки участвуют не только в формировании мышц, но практически во всех физиологических процессах.
Что может пойти не так? Как мы все знаем, важнейший энергетический элемент в организме – это молекулы АТФ, которые, путешествуя по крови, раздают клеткам необходимые нутриенты. При нарушении обмена белков “ломается” синтез АТФ и нарушаются процессы, которые косвенно или напрямую влияют на синтезирование из аминокислот новых белковых структур.
В числе наиболее вероятных последствий метаболических нарушений:
Это далеко не полный список того, что может произойти с организмом в случае, если будет нарушен белковый обмен. Однако не все так страшно. Чтобы вывести из строя механизм белкового обмена, нужно, чтобы одновременно совпало хотя бы несколько факторов из перечисленных:
Во что превращаются белки
I. Белки в природе
Белки – это молекулы жизни. Каждый живой организм содержит большое количество различных белковых молекул, при этом каждому виду присущи особые, свойственные только ему белки. Даже белки, выполняющие у различных видов одну и ту же функцию, отличаются друг от друга. Например, у всех позвоночных животных – рыб, птиц, млекопитающих – красные клетки крови содержат белок гемоглобин, переносящий кислород. Но гемоглобин у каждого вида животных свой, особенный. Молекула гемоглобина лошади отличается от соответствующего белка человека в 26 местах, свиньи – в 10 местах, а гориллы – всего лишь одной аминокислотой.
Функции белков в организме очень разнообразны. Есть белки – переносчики веществ (молекул, ионов) и электронов; есть биокатализаторы, ускоряющие реакции в миллиарды раз и отличающиеся удивительной специфичностью, есть регуляторы различных биологических процессов в организме – гормоны, например, инсулин, вазопрессин, окситоцин. Белки защищают организм от инфекции, они способны узнавать и уничтожать чужеродные объекты: вирусы, бактерии, клетки. Контакты клетки с внешней средой также выполняют разнообразные белки, умеющие различать форму молекул, регистрировать изменение температуры, ничтожные примеси веществ, отличать один цвет от другого.
II. Свойства белков
Свойства белков весьма разнообразны и определяются их строением.
По растворимости в воде белки делятся на два класса:
глобулярные белки – растворяются в воде или образуют коллоидные растворы;фибриллярные белки – в воде нерастворимы.
1. Денатурация
При нагревании, изменении кислотности среды происходит разрушение вторичной и третичной структуры белка с сохранением первичной. Это явление называют денатурацией.
Пример денатурации – свертывание яичных белков при варке яиц. Денатурация бывает обратимой (при употреблении алкоголя, солёной пищи) и необратимой. Необратимая денатурация может быть вызвана высокими температурами, радиацией, при отравлении организма солями тяжелых металлов, спиртами, кислотами.
2. Гидролиз белков
Это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот. Анализируя продукты гидролиза, можно установить количественный состав белков.
3. Качественные реакци
1. Биуретовая реакция

2. Ксантопротеиновая реакция

4. Амфотерные свойства белков
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
III. Превращение белков в организме
Животные организмы строят свои белки из аминокислот тех белков, которые они получают с пищей. Поэтому наряду с жирами и углеводами белки – обязательный компонент нашей пищи.
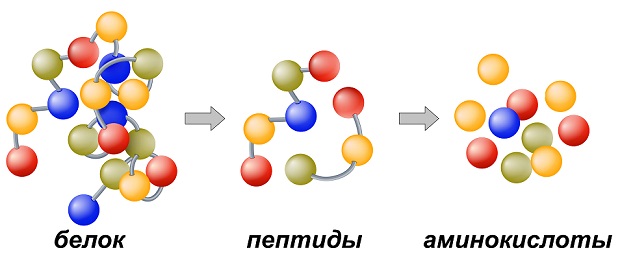
Животные и растительные белки в пищеварительном тракте человека расщепляются на аминокислоты. В процессе переваривания пищи происходит гидролиз белков под влиянием ферментов. В желудке они расщепляются на более или менее крупные «осколки» – пептиды, которые далее в кишечнике гидролизуются до аминокислот. Последние всасываются ворсинками кишечника в кровь и поступают во все ткани и клетки организма. Здесь из аминокислот под действием ферментов синтезируются белки, свойственные тканям человеческого тела. Для синтезирования белков необходимо наличие определенных аминокислот. Но в одних белках, поступающих с пищей, имеются все необходимые человеку аминокислоты, а в других не все. Организм человека может сам синтезировать некоторые аминокислоты или заменять их другими. Но 10 аминокислот он образовать не в состоянии. Их должен непременно получать с пищей. Эти кислоты называются незаменимыми (см. Приложения).
Судьба аминокислот в организме различна
1. Основная их масса расходуется на синтез белков, которые идут на увеличение белковой массы организма при его росте и на обновление белков, распадающихся в процессе жизнедеятельности.
2. Синтез белков идет с поглощением энергии.
3. Аминокислоты используются в организме и для синтеза небелковых азотсодержащих соединений, например нуклеиновых кислот.
4. Часть аминокислот подвергается постепенному распаду и окислению.
IV. Успехи в изучении и синтезе белков
Основные сведения о составе и строении белков были получены при изучении их гидролиза (гидролиз белков – необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот). Установлено, что в результате гидролиза любого белка получается смесь α-аминокислот, причем наиболее часто встречаются в составе белков 20 α-аминокислот.
Как же аминокислоты образуют белковую молекулу? Еще в 80-х годах прошлого века русский ученый-биохимик А.Я. Данилевский на основании своих опытов впервые высказал гипотезу о пептидной связи между остатками аминокислот в белковой молекуле. В 1899 году исследованиями белков занялись немецкие химики-органики Эмиль Фишер и Франц Гофмейстер. Они высказали предположение, что в белках аминокислоты связаны за счет аминогруппы одной кислоты и карбоксила другой. При образовании такой связи выделяется молекула воды. Эта гипотеза была блестяще подтверждена экспериментально в 1907 году и получила название “полипептидной теории”.
Фишеру удалось синтетически получить полипептиды, в молекулы которых входили различные аминокислотные остатки, соединенные пептидными связями.
Химический синтез широко применяют для получения пептидов, в т.ч. биологически активных гормонов и их разнообразных аналогов, используемых для изучения взаимосвязи структуры и биологической функции, а также пептидов, несущих антигенные детерминанты различных белков и применяемых для приготовления соответствующих вакцин. Первые химические синтезы белка в 60-е гг. (инсулина овцы и рибонуклеазы S), осуществленные в растворе с помощью тех же методов, которые используют при синтезе пептидов, были связаны с чрезвычайно большими сложностями. В каждом случае требовалось провести сотни химических реакций и окончательный выход белка был очень низок (менее 0,1%), в результате чего полученные препараты не удалось очистить. Позже были синтезированы некоторые химически чистые белки, в частности инсулин человека (П. Зибер и др.) и нейротоксин II из ядра среднеазиатской кобры (В.Т. Иванов). Однако до сих пор химический синтез белка представляет весьма сложную проблему и имеет скорее теоретическое, чем практическое значение. Более перспективны методы генетической инженерии, которые позволяют наладить промышленное получение практически важных белков и пептидов.
Упрощенный синтез полипептидов можно представить так:
Вспомните: связь между остатками аминокислот, а именно: между группами С = О одной кислоты и N-H другой кислоты – называется пептидной (амидной), группа атомов –СО─NH ─ называется пептидной (амидной) группой.
Пептидная или белковая цепь представляет собой продукт поликонденсации аминокислот. Один из концов цепи, где находится остаток аминокислоты со свободной аминогруппой, называется N-концом, сама аминокислота – N-концевой; другой конец цепи с остатком аминокислоты, имеющим карбоксильную группу, называется С-концом, кислота – С-концевой.
Пептидную цепь всегда записывают, начиная с N-конца. В названии пептида за основу принимают С-концевую кислоту, остальные аминокислоты указывают как заместители с суффиксом –ил-, перечисляя их последовательно, начиная с N-конца. Название полученного дипептида: ГЛИЦ ИЛ АЛАН ИН
Что происходит с белком в организме человека: особенности метаболизма в закладки
Белки – одна из важнейших групп макромолекул в организме человека, представленных в целом разнообразии форм: клеточные рецепторы, сигнальные молекулы, структурные элементы, ферменты, переносчики кислорода и углекислого газа (гемоглобин) – и это далеко не полный список. Белок является составной частью костей, мышц, связок, служит для роста и восстановления тканей организма. Помимо этих функций, белки также могут использоваться в качестве источника энергии. Важной особенностью метаболизма белков является неспособность организма хранить их про запас, потому очень важно постоянно употреблять белки с пищей.
Описание метаболизма белков в организме человека
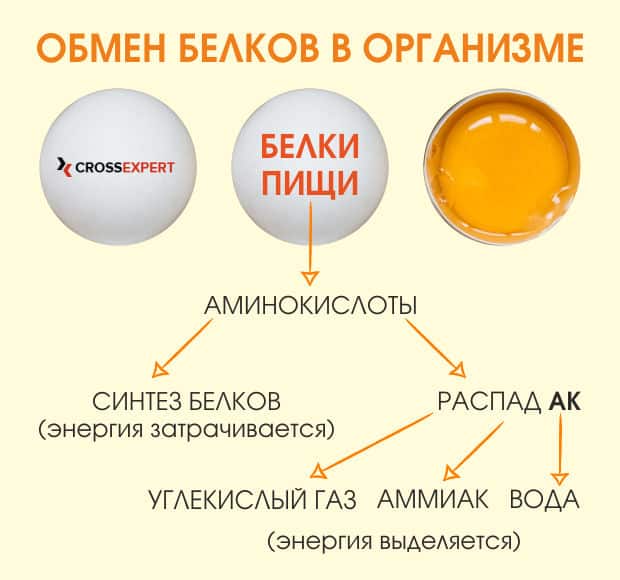
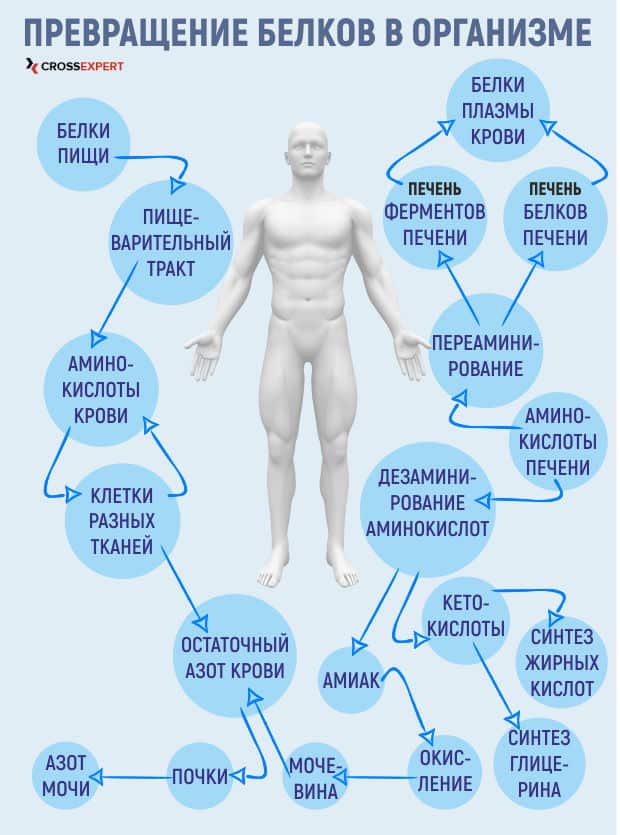
Метаболизм белков начинается в желудке. Когда богатая белком пища попадает в желудок, ее «встречает» фермент пепсин и соляная кислота (HCl, 05%), которая обеспечивает уровень рН 1,5 – 3,5, в котором белки денатурируются. Под воздействием пепсина белки распадаются на полипептиды и составляющие их аминокислоты. Когда химус (пищевая кашица) попадает в тонкий кишечник, поджелудочная железа выделяет сок с содержанием бикарбоната натрия (соды), который нейтрализует соляную кислоту. Это помогает защитить оболочку кишечника.
Организм синтезирует нужные ему белки из аминокислот, которые мы получаем из продуктов питания, а ненужные белки превращаются в глюкозу или триглицериды и используются для поддержания энергии или увеличения энергетического резерва организма.
Также в тонком кишечнике выделяются пищеварительные гормоны, в том числе секретин и холецистокинин, которые стимулируют дальнейшее расщепление белков. Секретин также стимулирует секрецию сока поджелудочной железы, которая также вырабатывает большинство пищеварительных ферментов, в т.ч. протеазу, трипсин, химотрипсин и эластазу, которые способствуют перевариванию белков. Вместе эти ферменты «разбивают» сложные белки на отдельные аминоксилоты, которые транспортируются через слизистую кишечника и используются для синтеза новых белков или конвертации в жиры или ацетил-коэнзим А и используются в цикле Кребса.
Роль пищеварительных ферментов и гормонов в метаболизме белков
Ферменты в желудке и тонком кишечнике расщепляют белки на аминокислоты. НСl в желудке способствует протеолизу, а секретируемые клетками кишечника гормоны регулируют процесс пищеварения.
Чтобы белки поджелудочной железы и тонкого кишечника не расщеплялись, поджелудочная железа также вырабатывает неактивные проферменты, которые активируются только в тонком кишечнике. В поджелудочной железе внутри везикул содержится трипсин, химитрипсин в форме трипсиногена и химотрипсиногена.
После попадания в тонкий кишечник фермент, находящийся в стенках тонкого кишечника (энтерокиназа), связывается с трипсиногеном и превращает его в активную форму – трипсин. После этого трипсин связывается с химотрипсиногеном и конвертирует его в активную форму – химотрипсин. Трипсин и химиотрипсин расщепляют большие белки на меньшие пептиды в процессе протеолиза. Эти небольшие пептиды расщепляются на составляющие аминокислоты, которые транспортируются через апикальную поверхность слизистой кишечника при помощи транпортеров аминокислот. Эти транспортеры связывают натрий и аминокислоту, после чего переносят ее через оболочку. На базальной поверхности клеток слизистой оболочки натрий и аминокислота высвобождаются. Натрий может повторно использоваться в качестве транспортера, а аминокислоты проникают в кровоток и транспортируются к печени и во все клетки организма для синтеза белков.
Свободные аминокислоты используются для синтеза новых белков. В случае избытка аминокислот организм, не имея механизма их хранения, конвертирует их в глюкозу или кетоны или же расщепляет. В результате расщепления аминокислот образуются углеводороды и азотистые шлаки. Однако азот в высоких концентрациях токсичен, потому в ходе орнитинового цикла он обрабатывается, что способствует выведению азота из организма.
Свободные аминокислоты используются для синтеза новых белков. В случае избытка аминокислот организм, не имея механизма их хранения, конвертирует их в глюкозу или кетоны или же расщепляет.
Орнитиновый цикл (цикл образования мочевины)
Орнитиновый цикл – это комплекс биохимический реакций, в результате которого из ионов аммония образуется мочевина с целью предотвращения повышения концентрации аммония в организме до критического уровня. Цикл в большей степени протекает в печени, и в меньшей – в почках. До начала орнитинового цикла ионы аммония образуются в результате расщепления аминокислот вследствие переноса аминогруппы с аминокислоты на кетокислоту. В результате такого трансаминирования образуется молекула, необходимая для цикла Кребса, и ион аммония, который входит в орнитиновый цикл и выводится из организма, объединяясь с СО2, в результате чего образуется мочевина и вода. В свою очередь, мочевина выводится почками в составе мочи.
Аминокислоты также могут использоваться в качестве источника энергии, в особенности в период голодания. Поскольку в процессе обработки аминокислот образуются промежуточные продукты метаболизма, в том числе пировиноградная кислота, ацетил-коэнзим А, ацетоацетил-КоА, оксалоацетат и альфа-кетоглутарат, аминокислоты могут служить источником энергии, выделяемой в ходе цикла Кребса.
Таким образом, образующиеся в результате метаболизма белков аминокислоты используются либо для синтеза необходимых организму белков, либо используются для получения энергии, либо выводятся за ненадобностью, но не хранятся в организме. Поэтому достаточное количество белков в рационе питания очень важно для роста, восстановления тканей и поддержания состояния здоровья.
Как белок превращается в мышцы
Представьте, что вы съели вкусный мраморный стейк. Что происходит дальше? Кислоты и ферменты расщепляют белок на более короткие белки, называемые пептидами. Этот процесс может занять до 90 минут, поэтому вы чувствуете себя сытым. (Углеводы, которые представляют собой менее сложные молекулы, перевариваются за 30 минут или около того).
Ферменты расщепляют пептиды до аминокислот. Ваш организм может вырабатывать 11 видов аминокислот, а девять других он получает из пищи. Аминокислоты соединяются друг с другом, чтобы создавать все — от мышц до гормонов.
Аминокислоты попадают в желудочно-кишечный тракт и стимулируют выделение гормонов сытости. В одном исследовани и люди, увеличившие потребление белка с 15 до 30 процентов от общего количества калорий, в среднем съедали на 441 калорию в день меньше.
Аминокислоты также поступают в печень, которая преобразует их в белки крови, гормоны и белки-носители. Они циркулируют в крови до пяти часов, ожидая, когда какая-либо часть тела потребует их помощи.
После тяжелой тренировки аминокислоты отправляются на восстановление ваших потрепанных мышечных волокон, которые состоят в основном из белков миозина и актина. Миозин состоит из 6,1 тысячи аминокислот, а актин — из 375.
Сердце
Укрепляя сердечную мышцу, аминокислоты могут увеличивать продолжительность жизни, предполагает исследование на грызунах, опубликованное в журнале Cell Metabolism.
Данные свидетельствуют о том, что высокоуглеводные диеты приводят к развитию болезни Альцгеймера, поэтому разумным выбором будет диета с высоким содержанием белка и низким содержанием углеводов.
Артериальное давление
У взрослых, потребляющих больше всего белка (в среднем 100 граммов в день), риск высокого давления на 40 процентов ниже, чем у тех, кто потребляет его меньше всего.