Вобэнзим или лонгидаза после пневмонии что лучше
Восстановление легких после коронавируса
Восстанавливаются ли легкие после COVID-19? Да. Но нужно не пропустить сроки реабилитации и серьёзно отнестись к рекомендациям врача.
Новая коронавирусная инфекция, вызванная SARS-CoV-2, недостаточно изучена, однако ясно, что она наносит вред всем органам и тканям человека. Вирус проникает в организм через слизистые оболочки носа, глаз, глотки. Первые симптомы появляются на 2-14 день. Обычно это повышение температуры выше 37.5 градусов Цельсия, насморк, потеря обоняния, сухой кашель, послабление стула, слабость и головная боль. На 6–10 сутки от момента появления первых симптомов могут начать беспокоить одышка, боль в груди, усиление кашля. Это тревожные симптомы, говорящие о поражении легких и требующие проведения дополнительного обследования: компьютерной томографии легких, измерения насыщения крови кислородом (сатурации).
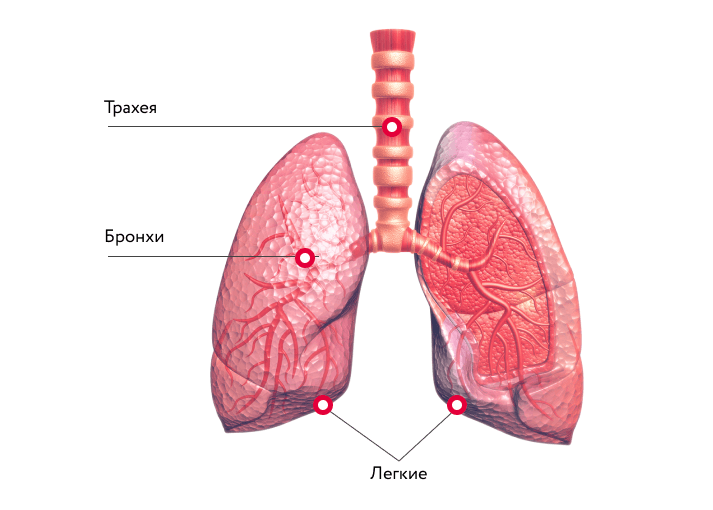
Легкие после COVID-19
Попадая в организм человека через слизистые оболочки дыхательных путей SARS-CoV-2 вызывает мощнейшую воспалительную реакцию. Активируются иммунные клетки, вырабатывается колоссальное количество воспалительных веществ (воспалительных цитокинов). Интенсивность этой реакции скорее всего обусловлена генетически. Именно интенсивностью воспалительной реакции и определяется тяжесть поражения легочной ткани по данным исследований. В легочной ткани поражение при COVID-19 обусловлено как поражением самих альвеол (в которых происходит газообмен и кровь насыщается кислородом из воздуха) нашими собственными иммунными клетками так и поражением легочных сосудов, оплетающих альвеолы. Степень поражения легких можно определить при помощи КТ (компьютерной томографии).
Таблица 1. Поражение лёгких при COVID-19
Процент поражения легочной ткани
Поражена часть лёгкого. Небольшое затруднение дыхания.
Вобэнзим : инструкция по применению
Состав
Лактоза моногидрат, прежелатинизированный крахмал кукурузный, магния стеарат, стеариновая кислота, кремния диоксид коллоидный, тальк, сополимер метаакриловой кислоты и метилметакрилата (1:1), натрия лаурилсульфат, макрогол 6000, триэтилцитрат, гипромеллоза, гидроксипропилцеллюлоза, целлюлоза микрокристаллическая, глицерин, титана диоксид, краситель пунцовый 4 R (Е124), краситель желтый оранжевый краситель S (Е110).
Описание
Круглые двояковыпуклые таблетки, покрытые оранжево-красной оболочкой, со специфическим запахом. Допускаются колебания в интенсивности окраски внешней оболочке от оранжево-красного до красного цвета.
Фармакотерапевтическая группа
Прочие лекарственные средства, используемые при нарушениях со стороны костно-мышечной системы. Энзимы; трипсин в комбинации.
Фармакологические свойства
Смесь ферментов, включающая бромелайн и папаин, способствует уменьшению отека травматического происхождения путем ферментативного протеолиза в интерстиции макромолекул медиаторов воспаления (гистамин, и т.д.) Кроме того, в области повреждения за счет лизиса фибрина и микротромбов улучшается микроциркуляция, что способствует уменьшению отека. У лабораторных животных (крыс) была продемонстрирована способность протеолитических ферментов, входящих в состав препарата Вобэнзим, ингибировать агрегацию тромбоцитов. В экспериментальных и клинических моделях продемонстрировано регуляторное воздействие на иммунную систему смеси протеаз входящих в состав препарата Вобэнзим.
Описан механизм поглощения крупномолекулярых веществ, таких как ферменты, путем парацеллюлярной диффузии в слизистой кишечника. Также имеет место расщепление протеаз в кишечнике до аминокислот. Для бромелаина и папаина период полувыведения установлен 5,5-8 ч и 36-48 ч соответственно. Рутозид, очевидно, быстро метаболизируется после перорального приема. В крови определяются метаболиты кверцетина: 3,4-диокси-фенилуксусная кислота, 3,4-дигидрокситолуол, 3-гидрокси-фенилуксусная кислота и З-метокси-4-гидрокси-фенплуксусная кислота (гомованилиновая кислота). После перорального приема рутозида около 50% его метаболитов выводятся из организма в течение 48 ч с мочой.
Показания к применению
Вобэнзим используется в составе комплексной терапии воспаления, отёка и боли при:
— при артритах, включая ревматоидный артрит, и при артрозах.
Лонгидаза при пневмофиброзе легких
«Через 6-8 месяцев после выписки почти половина взрослых, госпитализированных в связи с COVID-19, сообщили о стойких симптомах. Усталость и респираторные симптомы были наиболее распространенными, и женский пол был более подвержен»
Munblit D. Avdeev S. et al. Incidence and risk factors for persistent symptoms in adults previously hospitalized for COVID‐19 //Clinical & Experimental Allergy. – 2021. – Т. 51. – №. 9. – С. 1107-1120.
https://onlinelibrary.wiley.com/doi/full/10.1111/cea.13997.
Пневмофиброз — это
Пневмофиброз — заболевание, при котором ткань легких заменяется соединительной под воздействием воспалительных, деструктивных, дистрофических процессов.
Основу легких составляет соединительная ткань, окружающая бронхи, артерии, межальвеолярные перегородки. Она состоит из переплетенных волокон коллагена и эластина, которые дают легким возможность расширяться при вдохе и возвращаться в начальное положение при выдохе. Благодаря коллагеновым волокнам каркасу легочной ткани обеспечена прочность.
Также в соединительной ткани продуцируются ферменты протеиназы, которые разрушают белковые элементы и ингибиторы протеиназ, тормозящие процессы разрушения. Процесс работы такой системы сбалансирован, но при развитии воспаления он нарушается, что вызывает дефицит фермента α1-антитрипсин (A1AT). Недостаточность этого фермента приводит к разрушению эластина и коллагена. На месте поврежденных альвеол образуются пустоты, иммунные реакции провоцируют активность фибробластов (клеток соединительной ткани организма, синтезирующих внеклеточный матрикс) и чрезмерную выработку эластазы и коллагена 1-го типа.
При таком состоянии происходит следующее:
В результате этих процессов у больных появляется одышка во время физических нагрузок. По мере развития заболевания отмечается нарастание одышки, вплоть до полной инвалидизации больного:
Предотвратить развитие нарушений в легких можно с помощью препарата Лонгидаза ®
Его применяют для лечения и профилактики. Чем раньше начинается применение препарата, тем лучше может быть прогноз при данном заболевании.
Во временных методических рекомендациях от 26 октября 2020 года «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)» указано: «После перенесенного COVID-19 у многих пациентов в легких формируются выраженные остаточные изменения в виде фиброза».
На данный момент один из наиболее актуальных вопросов — способна ли легочная ткань восстановиться полностью после перенесенного заболевания.
Пневмофиброз был серьезной проблемой и в доковидные времена, так как любая пневмония — это риск развития пневмофиброза. При вторжении в нашу жизнь вируса COVID-19 значительно возрос процент пневмоний, осложняющихся выраженным пневмофиброзом. Однако при должном и своевременном лечении функциональность органов дыхания может восстановиться.
По мнению специалистов, делать окончательные выводы о пневмофиброзе после ковидной пневмонии еще рано, так как пандемия продолжается. COVID-19 не похож на обычную внебольничную пневмонию, патология отличается по клиническим показателям, лечится по другой терапевтической схеме.
Большинство пациентов с COVID-19 страдают нарушениями дыхательной функции различной степени выраженности. Кроме того, возможен рост интерстициальных легочных поражений. Отказ от лечения и реабилитации этих больных может грозить ростом количества пациентов с развившейся стойкой утратой трудоспособности (с присвоением группы инвалидности), снижением качества и продолжительности жизни.
Последствия и опасность пневмофиброза
Осложнениями заболевания являются следующие патологии и состояния:
Частота развитий осложнений зависит от ряда факторов: общего состояния организма, наличия других хронических заболеваний, возраста, генетической предрасположенности, работы иммунной системы. Немаловажную роль играет время обращения за врачебной помощью.
Комплексное лечение с применением препарата Лонгидаза ® позволяет улучшить состояние легких.
Лучший способ избежать осложнений — своевременная диагностика и лечение. При наличии характерных признаков заболевания нужно как можно раньше обратиться к врачу. Самолечение при патологиях, связанных с пневмофиброзом, недопустимо.
Симптомы
Основной признак пневмофиброза — это одышка. На первых этапах развития заболевания она может появляться только после физической нагрузки. При длительном течении болезни одышка возникает даже в состоянии покоя. К симптомам пневмофиброза также относятся:
Исследования
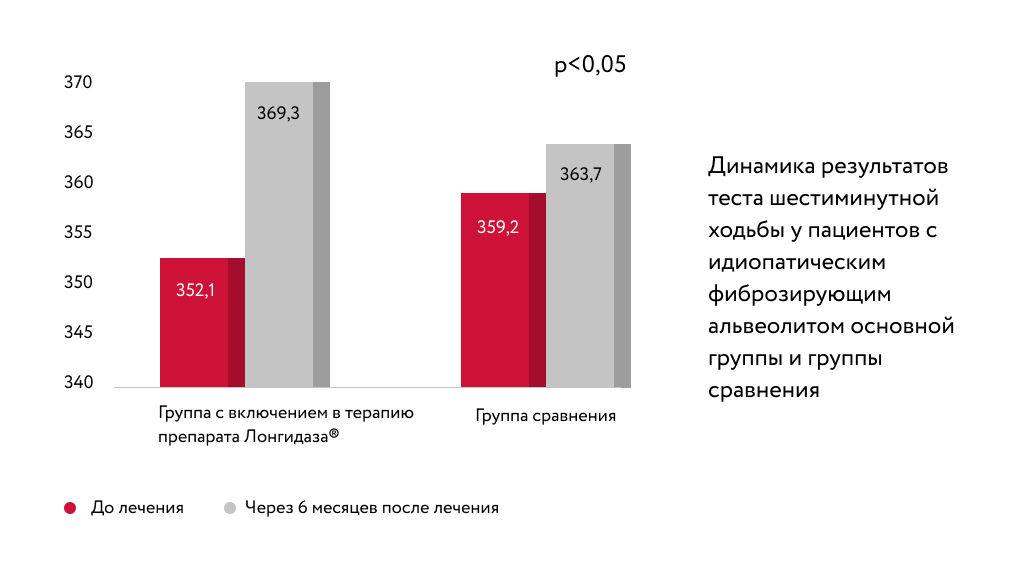
В статье автора более 40 научных работ Л. Н. Новиковой подчеркивается целесообразность включения препарата Лонгидаза ® в комплексное лечение пневмофиброза у больных с идиопатическим фиброзирующим альвеолитом. При использовании препарата Лонгидаза ® отмечалась положительная клиническая динамика: уменьшились кашель и слабость, повысилась толерантность к физической нагрузке.
У исследуемых групп применялся легкий и удобный способ определения степени толерантности к физической нагрузке — тест шестиминутной ходьбы. Оценивали расстояние, которое пациент проходил в течение 6 минут в удобном для него темпе. При включении в терапию Лонгидаза ® пройденное расстояние увеличивалось быстрее, чем в группе сравнения.
По данным исследования И. И. Ануфриева и Н. В. Козыревой, при применении Лонгидаза ® наблюдается положительная рентгенологическая динамика у 93% пациентов, а также уменьшение зоны пневмосклероза, что позволяет сделать вывод о повышении эффективности лечения внебольничной пневмонии и обострений хронической обструктивной болезни легких при включении Лонгидаза ® в состав комплексной терапии.
Применение препарата
Лонгидаза ®
Препарат содержит активное вещество бовгиалуронидаза азоксимер, которое способно тормозить процесс разрастания соединительной ткани.
Лонгидаза ® обладает многокомпонентным действием:
Новые подходы к лечению фиброзирующих интерстициальных заболеваний легких
Фиброзирующие варианты поражения легких, приводящие к развитию дыхательной недостаточности, относятся к числу наиболее тяжелых интерстициальных заболеваний легких. Помимо идиопатического легочного фиброза, они включают в себя хронический гиперсенситивный пневмонит, неспецифическую интерстициальную пневмонию, поражение легких в рамках системных заболеваний соединительной ткани, неблагоприятные варианты течения легочного саркоидоза и некоторые другие. Применяющаяся для лечения этих заболеваний иммуносупрессивная терапия у части пациентов оказывается неэффективной и сопряжена с высоким риском тяжелых нежелательных явлений. Изучение новых лекарственных препаратов с антифиброзным действием, в частности нинтеданиба, открывает новые возможности для лечения этой непростой группы больных.
С.В. Моисеев. Среди хронических интерстициальных заболеваний легких (ИЗЛ) наиболее тяжелыми являются варианты поражения легких, протекающие с формированием выраженного фиброза и, следовательно, дыхательной недостаточности. Хотя механизмы образования соединительной ткани при этих заболеваниях были достаточно хорошо изучены, терапевтические подходы к торможению фиброгенеза до недавнего времени оставались мало эффективными, а широко назначавшаяся ранее при всех вариантах ИЗЛ иммуносупрессивная терапия оказалась неоправданной при многих заболеваниях. Действительно, при хроническом гиперсенситивном пневмоните, фибротическом варианте неспецифической интерстициальной пневмонии (в том числе в рамках системных заболеваний соединительной ткани), продвинутых стадиях легочного саркоидоза применение преднизолона и иммуносупрессивных препаратов не приводит к торможению фиброзного ремоделирования легочной ткани и значительно повышает риск респираторных инфекций и других нежелательных явлений [1].
М.Ю. Бровко. В начале XXI века для лечения идиопатического легочного фиброза, характеризующегося рентгенологической и гистологической картиной обычной интерстициальной пневмонии, были зарегистрированы два препарата с доказанным антифиброзным действием – нинтеданиб и пирфенидон [2,3]. Общность механизмов развития легочного фиброза при обычной интерстициальной пневмонии и других вариантах фиброзирующих ИЗЛ позволили предположить, что эти препараты могут найти применение и при других заболевания [4].
Нинтеданиб является низкомолекулярным ингибитором тирозинкиназ, блокирующим важнейшие сигнальные пути фиброгенеза в легочной ткани, в которых участвуют фактор роста тромбоцитов (PDGF), фактор роста эндотелия сосудов (VEGF) и фактор роста фибробластов (FGF) [5]. Первоначально этот препарат изучали при онкологических заболеваниях и применяли для лечения немелкоклеточного рака легкого, однако в 2014 году были завершены 52-недельные двойные слепые плацебоконтролируемые исследования INPULSIS-1 и INPULSIS-2, которые доказали способность препарата замедлять прогрессирование идиопатического легочного фиброза [2]. В целом в эти исследования были включены 1066 пациентов с идиопатическим легочным фиброзом, которых рандомизировали на группы нинтеданиба в дозе 150 мг два раза в день или плацебо. Первичной конечной точкой была ежегодная скорость снижения форсированной жизненной емкости легких (ФЖЕЛ). В обоих исследованиях в группе нинтеданиба она была примерно в два раза ниже, чем в группе плацебо (в исследовании INPULSIS-1 разница ежегодной скорости снижения ФЖЕЛ между группами составила 125,3 мл; p 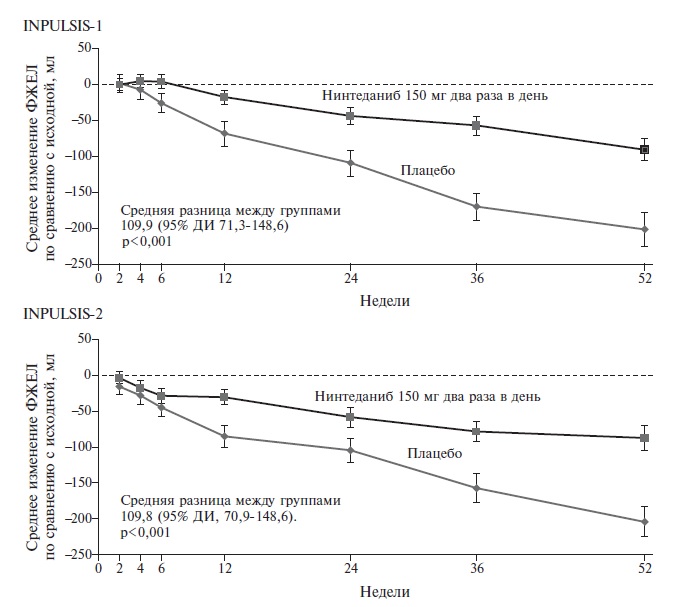
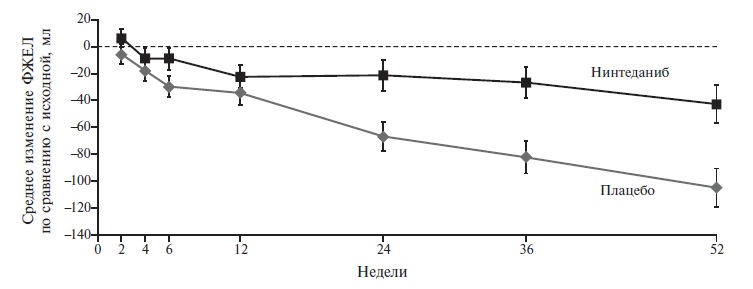
В 2018 г. после завершения двойного слепого, плацебо-контролируемого исследования SENCSIS была подтверждена эффективность назначения нинтеданиба при прогрессирующем поражении легких в рамках системной склеродермии (ССД) [6]. В исследование были включены 576 больных, которых рандомизировали на группы нинтеданиба в дозе 150 мг два раза в день внутрь или плацебо. Первичная конечная точка была такой же, как в исследованиях INPULSIS. Лечение нинтеданибом достоверно задерживало развитие фиброза у больных ССД, а разница ежегодной скорости снижения ФЖЕЛ между двумя группами составила 41,0 мл в пользу нинтеданиба (р=0,04; рис. 2).
П.И. Новиков. ССД – это аутоиммунное заболевание, в основе которого лежат генерализованная микроангиопатия и активация процессов фиброгенеза. На ранних стадиях заболевание проявляется кожными изменениями в виде плотного отека пальцев и синдромом Рейно, которые могут не сопровождаться ухудшением общего состояния или признаками поражения внутренних органов (в том числе одышкой), поэтому пациенты зачастую не сразу обращаются за медицинской помощью. В связи с этим ССД нередко диагностируют поздно, когда патологические изменения в органах необратимы, а лечение менее эффективно. По данным канадского регистра, у 408 пациентов диагноз ССД был установлен в среднем через 6,0 лет после развития феномена Рейно и через 2,7 года после появления первых «внекожных» проявлений [7]. В России ССД диагностировали через 2,0–2,7 года после появления феномена Рейно при диффузной форме заболевания [8]. При этом результаты крупного исследования (n=5860) показали, что смертность пациентов с ССД достигает 68 на 1000 человек в год [9]. Таким образом, своевременная диагностика ССД представляет собой сложную, но очень важную задачу для врача. Примерно у 75% больных уже в первые годы заболевания выяв ляют интерстициальное поражение легких, характеризующееся медленным прогрессирующим течением с исходом в фиброз разной степени тяжести [10]. Л.В. Теплова и соавт. с помощью компьютерной томографии высокого разрешения выявили признаки поражения интерстиция легких у 82% из 138 пациентов с ССД [11].
Лечение ИЗЛ в рамках ССД обычно начинают с иммуносупрессивных препаратов, в частности циклофосфамида [12]. В многоцентровом, проспективном, рандомизированном, двойном слепом, плацебо-контролируемом исследовании лечение цифлофосфамидом внутривенно в течение 6 мес с последующей заменой на азатиоприн привело к увеличению ФЖЕЛ на 4,2% по сравнению с контролем [13], что указывало на способность препарата замедлять прогрессирование поражения легких при этом заболевании. Тем не менее, через 2 года после начала 12-месячной иммуносупрессивной терапии было выявлено ухудшение ФЖЕЛ и рентгенологической картины [14].
В рандомизированном, двойном слепом 24-месячном исследовании микофенолат мофетил в дозе 3000 мг/сут у больных ССД с поражением легких не отличался от циклофосфамида в дозе 2 мг/кг/сут внутрь по эффективности, но имел преимущества по переносимости [15]. Результаты небольших неконтролируемых исследований свидетельствуют о том, что ритуксимаб может улучшить течение ИЗЛ у больных ССД [16]. Недавно эффективность и безопасность ритуксимаба были изучены у 254 больных ССД (у 58% из них имелось ИЗЛ), получавших лечение в центрах, которые входят в программу EUSTAR (в Российской Федерации – НИИ ревматологии им. В.А. Насоновой и клиника им. Е.М. Тареева). Контрольную группу составили 9575 подобранных пациентов с ССД, которым проводилось лечение другими препаратами. Хотя ритуксимаб вызывал улучшение фиброза кожи, он не оказывал существенного влияния на динамику ФЖЕЛ или диффузионной способности по оксиду углерода (DLCO).
В целом приведенные данные свидетельствуют о том, что иммуносупрессивные препараты, в том числе циклофосфамид, микофенолат мофетил и ритуксимаб, позволяют стабилизировать течение ИЗЛ у части, но далеко не у всех больных ССД, что определяет необходимость применения других подходов к лечению, прежде всего с использованием препаратов, обладающих антифиброзной активностью.
С.В. Моисеев. Особенно трудным является ведение пациентов с поражением легких в рамках ССД, у которых легочный фиброз прогрессирует несмотря на адекватную иммуносупрессивную терапию. Приводим клиническое наблюдение:
Л.А. Акулкина. Пациентка А., 50 лет. С 35 лет отмечает онемение и посинение пальцев рук на холоде. Диагностирован синдром Рейно. В 2010 г. в возрасте 40 лет появились малопродуктивный кашель и одышка при физической нагрузке. По месту жительства респираторная симптоматика трактовалась как проявление инфекционного процесса, в связи с чем периодически проводились антибактериальная терапия, инфузии эуфиллина без существенного эффекта. В 2014 г. при мультиспиральной компьютерной томография органов грудной клетки (МСКТ) выявлены признаки интерстициальной пневмонии, однако какая-либо терапия назначена не была, а дыхательная недостаточность постепенно нарастала. При контрольной МСКТ через полтора года в обоих легких, преимущественно в нижних долях, определялись участки фиброза и «сотового легкого» на фоне значительных интерстициальных изменений по типу «матового стекла» с утолщением и уплотнением легочного интерстиция и междольковых перегородок (более выражено в периферических отделах), а также внутригрудная лимфаденопатия верхней паравазальной, ретрокавальной, трахеобронхиальных и бифуркационной групп до 13 мм. Обратилась к фтизиатру, который исключил туберкулез органов дыхания. В 2016 г. в возрасте 46 лет впервые госпитализирована в клинику им. Е.М. Тареева. При осмотре обращали на себя внимание изменения кожи с формированием «кисетного рта», плотный отек пальцев рук, синдром Рейно с дигитальными язвами. При обследовании выявлены антинуклеарный фактор (АНФ) в титре 1:1280, положительные антитела к цитоплазматическому антигену SS-A (Ro), резкоположительные антитела к топоизомеразе I Scl-70. ФЖЕЛ была снижена до 74%, а DLСО – до 58%. При эхокардиографии выявлены умеренные признаки легочной гипертензии с повышением систолического давления в легочной артерии до 45 мм рт. ст. Сочетание характерных кожных изменений, синдрома Рейно, изменений в легких по типу прогрессирующего фиброзирующего заболевания легких (утолщение, деформация внутридолькового и междолькового легочного интерстиция, участки кистозной трансформации легочной ткани, уменьшение нижних долей легких в размерах, наличие тракционных бронхоэктазов, уплотнение легочной ткани по типу «матового стекла» в субплевральных и базальных отделах обоих легких) и серологических маркеров позволило диагностировать ССД с поражением легких. Начата комбинированная иммуносупрессивная терапия циклофосфамидом в дозе 800 мг внутривенно ежемесячно в течение 5 месяцев, пероральный прием преднизолона 10 мг/сут и гидроксихлорохина 200 мг/сут. В результате терапии отмечены уменьшение одышки и кашля, повышение толерантности к физическим нагрузкам, однако каждая инфузия циклофосфамида сопровождалась инфекционными осложнениями. Тем не менее, при МСКТ через 6 мес наблюдалась умеренная отрицательная динамика в виде нарастания интерстициальных фиброзных изменений в легких. Циклофосфамид был заменен на микофенолат мофетил, а терапия преднизолоном продолжена в прежней дозе. Увеличить дозу микофенолата мофетила до целевой не удалось в связи с развитием стойкой диареи, поэтому препарат был отменен. В декабре 2016 г. начаты инфузии ритуксимаба. В результате лечения наблюдался некоторый положительный клинический эффект в виде уменьшения одышки и выраженности синдрома Рейно, повышения толерантности к физическим нагрузкам. В мае 2017 г. лабораторные признаки активности заболевания отсутствовали, а при МСКТ выявлено уменьшение выраженности изменений по типу «матового стекла» в обоих легких, однако площадь фиброзных изменений несколько увеличилась. С учетом полной деплеции CD19+ B-лимфоцитов в периферической крови повторное введение ритуксимаба было решено отложить. В апреле 2018 г. рентгенологическая картина и функциональные легочные показатели без динамики. Отмечено нарастание числа CD19+ В-лимфоцитов до 0,8%, в связи с чем проведена очередная инфузия ритуксимаба 1 г. В мае 2019 года функция легких оставалась относительной стабильной (ФЖЕЛ 67%, DLCO 46%), однако при МСКТ отмечено нарастание уплотнения легочной ткани по типу «матового стекла». Выполнено очередное введение ритуксимаба 1 г. При обследовании в декабре того же года клиническое состояние пациентки стабильно, признаков активности ССД нет, однако выявлено нарастание фиброзных изменений легочной ткани при отсутствии существенной динамики ФЖЕЛ и DLCO. В настоящее время обсуждается возможность назначения нинтеданиба.
М.Ю. Бровко. История заболевания пациентки де монстрирует недостаточную эффективность применявшихся иммуносупрессивных лекарственных препаратов – несмотря на лечение в течение 3 лет отмечено снижение показателей легочной вентиляции, в том числе ФЖЕЛ на 10% и DLCO на 12%. В этом случае оправдано применение антифибротической терапии, так как в исследовании SENCSIS лечение нинтеданибом у таких больных позволило замедлить нарастание респираторного дефицита у пациентов с ССД практически вдвое [6].
В.И. Шоломова. Опубликованные в 2019 г. результаты 52-недельного двойного слепого, плацебо-контролируемого исследования INBUILD подтвердили эффективность терапии нинтеданибом при практически полном спектре фиброзирующих ИЗЛ, не относящихся к ИЛФ. В исследовании приняли участие 663 пациента из 15 стран, включая Российскую Федерацию. Критериями включения были признаки интерстициального фиброза с вовлечением более 10% легочной паренхимы по данным МСКТ органов грудной клетки в сочетании с признаками прогрессирования заболевания за предыдущие 24 мес (нарастание рентгенологических изменений, снижение ФЖЕЛ, усугубление респираторной симптоматики) несмотря на иммуносупрессивную терапию. Лечение нинтеданибом 150 мг два раза в сутки и плацебо получали пациенты с гиперсенситивным пневмонитом, идиопатической неспецифической интерстициальной пневмонией, неклассифицируемой интерстициальной пневмонией, поражениями легких, ассоциированными с различными системными заболеваниями соединительной ткани (в том числе ССД, ревматоидным артритом), профессиональными заболеваниями и саркоидозом. У большей части пациентов (62,1%) имелись рентгенологические изменения, соответствующие паттерну обычной интерстициальной пнев монии.
А.Ш. Янакаева. Больная К., 65 лет. В 2014 г. в возрасте 60 лет появился постоянный сухой кашель, однако к врачу не обращалась. В январе 2016 г. при диспансеризации впервые выявлены патологические признаки на рентгенограммах легких. При МСКТ обнаружены изменения по типу «матового стекла» в базальных отделах обоих легких, увеличение внутригрудных лимфатических узлов до 14 мм. Признаков дыхательной недостаточности не выявлено. ФЖЕЛ составила 110%, однако исследование диффузионной способности не проводилось. При эхокардиографии без существенных отклонений. Диагностирована идиопатическая интерстициальная пневмония. Проводилась терапия преднизолоном 25 мг/сут и ацетилцистеином 600 мг/сут. При контрольной МСКТ через 6 мес положительной динамики не наблюдалось, сохранялся сухой кашель. Рекомендовано продолжить прием преднизолона в дозе 15 мг/сут.
В апреле 2017 г. госпитализирована в Клинику им. Е.М. Тареева с жалобами на мучительный сухой кашель, слабость, умеренную одышку. В базальных отделах обоих легких выслушивалась крепитация. ФЖЕЛ – 91%, DLСО – 67%. Рентгенологически определялась картина неспецифической интерстициальной пневмонии. По сравнению с предыдущим исследованием отмечено нарастание фиброзных изменений, в то время как выраженность зон «матового стекла» существенно не изменилась (рис. 4). При иммунологическом исследовании обнаружено повышение титра АНФ до 1:320, слабоположительный титр SS-A. Неоднократно осматривалась ревматологом, данных за какое-либо системное заболевание соединительной ткани не было. Диагностирована интерстициальная пневмония с аутоиммунными признаками [18]. Продолжена терапия преднизолоном в дозе 20 мг/сут, к которому был добавлен микофенолат мофетил в дозе 2000 мг/сут. В ноябре 2017 г. отмечено уменьшение площади интерстициальных изменений по типу «матового стекла» при усилении выраженности тракционных бронхоэктазов. Несмотря на проводимую иммуносупресивную терапию вентиляционная функция продолжала снижаться, в том числе ФЖЕЛ до 82% и DLСО до 61%. С учетом неэффективности иммуносупрессивной терапии и соответствия пациенки критериям отбора в исследование INBUILD в декабре 2017 г. начато лечение нинтеданибом в дозе 150 мг два раза в сутки в сочетании с преднизолоном в дозе 10 мг/сут. На фоне 2-летней терапии нинтеданибом впервые отмечена стабилизация показателей функции внешнего дыхания: в сентябре 2019 г. ФЖЕЛ составила 81%, а DLСО – 59%. При МСКТ выраженность фиброзных изменений не изменилась, в связи с чем терапию антифиброзным препаратом решено продолжить.
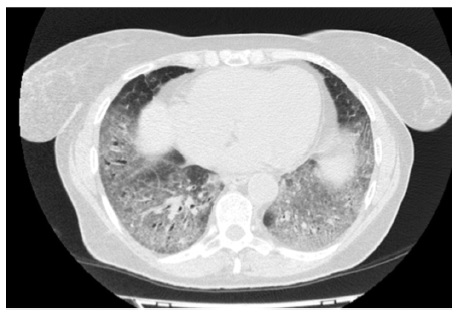
С.В. Моисеев. Представленные истории болезни демонстрируют варианты неблагоприятного фиброзирующего течения ИЗЛ, отличных от идиопатического легочного фиброза. Обеим пациенткам показана длительная терапия антифиброзным лекарственным препаратом – нинтеданибом в дозе 150 мг два раза в сутки. Результаты плацебо-контролируемых клинических исследований свидетельствуют о том, что лечение этим препаратом оказывает благоприятное влияние на различные фиброзирующие заболевания легких. Очевидно, что лучших результаты терапии можно ожидать у второй пациентки, учитывая отсутствие системного заболевания. Однако и первой больной назначение нинтеданиба также показано, так как неблагоприятный прогноз в первую очередь определяется поражением легких и прогрессирующей дыхательной недостаточности.
Необходимость лечения нинтеданибом должна быть подтверждена в лечебном учреждении, занимающемся изучением ИЗЛ и имеющем опыт ведения таких пациентов. Нинтеданиб переносится удовлетворительно и обычно не вызывает тяжелые нежелательные реакции, поэтому препарат может применяться под наблюдением врача поликлиники. Био химические показатели целесообразно контролировать ежемесячно в течение первых трех месяцев после начала лечения, а затем ежеквартально.