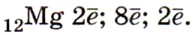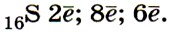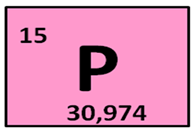Восстановительные свойства натрия сильнее чем у
§ 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева
Как и литературным героям, химическим элементам — «героям» химических процессов дают характеристики. Только если для первых в качестве первоисточника используют литературное произведение, то для вторых — Периодическую систему химических элементов Д. И. Менделеева. Однако и в первом, и во втором случае необходим план.
Характеризуя химический элемент, будем придерживаться следующего плана.
1. Положение элемента в Периодической системе Д. И. Менделеева и строение его атомов.
2. Характер простого вещества (металл, неметалл).
3. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами.
4. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами.
5. Состав высшего оксида, его характер (основный, кислотный, амфотерный).
6. Состав высшего гидроксида, его характер (кислородсодержащая кислота, основание, амфотерный гидроксид).
7. Состав летучего водородного соединения (для неметаллов).
В приведённом плане для вас незнакомыми являются следующие химические понятия: переходные металлы, амфотерные оксиды и гидроксиды. Их смысл будет раскрыт в следующем параграфе. Пока же рассмотрим характеристики металла и неметалла.
При этом будем руководствоваться уже известными вам из курса 9 класса основными закономерностями изменения свойств атомов, простых веществ и соединений, образованных химическими элементами главных подгрупп (А групп) и периодов Периодической системы Д. И. Менделеева (табл. 1).
Характеристика металла на примере магния.
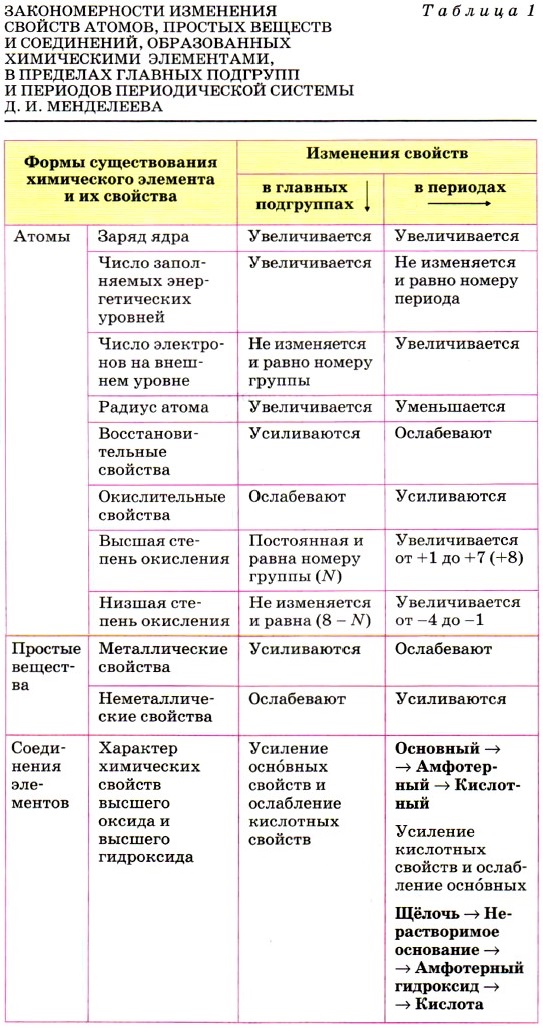
Элемент магний находится в 3-м периоде Периодической системы, значит, все электроны атома располагаются на трёх энергетических уровнях. Строение электронной оболочки атома магния можно отразить с помощью следующей схемы:
Исходя из строения атома, можно предсказать и степень окисления магния в его соединениях. В химических реакциях атом магния отдаёт два внешних электрона, проявляя восстановительные свойства, следовательно, он получает степень окисления +2.
Восстановительные свойства у магния выражены сильнее, чем у бериллия, но слабее, чем у кальция (элементы IIА группы), что связано с увеличением радиусов атомов при переходе от Be к Mg и Са. Соответственно в ряду Be — Mg — Са два внешних электрона всё более удаляются от ядра, ослабевает их связь с ядром, и они всё легче покидают атом, который при этом переходит в ион М2 + (М — металл).
2. Для магния — простого вещества — характерна металлическая кристаллическая решётка и металлическая химическая связь, а отсюда и все типичные для металлов свойства (вспомните какие).
3. Металлические свойства у магния выражены сильнее, чем у бериллия, но слабее, чем у кальция (объясните почему, учитывая, что металлические свойства определяются в первую очередь способностью атомов отдавать электроны).
4. Металлические свойства у магния выражены слабее, чем у натрия, но сильнее, чем у алюминия (соседние элементы 3-го периода) (объясните почему).
5. Оксид магния MgO является основным оксидом и проявляет все типичные свойства основных оксидов (iвспомните какие).
6. В качестве гидроксида магнию соответствует основание Mg(OH)2, которое проявляет все характерные свойства оснований (вспомните какие).
7. Летучего водородного соединения магний не образует.
Характеристика неметалла на примере серы.
1. Сера — элемент VIA группы и 3-го периода, Z = 16, А = 32. Соответственно атом серы содержит в ядре 16 протонов и 16 нейтронов и на электронной оболочке — 16 электронов. Строение его электронной оболочки можно отразить с помощью следующей схемы:
Сера — менее сильный окислитель, чем кислород, но более сильный, чем селен, что связано с увеличением радиусов атомов от кислорода к селену. По этой же причине восстановительные свойства элементов в главной подгруппе VI группы (VIA группы) при переходе от кислорода к селену усиливаются. (Дайте объяснения указанных изменений окислительных и восстановительных свойств.)
2. Сера — простое вещество, типичный неметалл. Сере свойственно явление аллотропии. Разные простые вещества, образованные химическим элементом серой, имеют различные свойства, так как кристаллическое строение их различно. Например, у ромбической серы молекулярная кристаллическая решётка состоит из циклических молекул состава S8, а у пластической серы молекулы представляют собой длинные открытые цепи атомов:
3. Неметаллические свойства у серы выражены слабее, чем у кислорода, но сильнее, чем у селена.
4. Неметаллические свойства у серы выражены сильнее, чем у фосфора, но слабее, чем у хлора (соседние элементы в 3-м периоде).
5. Высший оксид серы имеет формулу SO3. Это кислотный оксид. Он проявляет все типичные свойства кислотных оксидов какие?).
6. Высший гидроксид серы — хорошо известная вам серная кислота H2SO4, раствор которой проявляет все типичные свойства кислот (какие?).
7. Сера образует летучее водородное соединение — сероводород H2S.
Подобные характеристики можно привести для большинства элементов-металлов и элементов-неметаллов главных подгрупп. На их основе можно составить генетические ряды металла и неметалла.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
1. Дайте характеристику элементов: а) фосфора; б) калия.
2. Запишите уравнения химических реакций, характеризующие свойства: a) MgO и SO3; б) Mg(OH)2 и H2SO4. Уравнения реакций с участием электролитов запишите также в ионной форме.
3. Дайте характеристику магния — простого вещества. Какой тип связи наблюдается в нём? Какие физические свойства имеет металл магний? Запишите уравнения реакций магния со следующими веществами: а) кислородом; б) хлором Сl2; в) серой; г) азотом N2; д) соляной кислотой. Рассмотрите их с позиций процессов окисления-восстановления.
4. Что такое аллотропия? Какой тип химической связи реализуется в молекулах состава: a) S8; б) H2S? Какие физические свойства имеет наиболее устойчивая модификация серы — ромбическая сера? Запишите уравнения реакций серы со следующими веществами: а) натрием; б) кальцием;в) алюминием; г) кислородом; д) водородом; е) фтором F2. Рассмотрите их с позиций процессов окисления-восстановления.
5. Сравните свойства простого вещества кремния со свойствами простых веществ, образованных химическими элементами — соседями кремния по периоду.
6. У высшего оксида какого химического элемента наиболее выражены кислотные свойства: а) азота или фосфора; б) фосфора или серы?
7. Вычислите объём воздуха (примите объёмную долю кислорода в нём равной 0,2), который потребуется для сжигания 120 мг образца магния, содержащего 2% негорючих примесей.
8. Вычислите объём оксида серы (IV) (н. у.), который может быть получен при сжигании 1,6 кг серы, если выход продукта составляет 80% от теоретически возможного. Указание. Сначала по уравнению реакции рассчитайте объём оксида серы (IV) — это теоретический объём Итеор, затем найдите практический объём Упракт, исходя из известного выхода продукта W:
Аналогично можно найти массу продукта реакции, используя формулу:
9. Можно ли утверждать, что высшему оксиду серы SO3 соответствует сернистая кислота H2SO3? Почему?
10. Используя метод электронного баланса, определите коэффициенты в схемах химических реакций:
Характеристика ХЭ на основании его положения в ПС Д. И. Менделеева
Урок 1. Химия 9 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Характеристика ХЭ на основании его положения в ПС Д. И. Менделеева»
Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева.
Химические элементы в Периодической системе – это герои, и им, как и любым героям, нужно давать определенные характеристики. За основу их характеристики нужно брать Периодическую систему химических элементов Д.И. Менделеева.
Описывать химический элемент нужно будет по 7 пунктам:
1. указать Положение элемента в Периодической системе Д.И. Менделеева и строение его атома
2. характер простого вещества, т.е. металлом или неметаллом является этот химический элемент
3. сравнить свойства простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами
4. сравнить свойства простого вещества со свойствами простых веществ, образованных соседними по периоду элементами
5. определить состав высшего оксида и его характер (основный, кислотный, амфотерный)
6. состав высшего гидроксида, его характер (кислородсодержащая кислота, основание, амфотерный гидроксид)
7. для неметаллов ещё указать состав летучего водородного соединения.
Но для этого, придется вспомнить основные закономерности изменения свойств атомов, простых веществ и соединений, образованных химическими элементами главных подгрупп.
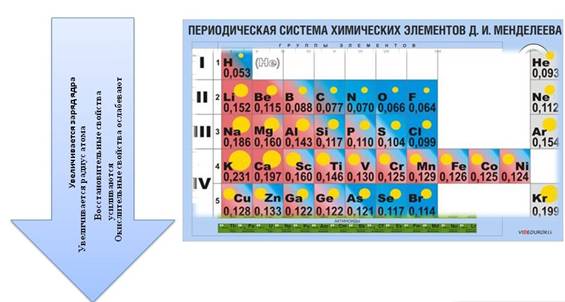
Для атомов химических элементов в группах сверху вниз
· увеличивается заряд ядра атомов, который численно равен порядковому номеру элемента
· радиус атомов тоже увеличивается, т.к. увеличивается число энергетических уровней, а число энергетических уровней определяется номером периода
· при этом число электронов остается неизменным, электроны все дальше и дальше отдаляются от ядра, поэтому их становится легче отдать и восстановительные свойства усиливаются
· высшая степень окисления остается неизменной и равна номеру группы
· низшая степень окисления тоже не изменяется и равна № группы – 8.
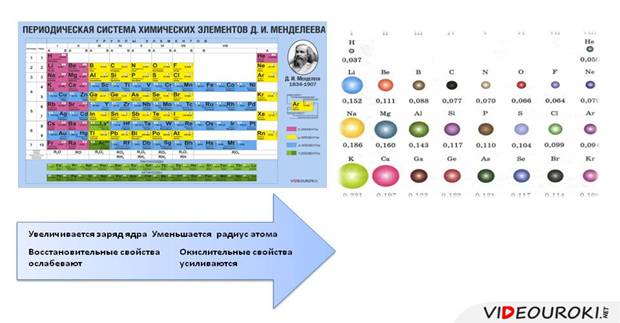
· заряд ядра увеличивается
· радиус уменьшается, т.к. увеличивается число электронов на внешнем уровне, которое определяется по номеру группы и электроны крепче связаны с ядром
· число энергетических уровней остается неизменным
· восстановительные свойства ослабевают
· усиливаются окислительные свойства.
· Высшая степень окисления изменяется от +1 до +8: в первой группе ‒ +1, во второй ‒ +2, в третьей ‒ +3, в четвертой ‒ +4, в пятой ‒ +5
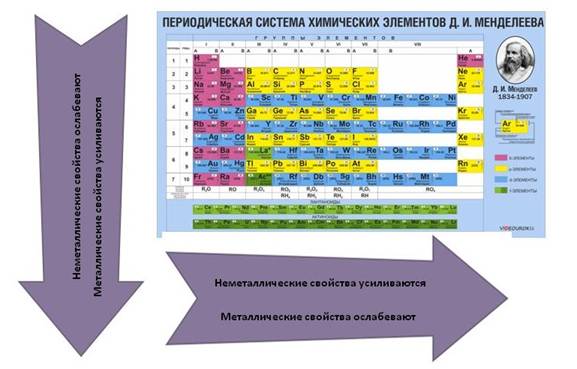
Что касается простых веществ, то металлические свойства в группах сверху вниз усиливаются, а в периодах слева направо ослабевают. Неметаллические свойства, наоборот, в группах сверху вниз ослабевают, а в периодах слева направо усиливаются.
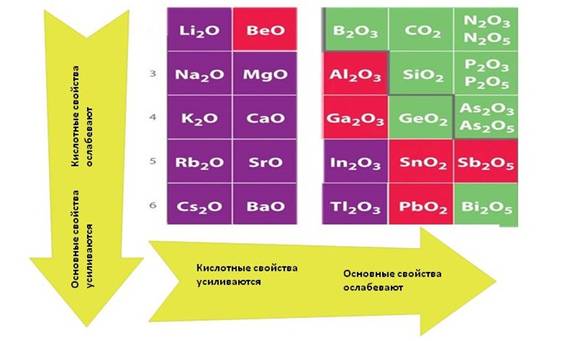
Для соединений химических элементов характерно то, что в группах сверху вниз усиливаются основные свойства, а кислотные ослабевают. Например, в I группе, основные свойства оксида калия (K2O)выражены сильнее, чем у оксида лития (Li2O), а в IV группе у оксида кремния (IV) (SiO2)– кислотные свойства выражены сильнее, чем у оксида свинца (IV) (PbO2). В периодах слева направо усиливаются кислотные свойства, а ослабевают основные. Например, у оксида магния (MgO) основные свойства выражены сильнее, чем у оксида алюминия (Al2O3), у оксида углерода (IV) (CO2) – кислотные свойства выражены сильнее, чем у оксида бора (B2O3).
Нам пришлось много вспомнить из курса химии 8 класса, но зато теперь мы может охарактеризовать металл натрий по всем признакам.
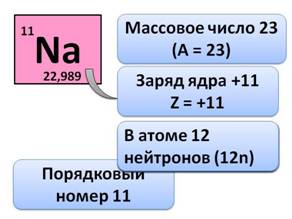
· Порядковый номер натрия (Na), т.е. клетка, в которой он стоит – 11
· Массовое число – 23
· Значит, заряд его ядра равен +11, Z = +11 (заряд ядра атома равен порядковому номеру элемента, числу протонов и числу электронов). Поэтому в атоме 11 электронов (11 ē), а число нейтронов определяется по формуле N = A – Z, т.е. 23 – 11 = 12, значит в атоме 12 нейтронов (12n).
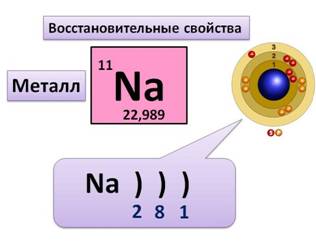
· Натрий находится в 3-ем периоде, у него 3 энергетических уровня, на которых располагаются все его электроны. На первом уровне 2 электрона (это максимально), на втором – 8, на третьем – 1 электрон.
Т.к. у натрия 1 электрон на внешнем уровне, то этот элемент относится к металлам. В реакциях он будет отдавать 1 электрон, проявляя восстановительные свойства, и получать степень окисления +1.
Охарактеризуем натрий как простое вещество. Натрий – это металл, для него характерна металлическая химическая связь и металлическая кристаллическая решетка. Как и для любого металла для него характерны такие физические свойства, как металлический блеск, пластичность, тепло и – электропроводность.
Сравним свойства натрия со свойствами его соседей по группе: металлические свойства натрия выражены сильнее, чем у лития, но слабее, чем у калия, т.к. в группе сверху вниз увеличивается радиус атома и электроны больше отдаляются от ядра и их становится легче оторвать.
Сравним свойства натрия со свойствами его соседей по периоду: металлические свойства натрия выражены сильнее, чем у магния, т.к. в периодах, слева направо радиус атомов уменьшается, а число электронов на внешнем уровне увеличивается, электроны крепче связаны с ядром, поэтому их становится тяжелее оторвать, чем присоединить.
Составим формулу оксида натрия, и определить его характер.
Т.к. натрий – металл I A группы, то ему соответствует оксид натрия – Na2O, значит, это основный оксид и он проявляет все свойства, характерные для этих оксидов: он реагирует с кислотами и кислотными оксидами, с водой с образованием щёлочи.
Гидроксид натрия – это NaOH, он является щёлочью – растворимым в воде основанием. Для него будут характерны следующие свойства: реакции с кислотами и кислотными оксидами, реакции с солями.
Натрий – металл, но он не образует летучих водородных соединений.
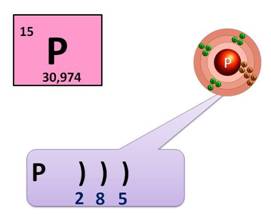
Фосфор находится в клетке номер 15, т.е. порядковый номер его – 15. Заряд ядра его атома будет +15. Число протонов, как и число электронов равно 15: (р = 15, ē = 15). Массовое число фосфора – 31, поэтому число нейтронов будет равно 16, т.к. если мы от массового числа отнимем число протонов, то будет 16 (31 – 15 = 16).
Фосфор находится в 3 периоде, значит, у него 3 энергетических уровня, на первом уровне – 2 электрона, на втором – 8, а на третьем будет пять: (2ē, 8ē, 5ē). На внешнем энергетическом уровне у фосфора 5 электронов.
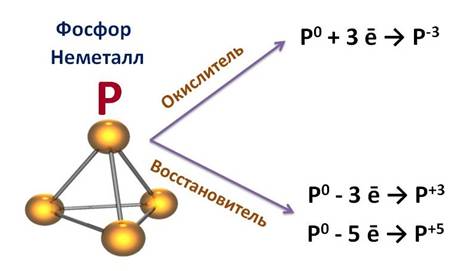
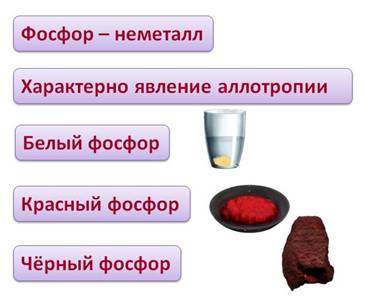
Фосфор – неметалл. Для него характерно явление аллотропии, как и для серы. Т.е. он может образовывать несколько простых веществ, отличающихся своими свойствами. Например, белый фосфор имеет белый цвет и молекулярную кристаллическую решетку, молекула имеет вид тетраэдра, а красный фосфор представляет собой полимер, черный фосфор является полупроводником и имеет металлический блеск.
Сравнить свойства фосфора и его соседей. Неметаллические свойства фосфора выражены сильнее, чем у мышьяка, но слабее, чем у азота, т.к. радиус у азота меньше, чем у фосфора. По сравнению с соседями по периоду, свойства фосфора выражены сильнее, чем у кремния, но слабее, чем у серы.
Составим формулу оксида и гидроксида фосфора.
Высший оксид фосфора – P2O5. Это кислотный оксид, который проявляет свойства, характерные для этих оксидов: он реагирует с основными оксидами, основаниями и водой с образованием соответствующей кислоты.
Высший гидроксид фосфора – это фосфорная кислота, или ортофосфорная – H3PO4, она проявляет свойства, характерные для всех кислот: реагирует с металлами, основаниями и основными оксидами, с солями.
Фосфор – неметалл, поэтому имеет летучее водородное соединение – РН3 – фосфин.
Нам пришлось потрудиться, но мы смогли выполнить все задание.
Усиление металлических и неметаллических свойств в таблице
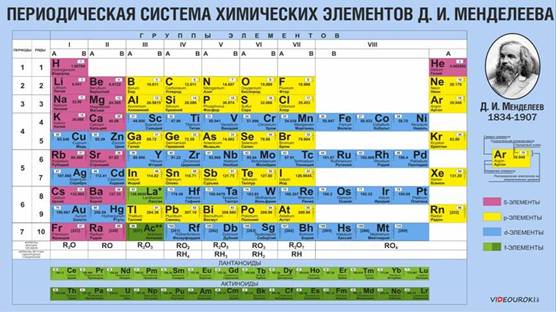
Периодическая таблица Дмитрия Ивановича Менделеева очень удобна и универсальна в своём использовании. По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны. Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают. Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу. Для неметаллов всё в точности наоборот. Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои. Он обладает наибольшими неметаллическими свойствами. Кислород (по своим характеристикам) идёт сразу же после фтора. Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.
Как изменяются металлические свойства в периодической системе
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий. Это происходит потому, что в периоде количество электронов на внешней оболочке увеличивается, следовательно, химическому элементу сложнее отдавать свои электроны.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий. Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать. Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке.
Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее. Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).
Как изменяются неметаллические свойства в периодической системе
Неметаллические свойства в периодической системе Менделеева изменяются с точностью до наоборот, нежели металлические. По сути, эти два признака являются антагонистами.
Неметаллические свойства усиливаются в периоде (в ряду справа налево). Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же. Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень.
Неметаллические свойства уменьшаются в ряду сверху вниз (в группе). Например, фосфор способен отдавать отрицательно заряженные частицы больше, чем азот, но при этом способен лучше притягивать, нежели мышьяк. Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).
Сравним, к примеру, серу и мышьяк. Сера находится выше и правее, а это значит, что ей легче завершить свой энергетический уровень. Как и металлы, неметаллы сложно сравнивать, если они находятся в разных группах и периодах. Например, хлор и кислород. Один из этих элементов выше и левее, а другой ниже и правее. Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.
Периодическая таблица Менделеева помогает узнать не только количество протонов в атоме, атомную массу и порядковый номер, но и помогает определить свойства элементов.
Видео
Видео поможет вам разобраться в закономерности свойств химических элементов и их соединений по периодам и группам.