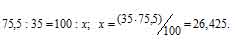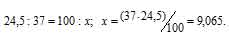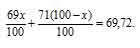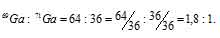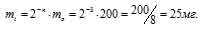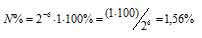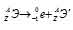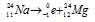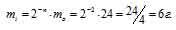Время чего указывается для изотопов
Запись символов изотопов элементов. Расчет количественного соотношения изотопов
Задача 206.
Символ одного из изотопов элемента 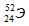
Решение:
Заряд ядра атома искомого элемента 24 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №24 – хром (Cr).
Число нейтронов в ядре данного элемента равно 28:
Число электронов равно заряду ядра; в данном случае число электронов равно 24.
Ответ: Cr
A = N + Z = 16 + 15 + 31
Символ изотопа фосфора будет иметь вид:
Ответ: 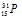
Задача 208.
Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Указать число протонов и нейтронов в ядре атома и название элемента.
Решение:
Количество электронов в атоме равно количеству протонов. В данном случае число протонов равно 73. Число нейтронов в данном ядре равно 108:
Заряд ядра атома искомого элемента 73 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №73 –тантал, символ – +73Ta.
Ответ: +73Та.
Задача 209.
В природных соединениях хлор находится в виде изотопов 35 Cl [75,5% (масс.)] и 37 Cl [24,5% (масс.)]. Вычислить среднюю атомную массу природного хлора.
Решение:
Рассчитаем содержание 35 Cl в природном хлоре, т.е. долю его в атомной массе из пропорции:
Теперь рассчитаем массу 37 Cl, содержащуюся в природном хлоре из пропорции:
Вычисляем среднюю массу природного хлора, состоящего из двух изотопов
Ответ: 35,49.
Задача. 210.
Природный магний состоит из изотопов: 24 Mg, 25 Mg, 26 Mg. Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78,6, 10,1 и 11,3.
Решение:
Вычислим атомную массу изотопов, содержащихся в природном магнии
а) (24 . 78,6)/100 = 18,864;
б) (25 . 10,1)/100 = 2,525;
в) (26 . 11,3)/100 = 2,938.
Находим среднюю массу атома магния:
18,864 + 2,525 + 2,938 = 24, 327.
Ответ: Ar(Mg) = 24,327.
Задача 211.
Природный галлий состоит из изотопов 71 Ga, 69 Ga. В каком количественном соотношении находятся между собой числа атомов этих изотопов, если средняя атомная масса галлия равна 69,72.
Решение:
Для решения задач применим алгебраический метод расчёта:
Обозначим процентное содержание изотопа 69 Ga через x. Тогда процентное содержание изотопа 71 Ga будет равно 100 – x. масса изотопа 69Ga в атоме будет составлять 69 . (x/100). Масса изотопа 71 Ga будет составлять 71 . (x/100).
В сумме масса обоих изотопов будет равняться атомной массе галлия:
Освобождаемся от знаменателя и получим уравнение:
Решаем его и, получаем:
Значит, процент изотопа 69 Ga составляет 64%, а процент изотопа 71 Ga – 36% (100 – 64 = 100).
Теперь находим, в каком количественном соотношении находятся эти изотопы в природном галлии:
Ответ: 1,8 : 1.
Задача 212.
Найти массу изотопа 81 Sr(T1/2 = 8,5ч), оставшуюся через 25,5 ч хранения, если первоначальная масса его составляла 200 мг.
Решение:
За время хранения радиоактивного изотопа прошло 3 периода полураспада (25,5/8,5 = 32). Массу нераспавшегося изотопа, оставшаяся после 25,5ч хранения, рассчитаем из уравнения:
Ответ: 25мг.
Задача 213.
Вычислить процент атомов изотопа 128 I(T1/2 = 25ч), оставшихся не распавшимися после его хранения в течение 2,5 ч.
Решение:
За время хранения радиоактивного изотопа прошло 6 периодов полураспада [(2,5 . 60)/25 = 6)]. Тогда процент атомов изотопа, оставшихся после радиоактивного распада, находим из формулы:
Ответ: 1,56%.
Задача 214.
Период полураспада 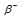
Решение:
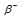
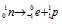
Уравнение радиоактивного распада должны удовлетворять правилу равенства сумм индексов.
Запишем уравнение реакции распада:
За время хранения 24 Na прошло 2 периода полураспада (29,6/14,2 = 2). Массу не распавшегося изотопа, оставшуюся после 14,8ч хранения находим по формуле:
Таким образом, радиоактивному распаду подверглось 18г 24 Na и столько же образовалось 24 Mg (24 – 6 = 18).
Наверное, нет на земле такого человека, который не слышал бы об изотопах. Но далеко не все знают, что это такое. Особенно пугающе звучит словосочетание «радиоактивные изотопы». Эти непонятные химические элементы нагоняют ужас на человечество, но на самом деле они не так страшны, как это может показаться на первый взгляд.
Определение
Чтобы разобраться с понятием радиоактивных элементов, необходимо для начала сказать, что изотопы – это образцы одного и тот же химического элемента, но с разной массой. Что это значит? Вопросы исчезнут, если для начала мы вспомним строение атома. Состоит он из электронов, протонов и нейтронов. Число первых двух элементарных частиц в ядре атома всегда постоянно, тогда как нейтроны, имеющие собственную массу, могут встречаться в одном и том же веществе в разных количествах. Это обстоятельство и порождает разнообразие химических элементов с разными физическими свойствами.
Теперь мы можем дать научное определение исследуемому понятию. Итак, изотопы – это совокупный набор похожих по свойствам химических элементов, но имеющих разную массу и физические свойства. Согласно более современной терминологии, они носят название плеяды нуклеотидов химического элемента.
Немного истории
В начале прошлого века ученые обнаружили, что у одного и того же химического соединения в разных условиях могут наблюдаться разные массы ядер электронов. С чисто теоретической точки зрения, такие элементы можно было посчитать новыми и начать заполнять ими пустые клеточки в периодической таблице Д. Менделеева. Но свободных ячеек в ней всего девять, а новые элементы ученые открывали десятками. К тому же и математические подсчеты показали, что обнаруженные соединения не могут считаться ранее не известными, ведь их химические свойства полностью соответствовали характеристикам уже существующих.
После длительных обсуждений было решено назвать эти элементы изотопами и помещать их в одну клеточку с теми, ядра которых содержат с ними одинаковое количество электронов. Ученым удалось определить, что изотопы – это всего лишь некоторые вариации химических элементов. Однако причины их возникновения и длительность жизни изучались еще почти целое столетие. Даже в начале XXI века утверждать, что человечество знает абсолютно все об изотопах, нельзя.
Стойкие и нестойкие вариации
Каждый химический элемент имеет несколько изотопов. Из-за того, что в их ядрах есть свободные нейтроны, они не всегда вступают в стабильные связи с остальными составляющими атома. Через некоторое время свободные частицы покидают ядро, из-за чего меняется его масса и физические свойства. Так образуются другие изотопы, что ведет в конце концов к образованию вещества с равным количеством протонов, нейтронов и электронов.
Те вещества, которые распадаются очень быстро, называются радиоактивными изотопами. Они выпускают в пространство большое количество нейтронов, образующих мощное ионизирующее гамма-излучение, известное своей сильной проникающей способностью, которая негативно влияет на живые организмы.
Более стойкие изотопы не являются радиоактивными, поскольку количество выделяемых ими свободных нейтронов не способно образовывать излучения и существенно влиять на другие атомы.
Достаточно давно учеными была установлена одна важная закономерность: у каждого химического элемента есть свои изотопы, стойкие или радиоактивные. Интересно, что многие из них были получены в лабораторных условиях, а их присутствие в естественном виде невелико и не всегда фиксируется приборами.
Распространение в природе
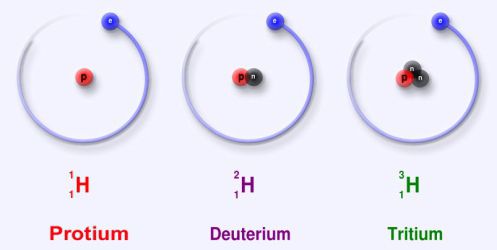
В естественных условиях чаще всего встречаются вещества, масса изотопа которых напрямую определяется его порядковым числом в таблице Д. Менделеева. К примеру, водород, обозначаемый символом Н, имеет порядковый номер 1, а его масса равна единице. Изотопы его, 2Н и 3Н, в природе встречаются крайне редко.
Даже человеческий организм имеет некоторое количество радиоактивных изотопов. Попадают они внутрь через пищу в виде изотопов углерода, который, в свою очередь, впитывается растениями из почвы или воздуха и переходит в состав органических веществ в процессе фотосинтеза. Поэтому и человек, и животные, и растения излучают определенный радиационный фон. Только он настолько низкий, что не мешает нормальному функционированию и росту.
Источниками, которые способствуют образованию изотопов, выступают внутренние слои земного ядра и излучения из космоса.
Как известно, температура на планете во многом зависит от ее горячего ядра. Но только совсем недавно стало понятно, что источником этого тепла выступает сложная термоядерная реакция, в которой участвуют радиоактивные изотопы.
Распад изотопов
Поскольку изотопы – это нестойкие образования, можно предположить, что они по прошествии времени всегда распадаются на более постоянные ядра химических элементов. Это утверждение верно, поскольку ученым не удалось обнаружить в природе огромного количества радиоактивных изотопов. Да и большинство из тех, которые были добыты в лабораториях, просуществовали от пары минут до нескольких дней, а потом снова превратились в обычные химические элементы.
Но есть в природе и такие изотопы, которые оказываются очень устойчивыми к распаду. Они могут существовать миллиарды лет. Образовались такие элементы в те далекие времена, когда земля еще формировалась, а на ее поверхности не было даже твердой коры.
Радиоактивные изотопы распадаются и вновь образуются очень быстро. Поэтому с той целью, чтобы облегчить оценку стойкости изотопа, учеными было принято решение рассматривать категорию периода его полураспада.
Период полураспада
Не всем читателям может быть сразу понятно, что имеется в виду под этим понятием. Определим же его. Период полураспада изотопа – это время, за которое перестанет существовать условная половина взятого вещества.
Это не означает, что оставшаяся часть соединения будет уничтожена за такое же количество времени. Применительно к этой половине необходимо рассматривать иную категорию – период времени, за который исчезнет ее вторая часть, то есть четверть изначального количества вещества. И такое рассмотрение продолжается до бесконечности. Можно предположить, что время полного распада изначального количества вещества посчитать просто невозможно, поскольку этот процесс практически бесконечен.
Однако ученые, зная период полураспада, могут определить, какое количество вещества существовало вначале. Эти данные успешно используются в смежных науках.
В современном научном мире понятие полного распада практически не используется. Относительно каждого изотопа принято указывать время его полураспада, которое варьирует от нескольких секунд до многих миллиардов лет. Чем меньше показатель полураспада, там большее излучение исходит от вещества и тем выше его радиоактивность.
Обогащение ископаемых
В некоторых отраслях науки и техники использование относительно большого количества радиоактивных веществ считается обязательным. Но при этом в естественных условиях таких соединений совсем немного.
Известно, что изотопы – это нераспространенные варианты химических элементов. Количество их измеряется несколькими процентами от самой стойкой разновидности. Именно поэтому ученым необходимо проводить искусственное обогащение ископаемых материалов.
За годы исследований удалось узнать, что распад изотопа сопровождается цепной реакцией. Освобожденные нейтроны одного вещества начинают влиять на другое. В результате этого тяжелые ядра распадаются на более легкие и получаются новые химические элементы.
Это явление получило название цепной реакции, в результате которой можно получить более стойкие, но менее распространенные изотопы, которые в дальнейшем используются в народном хозяйстве.
Применение энергии распада
Также учеными было выяснено, что в ходе распада радиоактивного изотопа выделяется огромное количество свободной энергии. Ее количество принято измерять единицей Кюри, равной времени деления 1 г радона-222 за 1 секунду. Чем выше этот показатель, тем больше энергии выделяется.
Это стало поводом для разработки способов использования свободной энергии. Так появились атомные реакторы, в которые помещается радиоактивный изотоп. Большая часть энергии, выделяемой им, собирается и превращается в электричество. На основании этих реакторов создаются атомные станции, которые дают самое дешевое электричество. Уменьшенные варианты таких реакторов ставят на самоходные механизмы. Учитывая опасность аварий, чаще всего такими машинами выступают подводные лодки. В случае отказа реактора количество жертв на подлодке будет легче свести к минимуму.
Изотопы в медицине
В мирных целях распад радиоактивных изотопов научились использовать в медицине. Направив излучение на пораженный участок организма, можно приостановить течение болезни или помочь пациенту полностью излечиться.
Но чаще радиоактивные изотопы используют для диагностики. Все дело в том, что их движение и характер скопления проще всего зафиксировать по излучению, которое они производят. Так, в организм человека вводится определенное неопасное количество радиоактивного вещества, а по приборам медики наблюдают, как и куда оно попадет.
Таким образом проводят диагностику работы головного мозга, характера раковых опухолей, особенности работы желез внутренней и внешней секреции.
Применение в археологии
Известно, что в живых организмах всегда есть радиоактивный углерод-14, полураспад изотопа которого равен 5570 лет. Кроме того, ученные знают, какое количество этого элемента содержится в организме до момента его смерти. Это значит, что все спиленные деревья излучают одинаковое количество радиации. Со временем интенсивность излучения падает.
Это помогает археологам определить, как давно умерло дерево, из которого построили галеру или любой другой корабль, а значит, и само время строительства. Этот метод исследования получил название радиоактивного углеродного анализа. Благодаря ему ученым легче установить хронологию исторических событий.
Строение атома. Изотопы
В 1913 г. английский физик Г. Мозли установил, что положительный заряд ядра атома (в условных единицах) равен порядковому номеру элемента в периодической системе Д. И. Менделеева.
Каждый протон имеет заряд +1, поэтому заряд ядра равен числу протонов. Атом является электронейтральной частицей, поэтому число протонов равно числу электронов. Следовательно:
Например, элемент железо Fe имеет порядковый номер 26. Следовательно, заряд ядра атома железа равен +26, т. е. ядро содержит 26 протонов, а вокруг ядра движутся 26 электронов.
Элементарные частицы имеют следующие абсолютные и относительные массы:
Данные этой таблицы показывают, что масса протона, как и масса нейтрона, приблизительно в 1840 раз больше массы электрона. Протоны и нейтроны находятся в ядре, поэтому масса атома почти равна массе ядра. Масса ядра, как и масса атома, определяется суммой числа протонов и числа нейтронов. Эта сумма называется массовым числом атома.
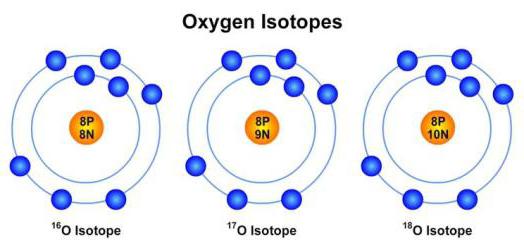
Атомы одного элемента, которые имеют разные массовые числа, называются изотопами.
Атомы изотопов одного элемента имеют одинаковое число протонов (Z) и отличаются друг от друга числом нейтронов (N).
Изотопы обозначаются символами соответствующих элементов, слева от которых вверху записывают массовое число изотопа, а внизу — порядковый номер (заряд ядра атома) элемента. Например:
12 6C — изотоп углерода с массовым числом 12;
18 8О — изотоп кислорода с массовым числом 18.
Иногда в символах изотопов записывают только массовые числа ( 12 С, 18 О, 27 Al и т. д.)
Элемент водород имеет три изотопа, каждый из которых имеет свое название:
В названиях изотопов других элементов указываются их массовые числа. Например: 12 6С — углерод-12; 35 17Cl — хлор-35 и т. д.
В природе различные элементы имеют разное число изотопов с разным процентным содержанием каждого из них.
Относительная атомная масса элемента Аr, которая приводится в периодической системе, — это средняя величина массовых чисел природных изотопов этого элемента с учетом процентного содержания каждого изотопа.
Например, в природе все атомы хлора представляют собой два вида изотопов: 35 Cl (процентное содержание 75,5%) и 37 Cl (24,5%). Относительная атомная масса хлора
Химические свойства всех изотопов одного элемента одинаковы. Следовательно, химические свойства элемента зависят не от атомной массы, а от заряда ядра.
Поэтому современная формулировка периодического закона читается так:
Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атома, или порядкового номера элемента.
Формулировка периодического закона Д. И. Менделеевым и современная формулировка не противоречат друг другу, потому что для большинства элементов при увеличении заряда ядра относительная атомная масса тоже увеличивается. Существуют лишь немногие исключения из этого правила. Например, элемент № 18 аргон Ar имеет большую атомную массу, чем элемент № 19 калий K.
Скачать:
Скачать бесплатно реферат на тему:«Строение атома и атомного ядра» СТРОЕНИЕ-АТОМА-И-АТОМНОГО-ЯДРА.docx (247 Загрузок)
Рефераты по другим темам можно скачать здесь
Примером использования изотопного мечения является исследование фенола (C 6 H 5 OH) в воде путем замены обычного водорода ( протия ) дейтерием ( мечение дейтерием ). При добавлении фенола к дейтерированной воде (вода, содержащая D 2 O в дополнение к обычной H 2 O), в гидроксильной группе фенола наблюдается замещение дейтерия на водород (что приводит к C 6 H 5 OD), что указывает на то, что фенол легко подвергается реакции водородообмена с водой. Затрагивается только гидроксильная группа, что указывает на то, что другие 5 атомов водорода не участвуют в реакциях обмена.
СОДЕРЖАНИЕ
Изотопный индикатор
Маркировка стабильных изотопов
Анализ метаболического потока с использованием метки стабильных изотопов
Методы измерения изотопной маркировки
Протонный ЯМР был первым методом, использованным в экспериментах по мечению 13 C. Используя этот метод, каждое отдельное положение протонированного углерода внутри определенного пула метаболитов можно наблюдать отдельно от других положений. Это позволяет узнать процентное соотношение изотопомеров, меченных в этом конкретном положении. Предел протонного ЯМР состоит в том, что если в метаболите n атомов углерода, может быть не более n различных значений позиционного обогащения, что составляет лишь небольшую часть общей информации об изотопомерах. Хотя использование протонного ЯМР-мечения ограничено, эксперименты с чистым протонным ЯМР намного легче оценить, чем эксперименты с большим количеством информации об изотопомерах.
В дополнение к протонному ЯМР использование методов 13 C ЯМР позволит получить более подробное представление о распределении изотопомеров. Меченый атом углерода будет производить различные сигналы сверхтонкого расщепления в зависимости от состояния метки его прямых соседей в молекуле. Если соседние атомы углерода не помечены, появляется синглетный пик. Дублетный пик появляется, если помечен только один соседний атом углерода. Размер дублетного расщепления зависит от функциональной группы соседнего атома углерода. Если помечены два соседних атома углерода, дублет дублетов может выродиться в триплет, если расщепления дублетов равны.
Недостатками использования методов ЯМР для анализа метаболических потоков является то, что он отличается от других приложений ЯМР, поскольку это довольно специализированная дисциплина. ЯМР-спектрометр может быть доступен не всем исследовательским группам. Оптимизация параметров измерения ЯМР и надлежащий анализ структуры пиков требует наличия квалифицированного специалиста по ЯМР. Для некоторых метаболитов также могут потребоваться специальные процедуры измерения для получения дополнительных данных по изотопомеру. Кроме того, необходимы специально адаптированные программные инструменты для определения точного количества площадей пиков, а также для определения разложения запутанных синглетных, дублетных и триплетных пиков.
В газовой хроматографии-масс-спектрометрии ( ГХ-МС ) МС соединяют с газовым хроматографом для разделения соединений гидролизата. Затем соединения, элюирующие из колонки для ГХ, ионизируются и одновременно фрагментируются. Преимущество использования ГХ-МС заключается в том, что измеряются не только массовые изотопомеры молекулярного иона, но также массовый спектр изотопомеров нескольких фрагментов, что значительно увеличивает измеряемую информацию.
В жидкостной хроматографии-масс-спектрометрии ( ЖХ-МС ) ГХ заменяется жидкостным хроматографом. Основное отличие состоит в том, что химическая дериватизация не требуется. Однако применения ЖХ-МС к MFA редки.
В каждом случае приборы MS делят конкретное распределение изотопомера по его молекулярной массе. Все изотопомеры конкретного метаболита, содержащие одинаковое количество меченых атомов углерода, собираются в один пиковый сигнал. Поскольку каждый изотопомер вносит вклад в ровно один пик в спектре МС, процентное значение затем может быть вычислено для каждого пика, давая массовую долю изотопомера. Для метаболита с n атомами углерода производится n + 1 измерение. После нормализации остается ровно n информативных массовых количеств изотопомеров.
Кроме того, наблюдаемые сильные изотопные эффекты влияют на время удерживания изотопомеров, меченных по-разному, в колонке для ГХ. Также необходимо предотвратить перегрузку колонки ГХ.
Наконец, естественное изобилие других атомов, помимо углерода, также приводит к нарушению массового спектра изотопомеров. Например, каждый атом кислорода в молекуле может также присутствовать как изотоп 17 O и как изотоп 18 O. Более значительным влиянием естественного изотопов изотопов является влияние кремния с естественным содержанием изотопов 29 Si и 30 Si. Si используется в дериватизирующих агентах для методов МС.
Приложения в исследованиях минерального питания человека
Изучаемые аспекты минерального питания / метаболизма включают всасывание (из желудочно-кишечного тракта в организм), распределение, хранение, выведение и кинетику этих процессов. Изотопные индикаторы вводятся субъектам перорально (с пищей или без нее или с минеральной добавкой) и / или внутривенно. Затем измеряется содержание изотопов в плазме крови, эритроцитах, моче и / или кале. Обогащение также измерялось в грудном молоке и содержимом кишечника. Дизайн экспериментов с индикаторами иногда отличается для разных минералов из-за различий в их метаболизме. Например, абсорбция железа обычно определяется по включению индикатора в эритроциты, тогда как абсорбция цинка или кальция измеряется по появлению индикатора в плазме, моче или кале. Введение нескольких изотопных индикаторов в одном исследовании является обычным делом, что позволяет использовать более надежные методы измерения и одновременное исследование нескольких аспектов метаболизма.
В связи с распространением дефицита полезных ископаемых и их критическим воздействием на здоровье и благополучие людей в странах с ограниченными ресурсами Международное агентство по атомной энергии недавно опубликовало подробные и всеобъемлющие описания методов стабильных изотопов, чтобы облегчить распространение этих знаний среди исследователей за пределами страны. западные академические центры.
Радиоизотопная маркировка
Строго говоря, радиоизотопная маркировка включает только те случаи, когда радиоактивность искусственно вводится экспериментаторами, но некоторые природные явления позволяют проводить аналогичный анализ. В частности, радиометрическое датирование использует тесно связанный принцип.
Приложения в протеомике
Приложения для анализа экосистемных процессов
Приложения для океанографии
Трассеры также широко используются в океанографии для изучения широкого круга процессов. Используемые изотопы обычно встречаются в природе с хорошо установленными источниками и скоростями образования и распада. Однако антропогенные изотопы также могут использоваться с большим успехом. Исследователи измеряют изотопные отношения в разных местах и в разное время, чтобы получить информацию о физических процессах в океане.
Перенос частиц
Океан представляет собой разветвленную сеть переноса частиц. Изотопы тория могут помочь исследователям расшифровать вертикальное и горизонтальное движение вещества. 234 Th имеет постоянную четко определенную скорость производства в океане и период полураспада 24 дня. Было показано, что этот встречающийся в природе изотоп изменяется линейно с глубиной. Следовательно, любые изменения этой линейной картины можно объяснить переносом 234 Th на частицах. Например, низкие отношения изотопов в поверхностных водах с очень высокими значениями на несколько метров ниже будут указывать на вертикальный поток в нисходящем направлении. Кроме того, изотоп тория можно проследить на определенной глубине, чтобы расшифровать боковой перенос частиц.
Тираж
Циркуляция в местных системах, таких как заливы, устья и подземные воды, может быть исследована с помощью изотопов радия. 223 Ra имеет период полураспада 11 дней и может естественным образом встречаться в определенных местах в реках и источниках подземных вод. Изотопное соотношение радия затем будет уменьшаться по мере того, как вода из исходной реки входит в залив или эстуарий. Измеряя количество 223 Ra в нескольких различных местах, можно расшифровать картину циркуляции. Тот же самый процесс можно использовать для изучения движения и разгрузки грунтовых вод.
Для изучения циркуляции в глобальном масштабе можно использовать различные изотопы свинца. Разные океаны (например, Атлантический, Тихий, Индийский и т. Д.) Имеют разные изотопные сигнатуры. Это происходит из-за различий в изотопных соотношениях отложений и горных пород в разных океанах. Поскольку разные изотопы свинца имеют период полураспада 50–200 лет, не хватает времени для гомогенизации изотопных соотношений во всем океане. Таким образом, точный анализ изотопных соотношений Pb может быть использован для изучения циркуляции различных океанов.
Тектонические процессы и изменение климата
Изотопы с чрезвычайно длительным периодом полураспада и продукты их распада могут быть использованы для изучения многомиллионных летних процессов, таких как тектоника и экстремальное изменение климата. Например, при датировании рубидий-стронций изотопное отношение стронция ( 87 Sr / 86 Sr) может быть проанализировано в ледяных кернах для изучения изменений на протяжении всей жизни Земли. Различия в этом соотношении в ледяном керне указывают на значительные изменения в геохимии Земли.