Врожденный миастенический синдром что это
Как распознать миастению? Все о диагностике и лечении
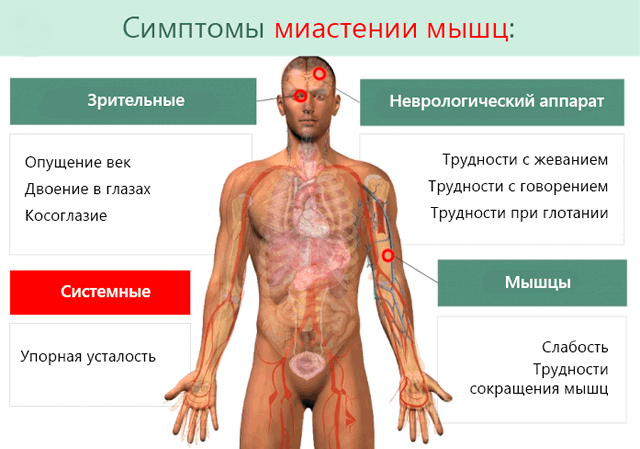
Миастения – это болезнь, которая характеризуется нарушением нервно-мышечной передачи (то есть нарушением процесса сокращения мышцы, возникающим в ответ на импульс, идущий по нервному волокну). Причиной миастении зачастую является аутоиммунный процесс, в результате которого в организме вырабатываются антитела к структурам нервно-мышечного синапса. Согласно статистике, миастения встречается у каждого 5-го из 100 тысяч человек. Это хроническое заболевание с острым или постепенным началом. Основным проявлением является преходящая мышечная слабость, так же может возникать птоз (опущение) верхних век, нарушение глотания, «гнусавость» голоса. В тяжелых случаях и при прогрессировании заболевания может возникнуть слабость дыхательных мышц, вплоть до остановки дыхания.
Опасный недуг быстро прогрессирует, клинические проявления могут утихать и вновь обостряться. Диагностируют патологическую мышечную утомляемость чаще у женщин, чем у мужчин, много реже у детей. Средний возраст пациентов от 15 до 45 лет, таким образом, максимальное количество случаев регистрируется у самой активной части населения.
О причинах
В настоящее время причины развития миастении изучены не до конца. Иногда нельзя однозначно сказать, почему у того или иного пациента возникло заболевание. Принято считать, что весомую роль играют следующие факторы:
При появлении злокачественных новообразований в яичниках, в органах дыхания или в молочных железах говорят о миастеническом синдроме Ламберта-Итона. Мышечная слабость, иногда принимаемая за миастению, возникает при болезни Шарко-Мари, при дерматомиозите (разрушении соединительной ткани), различных формах миопатий, синдроме БАС (боковой амиотрофический склероз) и многих других патологиях.
Сложность диагностики состоит в том, что у пациентов с миастенией в начале заболевания может не быть каких-либо четких жалоб и симптоматики. При нейровизуализации (КТ или МРТ) нет значимых отклонений в структурах центральной нервной системы. Только у 30% заболевших тимус увеличивается, либо в нем выявляются новообразования. Мышцы при осмотре так же никак не изменены, патология может выявляться только при микроскопическом исследовании.
Классификация
Врожденная миастения может быть обусловлена генетическими мутациями. Так же плод может получить антитела к рецепторам постсинаптической мембраны от матери, в этом случае речь идет о неонатальной миастении.
Приобретенная миастения может развиться у пациентов любого возраста. Данный диагноз ставят подросткам, молодым людям и пенсионерам. Наиболее часто недуг встречается в активном возрасте, от 20 до 30 лет. Причины могут быть внешними (инфекционные агенты) и внутренними (хронические заболевания, наследственность).
Условно, по распространенности мышечной слабости, миастения подразделяется на следующие виды:
Данное деление относительно, так как при углубленном исследовании чаще всего выявляется поражение всех мышц, но клинические проявления миастении могут возникать только в отдельных группах мышц определенной локализации.
По характеру течения различают:
Симптомы
Клинические проявления миастении зависят от формы заболевания.
Симптомы, характерные для генерализованной формы:
Симптомы, характерные для глазной формы:
Сложность диагностики миастении связана с тем, что вышеперечисленные симптомы могут появляться и пропадать. Наиболее выражено они проявляются, когда человек занимается спортом, длительно читает или работает за компьютером. То есть в те моменты, когда поперечнополосатые мышцы задействованы больше всего. Ведь даже поддержание определенной позы или чтение требуют постоянного напряжения определенных групп мышц.
При отсутствии адекватного лечения существует риск не только инвалидизации, но и смерти. В то время, когда уровень развития медицины не позволял проводить длительную искусственную вентиляцию легких, от миастении умирали 8 из 10 заболевших. При обнаружении тревожных симптомов миастении, необходимо записаться на прием к неврологу. При необходимости специалист направит на обследование и подберет эффективную терапию.
Диагностика
Врач-невролог ставит диагноз миастения на основе жалоб, данных анамнеза, осмотра и исследований. Специалист сравнивает жалобы пациента с симптомами, характерными для этой болезни. Для подтверждения диагноза проводят диагностические исследования.
Электронейромиография при миастении является «золотым стандартом» и обязательным исследованием. Используется специальный режим ЭНМГ – «декремент-тест». При проведении обследования с помощью электрической стимуляции исследуемую мышцу заставляют сокращаться с высокой частотой. В результате при миастении или миастеническом синдроме регистрируется уменьшение интенсивности мышечного сокращения.
Прозериновая проба. Выполняется самостоятельно или после проведения декремент-теста. Прозерин — вещество, улучшающее нервно-мышечную передачу. Подкожно вводится небольшое его количество, через 30 минут после этого пациент вновь осматривается врачом или проводится повторная ЭНМГ. Проба считается положительной, если отмечается клиническое улучшение или позитивная динамика при выполнении декремент-теста.
Лабораторная диагностика. Анализ крови на содержание специфических антител к рецепторам, мышцам. Антитела выявляются далеко не во всех случаях миастении.
Как правило, этих методов в сочетании с консультацией невролога бывает достаточно для установления диагноза.
Во время осмотра врач может провести пробы на повышенную мышечную утомляемость. Сначала на определенную группу мышц дается нагрузка, затем оценивается их состояние. При глазной форме миастении нагружают глазодвигательные мышцы, для этого больного просят в течение 30 секунд смотреть в одну точку. При жалобах на патологическую усталость мышц шеи, пациента укладывают на спину и просят держать голову поднятой в течение 1 минуты. При слабости в ногах, больному нужно сделать несколько приседаний либо походить на носочках. Для определения степени утомляемости мышц кисти и предплечья, человека просят несколько раз интенсивно согнуть и разогнуть кисть.
Миастения у детей
Содержание статьи
Миастения является аутоиммунным заболеванием, которое проявляется необычной для ребенка утомляемостью и преходящей слабостью мышц. Данной болезни чаще подвержены девочки, средний возраст больных составляет 7 лет. Однако клинически подтверждено, что недуг может поражать и подростков (до 15% всех случаев), и взрослых.
Каковы причины миастении?
Болезнь бывает врожденной и приобретенной. Врожденная форма провоцируется мутацией в генах некоторых белков, участвующих в процессе сокращения мышечных волокон. В большинстве случаев, когда болезнь проявилась в возрасте от года до 17 лет, выявляются нарушения в вилочковой железе, являющейся главным органом иммунной системы человека. Для лечения необходима операция по ее удалению. Источник:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3206364/
Maria F. Finnis and Sandeep Jayawant
Juvenile Myasthenia Gravis: A Paediatric Perspective
// Autoimmune Dis. 2011; 2011: 404101
Приобретенная форма часто развивается на фоне стресса, нарушений функции иммунной системы, вирусов. Из всего числа больных данной формой на детский возраст приходится 1-3%.
Течение и особенности заболевания
Если у матери имеется миастения, то существует 10-20% шанс рождения ребенка с этим недугом. Однако миастенический синдром в этом случае имеет преходящую форму (длится от нескольких дней до 1,5 месяцев).
У новорожденных болезнь проявляется следующим образом:
Также могут развиваться:
Врожденная миастения у детей раннего возраста может провоцировать следующие типы расстройств:
Миастения классифицируется по нескольким признакам:
Симптомы у детей
Для малышей характерны следующие проявления заболевания:
В основном болезнь начинается с одного симптома, но к нему присоединяются другие довольно стремительно. Первые несколько месяцев процесс распространяется на весь организм. Также встречаются локальные формы, которые у детей протекают тяжелее, чем у взрослых.
Для общей формы характерно вовлечение мышц туловища, шеи, конечностей, быстрая утомляемость и слабость, усиливающиеся после нагрузки.
Локальные формы подразделяются по пораженным отделам:
Методы диагностики
Лечение миастении у детей
Для лечения детей применяются консервативные и радикальные методы. К консервативным относится применение ряда препаратов. Они подбираются индивидуально на основе клинической картины и тяжести заболевания.
В ходе же хирургического вмешательства удаляется вилочковая железа. Именно она вызывает миастению в 70-80% случаев. Такое лечение показано при средней или тяжелой форме заболевания.
Для родителей крайне важно как можно скорее обратиться к специалисту – неврологу – для своевременной диагностики и назначения терапии. Это связано с тем, что при малой продолжительности миастении прогноз гораздо лучше, чем в том случае, когда болезнь длится более пяти лет.
В медицинском центре «СМ-Клиника» Вас готовы принять одни из лучших детских врачей Санкт-Петербурга. Запишитесь на прием как можно скорее, и Ваш ребенок будет здоров и счастлив.
Maria F. Finnis and Sandeep Jayawant. Juvenile Myasthenia Gravis: A Paediatric Perspective // Autoimmune Dis. 2011; 2011: 404101.
Врожденные миастенические синдромы
Это группа редких генетических заболеваний, которые наследуются по аутосомно-рецессивному типу. При данной патологии в разной степени изменяются механизмы, ответственные за регулирование мышечной активности, что приводит к нарушению функций последних. Несмотря на низкую частоту встречаемости, врожденные миастенические синдромы трудно выявить на ранних стадиях и эффективно вылечить. Поэтому данная группа заболеваний в настоящее время представляет большой интерес для врачей и находится под пристальным наблюдением ученых.
Механизм развития врожденных миастенических синдромов
Врожденные миастенические синдромы могут развиваться в результате пресинаптических и постсинаптических дефектов. В первом случае изменяются процессы синтеза и секреции ацетилхолина – важнейшего нейромедиатора, который обеспечивает передачу сигнала с нервных окончаний в саму мышцу. При этом механизме также возможно уменьшение пузырьков (везикул), в которых накапливается ацетилхолин, что также приводит к его недостаточному выделению. Постсинаптические дефекты могут приводить к дефициту специфического фермента (ацетилхолинэстеразы), который участвует в синтезе ацетилхолина. Возможно нарушение функций или изменение строения рецепторов, которые взаимодействуют с нейромедиатором.
Клинические проявления врожденных миастенических синдромов
Точная симптоматика зависит от конкретного вида врожденного миастенического синдрома:
Миастения может развиваться при приеме определенных лекарственных препаратов. Данная форма не относится к врожденным миастеническим синдромам, однако возникает в любом возрасте. При применении высоких доз антибиотиков может нарушаться нервно-мышечная передача. Пациенты жалуются на слабость в мышцах конечностей, быстрое утомление, нарушение глотания, глазодвигательные расстройства. После отмены препарата эти симптомы исчезают.
Диагностика и лечение
Как уже было отмечено, врожденные миастенические синдромы сложно выявить на ранних стадиях из-за недостаточно выраженной клинической картины. Пациенты часто не придают значения начальным признакам болезни и списывают появление слабости в мышцах на тяжелую работу, активное передвижение в течение дня, неправильное питание и другие причины. Поводом обратиться к врачу являются выраженные состояния, например, расстройства зрения или нарушение глотания. Для того чтобы достоверно подтвердить врожденный миастенический синдром, может потребоваться комплексное обследование:
Лечение врожденных миастенических синдромов не всегда оказывается успешным. Из-за недостаточной изученности механизмов, которые приводят к развитию нарушений, не всегда удается подобрать эффективную терапию. Однако некоторые формы все же поддаются коррекции. Например, лечение синдрома Ламберта-Итона подразумевает назначение антихолинэстеразных препаратов, цитостатиков, глюкокортикоидов, плазмафереза и проводится под строгим контролем врача. Точный план лечения врожденных миастенических синдромов всегда составляется индивидуально. Если заболевание не удается устранить, то специалист при возможности назначит симптоматическую терапию, которая поможет повысить качество жизни пациента.
Миастения у детей
Общая информация
Краткое описание
Союз педиатров России
Клинические рекомендации: Миастения у детей
Год утверждения (частота пересмотра): 2016 (пересмотр каждые 3 года)
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Наиболее удобна для практического врача классификация, предложенная в 1965 г. Б.М. Гехтом. В ней учитывается характер течения заболевания, степень генерализации миастенического процесса, тяжесть двигательных расстройств и степень их компенсации на фоне ингибиторов ацетилхолинэстеразы (АХЭ), что помогает достаточно полно и точно сформулировать диагноз.
4. Злокачественная форма – острое начало и быстрое нарастание нарушения функции мышц (25%).
Этиология и патогенез
Эпидемиология
Диагностика
При сборе анамнеза и жалоб обращают внимание на изменчивость симптомов в течение суток, связь их с нагрузкой, наличие частичных или полных ремиссий, обратимость симптомов на фоне приема ингибиторов АХЭ (на время их действия) и на фоне адекватной иммуносупрессивной терапии.
Клинический осмотр должен включать исследование общего неврологического статуса, а также проверку силы произвольных мышц лица, шеи, туловища и конечностей до и после нагрузки (оценка силы в баллах, где 0 – отсутствие силы, 5 – сила данной группы мышц здорового человека). Одним из самых важных клинических тестов для диагностики миастении является наличие синдрома патологической мышечной утомляемости: нарастание симптомов после нагрузки. Например, нарастание птоза, глазодвигательных нарушений при фиксации взора, после зажмуривания; снижение силы в отдельных группах мышц после повторных активных движений в исследуемой конечности, приседаний или ходьбы; появление или нарастание речевых нарушений при счете, чтении вслух и т.д. При этом не выявляется никаких симптомов органического поражения нервной и нервно-мышечной системы (при отсутствии сопутствующих заболеваний): нет нарушений в рефлекторной и координаторной сфере, сохранена чувствительность, в типичных случаях отсутствуют мышечные атрофии, сохранен мышечный тонус.
Первоначально мышечная сила может быть нормальной или почти нормальной, и поэтому мышечную силу нужно оценивать до и после физической нагрузки. Частота случаев, при которых поражение ограничено только глазодвигательными мышцами (глазная миастения), существенно отличается в различных публикациях, но, вероятно, составляет 20-50%, и до 80% у маленьких детей в Китае. МуСК-МГ чаще встречается у женщин, в клинической картине преобладает слабость глазодвигательных мышц и мышц черепа, отмечаются частые респираторные кризы. Различия между МуСК-МГ и АХР-МГ еще предстоит выяснить.
Таким образом, отличием всех симптомов миастении является динамичность в течение суток, усиление после нагрузки, обратимость или уменьшение степени их выраженности после отдыха.
Смешанные (миастенический + холинергический) кризы встречаются у больных миастенией при неправильном приеме и / или изначально узком диапазоне терапевтических доз ингибиторов АХЭ, а также на фоне состояний, вызывающих общую или мышечную слабость различного генеза (интеркуррентные инфекции, соматические, гормональные нарушения, прием препаратов, влияющих на сократительную функцию произвольных мышц и др.).
Комментарии: Этот тест вызывает стресс, особенно у маленьких детей, и поэтому должен выполняться щадяще. Технические трудности у маленьких детей также составляют проблему, и поэтому перед тем, как объявлять тест положительным, нужно быть полностью уверенным, что снижение амплитуды происходит по миастеническому типу. Суммарные потенциалы действия мышцы фиксируются с поверхностных электродов, лучше над слабой мышцей; частота стимуляции нерва 3Гц и 5Гц. Снижение амплитуды более чем на 10% в промежутке с третьего по пятый потенциал считается положительным результатом. Одноволоконная ЭМГ, позволяющая выявить усиленное «дрожание» при сокращении пар волокон, является более чувствительным, чем классическая ИСН, но трудновыполнимым у детей методом. Нормальная ИСН не исключает диагноза ЮМГ.
Комментарии: Основные качественные и количественные изменения при миастении обнаруживаются в постсинаптической мембране, которая содержит АХР, и в стадии развернутой клинической картины число АХР снижается до 10-30% от нормальных значений, падает их плотность.
Комментарии: Положительной полной проба считается при восстановлении мышечной силы до 5 баллов с компенсацией бульбарных и глазодвигательных нарушений, положительной неполной – при нарастании силы на 1-2 балла, но без полного ее восстановления и (или) сохранении редуцированного бульбарного или глазодвигательного дефекта. Частичная компенсация заключается в избирательном действии ингибиторов АХЭ на отдельные группы мышц, как правило, с нарастанием силы произвольных мышц на 1балл. Выделяется сомнительная прозериновая проба, когда отмечается некоторая положительная динамика в отношении отдельных симптомов (уменьшение птоза на 1-2мм, некоторое увеличение объема движений глазных яблок, несколько более звонкий голос, впечатление о некотором нарастании силы мышц конечностей и т.д.
Миастения
Общая информация
Краткое описание
Миастения (болезнь Эрба – Гольдфлама – Жолли) – аутоиммунное нервно-мышечное заболевание, клинически характеризующееся патологической слабостью и утомляемостью произвольной мускулатуры, и связанное с повреждением ацетилхолиновых рецепторов постсинаптической мембраны поперечно-полосатых мышц специфическими комплементфиксирующими антителами. [Кузин М.И., Гехт Б.М.]
Соотношение кодов МКБ-10 и МКБ-9
| КодМКБ-10 | Код МКБ-9 | ||||||||||||||||||
| Код | Название | Код | Название | ||||||||||||||||
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортных или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с не высоким риском систематической ошибки (+). Результаты, которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GPP | Наилучшая фармацевтическая практика. |
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Классификация [Б.М. Гехт 1965г]
По характеру течения:
• миастенические эпизоды (однократный или ремитирующее течение);
• миастенические состояния (т.е. стационарное течение);
• прогрессирующее течение;
• злокачественная форма.
По локализации
Локальные (ограниченные) процессы:
• глазные;
• бульбарные;
• лицевые;
• краниальные;
• туловищные.
Генерализованные процессы:
• генерализованные без бульбарных нарушений;
• генерализованные и генерализованные с нарушениями дыхания.
По степени тяжести двигательных расстройств:
• легкая;
• средней тяжести;
• тяжелая.
По степени компенсации двигательных нарушений на фоне АХЭР препаратов:
• полная;
• достаточная;
• недостаточная (плохая).
В зависимости от динамики клинической картины выделяют несколько форм миастении:
• миастенические эпизоды – представляющие из себя преходящие двигательные расстройства с полным восстановлением функции вне эпизода.
• миастеническое состояние – форма миастении, при которой клиника сохраняется на протяжении многих лет без изменений.
• прогрессирующая форма – форма миастении, при которой клинические проявления необратимо прогрессируют, без эпизодов восстановления сниженных двигательных функций.
• злокачественная форма – форма миастении, остро начинающаяся и неуклонно прогрессирующая весьма быстрыми темпами с неуклонным нарушением функций нервно-мышечного аппарата.
Классификации Американской Ассоциации неврологов, основанной на оценке тяжесть клинических проявлений миастении по пятибалльной шкале MGFA и распространенности патологического процесса:
Диагностика (амбулатория)
ДИАГНОСТИКА НА АМБУЛАТОРНОМ УРОВНЕ
Диагностические критерии
Жалобы:
• слабость, патологическая утомляемость мышц, которая возникает после физической нагрузки;
• патологическая слабость мышц конечностей, туловища, невозможность подняться по ступенькам городского транспорта;
• невозможность удержать голову, нижнюю челюсть;
• опущение век;
• двоение предметов;
• утомляемость жевательных мышц при пережевывании твердой пищи, разговоре;
• осиплость голоса, «носовой» оттенок голоса, его «затухание»;
• нечеткость речи, на затрудненное глотание.
NB! Предположение о миастении должно возникнуть в каждом случае глазодвигательных и бульбарных расстройств.
Анамнез:
• наличие в прошлом кратковременных эпизодов слабости и утомляемости, полностью/частично регрессировавших самопроизвольно/на фоне неспецифического лечения;
• семейный анамнез, наличие у родственников нервномышечных, аутоиммунных и онкологических заболеваний.
NB Наиболее высокая заболеваемость встречается в двух возрастных категориях: 20-40 лет (в этот период чаще болеют женщины) и 65-75 лет (в этот период женщины и мужчины поражаются одинаково часто). При расспросе больного нужно уточнить: Когда началось заболевание? – сколько времени назад (дни, недели, месяцы, годы). Нарастают ли слабость в ногах и руках к вечеру? Имеется ли двоение в глазах, нарушение глотания, изменения голоса? Если болезнь прогрессирует, то с чего она началась? Какими хроническими заболеваниями болеет и что постоянно принимает?
Физикальное обследование:
неврологический статус:
• нарушение зрения (двоение, слепота);
• нарушение речи и глотания (плохо говорит, не понимает обращенную речь); нарушение движений (в одной или нескольких конечностях с одной стороны, с двух сторон);
• нарушение болевой и температурной чувствительности (на лице, туловище, в одной или нескольких конечностях с одной стороны, с двух сторон);
• наличие координаторных расстройств (испытывает затруднения при ходьбе, выполнении мелких движений, пользовании предметами, чувствует сильное головокружение в покое или при движениях и др);
• мышечная слабость (при повторении стереотипных движений она резко усиливается и может достичь степени пареза/полного паралича), после отдыха объем движений увеличивется;
• характерна динамичность симптомов: интенсивность птоза может изменяться на протяжении суток в зависимости от физической нагрузки. Зрачковые реакции преимущественно живые, иногда встречается анизокория или истощение зрачковых реакций во время повторных обследований (например, усиление дисфагии во время еды/дисфонии во время разговора – так называемый феномен патологической мышечной утомляемости) и феномен генерализации мышечной слабости (например усиление птоза после нагрузки на мышцы руки);
• при вовлечении в патологический процесс глазодвигательных, мимических и жевательных мышц при внешнем осмотре у пациента наблюдается характерное маскообразное лицо, с отсутствием морщин, бедной мимикой, с опущением век. Во время улыбки поднимается лишь верхняя губа, в то же время нижняя губа и углы рта остаются неподвижными. Чаще всего наблюдается слабость круговой мышцы рта, что приводит к невозможности произнести звук «Р», губные звуки «Б», «П».
• поражение бульбарной группы мышц вызывает нарушения функции мягкого неба и надгортанника. Из-за нарушения акта глотания могут развиваться аспирационная пневмония/алиментарное истощение.
• при наличии генерализированных форм миастении – наличие слабость дыхательных мышц и сердечной деятельности. Мышечная слабость, которая доходит иногда до состояния тетраплегии, сопровождается выраженными вегетативными нарушениями: тахикардией, вялым пульсом, мидриазом.
NB! В клинической практике для оценки степени выраженности двигательных расстройств используют шкалу силы мышц конечностей, предложенную А. Szobor (1976):
Фармакологические тесты:
Одним из наиболее значимых критериев диагностики миастении считают фармакологический тест с введением антихолинэстеразных препаратов.
Методика пробы с введением неостигмина метилсульфата: 0.05 % раствор неостигмина метилсульфат 1.5 мл вводят подкожно при весе больного 50-60 кг, при весе 60-80 кг доза препарата соответствует 2.0 мл и при весе 80-100 кг 2.5 мл соответственно. В детской практике вводится 1.0 мл препарата. Оценка проводится во временном интервале от 40 минут до 90 минут после введения препарата. В основе оценки теста лежит колебания выраженности клинических симптомов. Проба оценивается как позитивная при полной и неполной компенсации клинических симптомов, сомнительной – при частичной компенсации и негативной при отсутствии каких либо изменений. При возникновении мускариновых эффектов антихолинстеразных препаратов после оценки эффективности теста вводят 0.1 % раствор атропина 0.2-0.5 мл.
Лабораторные исследования:
• исследование сыворотки крови на уровень аутоантител к мышечному ацетилхолиновому рецептору – важное значение имеет динамика этого показателя для оценки эффективности патогенетической терапии;
• определение электролитов крови – снижение показателей калия крови;
• гормоны щитовидной железы: и тиреотоксикоз, и гипотиреоз могут усиливать слабость при миастении;
Инструментальные исследования
Электронейромиография (декремент тест):
• повторная ритмическая стимуляция нерва низкой (3 имп/с) и высокой (50 имп/с) частотой с использованием функциональных (постактивационные облегчение и истощение) и фармакологических (введение антихолинэстеразных препаратов) проб. При миастении ЭНМГ-исследование проводится именно на «клинически пораженной мышце».
• дополнительный метод диагностики – ЭНМГ с использованием концентрических игольчатых электродов (для выявления степени возможного вовлечения мышечного субстрата в патологический процесс, например, для выявления сопутствующего воспалительного процесса при полимиозите).
• электронейромиографическое исследование – для выявления нарушения нервно-мышечной передачи. В мышцах больных миастенией при стимуляции частотами 3 и 40 имп/с выявляется декремент амплитуды М-ответа в серии последовательных импульсов, который определяет степень нарушения нервно-мышечной передачи. Большое значение для диагностики имеет обратимость электрофизиологических феноменов на фоне АХЭП – нарастание амплитуды М-ответа и уменьшение декремента.
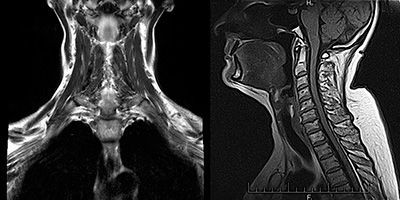
КТ/МРТ органов средостения: для исключения/подтверждения патологии вилочковой железы (тимома, гиперплазия вилочковой железы) с целью определения дальнейшей тактики лечения.
Сбор жалоб и анамнеза
Диагностический алгоритм:
Диагностика (скорая помощь)
ДИАГНОСТИКА НА ЭТАПЕ СКОРОЙ НЕОТЛОЖНОЙ ПОМОЩИ
Диагностические мероприятия:
· оценка общего состояния и жизненно важных функций пациента: сознания, дыхания, кровообращения (осмотр кожных покровов и видимых слизистых, измерение артериального давления, частоты пульса, частоты дыхания, температуры тела, и др.); визуальная оценка: положение больного, наличие асимметрии лица, птоза век.
· наличие очаговых неврологических симптомов: нарушение движений (в одной или нескольких конечностях с одной стороны, с двух сторон);
нарушение болевой и температурной чувствительности (на лице, туловище, в одной или нескольких конечностях с одной стороны, с двух сторон); наличие координаторных расстройств (испытывает затруднения при ходьбе, выполнении мелких движений, пользовании предметами, чувствует сильное головокружение в покое или при движениях и др.); нарушение зрения (двоение, слепота).
· установление или исключение критического состояния – миастенического криза.
NB! Каждый пациент с признаками миастении должен рассматриваться как пациент с потенциально возможной острой дыхательной недостаточностью. Обращают внимание на нарушения частоты, глубины и ритма дыхания, участие «вспомогательной» мускулатуры, обычно не участвующей в акте дыхания.
Поэтому в первую очередь оцениваются следующие признаки:
• одышка;
• ограниченная экскурсия грудной клетки и живота при вдохе;
• парадоксальное движение грудной клетки при дыхании;
• западание межреберных мышц на вдохе;
• попытка опираться руками при вдохе.
| Миастенический криз | Холинергический криз |
| Быстрое развитие (часы, минуты) | Медленное развитие (сутки и более) |
| Выраженная слабость произвольной мускулатуры с нарушением дыхания, сердечной деятельности, бульбарным синдромом, психомоторное возбуждение, нарушение сознания (сопор, кома) | |
| М-холинергические (вегетативные) симптомы | |
| · сухость слизистых | |
· густая слюна
· мидриаз
· тахикардия
· повышение АД
· задержка при мочеиспускании
· парез кишечника
· жидкая слюна
· миоз
· брадикардия
· снижение АД
· учащенное мочеиспускание, полиурия
· усиление перистальтики, диарея
тошнота, рвота, кишечная колика
· отсутствие фасцикуляций
· наличие фасцикуляторных подергиваний мышц, крампи, тремор конечностей и тела
Диагностика (стационар)
ДИАГНОСТИКА НА СТАЦИОНАРНОМ УРОВНЕ
Диагностические критерии на стационарном уровне:
Жалобы и анамнез: см. амбулаторный уровень.
NB! При сборе анамнеза обращается внимание на изменчивость симптомов в течение суток, связь их с нагрузкой, наличие частичных/полных ремиссий, обратимость симптомов на фоне приема АХЭ препаратов (на время их действия) и на фоне адекватной иммуносупрессивной терапии. Исключатся в анамнезе прием лекарственных препаратов, усиливающих мышечную слабость.
Физикальное обследование: см. амбулаторный уровень.
Инструментальные исследования:
· КТ/МРТ органов средостения – для определения тимомы или гиперплазии вилочковой железы.
· электронейромиография – для определения нарушения нейро-мышечной проводимости (снижение амплитуды М-ответа (больше чем на 10-15%) во время ритмической стимуляции нерва с частотой 2-3 Гц).
Перечень основных диагностических мероприятий:
· тесты на выявление патологической утомляемости;
· фармакологическая проба с неостигмина метилсульфатом/пиридостигмина бромидом;
· электронейромиография;
· исследование антител к ацетилхолиновым рецепторам;
· КТ/МРТ органов средостения.
Перечень дополнительных диагностических мероприятий:
· кровь на иммуноглобулины;
· УЗИ щитовидной железы;
· гормоны щитовидной железы;
· электролиты крови.
Дифференциальный диагноз
Лечение
Препараты (действующие вещества), применяющиеся при лечении
| Азатиоприн (Azathioprine) |
| Атропин (Atropine) |
| Галантамин (Galantamine) |
| Галоперидол (Haloperidol) |
| Декстроза (Dextrose) |
| Иммуноглобулин человеческий нормальный (Human normal immunoglobulin) |
| Калия хлорид (Potassium chloride) |
| Микофеноловая кислота (Микофенолата мофетил) (Mycophenolic acid (Mycophenolate mofetil)) |
| Неостигмина метилсульфат (Neostigmine methylsulfate) |
| Оротовая кислота (Orotic acid) |
| Пиридостигмина бромид (Pyridostigmine) |
| Преднизолон (Prednisolone) |
| Спиронолактон (Spironolactone) |
| Циклоспорин (Cyclosporine) |
| Циклофосфамид (Cyclophosphamide) |
Лечение (амбулатория)
ЛЕЧЕНИЕ НА АМБУЛАТОРНОМ УРОВНЕ
Тактика лечения:
Тактика лечения миастении определяются такими направлениями:
• компенсация нервно-мышечной передачи (препараты калия, систематический прием антихолинэстеразных препаратов);
• коррекция аутоиммунных нарушений (глюкокортикоидных препаратов, цитостатиков и плазмафереза);
• влияние на вилочковую железу.
Немедикаментозное лечение:
Режим:
• противопоказаны чрезмерные физические нагрузки, инсоляции.
Диета:
• диета богатая калием (печеный картофель, курага, бананы и др.).
Медикаментозное лечение:
В основу стратегии лекарственной терапии миастении положены следующие принципы:
• этапность лечебных мероприятий;
• сочетания компенсирующей, патогенетической и неспецифической терапии.
Учёт фазы течения заболевания (хроническая/острая (кризы)).
NB! Противопоказаны лекарственные препараты, содержащие магний/хинин; нельзя употреблять миорелаксанты, транквилизаторы, нейролептики, мочегонные препараты, аминогликозиды, фторхинолины, тетрациклин.
Первый этап
Компенсирующая терапия предполагает назначение следующих препаратов:
Антихолинэстеразные средства (отличаются они в основном длительностью действия).
| Препарат и его синонимы | Лекарственная форма | Начало дейтсвия, минуты | Продолжительность действия, часы |
| Неостигмина метилсульфат | Таблетки по 15мг, 0,05% раствор по 1мл (0,5мг) в ампулах | 20-40 | 2-4 |
| Пиридостигмина бромид | Таблетки по 60мг, 0, 5% раствор по 1мл (5мг) в ампулах | 60 | 4-6 |
| Галантамина гидрохлорид | Растворы 0,1%, 0,25%:, 0,5% по 1мл в ампулах | 60 | 8-12 |
Иньекционная форма неостигмина метилсульфат используется для оказания быстрого действия. Принцип дозирования – следующая доза принимается за 30 минут до окончания действия предыдущей. При переводе больных на парентеральное введение препаратов учитывается, что 1 таблетка пиридостигмина бромида (60 мг) равноценна 1 мл 0,05% раствора неостигмина метилсульфат. В некоторых ситуациях (mensis, инфекции, ремиссия) – чувствительность к АХЭ препаратам повышается. В этом случае доза препаратов уменьшается. Больных нужно обучать коррегировать дозу индивидуально в зависимости от течения болезни.
Относительные противопоказания к применению АХЭП:
• бронхиальная астма;
• тяжелый атеросклероз;
• ИБС, стенокардия;
• эпилепсия.
Второй этап
Лечение глюкокортикоидами назначается:
· при недостаточной эффективности препаратов, используемых на первом этапе;
· для создания своеобразного запаса прочности в компенсации миастенических расстройств перед подготовкой к операции (тимэктомии);
· больным миастенией с витальными нарушениями;
· при дебюте заболевания с бульбарных нарушений.
Применяемые чаще схемы – прием ГКС ежедневно или через день.
Дозу преднизолона (метилпреднизолона) подбирают индивидуально, ориентируясь на тяжесть состояния больного. В среднем она составляет 1 мг/кг/сут., но не менее 50 мг. Преднизолон 1 таблетка – 5 мг. При выраженном обострении назначают 60-150 мг/сутки утром ежедневно, через 5-7 дней (до терапевтического эффекта) переходят на схему через день. С больших доз следует уходить быстро. Эффект оценивают через 6-8 приёмов. В первые несколько дней некоторые пациенты могут отмечать эпизоды ухудшения состояния в виде нарастания мышечной слабости и утомляемости. Возможно, эти эпизоды связаны с прямым действием глюкокортикоидов на процессы освобождения синаптического медиатора и десенситизацией рецепторов. Это обстоятельство обусловливает необходимость временного уменьшения дозы антихолинэстеразных препаратов. По мере достижения эффекта и улучшения состояния больных дозу преднизолона постепенно уменьшают до поддерживающей. Длительно применяется поддерживающая доза через день 20-30 мг в сутки, возможно в течение нескольких месяцев или даже лет. При ухудшении состояния доза может быть увеличена. Используется так же ступенчатая схема приема ГКС. В разработанной схеме предлагается увеличение начальной дозы препарата до 25-30 мг в один прием утром. Каждый последующий прием гормонов увеличивается на 25-30 мг до достижения максимальной дозы 100 мг.
Третий этап
При недостаточной эффективности глюкокортикоидов/развитии выраженных побочных эффектов целесообразно назначение цитостатических препаратов.
• Азатиоприн можно использовать в качестве монотерапии/в сочетании с глюкокортикоидами, если они не оказывают достаточного эффекта/если из-за побочных эффектов необходимо снижение их дозы. Азатиоприн назначают перорально ежедневно по 50 мг/cyт с последующим увеличением дозы до 150-200 мг/cyт.
• Микофенолата мофетил назначают в дополнение к глюкокортикоидам в случаях, когда необходимо снижение их дозы. Микофенолата мофетил назначают перорально ежедневно по 2 г/cyт с последующей коррекцией дозы в зависимости от эффективности лечения.
• Циклоспорин успешно применяют при лечении тяжёлых форм миастении в случаях резистентности к другим препаратам. Препарат назначают перорально в дозе 3 мг/кг. При отсутствии токсических реакций дозу можно увеличить до 5 мг/кг 2 раза в день. После достижения стойкого терапевтического эффекта дозу циклоспорина можно снизить до минимальной поддерживающей.
• Циклофосфамид используют при отсутствии эффекта от других иммунодепрессантов как в виде монотерапии, так и в сочетании с азатиоприном. Препарат вводят внутримышечно ежедневно в дозе 200 мг/через день в дозе 400 мг. Терапию начинают в условиях стационара, и только убедившись в хорошей переносимости препарата, можно переводить больных на амбулаторное лечение.
NB! Следует отметить, что беременность не является противопоказанием к назначению основных препаратов лечения миастении. На время беременности желательно воздержаться от поддерживающей гормональной терапии, сеансов плазмафереза, использования больших доз калийсодержащих препаратов. Также следует строго придерживаться особых подходов терапии других заболеваний. Существует перечень препаратов, которые нельзя использовать при миастении.
Применение лекарств при миастении (по С. А. Мальбергу, 2001)
Алгоритм действий при неотложных ситуациях:
Кризы при миастении:
· миастенические
· холинергические
· смешанные.
Характеристика симптомов при миастеническом и холинергическом кризах
| Симптомы | При миастеническом кризе | При холинергическом кризе |
| Величина зрачков | широкие | узкие; парез аккомодации |
| Пульс | тахикардия | брадикардия |
| Артериальное давление | Нормально или нерезко снижено | быстро резко снижается |
| Мышечные фасцикуляции | не характерны | резко выражены |
| Боли в животе; бурная перистальтика кишечника; понос; рвота | не наблюдаются | резко выражены |
| Одышка, афония, невозможность отхаркивания содержимого ротоглотки | очень характерны | не характерны |
Алгоритм действий при миастеническом и/или холинергическом кризах
Другие виды лечения:
При хорошей эффективности препаратов первого этапа, но сохраняющихся лёгких бульбарных нарушениях на фоне отмены пиридостигмина бромида показано проведение тимэктомии.
Показания к тимэктомии у взрослых:
• опухоль вилочковой железы (тимома);
• вовлечение в процесс краниобульбарной мускулатуры;
• прогрессирующее течение миастении.
Показания к тимэктомии у детей:
• генерализованная форма миастении;
• прогрессирование заболевания при плохой лекарственной компенсации нарушенных функций.
Противопоказания к тимэктомии:
• тяжёлые соматические заболевания;
• острая фаза миастении (выраженные некомпенсированные бульбарные нарушения, а также нахождение больного в кризе);
• пациенты длительно страдающих миастенией при стабильном её течении, а также при локальной глазной форме миастении.
NB! Результатом операции могут стать полное клиническое выздоровление (эффект А), стойкая ремиссия при значительном уменьшении дозы антихолинэстеразных препаратов (эффект В), значительное улучшение состояния на фоне сохранения потребности в антихолинэстеразных препаратах (эффект С), отсутствие улучшения (эффект D).
Показания для консультации специалистов:
· консультация торакального хирурга – установление/исключения объемного образования средостения (тимома);
· консультация терапевта – установление/исключение терапевтического заболевания, онкопатологии внутренних органов (артериальная гипертензия, злокачественное новообразование, пневмония);
· консультация эндокринолога – установление/исключение заболевания щитовидной железы;
· консультация онколога – установления онкологического заболевания, проявлении паранеопластического синдрома.
· консультация офтальмолога – осмотр глазного дна для исключения патологии глаза, признаков внутричерепной гипертензии, застоя дисков зрительных нервов;
Профилактические мероприятия:
Первичная профилактика:
Постоянное лечение и регулярное посещение врача невролога является обязательным для больного миастенией, только так можно добиться улучшений и повысить качество жизни. Но также очень важно придерживаться следующих рекомендаций:
• нельзя загорать;
• нельзя заниматься тяжелым физическим трудом;
• избегать утомляемости и больше отдыхать;
• нельзя производить лечение самостоятельно или принимать лекарственные травы;
• нельзя употреблять лекарственные препараты, содержащие магний или хинин;
• нельзя употреблять миорелаксанты, транквилизаторы, нейролептики, мочегонные препараты, аминогликозиды, фторхинолины, тетрациклин.
Вторичная профилактика направлена на профилактику осложнений:
• тенденция к нарастанию веса требует систематического использования ограничения калорийности употребляемой пищи, в особенности углеводов;
• тенденция к снижению толерантности к углеводам и периодическое повышение сахара в крови, требует назначения препаратов, способствующих увеличению толерантности к углеводам, нормализации перекисного окисления липидов и сокращению переносимости к углеводным нагрузкам.
Мониторинг состояния пациента:
• оценка жизнеобеспечивающих функций – дыхания, гемодинамики;
• оценка неврологического статуса для выявления и мониторинга динамичности мышечной слабости и реакции на введение антихолинэстеразных препаратов (полная, неполная частичная компенсация, проба позитивная, сомнительная, негативная).
Индикаторы эффективности лечения:
• стойкая/частичная ремиссия на фоне приема медикаментозных средств/без них у больных миастенией.
Лечение (скорая помощь)
ЛЕЧЕНИЕ НА ЭТАПЕ СКОРОЙ НЕОТЛОЖНОЙ ПОМОЩИ
Медикаментозное лечение
Алгоритм экстренных мероприятий при любом варианте кризов:
· купирование нарушений дыхания: санация ротоглотки и трахеобронхиального дерева во избежание аспирационного трахеобронхита и пневмонии;
· интубация трахеи или перевод на ИВЛ — в зависимости от степени тяжести состояния больного.
· назначение антибактериальной терапии (класс цефалоспоринов) с учетом высокого риска возникновения аспирационной пневмонии.
· адекватное энтеральное или — при бульбарных нарушениях — парентеральное питание.
Алгоритм экстренных мероприятий при холинергическом кризе:
· немедленная отмена антихолинэстеразных препаратов.
· внутримышечное или подкожное – в зависимости от тяжести состояния больного – введение 0,5–1,0 мл 0,1% раствора атропина. Инъекции могут при необходимости повторяться с интервалом в 1–2 ч до появления сухости во рту.
Лечение (стационар)
ЛЕЧЕНИЕ НА СТАЦИОНАРНОМ УРОВНЕ
Тактика лечения:
На стационарном этапе в карте наблюдения за пациентом (история болезни) ежедневно отмечаются показатели гемодинамики (А/Д, пульс, ЧСС), оценивается дыхание и ЧДД, в неврологическом статусе определяется динамика синдрома патологической мышечной утомляемости, отмечается проводимая коррекция и переносимость медикаментозной терапии, уровень компенсации мышечной слабости после приема антихолинэстезаного препарата.
Немедикаментозное лечение:
Режим:
• противопоказаны чрезмерные физические нагрузки, инсоляции.
Диета:
• диета богатая калием (печеный картофель, курага, бананы и др.).
Искусственная вентиляция лёгких
В качестве первого мероприятия предполагает необходимость адекватного дыхания с помощью принудительной ИВЛ.
Показания к переводу на ИВЛ:
• нарушение ритма дыхания;
• цианоз;
• возбуждение;
• потеря сознания;
• участие вспомогательной мускулатуры;
• изменение величины зрачков отсутствие реакции на введение АХЭ препаратов.
Перевод пациента на самостоятельное дыхание после ИВЛ:
• отсутствия цианоза;
• тахипноэ;
• тахикардии;
• сохранности мышечного тонуса;
• достаточного дыхательного объёма (>300 мл), p.Oz более 80 мм рт.ст. при дыхании смесью с 50% кислорода;
• способности больного создать разрежение вдоха не менее 20 см вод.ст., полного восстановления сознания.
NB! В период проведения искусственной вентиляции полностью исключается введение антихолинэстеразных препаратов, проводится интенсивное лечение интеркуррентных заболеваний и патогенетическое лечение миастении.
NB! Введение АХЭП и использование ИВЛ одновременно недопустимо.
NB! Через 16-24 часа после начала ИВЛ, при условии ликвидации клинических черт холинергического или смешанного кризов, следует провести пробу с введением АХЭП (неостигмина метилсульфат) с учетом начала действия препарата и отключить от аппарата ИВЛ (не экстубируя!), затем оценить эффективность самостоятельного дыхания. Если в течение 1,5-2 часов больной самостоятельно дышит, процедуру повторить в течение суток 3-4 раза с АХЭП. В случае положительного результата больного экстубируют. Убедившись в возможности адекватного дыхания, перевести больного на прием пероральных антихолинэстеразных препаратов.
Если функция дыхания остается недостаточной и эффект от введения АХЭП непродолжительный, больного подключают к аппарату ИВЛ. До следующих суток неостигмина метилсульфат не вводить! Вышеуказанные действия повторить на следующие сутки. Если в течение 3-4 суток не наблюдается положительного эффекта (самостоятельное дыхание) больному необходимо наложить трахеостому для исключения пролежня трахеи. По мере восстановления жизненно важных функций дыхания и глотания больного отключают от аппарата ИВЛ и назначают прием АХЭП.
Медикаментозное лечение:
Лечение миастенических кризов должно быть направлено на компенсацию нарушений нервно-мышечной передачи и коррекцию иммунных расстройств.
Иммуноглобулины G:
• общепринятым режимом терапии считают короткие 5-дневные курсы внутривенного введения препарата Человеческий Ig в доза 400 мг/кг ежедневно. В среднем клинический эффект отмечается на 4 день терапии и продолжается в течение 50-100 дней.
Антихолинэстеразные препараты:
• чаще применяют парентеральное введение. Применение АХЭп в количестве диагностической пробы показаны при любой форме криза (наиболее эффективно их введение при миастеническом кризе). Неостигмина метилсульфат вводится п/к от 1,5 до 2,5 мл, для уменьшения нежелательных эффектов вводят атропин 0,2-0,5 мл 01% раствора. Результат оценивается как при неостигмина метилсульфатной пробе.
При назначении антихолинэстеразных препаратов должен соблюдаться определенный временной режим: применение каждой последующей дозы не чаще, чем через 3-4 часа для неостигмина метилсульфат и 5-6 часов для пиридостигмина бромида, в связи с опасностью возникновения холинергической интоксикации. В период максимальной выраженности клинических симптомов криза целесообразно парентеральное введение антихолинэстеразных препаратов. Препарат вводят под кожу, а при остановке дыхания внутривенно в дозе 20 мг при весе больного до 80 кг, в дозе 30 мг при весе более 80 кг. Для уменьшения нежелательных мускариновых эффектов антихолинэстеразных препаратов их вводят с атропином в виде 0,2 – 0,5 мл 0,1% раствора.
Своевременно и в правильной дозировке произведенное введение антихолинэстеразных препаратов, как правило, помогает восстановлению функции дыхания и бульбарной мускулатуры. По мере достижения стабильного клинического эффекта, восстановления жизненно важных функций дыхания и глотания, вместо парентерального введения назначается прием препаратов внутрь.
Для определения времени приема последующих доз пероральных препаратов следует ориентироваться на длительность и эффективность действия применяемой дозы. Вместе с тем необходимо помнить, что в различных состояниях длительность и эффективность действия каждого препарата может меняться.
Спиронолактон является антагонистом минералкортикоидного гормона альдостерона, необходимого для регуляции обмена электролитов в организме. Способность спиронолактона задерживать калий в клетках служит основанием для широкого его применения при лечении миастении. Препарат принимают внутрь в дозе 0,025 – 0,05 г 3-4 раза в день. Побочные явления: в отдельных случаях тошнота, головокружение, сонливость, кожные сыпи, обратимая форма гинекомастии.
Профилактика пневмонии (не применять аминогликозиды).
Проведение симптоматической терапии.
Специальный уход.
Некоторые лекарственные препараты могут сами по себе провоцировать обострение миастении (смотрите таблицу 2).
Перечень основных диагностических мероприятий:
— Определение электролитов крови
— Проведение неостигмина метилсульфатной пробы
— ЭНМГ
— КТ/МРТ органов средостения
— ЭКГ
Перечень дополнительных диагностических мероприятий:
— Определение гормонов щитовидной железы
— Определение уровня КФК
— МРТ головного мозга – для проведения дифференциального диагноза миастении с заболеваниями, при которых локализация патологического процесса определяется в стволе мозга: стволовым энцефалитом, опухолью ствола головного мозга, нарушением мозгового кровообращения в системе вертебрально-базилярных сосудов;
— УЗИ щитовидной железы – для исключения патологии щитовидной железы (обязательно надо проводить при подозрении на миастению. И тиреотоксикоз, и гипотиреоз могут усиливать слабость при миастении).
— КТ/МРТ органов грудной клетки, брюшной полости, органов малога таза.
— УЗИ органов брюшной полости, малого таза.
— глазное дно
Хирургическое вмешательство:
Тимэктомия:
Показанием к оперативному лечению:
• злокачественные формы;
• прогрессирующая форма;
• миастеническое состояние в зависимости от степени выраженности дефекта.
При локальных формах подходят избирательно.
Противопоказания к тимэктомии:
• тяжелые декомпенсированные соматические заболевания;
• старческий возраст.
До оперативного лечения обязательна предоперационная подготовка:
• общеукрепляющая терапия;
• проведение лечебного плазмафереза;
• при необходимости – курс глюкокортикостероидов.
Другие виды лечения:
Рентгеновское облучение вилочковой железы, когда противопоказана тимэктомия (как альтернатива тимэктомии).
Гамма-терапия на область тимуса. Данный метод применяют у пациентов, которым в силу тех/иных обстоятельств невозможно провести тимэктомию, а также как метод комплексной терапии после удалении тимомы (особенно в случаях инфильтрации опухоли в расположенные рядом органы). Суммарную дозу гамма-облучения подбирают индивидуально (в среднем 40-60 Грей).
Противопоказания гамма-терапии:
• дети пубертатного периода.
Методы экстракорпоральной иммунокоррекции (гемосорбция и плазмаферез – смотрите клинический протокол диагностики и лечения «Лечение кризов»). Можно использовать такие методы, как гемосорбция/энтеросорбция (угольные сорбенты СУМС 15-30 мг/кг веса 3 раза в сутки в течение 2-3 недель).
Проведение плазмафереза/плазмасорбции:
Основные показания для проведения плазмафереза:
· миастенический криз;
· острое течение миастении;
· начальная стадия стероидной терапии в связи с возможным обострением заболевания.
Обследование больного перед плазмаферезом включает:
· оценку состояния жизненно важных функций;
· полный клинический анализ крови (в том числе тромбоциты, гематокрит);
· определение группы крови и резус-фактора;
· серологические тесты на сифилис, ВИЧ, вирус гепатита В;
· определение концентрации общего белка, белковых фракций;
· определение основных показателей свёртываемости крови;
· клинический анализ мочи.
Как правило, плазмаферез проводится курсом на протяжении 1-2 недель с кратностью 2-5 операций. Прерывистый плазмаферез приводит к улучшению после проведения 3 – 4 сеансов.
Противопоказаний к применению плазмафереза нет.
Показания для консультации специалистов:
· консультация терапевта – при необходимости/в случае отсутствия специалиста на догоспитальном уровне – установление/исключение терапевтического заболевания (артериальная гипертензия, пневмония), коррекция показателей гемодинамики, электролитного баланса в ходе проводимой терапии;
· консультация эндокринолога – при необходимости/в случае отсутствия специалиста на догоспитальном уровне с целью коррекции терапии гормональных и электролитных нарушений;
· консультация торакального хирурга – при решении вопроса об оперативном лечении;
· консультация реаниматолога – для решения вопроса о переводе в отделение реанимации и интенсивной терапии.
Показания для перевода в отделение интенсивной терапии и реанимации:
· появление и нарастание симптомов миастенического криза;
· нестабильность гемодинамики;
· нарушение функции дыхания.
Индикаторы эффективности лечения:
· компенсация витальных нарушений;
· устранение метаболических нарушений, возникающих вследствие гипоксии и оксидантного стресса;
· снятие обострения миастенического процесса;
· полная или достаточная компенсации двигательных нарушений на фоне АХЭ препаратов.
Дальнейшее ведение.
· диспансерное наблюдение в поликлинике по месту жительства. Проведение первичной и вторичной профилактики при миастении (см.амбулаторный уровень).