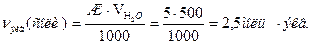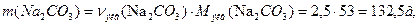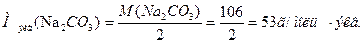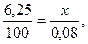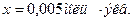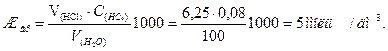Вычислите карбонатную жесткость воды зная что на титрование 100 см3
Решение. Пример 4. Вычислить карбонатную жесткость воды, зная, что на титрование 100 см3 этой воды, содержащей гидрокарбонат кальция
Пример 4. Вычислить карбонатную жесткость воды, зная, что на титрование 100 см3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см3 0,08 н раствора НСl.
Решение.
Находим количество моль эквивалентов солей, обусловливающих жесткость воды из формулы:
Один из методов устранения жесткости воды – введение соды (Na2CO3). Согласно закону эквивалентов,
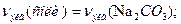
Вычисляем нормальность раствора гидрокарбоната кальция. Обозначив количество моль эквивалентов растворенного вещества в 1л раствора, т.е. нормальность, через х, составляем пропорцию:
Карбонатную (временную) жесткость можно рассчитать умножением объема кислоты (V, мл), пошедшего на титрование на концентрацию кислоты:
Контрольные задания
542. Какие соли обусловливают жесткость природной воды? Какую жесткость называют карбонатной, некарбонатной? Как можно устранить карбонатную, некарбонатную жесткость? Напишите уравнения соответствующих реакций. Чему равна жесткость воды, в 100 л которой содержится 14,632 г гидрокарбоната магния?
547. Вычислите жесткость воды, зная, что в 600 л ее содержится 65,7 г гидрокарбоната магния и 61,2 г сульфата кальция.
553. Чему равна жесткость воды, если для ее устранения к 50 л воды потребовалось прибавить 21,2 г карбоната натрия?
558. К 100 л жесткой воды прибавили 12,95 г гидроксида кальция. На сколько понизилась карбонатная жесткость?
20. р– ЭЛЕМЕНТЫ (…ns 2 np 1-6 )
В периодах слева направо атомные и ионные радиусы р – элементов по мере увеличения заряда ядра уменьшаются, энергия ионизации и сродство к электрону в целом возрастают, электроотрицательность увеличивается, окислительная активность простых веществ и неметаллические свойства усиливаются.
В группах радиусы атомов и однотипных ионов в общем увеличиваются. Энергия ионизации при переходе от 2р – элементов к 6р – элементам уменьшается, так как по мере возрастания числа электронных оболочек усиливается экранирование заряда ядер электронами, предшествующими внешними электронами. С увеличением порядкового номера р–элемента в группе неметаллические свойства ослабевают, а металлические усиливаются.
На свойства р–элементов и их соединений оказывает влияние как появление новых подуровней на внешней электронной оболочке, так и заполнение внутренних электронных оболочек. р – элементы второго периода (В, С, N, O, F) резко отличаются от элементов нижеследующих периодов, так как, начиная с р–элементов третьего периода, появляется низколежащий свободный d-подуровень, на который могут переходить электроны с р – подуровня при возбуждении атома. Полностью заполненный 3d-подуровень у р–элементов четвертого периода (Ga, Ge, As, Se, Br) обусловливает отличие их свойств от элементов третьего периода. Максимальное заполнение 4f-подуровня в шестом периоде сказывается на различии свойств р–элементов шестого и пятого периодов.
Вдоль периода у р–элементов падает способность к образованию положительно заряженных ионов с зарядом, отвечающим номеру группы, и наоборот, способность к образованию отрицательных ионов с зарядом, равным (8 – № группы), возрастает.
р – элементы образуют двухатомные молекулы Э2, различающиеся по устойчивости. Наиболее устойчивы молекулы элементов второго периода (N2, O2, F2). При переходе от IIIA к IVA и VA группам устойчивость двухатомных молекул возрастает, а затем при переходе к VIIIА группе понижается. В группах сверху вниз прочность связи Э–Э уменьшается.
р – элементы второго периода (азот, кислород, фтор) обладают ярко выраженной способностью участвовать в образовании водородных связей. Элементы третьего и последующих периодов эту способность теряют.
При переходе от р–элементов второго периода к р–элементам третьего и последующих периодов сохраняются все типы связей, характерные для элементов второго периода, и появляются новые типы химических связей. В этом направлении увеличивается склонность элементов образовывать комплексные соединения.
При переходе вниз по группе устойчивость максимальной положительной степени окисления у р–элементов уменьшается и возрастает устойчивость низших степеней окисления. Так, для углерода устойчивая степень окисления +4, а для свинца +2, для алюминия +3, а для таллия +1.
Физические свойства простых веществ р–элементов сильно различаются. Одни вещества (кислород, азот) кипят и плавятся при очень низких температурах, другие (углерод, бор) – при очень высоких. По группам и периодам физические свойства изменяются немонотонно, и не всегда характер изменений легко связать со строением электронных оболочек и типом химических связей.
Все р–элементы и в особенности р–элементы второго и третьего периодов образуют многочисленные соединения между собой и с s-, d-, f- элементами.
Контрольные задания
571. Составьте уравнения реакций, которые нужно провести для следующих превращений:
572. Составьте электронные и молекулярные уравнения реакции: а) алюминия с раствором щелочи; б) бора с концентрированной азотной кислотой.
573. Какой процесс называется алюмотермией? Составьте электронные и молекулярные уравнения реакций, на которых основано применение термита (смесь Аl и Fе3О4).
574. Составьте уравнения реакций, которые нужно провести для следующих превращений: В → Н3ВО3 → Na2B4O7 → H3BO3. Уравнение окислительно-восстановительной реакции составьте на основании электронных уравнений.
576. Чем можно объяснить восстановительные свойства соединений олова (+ 2) и окислительные – свинца (+ 4)? На основании электронных уравнений составьте уравнения реакций: а) SnCl2 c HgCl2; б) PbO2 c HClконц.
577. Какие оксиды и гидроксиды образуют олово и свинец? Как изменяются кислотно-основные и окислительно-восстановительные свойства в зависимости от степени окисления элементов? Составьте молекулярные и ионные уравнения реакций взаимодействия раствора едкого натра: а) с оловом; б) с дигидроксидом свинца.
578. Какие соединения называются карбидами и силицидами? Напишите уравнения реакций: а) карбида алюминия с водой; б) силицида магния с соляной кислотой. Являются ли эти реакции окислительно-восстановительными? Почему?
579. Почему атомы большинства р-элементов способны к реакциям диспропорционирования (самоокисления – самовосстановления)? На основании электронных уравнений напишите уравнение реакции растворения серы в концентрированном растворе щелочи. Один из продуктов содержит серу со степенью окисления + 4.
580. Почему сернистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций Н2SO3: а) с сероводородом; б) с хлором.
581. Как проявляет себя сероводород в окислительно-восстановительных реакциях? Почему? Составьте электронные и молекулярные уравнения реакций взаимодействия раствора сероводорода: а) с хлором; б) с кислородом.
582. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций НNО2: а) с бромной водой; б) с НI.
583. Почему диоксид азота способен к реакциям самоокисления – самовосстановления (диспропорционирования)? На основании электронных уравнений напишите уравнение реакции растворения NO2 в едком натре.
584. Какие свойства в окислительно-восстановительных реакциях проявляет серная кислота? Напишите уравнения реакций взаимодействия разбавленной серной кислоты с магнием и концентрированной – с медью. Укажите окислитель и восстановитель.
585. В каком газообразном соединении азот проявляет свою низшую степень окисления? Напишите уравнения реакций получения этого соединения: а) при взаимодействии хлорида аммония с гидроксидом кальция; б) разложением нитрида магния водой.
586. Почему фосфористая кислота способна к реакциям самоокисления – самовосстановления (диспропорционирования)? На основании электронных уравнений составьте уравнение процесса разложения Н3РО3, учитывая, что при этом фосфор приобретает минимальную и максимальную степень окисления.
587. В каком газообразном соединении фосфор проявляет свою низшую степень окисления? Напишите уравнения реакций: а) получения этого соединения при взаимодействии фосфида кальция с соляной кислотой; б) горения его в кислороде.
588. Какую степень окисления проявляют мышьяк, сурьма и висмут? Какая степень окисления является более характерной для каждого из них? Составьте электронные и молекулярные уравнения реакций: а) мышьяка с концентрированной азотной кислотой; б) висмута с концентрированной серной кислотой.
589. Как изменяются окислительные свойства галогенов при переходе от фтора к иоду и восстановительные свойства их отрицательно заряженных ионов? Почему? Составьте электронные и молекулярные уравнения реакций а) Сl2 + I2 + H2O =; б) КI + Br2 =. Укажите окислитель и восстановитель.
590. Состав стекла выражается формулой Na2O·CaO∙6SiO2. Вычислите теоретический расход сырья соды, известняка и песка на получение стекла массой 100 кг.
591. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
↓ 
592. Составьте электронные и молекулярные уравнения реакции, происходящей при пропускании хлора через горячий раствор едкого калия. К какому типу окислительно-восстановительных процессов относится данная реакция?
593. Какие реакции нужно провести для осуществления следующих превращений: NaCl → HCl → Cl2 → KClO3? Уравнения окислительно-восстановительных реакций составьте на основании электронных уравнений.
594. К раствору, содержащему SbCl3 и BiCl3, добавили избыток раствора едкого кали. Напишите молекулярные и ионные уравнения происходящих реакций. Какое вещество находится в осадке?
595. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
596. Определите массовую долю аммиака в растворе, полученном при разбавлении раствора аммиака объемом 1 л (ρ = 0,9 г/см 3 ) с массовой долей NH4OН 25% водой объемом 9,1л. Сколько граммов гидроксида железа (III) может быть осаждено полученным раствором массой 5 г?
597. Чем существенно отличается действие разбавленной азотной кислоты на металлы от действия соляной и разбавленной серной кислот? Что является окислителем в первом случае, что – в двух других? Приведите примеры.
598. В ряду напряжений алюминий находится до водорода, однако из воды его не вытесняет. В то же время взаимодействует с раствором щелочи с выделением водорода. Объясните причину такого поведения алюминия. Напишите уравнения соответствующих реакций.
599. Германий в присутствии перекиси водорода может растворяться в щелочах. Вычислите, сколько граммов NaOH потребуется для растворения 14,52 г германия.
601. С помощью каких реакций можно осуществить следующие превращения: Р → Р2О5 → Н3РО4 → Са(Н2РО4)2 → Са3(РО4)2→ Р?
602.Сколько потребуется фосфорита, содержащего 60% Са3(РО4)2, для получения 10 кг фосфора, если потери составляют 5 %?
603. Какие реакции нужно провести, имея азот и воду, чтобы получить нитрат аммония? Составьте уравнения соответствующих реакций.
604. Какую степень окисления может проявлять кремний в своих соединениях? Составьте уравнения реакций, которые надо провести для следующих превращений: Мg2Si → SiO2 → K2SiO3. При каком превращении происходит окислительно-восстановительная реакция?
605. Закончите уравнения реакций:
Коэффициенты в уравнениях расставьте, используя метод электронного баланса.
606. Какой объем гидроксида натрия (ρ = 1,2 г/см 3 ) с массовой долей NaOH 40% потребуется для растворения всего олова, содержащегося в 1000 консервных банок, если масса олова в каждой из них составляет 0,4 г?
607. Какое применение находит кремний? Составьте уравнения реакций, которые надо провести для следующих превращений: SiO2 → Si → K2SiO3 → H2SiO3. Окислительно-восстановительные реакции напишите на основании электронных уравнений.
608. При пропускании через раствор гидроксида натрия углекислого газа объемом 4,9 л получена смесь карбоната и гидрокарбоната натрия массой 22,9 г. Вычислите состав образовавшейся смеси солей.
609. Как получают диоксид углерода в промышленности и в лаборатории? Напишите уравнения соответствующих реакций, при помощи которых можно осуществить следующие превращения: NаHCO3 → CO2 → CaCO3 → Ca(HCO3)2.
610. Какие из солей угольной кислоты имеют наибольшее промышленное применение? Как получить соду из металлического натрия, соляной кислоты, мрамора и воды? Почему в растворе соды лакмус приобретает синий цвет? Ответ подтвердите составлением уравнений соответствующих реакций.
21. d-ЭЛЕМЕНТЫ (…(n-1)d 1-10 ns 0-2 )
В периодах с увеличением заряда ядра возрастание радиуса атомов происходит относительно медленно, непропорционально числу электронов, заполняющих оболочку атома. Такое непропорциональное изменение радиусов атомов объясняется лантоноидным сжатием, а также проникновением ns-электронов под d–электронный слой. В результате экранирования этим слоем с увеличением номера элемента атомный радиус, энергия ионизации, а следовательно, и химические свойства изменяются мало. В химическом поведении однотипных d–элементов много сходного.
Все атомы d-семейства, за исключением групп IВ и IIВ, имеют незавершенный d–электронный слой. Такие электронные оболочки неустойчивы. Этим объясняется переменная валентность и набор разных степеней окисления d–элементов в соединениях. В свою очередь, это определяет окислительно-восстановительные свойства большинства соединений d–элементов: в группах В сверху вниз ослабевают металлические и восстановительные свойства элементов: φ 0 (Zn/Zn 2+ )=0,76B; φ 0 (Cd/Cd 2+ ) = 0,403 B; φ 0 (Hg/Hg 2+ ) = 0,85 B.
Контрольные задания
611. Серебро не взаимодействует с разбавленной серной кислотой, тогда как в концентрированной оно растворяется. Чем это можно объяснить? Составьте электронные и молекулярные уравнения соответствующей реакции.
612. Составьте уравнения реакций, которые надо провести для следующих превращений: Cu → Cu(NO3)2 → Cu(OH)2 → CuCl2 → [Cu(NH3)4]Cl2.
613. Составьте электронные и молекулярные уравнения реакций цинка: а) с раствором едкого натра; б) с концентрированной серной кислотой, учитывая восстановление серы до нулевой степени окисления.
614. Составьте уравнения реакций, которые надо провести для следующих превращений: Ag → AgNO3 → AgCl →[Ag(NH3)2]Cl → AgCl.
615. При постепенном прибавлении раствора KI к раствору Hg(NO3)2 образующийся в начале осадок растворяется. Какое комплексное соединение при этом получается? Составьте молекулярные и ионные уравнения соответствующих реакций.
616. При постепенном прибавлении раствора аммиака к раствору сульфата кадмия образующийся в начале осадок основной соли растворяется. Составьте молекулярные и ионные уравнения соответствующих реакций.
617. При сливании растворов нитрата серебра и цианида калия выпадает осадок, который легко растворяется в избытке KCN. Какое комплексное соединение при этом получается? Составьте молекулярные и ионные уравнения соответствующих реакций.
618. К какому классу соединений относятся вещества, полученные при действии избытка едкого натра на растворы ZnCl2, CdCl2, HgCl2? Составьте молекулярные и ионные уравнения соответствующих реакций.
619. При действии на титан концентрированной соляной кислоты образуется трихлорид титана, а при действии азотной – осадок метатитановой кислоты. Составьте электронные и молекулярные уравнения соответствующих реакций.
620. При растворении титана в концентрированной серной кислоте последняя восстанавливается минимально, а титан переходит в катион с максимальной степенью окисления. Составьте электронные и молекулярные уравнения реакций.
621. Какую степень окисления проявляют медь, серебро и золото в соединениях? Какая степень окисления наиболее характерна для каждого из них? Иодид калия восстанавливает ионы меди (+ 2) в соединения меди со степенью окисления +1. Составьте электронные и молекулярное уравнения взаимодействия КI с сульфатом меди.
622. Диоксиды титана и циркония при сплавлении взаимодействуют со щелочами. О каких свойствах оксидов говорят эти реакции? Напишите уравнения реакций между: а) TiO2 иBaO; б) ZrO2 и NaOH. В первой реакции образуется метатитанат, а во второй – ортоцирконат соответствующих металлов.
623. На гидроксиды цинка и кадмия подействовали избытком растворов серной кислоты, едкого натра и аммиака. Какие соединения цинка и кадмия образуются в каждом из этих случаев? Составьте молекулярные и ионные уравнения реакций.
624. Золото растворяется в царской водке и в селеновой кислоте, приобретая при этом максимальную степень окисления. Составьте электронные и молекулярные уравнения соответствующих реакций.
625. В присутствии влаги и диоксида углерода медь окисляется и покрывается зеленым налетом. Какой состав имеет образующееся соединение и как оно называется? Что произойдет, если на него подействовать соляной кислотой? Напишите уравнения соответствующих реакций. Уравнение окислительно-восстановительной реакции составьте на основании электронных уравнений.
626. Кусок латуни обработали азотной кислотой. Раствор разделили на две части. К одной из них прибавили избыток раствора аммиака, к другой – избыток раствора щелочи. Какие соединения цинка и меди образуются при этом? Составьте уравнения соответствующих реакций.
627. Ванадий получают алюмотермически или кальцийтермически восстановлением ванадиевого ангидрида V2O5. Последний легко растворяется в щелочах с образованием метаванадатов. Напишите уравнения соответствующих реакций. Уравнение окислительно-восстановительной реакции составьте на основании электронных уравнений.
628. Азотная кислота окисляет ванадий до метаванадиевой кислоты. Составьте электронные и молекулярное уравнения реакции.
629. Какую степень окисления проявляет ванадий в соединениях? Составьте формулы оксидов ванадия, отвечающих этим степеням окисления. Как меняются кислотно-основные свойства оксидов ванадия при переходе от низшей к высшей степени окисления. Составьте уравнения реакций: а) V2O3 сH2SO4; б) V2O3 с NaOH.
630. При внесении цинка в подкисленный серной кислотой раствор метаванадата аммония NH4VO3 желтая окраска постепенно переходит в фиолетовую за счет образования сульфата ванадия (II). Составьте электронные и молекулярное уравнения реакции.
631. Хромит калия окисляется бромом в щелочной среде. Зеленая окраска раствора переходит в желтую. Составьте электронные и молекулярное уравнения реакции. Какие ионы обусловливают начальную и конечную окраску раствора?
632. Составьте электронные и молекулярные уравнения реакций: а) растворения молибдена в азотной кислоте; б) растворения вольфрама в щелочи в присутствии кислорода. Учтите, что молибден и вольфрам приобретают высшую степень окисления.
633. При сплавлении хромита железа Fe(CrO2)2 с карбонатом натрия в присутствии кислорода хром (+ 3) и железо (+ 2) окисляются и приобретают соответственно степень окисления + 6 и + 3. Составьте электронные и молекулярное уравнения реакции.
634. К подкисленному серной кислотой раствору дихромата калия прибавили порошок алюминия. Через некоторое время оранжевая окраска раствора стала зеленой. Составьте электронные и молекулярное уравнения происходящей реакции.
635. Хром получают алюмотермически из его оксида (+ 3), а вольфрам – восстановлением вольфрамового ангидрида водородом. Составьте электронные и молекулярные уравнения соответствующих реакций.
636. Составьте уравнения реакций, которые надо провести для превращений: NaCrO2 → Na2CrO4 →Na2Cr2O7 → CrCl3. Уравнения окислительно-восстановительной реакции напишите на основании электронных уравнений.
637. Марганец азотной кислотой окисляется максимально. Какие соединения при этом получаются? Составьте электронные и молекулярные уравнения соответствующих реакций.
638. Хлор окисляет манганат калия. Какое соединение при этом получается? Как меняется окраска раствора в результате этой реакции? Составьте электронные и молекулярное уравнения.
639. Как меняется степень окисления марганца при восстановлении KMnO4 в кислой, нейтральной и щелочной средах? Составьте электронные и молекулярное уравнения реакции между KMnO4 и KNO2 в нейтральной среде.
640. Каплю раствора соли неизвестного металла поместили на медную пластинку. Через некоторое время на том месте, где была капля раствора, осталось блестящее пятно, которое исчезает после нагревания. Объясните наблюдаемое явление. Какой металл входит в состав соли? Напишите уравнение реакций, происходящих при образовании пятна.
641. На смесь железа и меди массой 1,76 г подействовали горячей серной кислотой объемом 7 мл с массовой долей H2SO4 70% (ρ = 1,6 г/см 3 ). Определите состав смеси, сколько и какой газ выделился в результате реакции.
642. На основании электронных уравнений составьте уравнение реакции получения манганата калия сплавлением диоксида марганца с хлоратом калия в присутствии едкого кали. Хлорат восстанавливается максимально.
643. Почему диоксид марганца может проявлять и окислительные, и восстановительные свойства? Исходя из электронных уравнений составьте уравнения реакций:
644. Для получения хлора в лаборатории смешивают диоксид марганца с хлоридом натрия в присутствии концентрированной серной кислоты. Составьте электронные и молекулярное уравнения этой реакции.
645. Смесь железа с медью обработали раствором соляной кислоты с массовой долей НCl 20% (ρ = 1,1 г/см 3 ). Массовая доля железа в смеси составляет 35%. Вычислите массу исходной смеси, если при реакции выделился газ объемом 244 мл (н.у.), и объем кислоты, вступившей в реакцию.
646. Вычислите массу сульфата меди (II) и сульфата цинка в смеси массой 1,202 г, если при прибавлении к смеси избытка хлорида бария выпал осадок массой 1,089 г.
647. Составьте уравнения реакций, которые надо провести для следующих превращений: Fe → FeSO4→ Fe(OH)2 → Fe(OH)3. Уравнения окислительно-восстановительных реакций напишите на основании электронных уравнений.
648. Какие из следующих веществ реагируют между собой: Cr(OH)3 и KOH; Cr2O3 и SiO2; Cr(NO3)3 и MgCl2; K2CrO4 и H2SO4; Na2Cr2O7 и NaOH; Cr2O3 и H2O. Составьте уравнения соответствующих реакций.
649. Сколько оксида хрома (III) и азота (в объемных единицах) образуется при разложении дихромата аммония массой 27 г, содержащей массовую долю примесей 7,41%?
650. Какую степень окисления проявляет железо в соединениях? Как можно обнаружить ионы Fe 2+ и Fe 3+ в растворе? Составьте молекулярные и ионные уравнения реакций.
652. Составьте уравнения окислительно-восстановительных реакций: а) цинка с концентрированной серной кислотой; б) кадмия с разбавленной азотной кислотой. В чем можно растворить Zn(OH)2? Составьте молекулярные и ионные уравнения соответствующих химических реакций.
653. Чем отличается взаимодействие тригидроксидов кобальта и никеля с кислотами от взаимодействия тригидроксида железа с кислотами? Составьте электронные и молекулярные уравнения соответствующих реакций.
654. Могут ли в растворе существовать совместно следующие вещества: а) FeCl3 и SnCl2; б) FeSO4 и NaOH; в) FeCl3 и K4[Fe(CN)6]? Составьте уравнения реакций.
655. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
656. Составьте уравнения реакций, которые надо провести для превращений: Ni → Ni(NO3)2 → Ni(OH)2→ Ni(OH)3. Уравнения окислительно-восстановительных реакций напишите на основании электронных уравнений.
657. Составьте электронные и молекулярные уравнения реакций: а) растворения платины в царской водке; б) взаимодействия осмия с фтором. Платина окисляется до степени окисления + 4, а осмий – до + 8.
658. Составьте молекулярные и ионные уравнения реакций, которые надо провести для следующих превращений: Fe → FeCl2 → Fe(CN)2 → K4[Fe(CN)6].
659. Смесь железа и цинка, масса железа в которой составляет 5,6 г, обработана соляной кислотой (ρ = 1,1 г/см 3 ) с массовой долей НCl. 20%. Какова масса этой смеси, если выделился газ объемом 13,44 л (н.у.)? Какой объем кислоты был при этом израсходован?
660. Феррат калия К2FeO4 образуется при сплавлении Fe2O3 с калийной селитрой KNO3 в присутствии КОН. Составьте электронные и молекулярное уравнения реакции.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет