Выраженная рестрикция легких что это
Рестриктивные нарушения дыхания на фоне постторакотомического болевого синдрома как фактор риска развития внутрибольничной пневмонии
В.Э. Хороненко, Д.С. Баскаков, А.С. Маланова, Е.А. Мандрыка, М.М. Шеметова
Для корреспонденции: Маланова Анна Сергеевна, канд. мед. наук, младший научный сотрудник отдела анестезиологии и реанимации МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России, Москва; e-mail: malanova_anna@mail.ru
Для цитирования: Хороненко В.Э., Баскаков Д.С., Маланова А.С., Мандрыка Е.А., Шеметова М.М. Рестриктивные нарушения дыхания на фоне постторакотомического болевого синдрома как фактор риска развития внутрибольничной пневмонии. Вестник интенсивной терапии имени А.И. Салтанова. 2019;1:78–84. DOI: 10.21320/1818-474X-2019-1-78-84
Реферат
Обоснование. Болевой синдром является наиболее частым осложнением торакотомии. Он не только причиняет дискомфорт больным, но и может стать причиной нарушения дыхательной функции.
Цель исследования. Анализ влияния постторакотомического болевого синдрома (ПТБС) на функцию внешнего дыхания онкологических пациентов, перенесших открытые оперативные вмешательства на легких.
Материалы и методы. В исследование включены 300 пациентов, которым выполнены обширные онкологические оперативные вмешательства по поводу злокачественных новообразований легких. В зависимости от варианта анестезиологического пособия все исследуемые были рандомизированы на 3 сопоставимые группы: грудная эпидуральная анальгезия (ГЭА), n = 100; паравертебральная блокада (ПВБ), n = 100; межреберная блокада (МРБ) n = 100. На 3-и сутки после операции осуществлялась оценка интенсивности болевого синдрома по визуально-аналоговой шкале (ВАШ) и выполнялась спирометрия.
Результаты. Анализ интенсивности послеоперационного болевого синдрома показал превосходство эпидуральной анальгезии над другими методиками. У пациентов с болевым синдромом интенсивностью более 30 мм ВАШ показатели объема форсированного выдоха за 1 с (ОФВ1), жизненной емкости легких (ЖЕЛ) и экскурсии грудной клетки были значительно ниже, чем у больных с болевым синдромом до 30 мм ВАШ. Развитие болевого синдрома более 70 мм ВАШ приводило к значимому ухудшению показателей ЖЕЛ и экскурсии грудной клетки относительно больных с ПТБС 31–70 мм ВАШ, что увеличивало риск инфекционных осложнений.
Заключение. Обеспечение оптимальной антиноцицептивной защиты в периоперационный период обеспечивает лучшие показатели функции внешнего дыхания и тем самым способствует снижению частоты бронхопульмональных осложнений. Методом выбора в торакальной хирургии является сочетанная общая анестезия с высокой грудной эпидуральной блокадой.
Ключевые слова: онкохирургия, постторакотомический болевой синдром, эпидуральная анестезия, паравертебральная блокада, межреберная блокада
Поступила: 15.11.2018
Принята к печати: 01.03.2019
Введение
Болевой синдром является наиболее частым осложнением торакотомии, причиняющим дискомфорт больным в период после операции и вызывающим беспокойство не только у пациентов, но и у хирургов и анестезиологов-реаниматологов во всем мире [1]. Несмотря на все большее расширение знаний в области патофизиологии и фармакологии ноцицепции, постторакотомической болевой синдром (ПТБС) продолжает оставаться серьезной проблемой послеоперационного периода. Он способен привести к нарушению нормальной биомеханики дыхания, гормональным и иммунным изменениям [2, 3]. Ограниченная подвижность грудной стенки, в свою очередь, способна привести к нарушению дренажной функции бронхов, формированию участков ателектазирования в легких и, как следствие, присоединению воспалительных осложнений в послеоперационный период [4].
Возможные источники болевой импульсации после торакальной хирургии многочисленны и включают в себя хирургический разрез, повреждение или раздражение межреберных нервов, воспаление в стенке грудной клетки, паренхимы легких и плевры. Присоединение нейропатического компонента боли на ранних этапах послеоперационного периода обусловливает развитие труднокупируемого болевого синдрома [5].
В последние годы для решения проблемы ПТБС использовались разнообразные подходы [6]. Были исследованы различные методики анестезии, проведена сравнительная оценка эффективности высокой грудной анестезии/анальгезии и паравертебральных блокад, межреберных и внутриплевральных блокад [7]. Изучен мультимодальный подход с комбинированным использованием опиоидов, региональных методов обезболивания и других системных противовоспалительных лекарственных средств [8]. Основным направлением для исследования в подобных работах являлась оценка интенсивности болевого синдрома в условиях использования того или иного метода анестезии и анальгезии. Изменения биомеханики дыхания, связанные с болевым синдромом, и развитие на этом фоне респираторных осложнений в большинстве работ не изучались достаточно подробно.
Таким образом, на сегодняшний день представляет определенный интерес оценка влияния ПТБС на показатели функции внешнего дыхания и, как следствие, на частоту развития послеоперационных респираторных инфекций. Особенно актуально данная проблема стоит в хирургии рака легкого [9]. Это обусловлено большим травматизмом онкохирургических вмешательств, значительной коморбидностью пациентов, необходимостью быстрой реабилитации для начала следующего этапа противоопухолевого лечения. Целью нашего исследования являлось определение значимости нарушений функции внешнего дыхания на фоне ПТБС для формирования послеоперационных внутрибольничных респираторных осложнений.
Методы исследования
В исследование включены 300 пациентов (203 мужчин, 97 женщин) в возрасте от 45 до 70 лет (средний возраст 57,87 ± 8,96 года), которым в условиях МНИОИ им. П.А. Герцена в период с 2014 по 2017 г. выполнены обширные онкологические оперативные вмешательства по поводу злокачественных новообразований легких преимущественно II–III стадии или метастазов в легкие опухолей различных локализаций.
Критериями включения в исследование являлись:
В зависимости от варианта анестезиологического пособия все исследуемые были рандомизированы на 3 сопоставимые группы: грудная эпидуральная анальгезия (ГЭА), n = 100; паравертебральная блокада (ПВБ), n = 100; межреберная блокада (МРБ), n = 100.
Пациентам всех групп за сутки до операции назначали антиконвульсант прегабалин 75 мг 2 раза в сутки per os. На ночь перед операцией пациенты получали диазепам 10 мг в/м. За 2 ч до операции больные принимали внутрь утреннюю дозу прегабалина (75 мг). Затем пациентам согласно программе рандомизации осуществлялся определенный вид анестезии. В группе ГЭА (n = 100) катетеризацию эпидурального пространства проводили на уровне Th4–Th6, с последующим проведением катетера в краниальном направлении на 4 см, затем выполнялась инфузия модифицированной смеси Бревика (ропивакаин 3 мкг/мл + фентанил 4 мкг/мл + адреналин 2 мкг/мл) со скоростью 5–15 мл/ч в течение операции. В послеоперационном периоде 1–2 сутки продолжалась дотация смеси Бревика, далее в профильном отделении переходили на 0,2% раствор наропина со скоростью 4–6 мл/ч в течение 5 суток. В группе ПВБ (n = 100) катетеризацию паравертебрального пространства (ПВП) производили с унилатеральной стороны под контролем УЗИ навигации, под местной инфильтрационной анестезией на уровне Th5–Th6 с установкой катетера. До операции в ПВП вводили: лидокаин 2% — 10 мл и смесь 0,3% раствора ропивакаина, фентанила (4 мкг/мл) и адреналина (2 мкг/мл) — 20 мл. В конце операции также болюсно вводили модифицированную смесь Бревика. В послеоперационный период пациенты получали в ПВП модифицированную смесь Бревика в течение 1–2 суток, со скоростью от 8 до 12 мл/ч, с 3-х суток: ропивакаин 0,2% со скоростью 8–12 мл/ч в течение 5 суток. В группе МРБ (n = 100) хирургической бригадой после удаления препарата и выполнения лимфаденэктомии пункционной иглой производилась блокада межреберья, через которое осуществлялся хирургический доступ, а также на одно межреберье выше и ниже. Вводили 30 мл 96% этилового спирта + 30 мл 0,5% раствора новокаина. В послеоперационном периоде при ярко выраженном болевом синдроме проводилось дополнительное введение местного анестетика (новокаина 0,5%) чрескожно.
Интраоперационно осуществлялся стандартный мониторинг показателей гемодинамики (АД, Ps, SaO2, ЭКГ), уровня анестезии (энтропия), нейромышечной проводимости (TOF watch).
Для оценки интенсивности ПТБС использовалась 100-миллиметровая ВАШ. Пациентам предлагалось оценить интенсивность боли на 3-и сутки после операции, выставив специальный бегунок в определенной точке шкалы. Оценивалась только интенсивность болевого синдрома при движении — максимально глубокий вдох, кашель. Расстоянию в миллиметрах от начала шкалы соответствовала интенсивность боли в баллах, крайние точки шкалы были определены как «нет боли» и «настолько сильно болит, насколько это возможно себе представить». Болевой синдром 1–30 мм по ВАШ считался легким, 31–70 мм — умеренным, более 70 мм — тяжелым [10–12].
Оценку функции внешнего дыхания (показатели- ЖЕЛ, ОФВ1) осуществляли с помощью спирометра, а также производили измерения объема грудной клетки на вдохе и на выдохе с помощью сантиметровой ленты до и после операции, накануне операции и на 3-й день после операции.
Оценивали частоту жалоб пациентов на одышку или чувство нехватки воздуха в покое и потребность в выполнении фиброоптических санаций трахеобронхиального дерева в первые 3 суток после операции на основе показателей газообмена капиллярной крови. Особое внимание было уделено регистрации фактов развития внутрибольничных пневмоний за время пребывания пациентов в стационаре по данным рентгенографии легких.
Статистическую обработку данных проводили с помощью программы Statistica 6.0 for Windows (StatSoft Inc., USA), достоверность разницы относительных величин оценивали с помощью χ2 (хи-квадрат), достоверность отличий среди абсолютных величин определяли с помощью U-критерия Манна—Уитни. Разницу величин признавали достоверной при p 70 мм ВАШ) болевого синдрома приводило к значимому ухудшению показателей ЖЕЛ и экскурсии грудной клетки относительно больных с умеренно выраженным ПТБС (31–70 мм ВАШ).
| Таблица 3. Показатели функции внешнего дыхания в зависимости от интенсивности постторакотомического болевого синдрома | |||
| Интенсивность ПТБС (n = 300) | ОФВ1 (ЛЭ/ ПЭ) | ЖЕЛ (ЛЭ/ПЭ) | Экскурсия грудной клетки, см (ЛЭ/ПЭ) |
| 1–30 мм | 1,88 ± 0,6/ | 2,0 ± 0,6/ | 3,6 ± 1,4/ |
| (n = 138) | 1,65 ± 0,4 | 1,51 ± 0,3 | 2,8 ± 1,0 |
| 31–70 мм | 1,59 ± 0,4*/ | 1,72 ± 0,4*/ | 2,9 ± 1,2*/ |
| (n = 141) | 1,41 ± 0,4* | 1,45 ± 0,4 | 2,6 ± 1,0 |
| от 71 мм | 1,52 ± 0,8*/ | 1,48 ± 0,3* / | |
| (n = 21) | 1,16 ± 0,3* | 1,36 ± 0,3 | 1,8 ± 0,9* |
ЖЕЛ — жизненная емкость легких; ЛЭ — лобэктомия; ОФВ1 — объем форсированного выдоха за 1 с; ПТБС — постторакотомический болевой синдром; ПЭ — пневмонэктомия.
Что такое хроническая обструктивная болезнь легких (ХОБЛ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Никитина И. Л., врача УЗИ со стажем в 26 лет.
Определение болезни. Причины заболевания
Данная болезнь коварна тем, что основные симптомы болезни, в частности, при табакокурении проявляются лишь через 20 лет после начала курения. Оно долгое время не даёт клинических проявлений и может протекать бессимптомно, однако, в отсутствии лечения незаметно прогрессирует обструкция дыхательных путей, которая становится необратимой и ведёт к ранней нетрудоспособности и сокращению продолжительности жизни в целом. Поэтому тема ХОБЛ представляется в наши дни особенно актуальной.
Важно знать, что ХОБЛ — это первично хроническое заболевание, при котором важна ранняя диагностика на начальных стадиях, так как болезнь имеет тенденцию к прогрессированию.
Если врач поставил диагноз «Хроническая обструктивная болезнь лёгких (ХОБЛ)», у пациента возникает ряд вопросов: что это значит, насколько это опасно, что изменить в образе жизни, какой прогноз течения болезни?
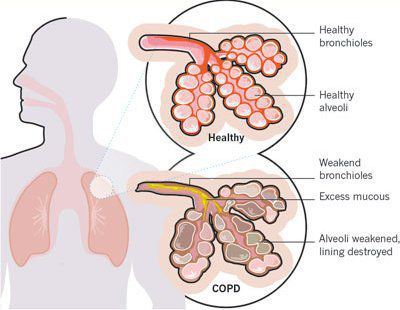
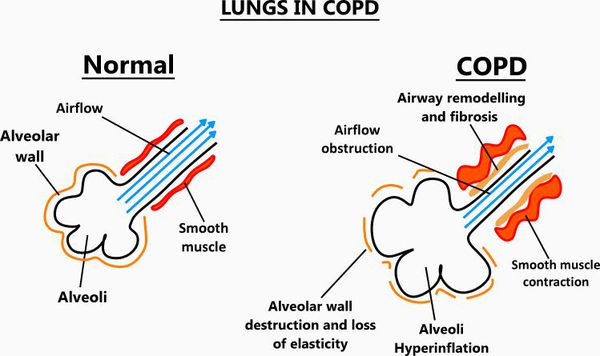
Итак, хроническая обструктивная болезнь лёгких или ХОБЛ – это хроническое воспалительное заболевание с поражением мелких бронхов (воздухоносных путей), которое приводит к нарушению дыхания за счёт сужения просвета бронхов. [1] С течением времени в лёгких развивается эмфизема. Так называется состояние, при котором снижается эластичность лёгких, то есть их способность сжиматься и расширяться в процессе дыхания. Лёгкие при этом находятся постоянно как будто в состоянии вдоха, в них всегда, даже во время выдоха, остается много воздуха, что нарушает нормальный газообмен и приводит к развитию дыхательной недостаточности.
Основными причинами заболевания ХОБЛ являются:
К другим причинам относятся:
Симптомы хронической обструктивной болезни легких
ХОБЛ — болезнь второй половины жизни, чаще развивается после 40 лет. Развитие болезни — постепенный длительный процесс, чаще незаметный для пациента.
Обратиться к врачу заставляют появившиеся одышка и кашель — самые распространённые симптомы заболевания (одышка почти постоянная; кашель частый и ежедневный, с выделениями мокроты по утрам). [2]
Типичный пациент с ХОБЛ — курящий человек 45-50 лет, жалующийся на частую одышку при физической нагрузке.
Кашель — один из самых ранних симптомов болезни. Он часто недооценивается пациентами. На начальных стадиях болезни кашель носит эпизодический характер, но позже становится ежедневным.
Мокрота также относительно ранний симптом заболевания. На первых стадиях она выделяется в небольших количествах, в основном по утрам. Характер слизистый. Гнойная обильная мокрота появляется во время обострения заболевания.
Одышка возникает на более поздних стадиях заболевания и отмечается вначале только при значительной и интенсивной физической нагрузке, усиливается при респираторных заболеваниях. В дальнейшем одышка модифицируется: ощущение недостатка кислорода во время обычных физических нагрузкок сменяется тяжёлой дыхательной недостаточностью и через время усиливается. Именно одышка становится частой причиной для того, чтобы обратиться к врачу.
Когда можно заподозрить наличие ХОБЛ?
Вот несколько вопросов алгоритма ранней диагностики ХОБЛ: [1]
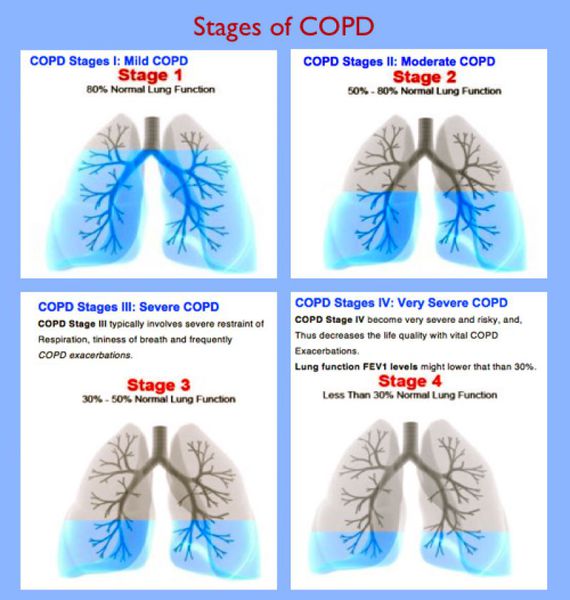
При положительно ответе более чем на 2 вопроса необходимо проведение спирометрии с бронходилятационным тестом. При показателе теста ОФВ1/ФЖЕЛ ≤ 70 определяется подозрение на ХОБЛ.
Патогенез хронической обструктивной болезни легких
При ХОБЛ страдают как дыхательные пути, так и ткань самого лёгкого — лёгочная паренхима.
Начинается заболевание в мелких дыхательных путях с закупорки их слизью, сопровождающейся воспалением с формированием перибронхиального фиброза (уплотнение соединительной ткани) и облитерации (зарастание полости).
При сформировавшейся патологии бронхитический компонент включает:
Эмфизематозный компонент приводит к разрушению конечных отделов дыхательных путей — альвеолярных стенок и поддерживающих структур с образованием значительно расширенных воздушных пространств. Отсутствие тканевого каркаса дыхательных путей приводит к их сужению вследствие тенденции к динамическому спадению во время выдоха, что становится причиной экспираторного коллапса бронхов. [4]
Ко всему прочему, разрушение альвеолярно-капиллярной мембраны влияет на газообменные процессы в лёгких, снижая их диффузную способность. В результате этого возникают уменьшение оксигенации (кислородное насыщения крови) и альвеолярной вентиляции. Происходит избыточная вентиляция недостаточно перфузируемых зон, приводящая к росту вентиляции мёртвого пространства и нарушению выведения углекислого газа СО2. Площадь альвеолярно-капиллярной поверхности уменьшена, но может быть достаточной для газообмена в состоянии покоя, когда эти аномалии могут не проявляться. Однако при физической нагрузке, когда потребность в кислороде возрастает, если дополнительных резервов газообменивающихся единиц нет, то возникает гипоксемия — недостаток содержания кислорода в крови.
Появившаяся гипоксемия при длительном существовании у пациентов с ХОБЛ включает ряд адаптивных реакций. Повреждение альвеолярно-капиллярных единиц вызывает подъём давления в лёгочной артерии. Поскольку правый желудочек сердца в таких условиях должен развивать большее давление для преодоления возросшего давления в лёгочной артерии, он гипертрофируется и расширяется (с развитием сердечной недостаточности правого желудочка). Кроме того, хроническая гипоксемия способна вызывать увеличение эритропоэза, который впоследствии увеличивает вязкость крови и усиливает правожелудочковую недостаточность.