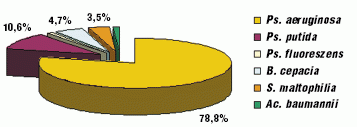Высев при муковисцидозе что это
Муковисцидоз: что за болезнь, как проходит лечение?
Симптомы муковисцидоза
Специалисты выделяют несколько форм заболевания: кишечную, легочную и смешанную.
К основным симптомам заболевания обычно относят:
Симптомы муковисцидоза зависят от формы болезни. Муковисцидоз легких сильно снижает иммунитет, а поскольку слизистые пробки легко поражаются бактериями стафилококка или синегнойной палочки, люди постоянно страдают от повторяющихся бронхитов и пневмоний.
Основные признаки муковисцидоза легких 1 :
Кишечная форма муковисцидоза характеризуется ферментной недостаточностью, нарушением всасывания полезных веществ в кишечнике. В результате нехватки ферментов стул становится «жирным», могут активно размножаться бактерии, в результате чего накапливаются газы, что приводит к выраженному метеоризму. Стул учащается, а объем каловых масс может в несколько раз превышать возрастную норму.
Причины муковисцидоза
Скопление слизи создает благоприятные условия для размножения условно-патогенной флоры, поэтому резко возрастает риск возникновения гнойных осложнений и сопутствующих заболеваний. При муковисцидозе у взрослых значительно страдает репродуктивная функция.
Диагностика муковисцидоза
Для диагностики муковисцидоза могут понадобиться как лабораторные, так и генетические обследования. Генетические исследования обладают высокой информативностью и позволяют заподозрить развитие болезни почти сразу после рождения. На данный момент обнаружить заболевание можно еще до рождения ребенка при неонатальном скрининге.
Для того, чтобы с уверенностью говорить о наличии у человека муковисцидоза, врач должен диагностировать следующие показатели 1 :
Лечение муковисцидоза
Лечение муковисцидоза должно быть комплексным и направленным на основные симптомы болезни: борьбу с инфекционными заболеваниями, очищение бронхов от мокроты, восполнение недостающих ферментов поджелудочной железы.
Часть терапии обязательно должна быть направлена на поддержку бронхолегочной системы, предупреждение осложнений от повторяющихся бронхитов и пневмоний. При развитии инфекционных заболеваний показано лечение антибиотиками. Обязательно используют методы и средства, которые способствуют разжижению мокроты и ее свободному удалению из бронхов и легких. Муколитики – препараты, разжижающие мокроту, используют длительными курсами, делая небольшие перерывы.
Диета при муковисцидозе – это не временные ограничения, а пожизненный образ питания. В рационе человека должно быть большое количество белка, получаемого из нежирного мяса, качественной рыбы, творога и яиц. Желательно, чтобы диета была высококалорийной, но необходимо ограничить количество поступающих жиров животного происхождения, трансжиров и грубой клетчатки, которая раздражает воспаленные стенки желудочно-кишечного тракта.
При развитии непереносимости лактозы из рациона исключают молоко. Из-за сухости слизистых оболочек и нарушения секреции слизи рекомендуется повышенный питьевой режим, особенно в жаркие месяцы.
Препарат Креон ® при муковисцидозе
Также в линейке Креон ® есть специальная форма – Креон ® Микро, выпущенная специально для лечения детей с муковисцидозом. Минимикросферы помещены во флакон россыпью, в комплекте идет мерная ложечка, которая позволяет удобно насыпать нужное количество препарата.
Подробнее о Креон ® Микро можно прочитать здесь.
Значение микробиологического мониторинга больных муковисцидозом в условиях регионального центра
Муковисцидоз (МВ) (Cystic Fibrosis) — наиболее частая наследственная патология, характеризующаяся мультисистемным поражением, обусловленным мутацией гена МВТР (муковисцидозного трансмембранного регулятора проводимости), вызывающей нарушение транспор
Муковисцидоз (МВ) (Cystic Fibrosis) — наиболее частая наследственная патология, характеризующаяся мультисистемным поражением, обусловленным мутацией гена МВТР (муковисцидозного трансмембранного регулятора проводимости), вызывающей нарушение транспорта ионов хлора, натрия и бикарбонатов в эпителиальных клетках, что приводит к прогрессирующему повреждению экзокринных желез жизненно важных органов.
С течением времени эпидемиологические показатели патогенов претерпевают изменения в силу увеличения продолжительности жизни больных, агрессивной и пролонгированной антибиотикотерапии, появления новых антибактериальных препаратов с ингаляционным методом введения, модификации микробиологических свойств самих бактерий. Проведение антимикробной терапии требует всe более серьeзной бактериологической и клинической оценки. В этой связи микробиологический мониторинг является определяющим для своевременного и оптимального подбора антибактериальной терапии, способной стабилизировать, а порой и улучшить падение лeгочной функции, которая является наиболее информативным маркeром выживаемости [2].
Цель исследования: сравнить состав микрофлоры у 38 больных МВ Ярославского региона в 2000 и 2008 годах и проследить его динамику за последние 4 года (30 пациентов) с изменением уровня резистентности основных патогенов к антибактериальным препаратам под влиянием антимикробной терапии.
Материалы и методы. Проведен сравнительный анализ бактериальной флоры у 38 больных МВ в 2000 и 2008 годах и бактериологический мониторинг 30 пациентов (возраст от 4 месяцев до 22 лет) с МВ (1048 изолятов) с 2005 по 2008 год. Исследовались образцы мокроты с предварительной оценкой еe адекватности (выявление нейтрофилов и сквамозных эпителиальных клеток) или, при еe отсутствии, смывы из глубоких отделов глотки, которые считаются высокоинформативными у пациентов без экспекторации мокроты [8]. Бактериологическое исследование проводилось при каждом рутинном визите, не реже 1 раза в 3 месяца, а также во время антибактериальной терапии инфекции, обусловленной Ps. aeruginosa, до и после лечения.
Были выделены группы больных (8) с хронической синегнойной инфекцией и пациенты с первичным (6) и интермиттирующим высевом Ps. aeruginosa (4). Согласно международным рекомендациям, о хронической инфекции Ps. aeruginosa можно судить при идентификации патогена в течение минимум 6 месяцев, подтверждeнной позитивными культурами (тремя и более) с прямыми (температура, интоксикация и т. д.) или непрямыми (уровень специфических антител) признаками инфекции и повреждения тканей. С учeтом ограниченных возможностей определения уровня антител к Ps. aeruginosa с практической точки зрения более приемлемыми являются критерии, предложенные Lee et al. в 2003 году [6], которыми мы и пользуемся в своей работе. В соответствии с этими критериями, обнаружение Ps. aeruginosa более чем в 50% образцов мокроты или смывов в течение предшествующих 12 месяцев есть не что иное, как хроническая инфекция Ps. aeruginosa. В случае высева синегнойной палочки менее чем из 50% образцов мокроты и орофаренгиальных смывов ситуация расценивалась как интермиттирующая инфекция (4). Пациенты с хронической синегнойной инфекцией получали плановые внутривенные курсы антисинегнойных препаратов 3–4 раза в год. Использовались сочетания цефалоспоринов III поколения (цефтазидим, цефепим, цефоперазон/сульбактам) или карбапенемов (имипенем) с аминогликозидами (амикацин). Больные с первичным высевом Ps. aeruginosa получали курс в/в антибактериальной терапии в течение 14 дней с последующим 3-недельным приeмом перорального ципрофлоксацина в сочетании с ингаляциями гентамицина. C 2008 года больные с первичным и интермиттирующим высевом патогена получали эрадикационную терапию ингаляционным колистиметатом натрия и/или пероральным ципрофлоксацином в течение трех месяцев. Все пациенты получали базисную терапию микросферическими ферментами, ацетилцистеин, урсодезоксихолиевую кислоту, витамины, ежедневную кинезитерапию.
С 2006 года в состав базисного лечения включена рекомбинантная человеческая ДНаза (дорназа альфа, Пульмозим), улучшающая реологию мокроты за счeт фрагментации длинных цепей ДНК, высокая концентрация которых является основным фактором накопления патологически вязкого бронхиального секрета [3]. Использование Пульмозима в качестве базисного препарата обосновано ещe и доказанным противовоспалительным и антибактериальным эффектами. Снижение обсемененности мокроты St. aureus и Ps. аeruginosa [1, 4, 10] позволяет сократить количество дней внутривенной антибиотикотерапии, улучшить показатели функции внешнего дыхания [10]. Эти данные, а также отсутствие в течение трех лет нежелательных явлений при использовании препарата позволили применить дорназу альфа у детей с появлением первых признаков заинтересованности респираторного тракта, в т. ч. выявленных в процессе неонатального скрининга.
Проведeн сравнительный анализ динамики резистентности Ps. aeruginosa к антибактериальным препаратам за период с 2005 по 2008 год в зависимости от инфекционного диагноза (первичный высев, хроническая синегнойная инфекция).
Профиль бактериальной чувствительности и резистентности определялся с помощью дискодиффузионного метода с получением результата в соответствии с установленными контрольными точками, согласно рекомендациям Института клинических и лабораторных стандартов (Clinical and Laboratory Standards Institute — CLSI).
Статистический анализ проводился с использованием программного обеспечения базы данных микробиологической лаборатории WOHNET 5, разработанной Центром по сотрудничеству с ВОЗ по контролю за резистентностью к антимикробным препаратам.
Результаты. Ведущими микроорганизмами, вызывающими хронический бронхолeгочный процесс, являются St. aureus, Ps. aeruginosa и другие неферментирующие грамотрицательные микроорганизмы.
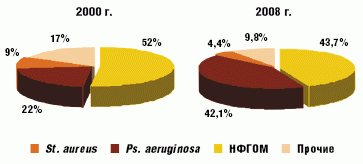
Сравнение микробиологического статуса пациентов в 2000 и 2008 году свидетельствует об уменьшении доли St. aureus (с 52% до 43,7%) в структуре патогенов и роста высева изолятов неферментирующей грамотрицательной микрофлоры (НФГОМ) и, прежде всего, Ps. aeruginosа (рис. 1). Высев Ps. aeruginosa составил 42,1% всех полученных микроорганизмов. Причeм 2,6% штаммов были представлены мукоидными формами, в 19,8% случаев (28) Ps. aeruginosa высевалась в комбинации со St. аureus. У 5 пациентов в мокроте обнаружено по два различных морфотипа, различающихся по чувствительности к антибиотикам.
С 2000 года идентификация Ps. aeruginosa имела место у 22 (57,9%) из 38 наблюдаемых пациентов. Впервые колонизация синегнойной палочки обнаруживалась у больных в возрасте от 1,2 до 17 лет (средний возраст 10,4 года). На сегодняшний день о хронической синегнойной инфекции можно говорить в 8 случаях, у 6 больных высев Ps. аeruginosa носит интермиттирующий характер, у 4 пациентов Ps. аeruginosa обнаружена впервые.
С внедрением современных идентификационных систем (BBL Cristal) улучшилась идентификация НФГОМ. Появилась возможность дифференцировать другие виды псевдомонад (Ps. putida (10,6%), Ps. fluoreszens (1,2%)), B. cepacia (4,7%), S. maltophilia (3,5%), Ac. baumannii (1,2%) (рис. 2).
За 2005–2008 годы высев B. cepacia у всех больных (10) можно расценивать как интермиттирующий. Колонизация патогена не зависела от тяжести течения бронхолeгочного процесса. Ни в одном случае B. cepacia не оказала значимого влияния на частоту обострений, показатели лeгочной функции. У одного пациента высев B. cepacia неоднократно отмечался сразу после курсов в/в инфузий антисинегнойных препаратов, с последующим подавлением еe роста на фоне ингаляционной терапии тиамфениколом. Также эпизодически за этот период времени у 10 пациентов наблюдалась идентификация S. maltophilia, не оказывая существенного влияния на клинико-функциональные показатели.
Хроническая инфекция респираторного тракта, обусловленная ассоциацией Ac. baumannii и МRSA, явилась причиной гибели больного 22 лет с тяжeлым поражением лeгких.
Антибактериальная резистентность патогенов с течением времени также претерпевает существенные изменения.
В 2008 году из 80 изолятов St. aureus 8,85% (7) демонстрировали резистентность к оксациллину. Из 77 штаммов Ps. aeruginosa лишь 36,4% (28) были чувствительны ко всем препаратам, 15,6% (12) оказались панрезистентными. Из четырех изолятов B. cepacia два штамма продемонстрировали чувствительность к цефтазидиму, один — к меропенему, но два других оказались резистентны ко всем антибиотикам.
Чувствительность синегнойной палочки существенно различается при первичном высеве и у больных с хронической инфекцией, обусловленной Ps. aeruginosa.
У 10 пациентов с первичным высевом Ps. aeruginosa за 2007–2008 годы в 70% была высокочувствительна ко всем препаратам, что свидетельствует о высокой вероятности приобретения патогена из источников окружающей среды, а не от пациентов. У трех больных Ps. aeruginosa была резистентна к двум и более антибиотикам. В данном случае источником инфекции, скорее всего, являются больные муковисцидозом. Высокая вероятность внутрибольничного инфицирования подтверждается существенным преобладанием частоты и длительности предшествующего пребывания этих больных в пульмонологическом стационаре, по сравнению с детьми, которые при первичной изоляции Ps. aeruginosa имели высокочувствительные штаммы (табл. 1).
Несмотря на агрессивную антибактериальную терапию в/в антисинегнойными препаратами, эрадикации на срок 1 года и более удалось добиться только у четырeх больных (40%) с высокочувствительными штаммами. В остальных случаях повторный высев патогена отмечался в среднем через 7 месяцев после окончания эрадикационной терапии. При повторном высеве Ps. aeruginosa у 2 больных отмечалось двукратное нарастание уровня резистентности к антибактериальным препаратам. У одного пациента резистентный штамм сменился на чувствительный, что, скорее всего, обусловлено успешной эрадикацией и повторным инфицированием «диким» штаммом.
У больных с хронической синегнойной инфекцией (8) Ps. aeruginosa демонстрирует рост резистентности к антибактериальным препаратам (табл. 2). Комбинации цефтазидима, цефоперазона/сульбактама с амикацином являются наиболее часто используемыми. Однако нарастание резистентности отмечается в отношении всех изучаемых антибиотиков, в т. ч. и к препаратам, которые в течение последних 4 лет практически не применялись. Это касается в равной степени как пенициллинов, цефалоспоринов III поколония, так и карбапенемов. Использование ингаляционных гентамицина и колистиметата натрия не оказало влияния на рост к ним резистентности микроорганизмов. Выявленная более высокая резистентность немукоидных изолятов в сравнении с мукоидными остаeтся недостаточно понятной.
При динамическом мониторинге резистентности Ps. aeruginosa у одного и того же больного с хронической инфекцией в процессе плановой антибактериальной терапии не раз отмечалось нарастание резистентности Ps. aeruginosa к антибиотикам после 2-недельного курса в/в лечения с последующим восстановлением чувствительности микроорганизмов к последующему курсу через 3–4 месяца (феномен «адаптивной резистентности»).
Снижение плотности Ps. aeruginosa в образцах мокроты после проведения в/в антибактериальной терапии было связано с улучшением лeгочной функции. Однако у половины больных, несмотря на улучшение клинико-функциональных показателей, изменения в количестве колоний из образцов мокроты отсутствовали. Во всех случаях патогены, резистентные к антибиотикам in vitro, in vivo, оказывались эффективными при использовании их в комбинации.
Обсуждение. Восьмилетний бактериологический мониторинг больных МВ, наблюдаемых в региональном центре, свидетельствует об изменении бактериологического статуса пациентов в сторону увеличения высева синегнойной палочки и других неферментирующих грамотрицательных микроорганизмов. С одной стороны, это связано с увеличением продолжительности жизни больных, с другой, с улучшением диагностических возможностей региональных лабораторий. У больных с хронической синегнойной инфекцией отмечается высокий уровень резистентности Ps. aeruginosa в связи с массивной и пролонгированной антибактериальной терапией. Агрессивная эрадикационная терапия, используемая при первичном высеве патогена, не оказывает значимого влияния на чувствительность штаммов, полученных при повторном высеве микроба. Не исключено, что второй высев обусловлен колонизацией нового штамма. Эти данные согласуются с результатами 10-летнего ретроспективного анализа антибактериальной резистентности повторных изолятов Ps. aeruginosa у больных после успешно проведeнной интенсивной эрадикационной терапии, представленными Sheng-Ang Ho и Tim W. R. Lee (UK) с соавт. [6]. Они показали, что агрессивные режимы антибактериальной терапии при первичном высеве Ps. aeruginosa не оказали значимого влияния на рост резистентности штаммов, идентифицированных в последующем. В этом исследовании также не проводилось генетической идентификации штаммов, что позволяет предположить успешную первичную эрадикацию и повторную колонизацию новым патогенном. В работе Pitt c соавт. [7], где изучался генотип Ps. aeruginosa, наоборот, был показан высокий уровень резистентности к наиболее часто используемым антибактериальным препаратам как у больных с впервые выявленной инфекцией, так и при хроническом еe течении.
Прослеживается зависимость антибактериальной резистентности от источника инфицирования, длительности колонизации в дыхательных путях, антибактериальной стратегии. Высокая чувствительность штаммов при первичном высеве Ps. aeruginosa с высокой степенью вероятности позволяет предполагать колонизацию внешнесредовых микроорганизмов, в отличие от хронически инфицированных пациентов, у которых резистентность возрастает с течением времени и объeмом проводимой антисинегнойной терапии. Прямая корреляция резистентных штаммов Ps. aeruginosa, обнаруженных у больных при первичном высеве, с частотой и длительностью пребывания в условиях стационара лишний раз убеждает в необходимости более взвешенного подхода к терапии пациентов с колонизацией St. aureus и определения показаний к госпитализации. В связи с отсутствием селективных антистафилококковых препаратов (флуклоксациллин) лечение больных с хронической колонизацией St. aureus целесообразно ограничить лечением обострений и другой респираторной суперинфекции. В противном случае возрастает риск колонизации синегнойной палочки и другой НФГОМ [2, 4, 5].
Заключение. На сегодняшний день эффективная терапия инфекции дыхательных путей у больных МВ невозможна без проведения микробиологического мониторинга мокроты или орофаренгиального аспирата с определением чувствительности и резистентности патогенов к антибактериальным препаратам. Бактериологический контроль способствует своевременному выявлению колонизации новых микроорганизмов и проведению ранней эрадикационной терапии. При отсутствии в рутинной практике возможности определения уровня специфических антител к различным морфотипам Ps. aeruginosa микробиологический мониторинг является единственным инструментом идентификации хронической синегнойной инфекции, требующей пересмотра антибактериальной стратегии.
Определение уровня резистентности микроорганизмов способствует адекватному подбору антибактериальных препаратов в соответствии с разработанными протоколами лечения. Кроме того, бактериологический мониторинг является чрезвычайно важным для контроля изменений микробиологического статуса пациентов и необходимости проведения своевременных мероприятий по профилактике перекрeстного инфицирования, строгого соблюдения стандартов гигиены.
По вопросам литературы обращайтесь в редакцию.
И. К. Ашерова, кандидат медицинских наук
О. Ю. Верина
Е. Н. Медведева
Центр помощи больным муковисцидозом,
МУЗ Детская клиническая больница №1, Ярославль
Муковисцидоз: проявления, диагностика, лечение и помощь
Время чтения: 7 мин.
Оно поражает все органы, выделяющие слизь: бронхолегочную систему, поджелудочную железу, печень, железы кишечника, потовые, слюнные и половые железы. При муковисцидозе железы производят вязкий секрет, который не дает внутренним органам полноценно функционировать. Особенно поражаются печень, поджелудочная железа, кишечный тракт и бронхолегочная система. Легкие забиваются слизью: их работа нарушается, развиваются опасные инфекции, которые трудно лечить. Слизь, которая копится в поджелудочной железе, нарушает работу ферментов — плохо усваиваются жиры и другие жизненно важные питательные вещества.
Как проявляется муковисцидоз?
Заболевание проявляется по-разному. Это зависит от мутации гена, которая приводит к нарушению функции белкового продукта — трансмембранного регулятора муковисцидоза (МВТР).
У некоторых людей оно проявляется сразу после рождения, и это считается «тяжелой» формой болезни. Если мутации «мягкие», муковисцидоз проявляются позднее, в 10-15 лет.
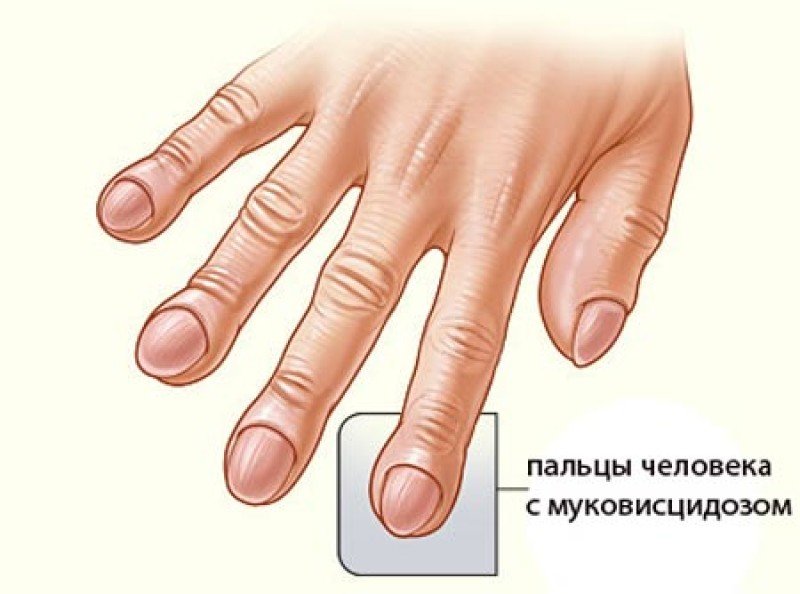
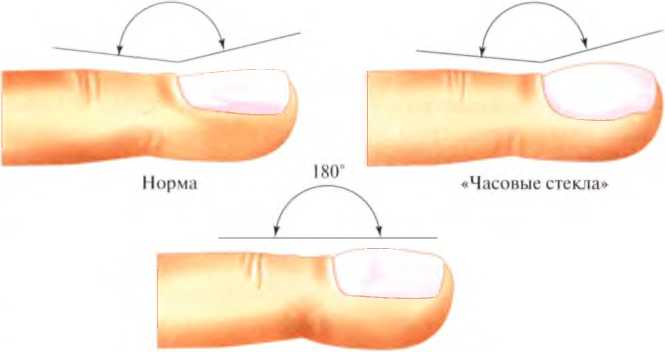
Признаки муковисцидоза у детей:
Взрослые больные страдают заболеваниями верхних и нижних дыхательных путей, кишечно-желудочного тракта. Постоянно повторяются бронхиты и бронхопневмонии. Также у больных муковисцидозом бывает диареи с большим количеством каловых масс, приступы кишечной непроходимости, боли в животе.
Наблюдается полипоз носа, человек постоянно кашляет по непонятной причине. Может развиваться остеопения (снижение плотности костной ткани) и остеопороз (повышение хрупкости костей) с риском тяжелых переломов. Воспалительный процесс поражает суставы, развивается артрит. У некоторых развивается сахарный диабет и цирроз печени.
Большинство мужчин с муковисцидозом не могут иметь детей естественным путем: мужское бесплодие развивается из-за непроходимости семявыносящих протоков. Это не влияет на сексуальные способности, а с помощью репродуктивных технологий мужчины с муковисцидозом могут иметь детей. Женщины с муковисцидозом обычно могут иметь детей естественным путем.
Новорожденных проверяют на муковисцидоз с 2006 года. Если скрининговый тест положительный, ребенок попадает в группу особого контроля, и уже к месяцу врачи могут поставить точный диагноз.
Основные критерии при диагностике муковисцидоза:
Обычно детей с муковисцидозом наблюдают врач-пульмонолог и врач-педиатр, а также врач-генетик. Заболевание поражает многие органы и требует комплексной терапии, поэтому пациентов наблюдают врачи разных профилей.
Как лечат муковисцидоз?
Состояние поддерживается дието- и витаминотерапией. При муковисцидозе в сутки нужно потреблять на 120-150% калорий больше, чем при стандартном рационе, пропорционально увеличивается потребление белка и жира. При недостаточности функции поджелудочной железы применяется ферментозаместительная терапия, для уменьшения вязкости мокроты и облегчения ее эвакуации прописывают муколитики. Для лечения печени назначаются гепатопротекторы.
В обязательном порядке проводится кинезитерапия — комплекс процедур и упражнений, который восстанавливает двигательную функцию, уменьшает риск возникновения осложнений и сохраняет общую физическую способность, способствует выделению мокроты из бронхиального дерева, улучшает вентиляцию легких и снижает риск развития множества опасных осложнений. Проводится антибактериальная терапия — плановые курсы в виде ингаляций через небулайзер, совместно с таблетками или внутривенно всем пациентам с легочными проявлениями муковисцидоза, а также при обострении заболевания и выявлении респираторной инфекции. При дыхательной недостаточности проводят кислородотерапию, а при острой дыхательной недостаточности — неинвазивную вентиляцию легких.
При необходимости используют:
Пересадка легких при муковисцидозе
Трансплантация легких — шанс для больных муковисцидозом, когда медикаментозная терапия уже не помогает.
В 2016 году в Национальном медицинском исследовательском центре трансплантологии и искусственных органов имени академика В.И. Шумакова трансплантацию легких впервые выполнили 13-летней Кате Матвеевой с муковисцидозом. Она — первый ребенок, которому в России пересадили легкие. Первый опыт оказался успешным: появилась возможность оказывать трансплантологическую помощь подросткам, используя органы взрослого умершего донора.
Первую в мире успешную одновременную трансплантацию печени и легких ребенку с муковисцидозом провели в начале 2019 года тоже в НМИЦ трансплантологии и искусственных органов им. Шумакова девятилетнему Мише из Южно-Сахалинска. Зарубежные трансплантологи и до этого пытались провести подобную операцию у детей этой возрастной группы, но все заканчивалось неудачно.
«Пациенты с муковисцидозом подходят к состоянию, когда трансплантация показана, обычно уже во взрослом возрасте. Все зависит от течения самого заболевания, в какой степени поражены органы, — поясняет директор Центра, главный трансплантолог Минздрава России Сергей Готье. — Либо это преимущественное поражение легких с развитием дыхательной недостаточности, и тогда показана трансплантация легких. Либо торпидное, то есть вялое, мягкое течение заболевания в отношении легких, но при этом формирование цирроза печени и показания к трансплантации печени. То есть бывают пациенты с показаниями к трансплантации печени и пациенты с показаниями к трансплантации легких. А посередине этих двух групп как раз наш Миша, которому пришлось делать сочетанную операцию в связи с тяжелым поражением и печени, и легких».
Председатель межрегиональной общественной организации «Помощь больным с муковисцидозом» Ирина Мясникова назвала эту операцию неоспоримым успехом. «Я очень обрадовалась, когда узнала, что Мише пересадили легкие и печень. Для больных муковисцидозом это самые-самые уязвимые органы, они больше всего страдают. Есть случаи, когда несмотря на все усилия врачей и семей с такими детьми, не получается поддержать таких пациентов. Это очень печальные ситуации, просто невозможные, особенно если речь идет о детях, которые кроме страданий ничего в этой жизни не видели. И до сих пор никакого выхода не было. Мы гордимся и рады, что именно российские врачи были первыми, кто такую уникальную операцию осуществил. Это дает надежду всем таким нашим пациентам и их родителям».
Современное лечение и разработка новых методов терапии муковисцидоза
До недавнего времени лечили только симптомы муковисцидоза. В последние годы произошел существенный прогресс в патогенетической терапии заболевания, а также возникли предпосылки для развития новых методов генной терапии.
Еще один новый препарат, применяемый при муковисцидозе — « Оркамби ». Он зарегистрирован в России, и в августе 2021 года утвержден в перечень ЖНВЛП. « Оркамби » используют для коррекции генетических причин муковисцидоза. Этот препарат разработан для пациентов, у которых две генетические мутации 508del. Согласно регистру пациентов с муковисцидозом от 2017 года, такую мутацию имеют 31% детей и 23% взрослых пациентов. При применении этого препарата у пациентов увеличивается объем легких, и болезнь протекает гораздо легче.
Паллиативная помощь при муковисцидозе
Отдельной паллиативной программы для пациентов с муковисцидозом нет, но хосписы берут под опеку людей с муковисцидозом в терминальной стадии заболевания. Среди них есть те, кто ждет трансплантацию легких: в этот сложный период людям нужна и куративная, и паллиативная помощь. Если человек после трансплантации легких чувствует себя хорошо, его снимают с учета в хосписе. Если пересадка неуспешна, его оставляют на учете.
За рубежом оказание паллиативной помощи пациентам с муковисцидозом распространено широко. По словам директора Благотворительного фонда «Детский паллиатив» по научно-методической работе Натальи Савва, в Англии такие люди могут лечиться и обратиться в хоспис, лечь туда для социальной передышки, симптоматического контроля, помощи в конце жизни, их может наблюдать выездная служба. Она подчеркивает, что паллиативная помощь — это не только помощь умирающим: «У нас большинство детей (с муковисцидозом) не являются умирающими. Они долго живут с момента постановки диагноза и/или развития комплекса проблем, нарушающих качество жизни, параллельно наблюдаются специализированной и паллиативной службами, могут перейти во взрослый возраст».