Высокий риск преэклампсии по первому скринингу что это
Высокий риск преэклампсии по первому скринингу что это
Рекомендации: Все беременные женщины должны проходить измерение систолического и диастолического кровяного давления в первый пренатальный визит и периодически в третьем триместре.
Гипертензивность является наиболее частым осложнением при беременности, наблюдаемым в 6—8% случаев. Она наблюдается в группе заболеваний, которые включают преэклампсию — эклампсию, латентную или хроническую гипертензивность и гипертензивность при беременности. Определения, используемые для различения этих заболеваний, являются предметом обсуждения и ведут к неопределенности.
Преэклампсия (или токсикоз беременных) является наиболее опасным из этих заболеваний. Хотя определения различны, многие описывают преэклампсию как острую гипертензивность (более 140/90 или больше чем 15 мм р.т. ст. и 30 мм рт. ст. выше обычного диастолического или систолического давления соответственно), имеющую место после 20 недели беременности, вместе с отеком, протеинурией (более, чем 0,3 г/24 часа) или и тем, и другим. У женщин с преэклампсией очень высок риск таких осложнений, как отрыв плаценты, острая почечная недостаточность, мозговые кровоизлияния, отек легких, распространение свертываемости крови в сосудах, тромбоз и эклампсия. Плод подвержен риску возникновения гипоксии, низкого веса при рождении, преждевременных родов и прена-тальной смертности. Эклампсия — развитая стадия этого заболевания, характеризующаяся припадками, является основной причиной материнской смертности в США Женщинь с преэклампсией не находятся в группе повышенного риск развития хронической гипертензивности. В группу риска развития преэклампсии входят также женщины, у которых первая беременность, женщины, у которых было много беременностей, женщины с хронической гипертензивностью или диабетом или наличием в семье случаев эклампсии или преэклампсии.
Другие причины гипертензивности в течение беременности включают в себя гестативную и идиопатическую гипертензивность. Гестативная гипертензивность является острым случаем гипертензивности в течение беременности или в течение раннего послеродового периода и не связана с протеинурией или отеком. Идиопатическая гипертензивность может быть латентной до беременности и проявляться во время ношения плода. Женщины с латентной идиопатической гипертензивностью находятся в группе повышенного риска по рождение мертвых младенцев, младенческой смертности и других заболеваний плода, но эта опасность много ниже, чем у женщин с преэклампсией. У женщин с латентной идиопатической гипертензивностью также может впоследствии развиться хроническая гипертензивность.
Эффективность скрининговых тестов на преэклампсию.
Постановка тестов на преэклампсию сложна из-за отсутствия «золотого стандарта» для подтверждения диагноза. Клубочковый эндотелиоз — почечная характеристика преэклампсии — присутствует только у 54% пациентов, проявлявших клинические симптомы заболевания. Кроме того, клубочковые поражения не специфичны именно для этого заболевания и могут проявляться и при других заболеваниях, таких, как обрыв плаценты и хроническая почечная недостаточность. Для практического применения большинство исследований потенциальных анализов на преэклампсию предлагают использовать клинические симптомы.
Большинство предлагающихся скрининговых тестов на преэклампсию не применимы для раннего обнаружения преэклампсии. Наличие водянки или протеинурии не является надежным, так как водянка часто встречается при нормальных беременностях. Измеримая протеинурия часто возникает в конце течения болезни и не может быть использована для раннего обнаружения. В одном из исследований, охватывавшем женщин между 24 и 34 неделями беременности, определение концентрации альбумина в моче больше или равной 11 мкг/мл, имело 50% чувствительность предсказания последующей преэклампсии. Другой тест на протеинурию — 24-часовой сбор анализа мочи, неудобен для тестирования. Другие предлагаемые тесты включают введение ангиотензина II и вазопрессорный тест, проводимый на спине, но они также не являются приемлемыми.
Наиболее распространенным тестом на преэклампсию является измерение кровяного давления, хотя при этом возникает ряд проблем при использовании для предсказаний значений кровяного давления. Существуют постоянные источники ошибок, связанные с недостатками постановки опыта или экспериментальной техники. Кроме того, положение тела тоже может существенно влиять на измерение кровяного давления, результаты могут быть также неточными, если женщина лежит на спине. Более важным является то, что единичное повышение кровяного давления не подтверждает наличие преэклампсии. Динамика развития кровяного давления является более важной, чем одно изолированное измерение.
Как было замечено выше, обычно критерием наличия преэклампсии является кровяное давление больше, чем 140/90 или превышение диастолического давления на 15 мм рт. ст. или систолического на 30 мм рт. ст. выше обычного. Последний критерий требует по меньшей мере двух повышенных измерений, что увеличивает ошибку эксперимента, и имеет ограниченную чувствительность (21 —52% и 7—23% для диастолического и систолического критериев соответственно). Более целесообразной представляется комбинация этих критериев.
Во втором триместре у женщин с преэклампсией отсутствует тенденция к возвращению кровяного давления на нормальный уровень. Обнаружение этого или увеличение кровяного давления может быть ранним симптомом преэклампсии. Некоторые специалисты рекомендуют использовать во втором триместре так называемое приведенное артериальное давление — ПАД — равное : (систолическое давление + [2х(диастолическое давление])/3 в качестве скринингового теста. Исследования показывают, что превышение ПАД во втором триместре 90 мм рт. ст. имеет чувствительность 61—71% и специфичность 62—74% и даже выше. Последние исследования предполагали, что чувствительность этого теста намного ниже (29—35%). В одном из обзоров заключается, что ПАД является более точным датчиком гипертензивности, чем, собственно, преэклампсии.
Профилактика преэклампсии
Гипертензивные расстройства беременных — одна из главных причин материнской и младенческой смертности и возникновения перинатальной патологии. Большинства неблагоприятных исходов можно избежать благодаря назначению своевременной и эффективной профилактики [1].
Уже более 30 лет не утихают споры вокруг профилактики преэклампсии с помощью аспирина — антиагреганта, широко использующегося для профилактики тромбозов. Стремление снизить риск развития тяжелых осложнений беременности всегда сопровождается страхом навредить матери и ребенку чрезмерным вмешательством. На сегодняшний день разработан ряд критериев стратификации риска преэклампсии, позволяющий отбирать кандидатов для профилактики и рекомендовать наиболее эффективную и безопасную для матери и плода тактику [2].
При нормальном течении беременности существует равновесие между тромбоксаном А2 (TXA2 — активатор тромбоцитов и вазоконстриктор) и эндотелиальными простациклинами (PGI2 — ингибитор тромбоцитов и вазодилататор). Это равновесие регулирует агрегацию тромбоцитов и периферическую вазореактивность во время беременности и поддерживает адекватный маточно-плацентарный кровоток [2].
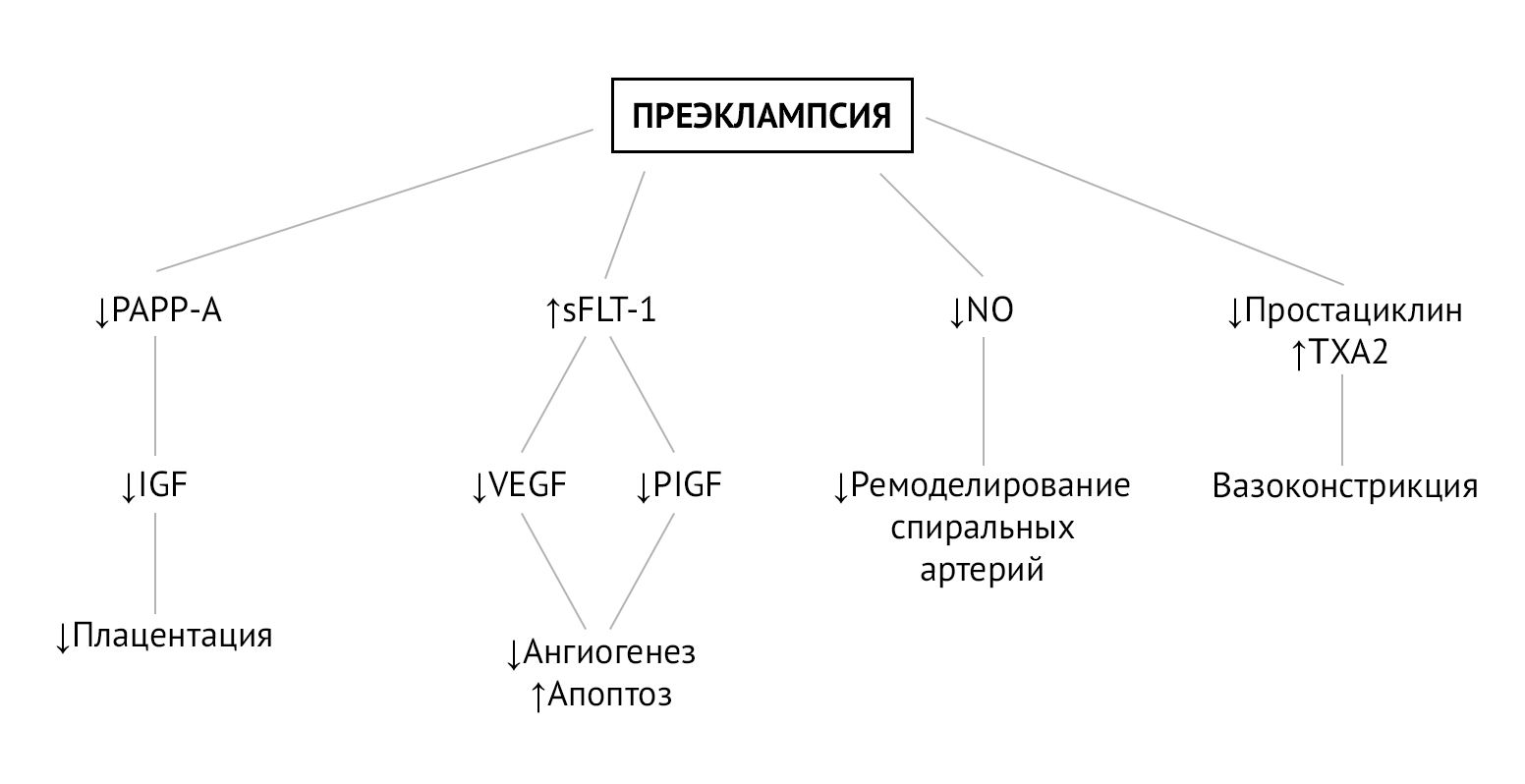
Преэклампсия — вторичное осложнение беременности по отношению к плацентарной дисфункции, которая развивается из-за нарушения ремоделирования спиральных артерий матки на этапе инвазии трофобласта. Постепенно гипоксия плаценты и оксидативный стресс приводят к генерализованной дисфункции ворсинчатого трофобласта, что в свою очередь провоцирует выброс в материнский кровоток факторов (свободных радикалов, продуктов перекисного окисления липидов, цитокинов, sFlt-1), вызывающих генерализованную эндотелиальную дисфункцию. Эндотелиальная дисфункция сопровождается повышенным перекисным окислением эндотелиальных липидов, что активирует ЦОГ и ингибирует простациклин-синтазу, тем самым вызывая быстрый дисбаланс в соотношении TXA2/простациклины (PGI2) в пользу TXA2. TXA2 способствует системной вазоконстрикции, слабо компенсируемой сосудорасширяющим действием простациклинов, уровень которых резко падает [2].
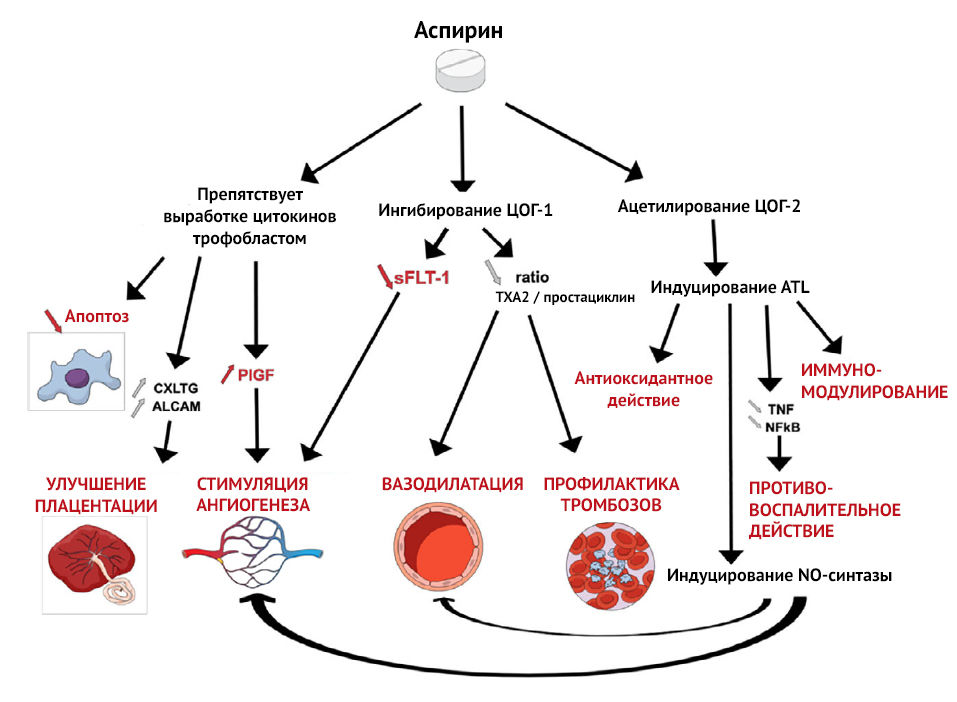
Этот дисбаланс наблюдается с 13 недель беременности у пациенток из группы высокого риска преэклампсии. Баланс TXA2/PGI2 можно восстановить помощью 2-недельного приема низких доз аспирина, который подавляет секрецию TXA2 и, следовательно, агрегацию тромбоцитов, без изменения секреции эндотелиального простациклина (PGI2), тем самым способствуя системной вазодилатации [2].
Рисунок 1 | Биомаркеры и патофизиология преэклампсии [3]
На плацентарную гемодинамику также оказывают влияние местные ангиогенные и антиангиогенные факторы. Один из них, Fms-подобная тирозинкиназа-1 (sFlt-1), представляет собой растворимую форму рецептора VEGF, который, связываясь с циркулирующим фактором роста плаценты (PlGF) и фактором роста эндотелия сосудов (VEGF), ведет себя как мощный антиангиогенный фактор. sFlt-1 определяется в больших количествах у пациенток с преэклампсией и ответственен за ангиогенный дисбаланс, наблюдаемый в патогенезе преэклампсии. В условиях гипоксии аспирин подавляет экспрессию sFlt-1 в трофобластах человека и, таким образом, проявляет проангиогенную активность [2].
Рисунок 2 | Механизм действия аспирина [3]
Оценка риска
Прежде всего стоит определиться с группами риска преэклампсии, коих выделяют три — «низкий», «средний» и «высокий риск».
К группе высокого риска, согласно рекомендациям NICE, относятся женщины, имеющие в анамнезе гипертензию во время предыдущей беременности или хроническую артериальную гипертензию, хронические заболевания почек, системную красную волчанку, антифосфолипидный синдром, сахарный диабет 1 или 2 типа.
К группе умеренного риска относятся женщины с 2 и более из следующих критериев: первобеременные, возраст 40 лет и старше, интервал между беременностями более 10 лет, ИМТ при первом посещении 35 кг\м2 и более, семейная история преэклампсии, многоплодная беременность [4].
На степень риска преэклампсии, по разным данным, также может влиять повышенное среднее артериальное давление до 15 недель беременности, синдром поликистозных яичников, нарушение дыхания во сне и различные инфекции. Что касается акушерского анамнеза, риск повышается в случае вагинального кровотечения во время беременности (продолжительностью не менее пяти дней) и при использовании донорских ооцитов [5].
Однако методы скрининга, основанные на материнском анамнезе, выявляют только 40 % случаев преэклампсии, которые потребуют родоразрешения до 37 недель беременности, что влечет за собой рождение недоношенных детей. В связи с этим разрабатываются системы расчета индивидуального риска преэклампсии с использованием дополнительных критериев [6].
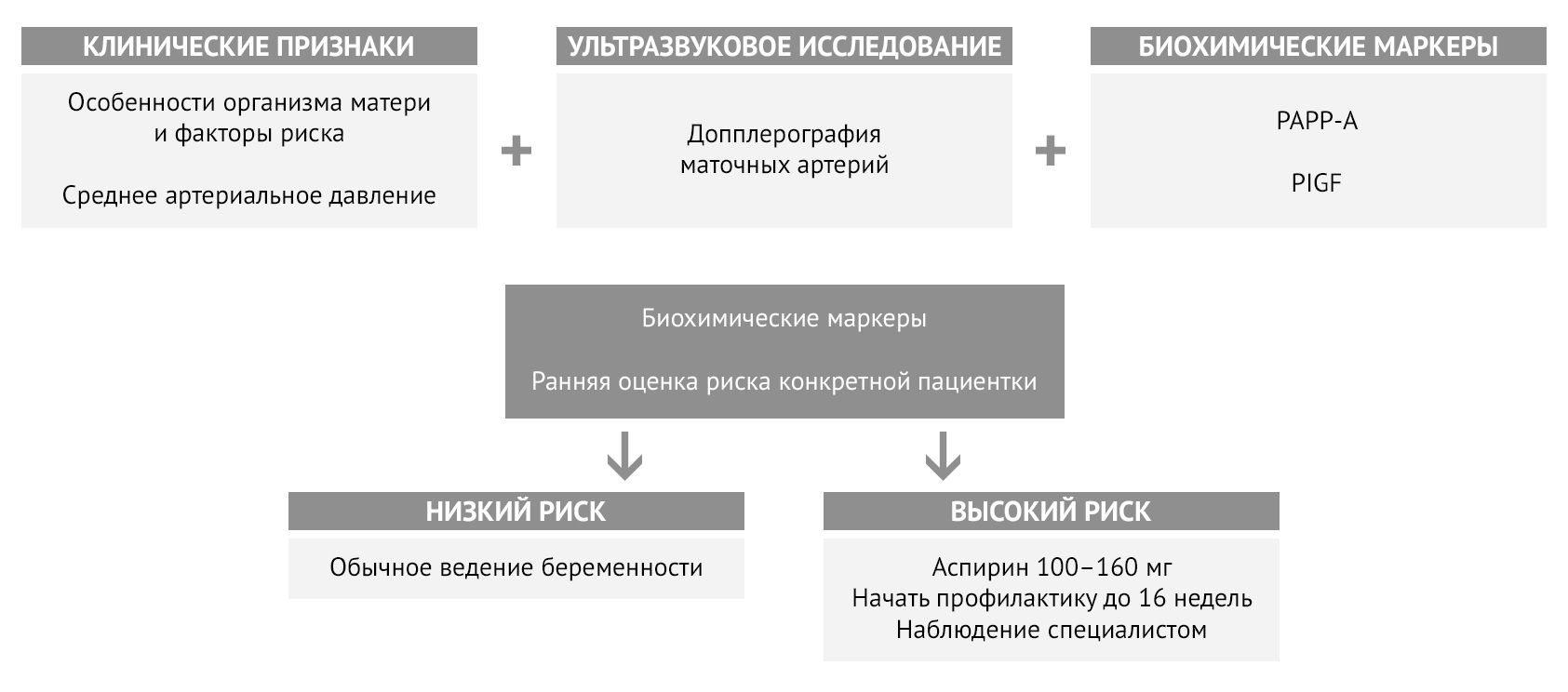
Ультразвуковое исследование дает информацию о состоянии маточно-плацентарного кровотока и плода. Для оценки риска преэклампсии чаще всего используется допплерография маточных артерий с оценкой характера кровотока. Оценка кровотока в пупочной артерии также может выявить предикторы развития ПЭ. Параллельно оценивается состояние плода на предмет гипоксии и задержки развития, а также состояние плаценты и ее кровотока [5, 6, 7].
Среди биохимических маркеров преэклампсии для стратификации риска наиболее широко используется соотношение двух маркеров — фактора роста плаценты (PlGF) и sFlt-1. У женщин с преэклампсией наблюдается более высокий уровень циркулирующего sFlt-1 и более низкий уровень PlGF, что заметно и до начала заболевания [5]. Уровень ассоциированного с беременностью плазменного протеина А (РАРР-А) также используется для расчета риска: клинически значимым будет являться снижение концентрации ниже 0,4 MоM [8]. Мета-анализы описывают потенциальную связь между преэклампсией и повышенными уровнями триглицеридов, холестерина и воспалительных маркеров в сыворотке, включая C-реактивный белок, IL-6, IL-8 и ФНОα [5].
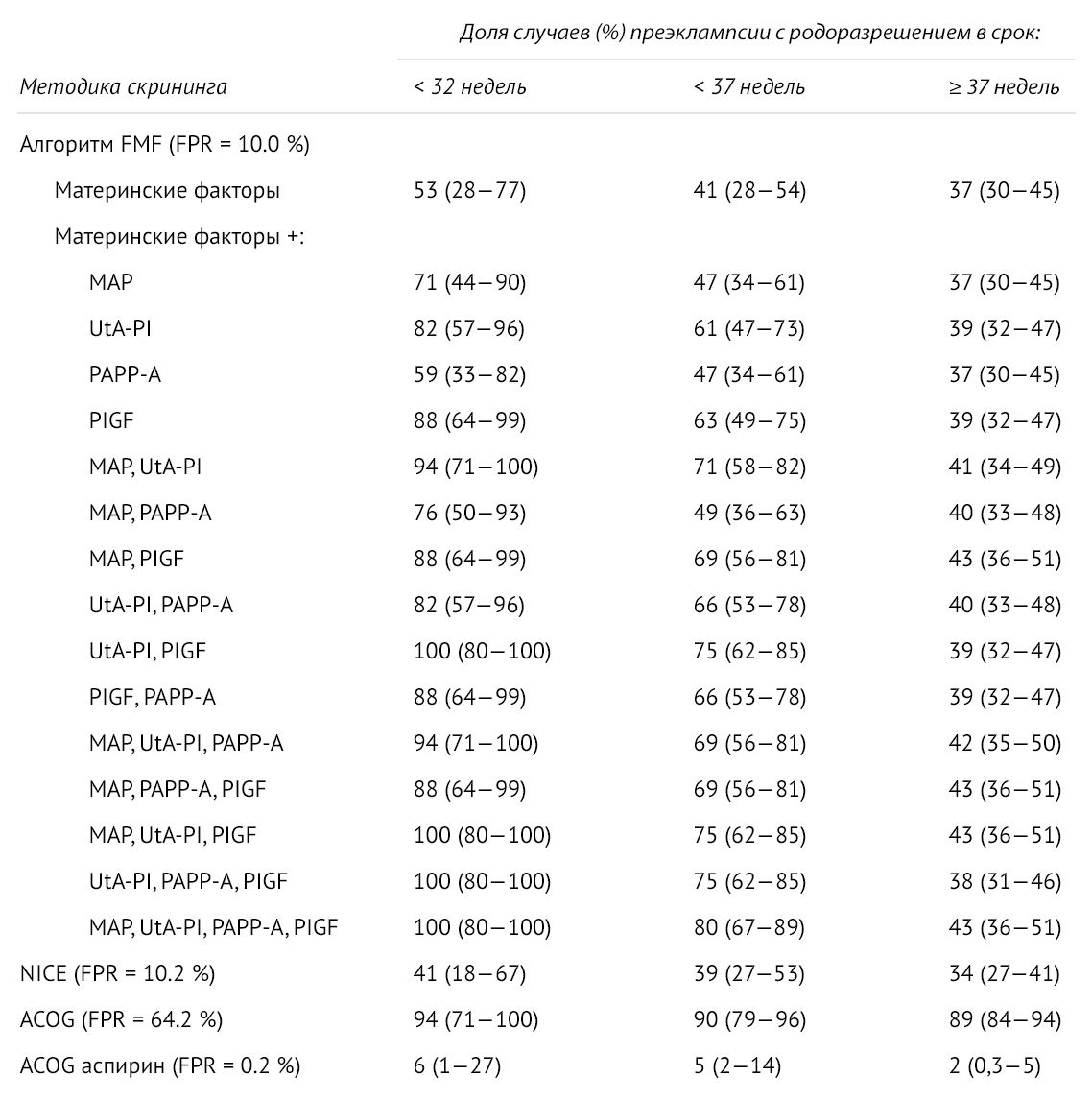
FMF (The Fetal Medicine Foundation) для оценки индивидуального риска преэклампсии предложила комбинировать материнские факторы с показателями среднего артериального давления, индексом пульсации маточной артерии, PAPP-A и PlGF [6, 9].
Рисунок 3 | Частота выявления преэклампсии в сроке до 32 недель, до 37 недели, после 37 недели при использовании алгоритмов скрининга FMF, NICE, ACOG и при профилактическом приеме аспирина [9]
Рисунок 4 | Алгоритм определения индивидуального риска преэклампсии и необходимости профилактики
В 2017 году было проведено исследование ASPRE — комбинированный мультимаркерный скрининг и рандомизированное лечение пациентов аспирином, по результатам которого сделано два важных вывода:
Выбор дозировки
Согласно отечественным рекомендациям, аспирин назначается всем пациенткам из группы высокого и умеренного риска после 12 недели беременности и принимается ежедневно вплоть до 36 недели. Дозировка — от 75 до 150 мг в сутки [11].
Все больше исследователей склоняется к тому, что наиболее эффективным является назначение аспирина до 16 недель беременности, а оптимальной дозой — ≥ 100 мг/сут [3, 6, 10, 12].
Раннее начало приема аспирина значительно снижает нежелательные явления у матери и новорожденного. Наиболее вероятное объяснение этих результатов заключается в том, что раннее введение низких доз аспирина улучшает раннее формирование и развитие плаценты [12].
Побочные эффекты
Побочные эффекты, такие как незначительное вагинальное кровотечение и желудочно-кишечные симптомы, наблюдаются примерно у 10 % пациентов. Доказательств повышенного риска серьезного материнского кровотечения или преждевременной отслойки плаценты на данный момент нет [6].
Лечение аспирином приводит к снижению агрегации тромбоцитов плода и, следовательно, к теоретическому риску внутриутробного церебрального кровоизлияния. Этот риск невелик, но число случаев таких побочных эффектов может возрасти при широком назначении аспирина беременным женщинам. Поскольку лечение аспирином следует прекратить примерно на 36 неделе беременности, в зоне риска оказываются дети, рожденные раньше этого срока, следовательно, аспирин может увеличить риск кровотечений, связанных с недоношенностью. Тератогенность, связанная с аспирином, касается только пациенток, получающих дозы от 650 до 2600 мг/сут в связи с заболеваниями сердечно-сосудистой системы. Тератогенного эффекта при приеме аспирина в низких дозах выявлено не было. Негативного влияния на риск развития преждевременных родов и рост плода также не определено, напротив, улучшение маточно-плацентарного кровотока способствует более продолжительной беременности и лучшим показателям роста плода [2].
Диагностика и оценка риска развития преэклампсии (sFlt-1/PlGF)
Расчет соотношения концентраций растворимой фмс-подобной тирозинкиназы-1 (sFlt-1) и плацентарного фактора роста (PlGF), которое используется для оценки риска развития и степени тяжести преэклампсии.
Растворимая фмс-подобная тирозинкиназа-1 / Плацентарный фактор роста.
Solublefms-like tyrosinekinase-1 / Placental Growth Factor.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Диагноз «преэклампсия» чаще всего ставится на основании достаточно неспецифических симптомов и признаков, главным образом – гипертензии и протеинурии. Следует, однако, отметить, что анализы на белок в моче могут быть неточными, и что осложнения преэклампсии часто возникают до того, как протеинурия становится выраженной. Кроме того, клиническая картина преэклампсии может значительно варьировать от мягкой поздней формы до тяжелой и быстро прогрессирующей ранней преэклампсии, требующей немедленного родоразрешения. Эти особенности свидетельствуют о том, что «классическое» определение преэклампсии (гипертензия более 140/90 мм рт. ст. и протеинурия 0,3 г в суточной моче) не достаточно для того, чтобы полностью охватить все компоненты этого синдрома. Учитывая это, последние рекомендации допускают диагностику преэклампсии на основании гипертензии и признаков нарушения функции органов беременной женщины, а не протеинурии. Также большое внимание уделяется новым методам диагностики и оценки риска преэклапсии. Одним из таких методов является соотношение sFlt-1/PlGF.
sFlt-1/PlGF – это соотношение концентраций в крови двух белков: растворимой fms-подобной тирозинкиназы-1 (sFlt) и плацентарного фактора роста (PlGF). Оба белка вырабатываются плацентой. PlGF обладает ангиогенными свойствами. Считается, что он необходим для нормального развития сосудистой системы плаценты. В норме концентрация PlGF постепенно возрастает к 30 неделе беременности. sFlt обладает антиангиогенными свойствами. Считается, что он связывает и нейтрализует PlGF и другие ангиогенные факторы. При нормально протекающей беременности уровень sFlt-1 остается стабильно низким вплоть до 33-36 недели беременности, после чего он незначительно возрастает вплоть до родов. При преэклампсии наблюдают обратные изменения: снижение концентрации PlGF и увеличение концентрации sFlt-1. Вероятно, изменение соотношения sFlt-1/PlGF является одной из причин развития преэклампсии. С практической точки зрения, это соотношение исследуют для оценки риска развития и степени тяжести этого заболевания.
Применение соотношения sFlt-1/PlGF у женщин с симптомами и признаками, подозрительными на преэклампсию:
В эту группу пациентов относятся женщины, у которых преэклампсия подозревается на основании таких признаков, как нарушение зрения, снижение количества тромбоцитов и других, но отсутствуют классические критерии заболевания «гипертензии плюс протеинурия».
Такие женщины должны быть госпитализированы и находиться под очень тщательным наблюдением. Очень высокое значение соотношения sFlt-1/PlGF>655 (при ранней форме) или >201(при поздней форме) ассоциировано с необходимостью родоразрешить в течение следующих 48 часов.
Повторное исследование соотношенияsFlt-1/PlGF через 2-4 дня может помочь оценить степень риска развития преэклампсии. У женщин с относительно стабильным результатом при повторном анализе вероятность быстрого ухудшения состояния пациентки маленькая. В этом случае, тест может быть повторен еще раз через 2 недели. С другой стороны, если при повторном анализе соотношениеsFlt-1/PlGF нарастает, это указывает на прогрессирование состояния.
Применение соотношения sFlt-1/PlGF у бессимптомных женщин из группы высокого риска развития преэклампсии:
В эту группу относятся женщины с факторами риска преэклампсии (ожирение, осложненный по преэклампсии семейный и личный анамнез, антифисфолипидный синдром, инсулинзависимый сахарный диабет, многоплодная беременность, отсутствие родов в анамнезе, артериальная гипертензия до беременности, болезнь почек до беременности) и женщины с нарушениями маточно-плацентарного кровотока по данным допплеровского исследования.
Исследование проводят на 24-26 неделе беременности. У пациенток с нормальным результатом соотношения sFlt-1/PlGF диагноз «преэклампсия» исключен, по крайней мере в течение 1 недели, но не на протяжении всей беременности. В этой группе может быть показано повторное исследование. Напротив, у пациенток с высоким значением sFlt-1/PlGF подозревается преэклампсия, и они должны быть направлены под более тщательное наблюдение.
Применение соотношения sFlt-1/PlGF у женщин подтвержденным диагнозом преэклампсии:
У женщин с подтвержденным диагнозом преэклампсии (гипертензии и протеинурия) соотношение sFlt-1/PlGF не добавляет никакой новой диагностической информации, но может быть использовано для оценки прогноза: более высокое значение sFlt-1/PlGF говорят о тяжелой степени заболевания.
Необходимо помнить следующие ограничения применения соотношения sFlt-1/PlGF:
Результаты анализа интерпретируют с учетом всех значимых анамнестических, клинических, других лабораторных и инструментальных данных.
Для чего используется анализ?
Когда назначается анализ?
Что означают результаты?
Референсные значения: менее 38.
Соотношение sFlt-1/PlGF:
Риск преэклампсии
Что может влиять на результат?
Кто назначает исследование?
Акушер-гинеколог, врач общей практики.
Литература
Подписка на новости
Оставьте ваш E-mail и получайте новости, а также эксклюзивные предложения от лаборатории KDLmed
Расшифровка результатов 1 скрининга при беременности
Комбинированный пренатальный скрининг проводится на 11-14 неделе беременности при размере эмбриона не менее 45 мм и не более 84 мм. Это комплексное обследование плода для оценки параметров его развития. Основная его задача – раннее выявление пороков развития плода, профилактика детской инвалидности, снижение младенческой и детской смертности.
Первый скрининг состоит из инструментальной части – проведение УЗИ и лабораторной – анализ крови на определение концентрации хорионического гонадотропина (βХГЧ) и ассоциированного с беременностью протеина А (РАРР-А). Совокупные результаты этих показателей позволяют спланировать тактику ведения беременности.
Почему обследование проводится на сроке 11-14 недель
Первый триместр – это период формирования всех органов и структур организма. К концу первого триместра заканчивается эмбриональный и начинается фетальный период развития плода. Именно в сроке от 11 недель 1 дня до 13 недель 6 дней беременности наиболее хорошо визуализируются эхографические маркеры хромосомных аномалий.
Кому нужно пройти обследование
По результатам исследования можно судить о риске рождения детей с хромосомными болезнями и врожденными пороками развития, поэтому рекомендуется внимательно отнестись к вопросу и обследоваться всем беременным. Показаниями к обязательному пренатальному скринингу первого триместра являются:
Как подготовиться
Подготовка к первому скринингу выражается в щадящей диете. Погрешности питания могут сказаться на общем состоянии женщины и снизить точность результатов. За неделю до обследования:
За сутки до скрининга:
Желательно соблюдать умеренную физическую активность, если для этого нет противопоказаний. Также важны прогулки, полноценный отдых.
Проведение обследования
Анализ крови и УЗИ выполняются в один день, чтобы избежать погрешностей из-за разницы срока.
Только по расшифровке результатов УЗИ и анализа на гормоны делается вывод о возможных рисках.
Что показывает УЗИ
На скрининге при беременности производится фетометрия плода – определение размеров частей тела и оцениваются все анатомические структуры.
Полученные результаты сравниваются со статистической таблицей, в которой указан процентиль попадания в выборку нормативных значений. При показателях менее 5 и более 95 назначаются дополнительные обследования.
Во время ультразвукового исследования в 1 триместре оценивают следующие параметры: кости свода черепа и головной мозг, позвоночник, передняя брюшная стенка, конечности плода, структуры лица, органы грудной клетки и брюшной полости, а также основные эхографические маркеры хромосомных аномалий.
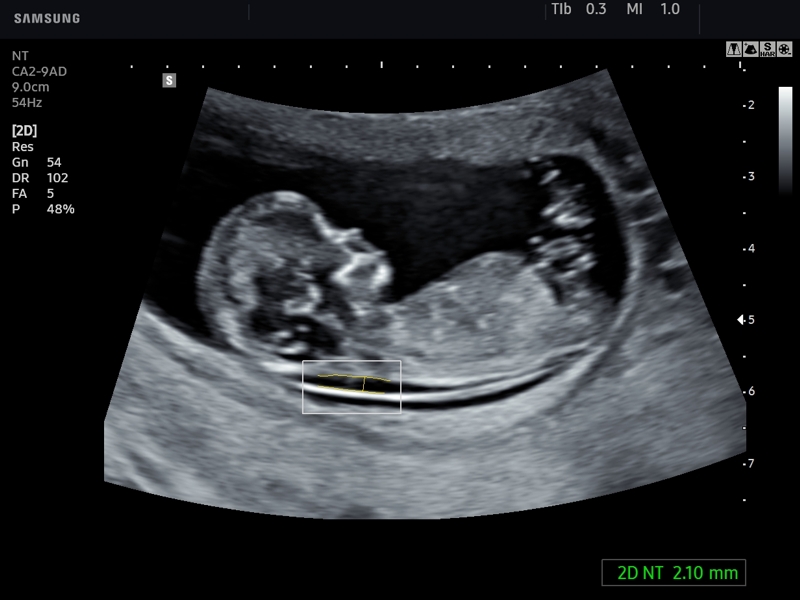
Толщина воротникового пространства (ТВП)
Область между внутренней поверхностью кожи плода и наружной поверхностью мягких тканей, покрывающих шейный отдел позвоночника. ТВП считается наиболее важным маркером хромосомных аномалий.
Это пространство после 13 недели начинает уменьшаться, поэтому возможность его оценить есть только на первом скрининге.
| Срок | Толщина воротниковой зоны в мм | ||
| Процентиль 5 | Процентиль 50 | Процентиль 95 | |
| 11 недель | 0,8 | 1,6 | 2,4 |
| 12 недель | 0,7 | 1,6 | 2,5 |
| 13 недель | 0,7 | 1,7 | 2,7 |
Несоответствие результатов нормативным значениям говорит о повышенном риске развития хромосомных патологий. В зависимости от сформировавшегося набора хромосом, это могут быть синдром Дауна, Патау, Эдвардса, Шерешевского-Тернера. Для уточнения диагноза в этом случае могут быть назначены биопсия хориона или плаценты, анализ пуповинной крови, околоплодных вод. Только после проведения дополнительных исследований можно поставить точный диагноз.
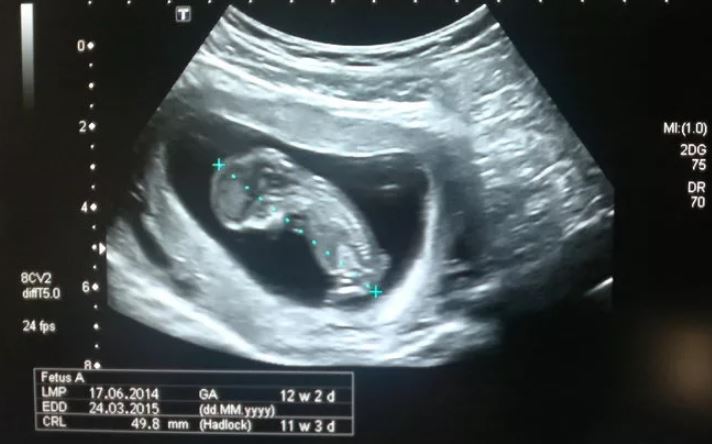
Копчико-теменной размер (КТР)
Показывает расстояние между копчиковой и теменной костями. По этому параметру на УЗИ определяют точный срок гестации, а также устанавливают соотношение массы плода к его КТР.
Незначительное отклонение от норм говорит об особенностях телосложения и не является поводом для беспокойства.
| Срок | Копчико-теменной размер в мм | ||
| Процентиль 5 | Процентиль 50 | Процентиль 95 | |
| 11 недель | 34 | 42 | 50 |
| 12 недель | 42 | 51 | 59 |
| 13 недель | 51 | 63 | 75 |
Если скрининг при беременности показал результаты, превышающие нормы, это указывает, что плод достаточно крупный. Показатель существенно меньше говорит либо о неправильно определенном сроке гестации (в этом случае проводится повторное обследование через 1-1,5 недели), либо о замедлении развития вследствие внутриутробной гибели, нарушенного гормонального фона или инфекционного заболевания матери, генетических отклонений.
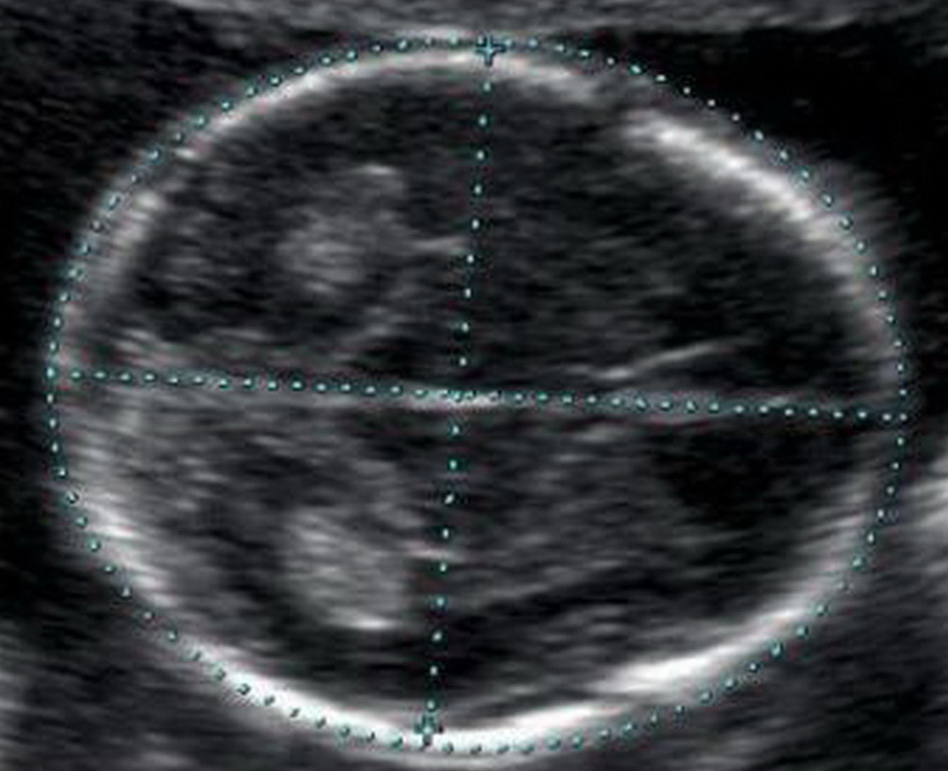
Кости свода черепа и головной мозг
Уже с 11 недели при УЗ-исследовании можно обнаружить дефекты костей черепа, что говорит о тяжелых пороках развития плода, несовместимых с жизнью. Оценка головного мозга основана на изучении так называемой «бабочки» – сосудистых сплетений боковых желудочков. Четкая визуализация и ее симметричность говорит о нормальном развитии головного мозга.
| Срок | БПР, ЛЗР в мм | ||
| Процентиль 5 | Процентиль 50 | Процентиль 95 | |
| 11 недель | 13, 19 | 17, 21 | 21, 23 |
| 12 недель | 18, 22 | 21, 24 | 24, 26 |
| 13 недель | 20, 26 | 24, 29 | 28, 32 |
Носовая кость
К концу триместра она должна быть сформирована, четко визуализироваться.
| Срок | Носовая кость в мм | ||
| Процентиль 5 | Процентиль 50 | Процентиль 95 | |
| 11 недель | визуализируется, не измеряется | визуализируется, не измеряется | визуализируется, не измеряется |
| 12 недель | 2 | 3,1 | 4,2 |
| 13 недель | 2 | 3,1 | 4,2 |
Патологией носовой кости считается ее отсутствие, гипоплазия (очень маленькие размеры) и изменение ее эхогенности.
Диаметр грудной клетки, окружность головы и живота, длина бедренной кости также позволяют судить о пропорциональности развития.
Состояние сердца
При исследовании сердца оценивается его расположение, устанавливается наличие четырех камер сердца – два предсердия и два желудочка и оценивается их симметричность. Измеряется частота сердечных сокращений.
| Срок | Частота сердечных сокращений в ударах за минуту | ||
| Процентиль 5 | Процентиль 50 | Процентиль 95 | |
| 11 недель | 153 | 165 | 177 |
| 12 недель | 150 | 162 | 174 |
| 13 недель | 147 | 159 | 171 |
Венозный проток (ВП) – прямая коммуникация между пупочной веной и центральной венозной системой. При нормально развивающейся беременности кровоток в ВП представляет собой трехфазную кривую. Появление реверсного кровотока может говорить о наличии патологии плода.
Что показывает анализ крови
Результаты УЗИ сопоставляются с показателями ассоциированного с беременностью протеина А из плазмы матери (PAPP-A) и хорионическим гонадотропином человека (ХГЧ). Значения приведены в таблице:
| Срок | ХГЧ в нг/мл | PAPP-A в мЕд/л |
| 11 недель | 17,4 – 130,4 | 0,46 – 3,73 |
| 12 недель | 13,4 – 128,5 | 0,79 – 4,76 |
| 13 недель | 14,2 – 114,7 | 1,03 – 6,01 |
Отличия от референсных значений может говорить о патологиях матери или плода.
Интерпретация обследования
Первое исследование оценивается только по совокупности всех показателей. Отдельно взятый параметр не может стать основанием для точного заключения. В протоколе фиксируются данные УЗИ, анализа на гормоны, отражаются риски вероятных заболеваний и комплексный медианный коэффициент MoM. Он указывает совокупное отклонение полученных результатов от средних значений. Коэффициент должен находиться в интервале от 0,5 до 2,5. Рассчитывается он специализированными программами.
Что может повлиять на результат
Современное диагностическое оборудование позволяет оценить более 15 параметров плода, построить его объемную реконструкцию для исследования органов на ранних периодах развития, рассчитать возможные риски с высокой точностью. Обращайтесь в хорошо оснащенные клиники и доверяйте специалистам с подтвержденной квалификацией.