Генерализация процесса в онкологии что это такое и последствия
Саркомы мягких тканей – редкое заболевание, которое составляет 1% от всех случаев рака в мире. Они характеризуются высоким риском рецидива – по разным данным от 25 до 60%. Чаще всего причиной гибели пациентов с этим диагнозом становится генерализация опухолевого процесса, то есть его распространение и метастазирование.
Главным методом лечения сарком мягких тканей остается хирургическое вмешательство. В то же время по данным международных рандомизированных исследований лучевая терапия снижает частоту возникновения рецидивов.
На данный момент в клинической практике применяются два варианта лучевой терапии для таких пациентов – до операции и после. Для врачей по всему миру остается открытым вопрос планирования облучения – в каком случае терапию лучше провести до хирургического вмешательства, а в каком – после? Оба метода имеют свои преимущества и недостатки.
Так, предоперационная терапия снижает биологическую агрессивность опухоли и ее размеры. Предоперационное облучение также характеризуется высокой точностью доставки дозы и может способствовать запуску естественного иммунного ответа организма человека. Главный недостаток такого метода – значительное увеличение послеоперационных осложнений, которые связаны с облучением здоровых тканей вокруг опухоли. Послеоперационная лучевая терапия, которая направлена на опухолевое ложе и окружающие ткани, снижает риски рецидива и метастазирования.
Сочетание этих двух видов облучения позволило бы использовать преимущества обоих методов. Однако, если выполнять такое лечение в стандартных объемах, указанных в клинических рекомендациях, пациент получит непереносимо высокую лучевую нагрузку.
— Мы встаём перед выбором – либо проводить предоперационную лучевую терапию, рассчитывая на её иммунологические феномены, и на то, что она уменьшит размеры опухоли; либо проводить послеоперационную лучевую терапию, которая защитит от рецидивов.
Наш научный коллектив решил изучить возможность комбинированного подхода, чтобы пациент получал одновременно плюсы и предоперационного облучения и послеоперационной лучевой терапии, — разъяснил Сергей Николаевич Новиков, д.м.н., заведующий отделением радиотерапии, заведующий научным отделением радиационной онкологии и ядерной медицины НМИЦ онкологии им. Н.Н. Петрова, руководитель исследования.
В 2017 году группа ученых отделения радиотерапии и хирургического отделения опухолей костей, мягких тканей и кожи Центра онкологии им. Н.Н. Петрова начала работать над научным исследованием, целью которого было проанализировать целесообразность и безопасность комбинации пред- и послеоперационной лучевой терапии у пациентов с саркомами мягких тканей конечностей.
Чтобы реализовать научный эксперимент, ученые разработали протокол лечения, рассчитали допустимые дозы облучения и выбрали методы облучения пациентов. Опираясь на опыт коллег, в качестве предоперационного лечения врачи выбрали стереотаксическую абляционную лучевую терапию, которая должна проводиться исключительно в пределах опухолевых тканей и места операции. Этот метод позволяет снизить риск послеоперационных осложнений на здоровых тканях, сделать более четкими границы опухоли, что важно во время проведения операции, запустить иммунный ответ организма и снизить риск метастазирования.
Лечение по разработанному протоколу в рамках исследования прошли 14 пациентов с диагнозом саркома мягких тканей. Они получили предоперационную стереотаксическую лучевую терапию, хирургическую операцию, а также стандартное послеоперационное облучение. Каждый больной наблюдался в послеоперационном периоде от 13 до 30 месяцев. В это время лишь в двух случаях (14%) были зафиксированы тяжелые осложнения, при этом ни у кого из пациентов не было зафиксировано рецидива заболевания. В 2020 году ученые провели промежуточный анализ результатов научной работы.
— Мы достигли главной цели исследования – убедились в технической возможности проведения предоперационной и послеоперационной лучевой терапии, а также доказали, что данный подход не приведёт к увеличению осложнений и он безопасен для больных, — разъяснил Сергей Николаевич Новиков. – В какой-то степени это новый подход, который позволяет существенно расширить список задач, которые мы сможем решать с помощью лучевой терапии. Мы рассматриваем его как модель, которую можно будет внедрить и при лечении других онкологических заболеваний, например, рака легкого.
Промежуточные результаты первой в мире научной работы о возможности и безопасности сочетания пред- и послеоперационной лучевой терапии опубликованы в мае 2021 года в журнале Radiotherapy and Oncology.
Ознакомиться с текстом научной статьи можно зде сь
Работа над новым протоколом продолжается.
Способ лечения генерализованных опухолевых процессов
Изобретение относится к медицине, а именно к онкологии, и может быть использовано при лечении рака различных локализаций на стадии генерализации с метастатированием в печень, легкие, кости, лимфатические узлы, при резистентности к химиотерапии или невозможности ее проведения из-за стойкой лейкопении или тяжелого общего состояния.
Известен способ лечения генерализованных опухолевых процессов при невозможности химиотерапии в чистом виде с использованием натриевой соли нативной дезоксирибонуклеиновой кислоты (ДНК). (См. заявку на патент РФ 93002773, «Способ лечения нарушений гемопоэза», 1993 г.).
Однако этот способ может рассматриваться только как поддерживающая терапия.
Известен способ лечения генерализованных опухолевых процессов путем проведения курса инъекций противоопухолевых антибиотиков антрациклинового ряда в комплексе с натриевой солью нативной ДНК (см. патент РФ 2007165, «Способ лечения злокачественных новообразований», 1993 г.). В указанном способе комплекс препаратов вводится внутримышечно, однако при введении внутримышечно или подкожно он может вызывать некробиотические процессы в месте введения (до 30% случаев).
Известен способ лечения генерализованных опухолевых процессов путем введения комплекса антрациклинового антибиотика и натриевой соли ДНК с предварительным созданием конъюгата с белками крови. При этом снижается некробиотический эффект в месте введения комплекса (до 5% случаев), транспортирование противоопухолевого препарата из депо к опухолевым клеткам происходит в неактивной для здоровых тканей форме (см. патент РФ 2155590 «Способ лечения генерализованных опухолевых процессов», заявл. 20.06.1996 г., опубл. 10.09.2000 г.).
Однако известный комплекс не обладает необходимой избирательностью к клеткам генерализованных опухолей рака желудка и рака толстой кишки. Возможно развитие резистентности к антрациклиновым антибиотикам.
Известен способ лечения рака путем последовательного введения внутривенно лейковорина и 5-фторурацила с целью увеличения эффективного времени воздействия препарата на опухоль. Лейковорин используется как биохимический модулятор фторпроизводных пиримидина (см. Химиотерапия опухолевых заболеваний. Краткое руководство. Под редакцией Н.И. Переводчиковой. Москва, 2000, с.82, 121). Способ лечения выбран за прототип.
Основной задачей при лечении генерализованных опухолевых процессов является повышение избирательности к клеткам, увеличение времени контакта 5-фторурацила (цитостатика) с клеткой-мишенью при минимальном воздействии его на здоровые ткани и при упрощении способа введения цитостатика.
Целью настоящего изобретения является изменение транспортирования 5-фторурацила, избирательно действующего на опухолевые клетки желудочно-кишечного тракта, сохранение концентрации цитостатика в опухолевой ткани.
Введение подкожно или внутримышечно предварительно приготовленной смеси, состоящей из 5-фторурацила и натриевой соли ДНК, позволяет использовать наиболее удобную форму введения цитостатика в неактивном виде в мышцу, нейтрализуя местный некробиотический эффект 5-фторурацила.
Смесь, состоящая одновременно из цитостатика и лейкостимулятора, позволяет предупредить цитопенические осложнения при проводимом лечении.
Наблюдения за больными показали, что данный подход является сопоставимым по лечебному эффекту с признанным «стандартным» сочетанием 5-фторурацила и лейковорина.
Конкретные примеры использования предлагаемого изобретения.
В ноябре 1999 назначен 1 курс профилактической химиотерапии 5-фторурацилом с лейковорином в суммарной дозе 5-фторурацила 4 г. На фоне лечения, осложнившегося герпесом, геморрагическим дерматитом, стоматитом, агранулоцитозом до 1800 лейкоцитов, выявлен вторичный очаг в правой доле печени 3-3 см.
С января 2000 года по июнь 2000 года проведено 3 курса химиотерапии по предложенному способу с введением 5-фторурацила внутримышечно, пролонгирование в суммарной дозе 4 г каждый.
Паллиативная химиотерапия 5-фторурацилом в дозе 4 г привела к осложнениям в виде анемии 85 г/л и лейкопении 2500, стоматиту и диарее.
При восстановлении лейкоцитов до 3000 больной было продолжено лечение по предложенному способу с внутримышечным еженедельным введением смеси 5-фторурацила и натриевой соли ДНК в дозах 500 мг и 75 мг соответственно.
2. Способ по п. 1, отличающийся тем, что в качестве натриевой соли ДНК используют деринат.
Генерализация процесса в онкологии что это такое и последствия
Должен ли я всегда проходить лечение в больнице?
Большинство лучевых терапий сегодня не требуют пребывания в стационарном отделении клиники. Пациент может ночевать дома и приходить в клинику амбулаторно, исключительно для проведения самого лечения. Исключением являются те виды лучевой терапии, которые требуют настолько масштабной подготовки, что идти домой просто не имеет смысла. То же касается и лечения, при котором необходимо хирургическое вмешательство, например, брахитерапия, при которой проводится облучение изнутри.
При некоторых сложных комбинированных химиолучевых терапиях также целесообразно оставаться в клинике.
Кроме того, возможны исключения при решении о возможном амбулаторном лечении, если общее состояние пациента не позволяет проводить лечение в амбулаторном режиме или если врачи считают, что регулярное наблюдение будет более безопасным для пациента.
Какую нагрузку я могу переносить во время лучевой терапии?
В конечном итоге и психическая ситуация оказывает свое влияние. Лечение на протяжении нескольких недель резко прерывает привычный ритм жизни, повторяется снова и снова, и уже само по себе утомительно и обременительно.
В целом, даже у пациентов с одним и тем же заболеванием медики наблюдают большие различия – некоторые не испытывают практически никаких проблем, другие отчетливо ощущают себя больными, их состояние ограничивают такие побочные эффекты, как усталость, головные боли или отсутствие аппетита, им необходимо больше покоя. Многие пациенты в целом чувствуют себя как минимум настолько хорошо, что в ходе амбулаторного лечения они ограничены при выполнении несложных дел только в умеренной степени, или же вовсе не ощущают никаких ограничений.
Разрешены ли более высокие физические нагрузки, например, занятия спортом или небольшие путешествия в перерывах между курсами лечения, должен решать лечащий врач. Тот, кто в период облучения хочет вернуться на свое рабочее место, также должен в обязательном порядке обсудить этот вопрос с врачами и кассой медицинского страхования.
На что мне следует обратить внимание в вопросе питания?
Влияние облучения или радионуклидной терапии на питание сложно описать в целом. Пациенты, которые получают высокие дозы облучения в области рта, гортани или горла, находятся абсолютно в другой ситуации, чем, например, пациенты с раком молочной железы, у которых пищеварительный тракт совершенно не попадает в лучевое поле и в случае с которыми лечение, в основном, проводится с целью для закрепления успеха операции.
Пациенты, у которых пищеварительный тракт не затрагивается в ходе лечения, обычно могут не опасаться возникновения каких – либо последствий со стороны питания и пищеварения.
Они могут питаться в обычном режиме, при этом, им необходимо обращать внимание на потребление достаточного количества калорий и на сбалансированное сочетание продуктов питания.
Как необходимо питаться при облучении головы или пищеварительного тракта?
В наблюдении и поддержке нуждаются особенно те пациенты, которые еще до начала облучения не могли нормально питаться, потеряли в весе и/или обнаруживали определенные дефициты. Вопрос о том, необходимо ли пациенту поддерживающее питание («Питание для космонавтов») или введение питательного зонда, решается в зависимости от индивидуальной ситуации, лучше всего до начала лечения.
Пациенты, у которых развивается тошнота или рвота, ассоциирующаяся по времени с облучением, должны обязательно поговорить со своими врачами на тему медикаментов, которые подавляют тошноту.
Помогают ли комплементарные или альтернативные лекарственные препараты, витамины и минеральные вещества справиться с последствиями облучения?
Из страха перед побочными действиями многие пациенты обращаются к средствам, о которых говорят, что они якобы могут защитить от лучевого поражения и возникновения побочных эффектов. Что касается продуктов, о которых спрашивают пациенты в информационной службе по раковым заболеваниям, то здесь мы приведем так называемый «список самых популярных препаратов», включающий комплементарные и альтернативные методы, витамины, минеральные вещества и другие биологически активные добавки.
Однако, подавляющее большинство из этих предложений вовсе не являются лекарственными препаратами и они не играют никакой роли в лечении рака. В частности, в отношении некоторых витаминов ведутся дискуссии о том, не могут ли они даже оказать отрицательное влияние на действие облучения:
Предполагаемая защита от побочных эффектов, которую предлагают так называемые поглотители радикалов или антиоксиданты, такие как витамин А, С или Е, как минимум теоретически, могла бы нейтрализовать необходимый эффект ионизирующего излучения в опухолях. То есть, защищенной была бы не только здоровая ткань, но и раковые клетки.
Первые клинические испытания на пациентах с опухолями головы и шеи, по всей видимости, подтверждают это опасение.
Могу ли я предотвратить повреждение кожи и слизистой оболочки при помощи правильного ухода?
Первые симптомы реакции часто похожи на легкий солнечный ожог. Если же образуются более интенсивные покраснения или даже волдыри, то пациентам следует обратиться к врачу, даже если врачебный прием не был назначен. В долгосрочной перспективе облученная кожа может изменить пигментацию, то есть, стать либо немного темнее, либо светлее. Могут разрушаться потовые железы. Однако, на сегодняшний день тяжелые повреждения стали очень редкими.
Как должен выглядеть уход за зубами?
Для пациентов, которым должно проводиться облучение головы и/или шеи, уход за зубами представляет собой особую проблему. Слизистая оболочка относится к тканям, клетки которых очень быстро делятся, и она страдает от лечения больше, чем, например, кожа. Маленькие болезненные ранки являются достаточно частыми. Риск развития инфекций возрастает.
Если это вообще возможно, перед началом облучения необходимо проконсультироваться со стоматологом, возможно даже в стоматологической клинике, которая имеет опыт в подготовке пациентов к проведению лучевой терапии. Дефекты зубов, если они есть, следует устранить до начала лечения, однако, часто это невозможно осуществить вовремя по практическим причинам.
Во время облучения специалисты рекомендуют чистить зубы тщательно, но очень осторожно, чтобы уменьшить количество бактерий в полости рта, несмотря на возможно поврежденную слизистую оболочку. Чтобы защитить зубы многие радиологи совместно с лечащими стоматологами проводят профилактику фтором с применением гелей, которые используются как зубная паста или же в течение некоторого времени воздействуют непосредственно на зубы через каппу.
Будут ли у меня выпадать волосы?
Выпадение волос при облучении может возникнуть только в том случае, если покрытая волосами часть головы находится в лучевом поле, а доза излучения является относительно высокой. Это касается и волосяного покрова на теле, который попадает в лучевое поле. Таким образом, адъювантное облучение груди при раке молочной железы, например, не влияет на волосы головы, ресницы или брови. Только рост волос в подмышечной области с пораженной стороны, которая попадает в поле излучения, может стать более скудным. Тем не менее, если волосяные фолликулы действительно повреждены, то до того момента, пока снова не появится видимый рост волос, может пройти полгода и больше. Каким образом должен выглядеть уход за волосами в это время, необходимо обсудить с врачом. Важной является хорошая защита от солнечных лучей для кожи головы.
Некоторые пациенты после облучения головы вынуждены считаться с тем, что на протяжении некоторого времени рост волос непосредственно в месте попадания лучей будет скудным. При дозах выше 50 Грей специалисты в области лучевой терапии исходят из того, что не все волосяные луковицы смогут снова восстановиться. До настоящего времени не существует эффективных средств для борьбы или профилактики этой проблемы.
Буду ли я «радиоактивным»? Должен ли я держаться подальше от других людей?
Это необходимо уточнить
Спросите об этом Ваших врачей! Они объяснят Вам, будете ли Вы вообще контактировать с радиоактивными веществами. При обычном облучении этого не происходит. Если Вы все-таки будете контактировать с такими веществами, Вы и Ваша семья получите от врачей несколько рекомендаций по защите от излучения.
Этот вопрос беспокоит многих пациентов, а также их близких, прежде всего, если в семье есть маленькие дети или беременные.
При «нормальной» чрескожной лучевой терапии сам пациент все же не является радиоактивным! Лучи пронизывают его тело и там отдают свою энергию, которую поглощает опухоль. Радиоактивный материал не используется. Даже тесный физический контакт полностью безопасен для родственников и друзей.
При брахитерапии радиоактивный материал может оставаться в теле пациента в течение непродолжительного времени. Пока пациент «испускает лучи» он, как правило, остается в больнице. Когда врачи дают «зеленый свет» для выписки, опасности для семьи и посетителей больше нет.
Имеются ли отдаленные последствия, которые я должен принимать в расчет даже через несколько лет?
Лучевая терапия: у многих пациентов после облучения не остается никаких видимых изменений на коже или внутренних органах. Тем не менее, им необходимо знать, что облученная однажды ткань на длительное время остается более восприимчивой, даже если это не очень заметно в повседневной жизни. Однако, если учитывать повышенную чувствительность кожи при уходе за телом, при лечении возможных раздражений, возникших вследствие воздействия солнечных лучей, а также при механических нагрузках на ткань, то обычно мало что может случиться.
При проведении медицинских мероприятий в области бывшего поля облучения, при заборах крови, физиотерапии и т.д., ответственному специалисту необходимо указать на то, что ему следует соблюдать осторожность. В противном случае даже при незначительных повреждениях существует опасность, что при отсутствии профессиональной обработки процесс заживления будет протекать неправильно и образуется хроническая рана.
Поражение органов
Не только кожа, но и каждый орган, который получил слишком высокую дозу излучения, может реагировать на облучение изменением тканей.
Сюда относятся рубцовые изменения, при которых здоровая ткань замещается менее эластичной соединительной тканью (атрофия, склерозирование), а функция самой ткани или органа утрачивается.
Поражается также и кровоснабжение. Оно или является недостаточным, так как соединительная ткань хуже снабжается кровью через вены, или же образуются множественные маленькие и расширенные венки (телеангиэктазии). Железы и ткани слизистых оболочек после облучения становятся очень чувствительными и по причине рубцовой перестройки реагируют на мельчайшие изменения залипанием.
Какие органы поражаются?
Как правило, поражаются только те области, которые действительно находились в лучевом поле. Если орган поражается, то рубцовая перестройка, например, в слюнных железах, ротовой полости и других отделах пищеварительного тракта, во влагалище или в мочеполовом тракте, при определенных обстоятельствах фактически приводит к утрате функций или к образованию создающих препятствия сужений.
Головной мозг и нервы также могут поражаться высокими дозами излучения. Если матка, яичники, яички или предстательная железа находились в траектории лучей, то способность к зачатию детей может быть утрачена.
Возможно также повреждение сердца, например, у пациентов с раковыми заболеваниями, в случае с которыми при облучении грудной клетки не было возможности обойти сердце.
Из клинических и доклинических исследований радиологам известны специфические для конкретных тканей дозы облучения, при использовании которых можно ожидать появления подобных или других тяжелых повреждений. Поэтому они пытаются, насколько это возможно, избегать таких нагрузок. Новые техники прицельного облучения облегчили эту задачу.
Если нельзя добраться до опухоли, не облучая попутно чувствительный орган, то пациенты вместе со своими врачами, должны совместно обдумать соотношение пользы и риска.
Вторичные раковые заболевания
В самом неблагоприятном случае отсроченные последствия в здоровых клетках приводят также к возникновению спровоцированных облучением вторичных опухолей (вторичных карцином). Они объясняются стойкими изменениями генетического вещества. Здоровая клетка может устранить такие повреждения, но только до определенной степени. При определенных условиях они все-таки передаются дочерним клеткам. Возрастает риск, что при дальнейшем делении клеток появится еще больше повреждений и в итоге возникнет опухоль. В целом, риск после облучений является небольшим. Зачастую может пройти несколько десятков лет, прежде чем такая «ошибка» действительно возникнет. Однако, большинство всех облученных пациентов с раковыми заболеваниями заболевают уже во второй половине своей жизни. Это необходимо учитывать при сравнении возможных рисков и пользы от лечения.
Кроме того, нагрузка при новых методах облучения намного меньше, чем при тех методах, которые применялись еще пару десятилетий назад. Например, у молодых женщин, которые по причине лимфомы получили обширное облучение грудной клетки, то есть, так называемое облучение через магнитное поле вокруг оболочки, как правило, несколько повышен риск развития рака молочной железы. По этой причине в рамках лечения лимфом врачи пытаются применять обширные облучения как можно реже. Среди пациентов с раком предстательной железы, которые проходили лучевую терапию до конца 80-х годов с использованием обычных для того времени методов, риск развития рака кишечника выше в сравнении со здоровыми мужчинами. Актуальное исследование американских ученых показывает, что примерно с 1990 года риск значительно снизился – применение более новых и намного более целенаправленных техник облучения сегодня ведет к тому, что у большинства мужчин кишечник больше совсем не попадает в лучевое поле.
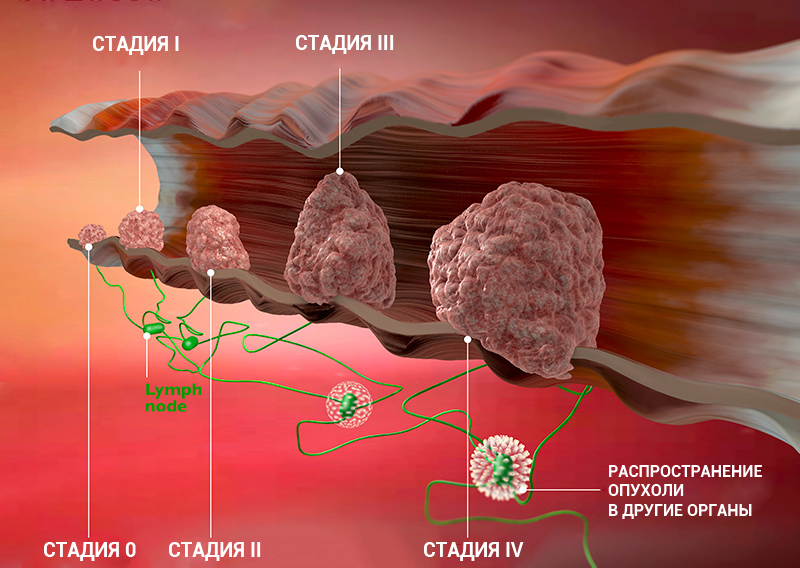
Стадии рака: классификация онкологических заболеваний
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
Клиническая стадия обозначается буквой «c», например, cT2. Патоморфологическая — буквой «p», например, pN1.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Например, с нейроэндокринным раком поджелудочной железы люди могут жить десятилетиями, а при метастатической стадии рака поджелудочной железы — полгода или год, — объясняет врач-онколог.
Что может повлиять на прогноз людей с одинаковой стадией и одним видом рака?
Сергей Югай выделяет три фактора: