Генерализация процесса в онкологии что это
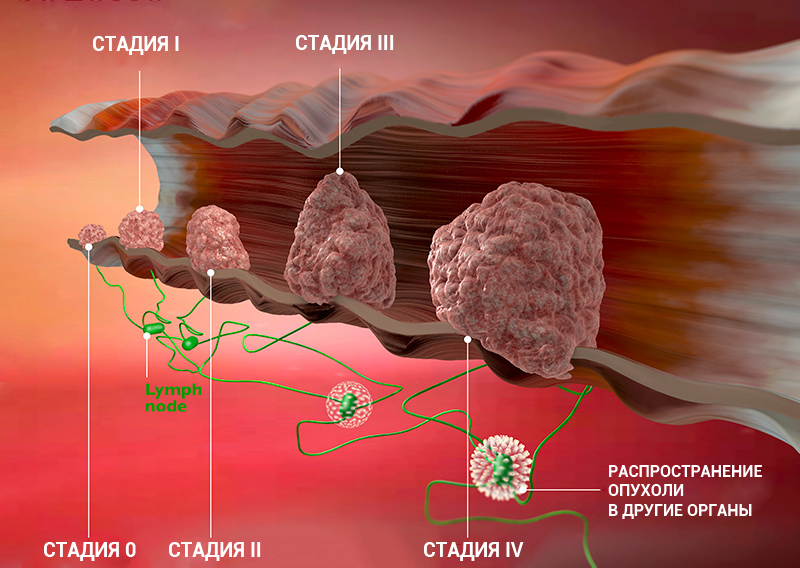
Стадии рака: классификация онкологических заболеваний
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
Клиническая стадия обозначается буквой «c», например, cT2. Патоморфологическая — буквой «p», например, pN1.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Например, с нейроэндокринным раком поджелудочной железы люди могут жить десятилетиями, а при метастатической стадии рака поджелудочной железы — полгода или год, — объясняет врач-онколог.
Что может повлиять на прогноз людей с одинаковой стадией и одним видом рака?
Сергей Югай выделяет три фактора:
Способ диагностики генерализации злокачественных новообразований у онкологических больных
Использование: в области медицины, в частности в онкологии. Сущность изобретения: исследуют периферическую кровь больного, при этом определяют в ней количество тромбоцитов, скорость оседания эритроцитов, процентное содержание сегментоядерных лейкоцитов, лимфоцитов, палочкоядерных лейкоцитов, эозинофилов и моноцитов, цветной показатель, содержание гемоглобина, общего белка, тимоловую пробу и протромбиновый индекс, рассчитывают диагностические индексы по определенным формулам и при наличии двух и более положительных показателей диагностических индексов или значений показателей содержания тромбоцитов, сегментоядерных лейкоцитов, лимфоцитов и скорости оседания эритроцитов относительно порогового уровня диагностируют генерализацию злокачественного новообразования, а при отсутствии или наличии одного аналогичного положительного показателя дополнительно определяют вес больного, средний диаметр опухоли, а также содержание юных лейкоцитов, базофилов, тимоловую пробу, абсолютное число сегментоядерных лейкоцитов и общую численность популяции всех лимфоцитов крови, рассчитывают диагностические индексы по определенным формулам и при наличии одного и более положительного показателя диагностических индексов относительно порогового уровня диагностируют генерализацию злокачественного новообразования, а при отсутствии аналогичных положительных показателей дополнительно определяют соотношения численности популяции нормальных клеток и субпопуляций клеток крови к общей численности злокачественных клеток в организме больного по определенным формулам и при наличии одного и более положительных показателей относительно порогового уровня диагностируют генерализацию злокачественного новообразования, а при отсутствии аналогичных положительных показателей исключают наличие генерализации злокачественного новообразования. Способ позволяет повысить точность диагностики генерализации злокачественных новообразований. 6 табл.
Изобретение относится к области медицины, в частности к онкологии, и может применяться для распознавания генерализации онкопатологии у больных на основе гематологических, биохимических и антропометрических данных.
Этот способ идентифицирует запущенность опухолевого процесса на основе, в процессе которого пациент тестируется по 3 подпрограммам: ST1, ST2, ST3 (табл. 1-6).
Однако данные методы не имеют высокой информативности.
Предложенный способ позволяет точнее идентифицировать генерализацию опухоли, не прибегая к инвазивным и дорогостоящим визуализирующим методам обследования, а также скрытую генерализацию процесса.
Примеры конкретного выполнения способа.
Больной Д., 58 лет, вес. 56 кг, поступил с диагнозом периферический рак верхней доли правого легкого, диаметром 3 см.
Факторы соотношения: Вес/Д = 18,67, Lтот/Д = 9,41, Тртот/Д = 339,73, Эртот/Д = 5,23, Стот/Д = 5,08, Лтот/Д = 3,76, Мтот/Д = 0,19.
Действительно, больной погиб через 58 суток после радикальной операции (верхней лобэктомии справа, гистологически плоскоклеточный неороговевающий рак без метастазов в лимфатических узлах, диаметром 3 см, II стадия) от генерализации онкопатологии, т. е. у пациента имелась скрытая генерализация процесса, которая современными методами не диагностируется.
Индексы Кшивца: ИК15 = 10,61, ИКП2 = 2,49, ИКП8 = 0,42, ИКП4 = 11,34, ИКМ1 = 0,35, ИКМ2 = 8,22, ИКМ3 = 10,43, ИКМ4 = 0,53, ИКМ5 = 6,61, ИКМ6 = 0,72, ИКМ7 = 0,43, ИКМ8 = 1,52, ИКМ9 = 0,17, ИКМ10 = 2,41.
Факторы соотношения: Вес/Д = 17,25, Lтот/Д = 8,81, Тртот/Д = 217,35, Эртот/Д = 4,95, Стот/Д = 4,67, Лтот/Д = 2,91, Мтот/Д = 0,79.
При тестировании по программам ST1, ST2 и ST3 не выявлено ни одного положительного теста, т.е. у больного нет генерализации злокачественного новообразования.
Действительно, больной жив более 3 лет после радикальной операции (пневмонэктомия справа, гистологически плоскоклеточный неороговевающий рак без метастазов в лимфатических узлах, диаметром 4 см, II стадия).
Больной А., 58 лет, вес 70 кг, поступил с диагнозом рак желудка, диаметром 12 см.
Факторы соотношения: Вес/Д = 5,83, Lтот/Д = 3,59, Тртот/Д = 138,83, Эртот/Д = 1,47, Стот/Д = 2,84, Лтот/Д = 0,36, Мтот/Д = 0,11.
Действительно, больной погиб через 111 суток после радикальной операции (гастрэктомия, гистологически аденокарцинома без метастазов в лимфатических узлах, диаметром 12 см, III стадия) от генерализации онкопатологии.
Больной Ф., 56 лет, вес 72 кг, поступил с диагнозом рак желудка, диаметром 3 см.
Индексы Кшивца: ИК15 = 8,17, ИКП2 = 4,06, ИКП8 = 0,07, ИКП4 = 21,77 ИКМ1 = 0,11, ИКМ2 = 8,16, ИКМ3 = 8,33, ИКМ4 = 0,13, ИКМ5 = 7,32, ИКМ6 = 0,61, ИКМ7 = 0,60, ИКМ8 = 1,24, ИКМ9 = 0,27, ИКМ10 = 2,12.
Факторы соотношения: Вес/Д = 0,24, Lтот/Д = 7,22, Тртот/Д = 336,0, Эртот/Д = 7,06, Стот/Д = 4,26, Лтот/Д = 2,17, Мтот/Д = 0,22.
При тестировании по программам ST1, ST2 и ST3 не выявлено ни одного положительного теста, т.е. у больного нет генерализации злокачественного новообразования.
Действительно, больной жив более 3 лет после радикальной операции (субтотальной резекции желудка, гистологически аденокарцинома без метастазов в лимфатических узлах, диаметром 3 см, III стадия).
Сценарий работы подпрограммы ST3 аналогичен подпрограммам ST1 и ST2: если у больного фиксируется хотя бы 1 положительный тест, то у него следует исключить генерализацию опухолевого процесса. Если онкологический больной проходит через все 3 подпрограммы ST1-3, не выходя за рамки допустимого количества положительных тестов, то у пациента I-III стадии опухолевого процесса. Общая точность способа на выборке из свыше 4 тысяч онкологических больных достигает 96%, причем он идентифицирует и так называемую «скрытую» генерализацию онкопатологии, которую вообще невозможно распознать современными диагностическими методами.
Медицинское общество по лечению
нейроэндокринных опухолей
Современные подходы лекарственного лечения генерализованных форм нейроэндокринных опухолей. Симптоматическая терапия синдромов при нейроэндокринных неоплазиях
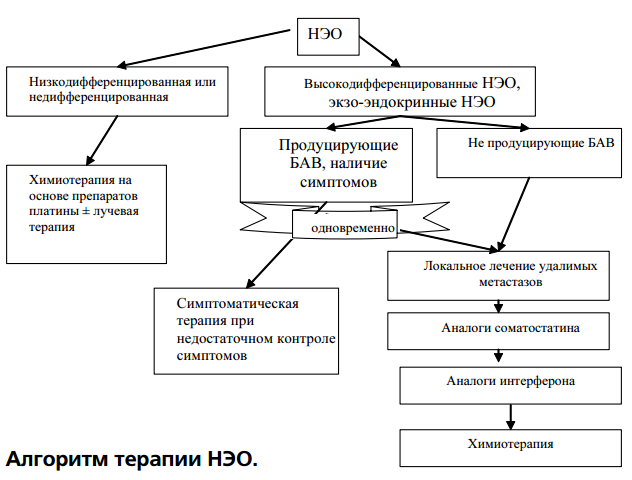
Нейроэндокринные опухоли представляют собой гетерогенную группу заболеваний, что требует дифференцированного подхода к их лечению.
1. Высокодифференцированные НЭО (доброкачественные или низкой. степени злокачественности).
2. Низкодифференцированные (мелкоклеточные) карциномы.
3. Смешанные экзокринно-эндокринные карциномы.
Первая группа характеризуется низким пролиферативным потенциалом, способностью секретировать разнообразные биологически активные вещества и низкой чувствительностью к химиотерапии. К данной группе могут быть отнесены:
— карциноиды (К) различного происхождения (эмбриогенетически развивающиеся в производных передней, средней и задней кишки),
— опухоли из хромаффинных клеток (феохромоцитома),
— медуллярная карцинома щитовидной железы.
Вторая группа представлена высокозлокачественными опухолями с высоким пролиферативным потенциалом, чувствительными к химиотерапии и лучевой терапии. К этой группе может быть отнесен мелкоклеточный рак лёгкого (МЛР).
Для третьей группы характерно наличие клеток как с экзокринной, так и с эндокринной секреторной функцией. К ней относятся различные опухоли поджелудочной железы (ОПЖ); исключение составляют карциноиды. Чувствительность к химиотерапии у данного типа опухолей умеренная [8].
Учитывая системное воздействие опухоли на организм, при лечении НЭО необходимо обращать особое внимание на лечение симптомов заболевания, так как одной из основных целей терапии любой диссеминированной опухоли является увеличение продолжительности качественной жизни.
Ввиду чрезвычайной схожести терапевтических подходов к лечению НЭО в каждой из указанных групп целесообразно рассмотреть терапию наиболее часто встречающихся представителей данного типа неоплазий, а также симптоматической терапии ряда паранеопластических синдромов и дистантных проявлений НЭО.
Учитывая в целом индолентное течение данной опухоли (хотя в некоторых случаях возможно и достаточно агрессивное её поведение), хирургический подход в настоящее время остаётся основным даже при распространенных формах НЭО. Всем пациентам, у которых возможно удаление опухоли, необходимо проводить операцию [7, 8]. В данном случае циторедуктивные вмешательства позволяют, наряду с контролем симптомов и повышением качества жизни, увеличить длительность ремиссии и улучшить прогноз [8].
Отдельно необходимо остановиться на лечении поражений печени при карциноидах. Это связано с высокой частотой метастатического поражения данного органа и резким ухудшением прогноза у этой группы больных.
Эмболизация и химиоэмболизация метастазов, радиочастотная абляция и криодеструкция, как в сочетании с системной терапией, так и без таковой, показали свою целесообразность в некоторых исследованиях. По данным, обобщенным GA Kaltsas [8], локальные методы воздействия на метастазы в печени позволяют достичь регресса карциноида в 35-80 % случаев, при этом контроль симптомов достигается у 50-100 % больных, причем, даже в тех случаях, когда опухоль полностью не удалена.
Дистанционная лучевая терапия, с учетом низкой пролиферативной активности неоплазий данной группы, оказалась неэффективной [8].
Наряду с локальными методами воздействия на опухоль, безусловный приоритет в лечении диссеминированного карциноида остаётся за системной терапией. На протяжении последних 20 лет активно изучалась эффективность цитостатиков и их комбинаций. Результаты этих исследований приведены в табл. 1.
Активность цитостатиков в лечении нейроэндокринных опухолей [1, 6–9, 12]
| Препарат | Частота объективного ответа (%) | ||
| Карциноид | НЭО поджелудочной железы | Мелкоклеточный рак | |
| Монотерапия | |||
| Доксорубицин | 21 | 20 | 25 |
| Фторурацил | 26 | ||
| Дакарбазин | 16-29 | 9 | |
| Препараты платины | 7 | 9 | 63 |
| Алкилирующие агенты (циклофосфамид, ифосфамид) | 9 | 10 | 22-57 |
| Этопозид | 5 | 6 | 82 |
| Стрептозотоцин | 30 | 36-54 | Нет данных |
| Винкаалкалоиды | Нет данных | Нет данных | 26-40 |
| Таксаны | 0-11 | 22-45 | |
| Иринотекан | 0-11 | 50 | |
| Топотекан | 39-75 | ||
| Гемцитабин | 27 | ||
| Полихимиотерапия | |||
| Стз+F | 3-40 | 45-68 | Нет данных |
| Стз+C | 26 | ||
| Стз+A | 40 | 20-69 | |
| Интерферон-альфа + F | 7 | 14 | |
| Д+F | 11 | ||
| CCNU+F | 17 | 40 | |
| Д+эпирубицин+ F | 10 | 26,7 | |
| F+A+P | 10 | 20 | |
| Стз+C+F | 22 | ||
| Стз+C+F+A | 30 | ||
| Стз+A + интерферон-альфа | 10-30 | ||
| ЕР | 0 | 14 | 62–63 |
| Топ+ Е | Нет данных | 14-55 | |
| ЕР + Тр | 50 | ||
| ЕР, чередующийся с Топ+Тр | 77 (62-89) | ||
| Р+Топ | 77 (39-94) | ||
| ЕР + Г | 72,2 (56,5–85,0) | ||
| Рс+Тр+Н | 71 | ||
| ЕР, чередующийся с Топ | 64 (48-79) | ||
| ЕР+К | 77-84 | ||
| Топ+Тр | 28-77 | ||
Сокращения: А – доксорубицин, Е – этопозид, Стз – стрептозотоцин, Р – цисплатин, Рс – карбоплатин, Тр – паклитаксел, Топ – топотекан, Н – ифосфамид, F – фторурацил, Д – дакарбазин, К – иринотекан, С – циклофосфамид, Г – гемцитабин.
Как видно из приведенной таблицы, эффективность монотерапии колеблется в пределах 0-30%. Однако и полихимиотерапия не показала никаких преимуществ перед ней. Необходимо отметить, что недостаточная чувствительность к химиотерапии характерна для большинства НЭО высокой степени дифференцировки. Л ишь при лечении некоторых опухолей этой группы полихимиотерапия позволяет достичь удовлетворительных результатов. Так, стандартом лечения крупноклеточного нейроэндокринного рака лёгкого являются схемы на основе препаратов платины [8].
С введением в клиническую практику аналогов соматостатина и интерферонов началась новая эра в лечении карциноида. Активность данных препаратов представлена в табл. 2. В рандомизированных исследованиях, показано, что биотерапия позволяет увеличить как выживаемось больных, так и качество их жизни, поскольку позволяет контролировать симптомы заболевания практически у всех пациентов [8].
Таким образом, при карциноиде стандартом терапии является применение соматостатина 200-400 мг/сут или его аналогов, например, лартреотида аутогеля 120 мг ежемесячно, соматостатина-ЛАР 30-60 мг 1 раз в 3-4 нед. Для интерферона оптимальной дозой является 3-9 млн. МЕ ежедневно или через день или (в случае пегелиро- ванных форм) 90-100 мкг в неделю [8].
Низкая противоопухолевая активность всех вышеперечисленных препаратов стимулировала поиск путей повышения её эффективности. Но ни комбинированная химиотерапия, ни иммунотерапия, ни химиоиммунотерапия не улучшили результаты лечения [7]. Повышение доз биотерапевтических агентов, хотя и позволяло улучшить контроль симптомов, но не реализовалось в увеличении выживаемости или частоты регрессов опухоли [8].
Многообещающие результаты предоставляет системная лучевая терапия выскодифференцированных НЭО. Использование радиоиодина при опухолях щитовидной железы привело к созданию нескольких препаратов, механизм действия которых основан на захвате опухолью вещества, меченного радиоактивным изотопом. Эффективность данных препаратов представлена в табл. 3.
| Препарат | Объективный ответ (%)/симптоматический эффект | |
| Карциноид | НЭО поджелудочной железы | |
| Интерферон-альфа | 0-22/50-80 | 0-50/70 |
| Октреотид | 0-16/60-90 | 0-17/70 |
| Ланреотид | 0-8/40-90 | Нет данных |
| Интерферон-альфа + октреатид | 0/100 | |
| Интерферон-альфа + гамма | 0/50 | |
| Препарат | Объективный ответ (%)/симптоматический эффект | |
| Карциноид, НЭО поджелудочной железы | РЩЖ | |
| 131 I-MIBG | 15 | 24 |
| 111 In Октреотид | 27 | Не исследовалось |
| 90Y Октреотид | 23 | |
| 90Y лартреотид | 20 | |
| [ 177 Lu-DOTA Tyr 3 ]-октреатид | 29 | |
Относясь к высокодифференцированным опухолям, медуллярный рак щитовидной железы обладает теми же особенностями, что и другие представители этой группы. Хирургический метод является основным не только при первичной опухоли, но и при местном рецидиве заболевания. Как и при карциноиде, эффективность монотерапии колеблется от 0 до 30%. Преимущество при этом отдается терапии с использованием доксорубицина. Химиотерапия не приводит к увеличению выживаемости, однако, позволяет у отдельных больных получить длительные ремиссии. Системная лучевая терапия с использованием метайодбензилгуанидина (табл. 3) обладает гораздо большей эффективностью, позволяя достичь клинически значимых результатов (регресс или стабилизация опухоли, контроль симптомов) у большинства пролеченных больных [8].
Данный тип НЭО имеет некоторое сходство с опухолями нервной ткани, такими как нейробластома, в связи с чем имеются различия в терапии представителей данной группы. Чрезвычайно важным аспектом терапии является симптоматическое лечение сопутствующих симптомов. Вся другая терапия должна проводиться в сочетании с использованием подобных препаратов [8].
Хирургический метод лечения является основным даже при диссеминированном процессе. Циторедуктив- ные операции позволяют не только достичь лучшего контроля за симптомами заболевания, но и в ряде случаев увеличивают эффективность последующего системного лечения.
Значимое место в лечении также занимает системная лучевая терапия (табл. 3) с использованием препарата метайодбензилгуанидина ( 131 1-M1BG) [8].
К данному типу относятся высокоагрессивные, интенсивно пролиферирующие опухоли. Для них проявления самой опухоли выходят на первое место в клинической картине, хотя отдаленные симптомы также встречаются довольно часто. Важной характеристикой этих опухолей является раннее метастазирование, высокая частота поражения головного мозга. Большинство из данных заболеваний высокочувствительны к химиотерапии. Наиболее ярким представителем данной группы опухолей является мелкоклеточный рак лёгкого. Основные принципы его терапии могут быть распространены и на другие локализации низкодифференцированных и недифференцированных НЭО, в том числе с неясной первичной локализацией очага [8, 12].
Многочисленные клинические исследования, проведенные после внедрения в практику препаратов платины, позволили выбрать комбинированную терапию на основе этих препаратов стандартом лечения. Метаанализ, обобщивший 18-летний опыт применения этих комбинаций [3], показал не только высокий уровень объективных ответов, но и явные преимущества в выживаемости больных. Изучение новых цитостатиков и их комбинаций со стандартной химиотерапией в настоящее время не показали значимых преимуществ по сравнению с существующим лечением. В настоящее время активно ведётся поиск новых схем терапии. Большие надежды возлагаются на использование такого препарата, как иринотекан.
Отдельную задачу представляет собой терапия метастатического поражения головного мозга при мелкоклеточной НЭО. Анатомо-физиологические особенности головного мозга, такие как ограниченный объем пространства внутри черепной коробки, наличие гематоэнцефалического барьера и многочисленных функционально и жизненно важных зон, обусловливают резкое ухудшение прогноза пациентов и ставят лечение этих поражений первоочередной задачей. В случае наличия единичных удалимых поражений хирургический подход целесообразен и желателен. При множественном поражении головного мозга возможна неполная циторедукция с последующей лучевой терапией или/и химиотерапией [6]. Несмотря на то, что при метастатическом поражении значительно повышается проницаемость гематоэнцефалического барьера для цитостатиков [13], по нашему мнению, предпочтительнее использовать препараты, проникающие через него ( ломустин, темозоламид, тениопозид). Особо следует подчеркнуть важность профилактического облучения головного мозга при полном регрессе опухоли, поскольку, по результатам метаанализа нескольких рандомизированных исследований, такой подход продлевает жизнь больных [15].
Дистанционная лучевая терапия занимает важное место в лечении низкодифференцированных и недифференцированных НЭО в отличие от высокодифференцированных,. При диссеминированном процессе её можно проводить как на зоны остаточной опухоли, так и на метастазы, особенно в головном мозге. Достаточно широкое распространение получило сочетание химиотерапии с лучевой терапией, когда после нескольких циклов лекарственного лечения проводятся сеансы облучения, после чего химиотерапия возобновляется.
НЭО поджелудочной железы
Как и при других НЭО, локальные методы играют важную роль в лечении данного типа опухолей, так как циторедуктивные операции и химиоэмболизация позволяют достичь удовлетворительных результатов лечения [8]. Химиотерапия позволяет у большинства больных контролировать симптомы заболевания, при этом у половины из них наблюдается регресс опухоли (табл.1). Наиболее приоритетными режимами являются комбинации стрептозотоцина или любого производного нитрозомочевины с доксорубицином или фторпиримидинами. Биотерапия с использованием аналогов соматостатина также эффективна у данной группы больных и в целом используется как стандарт терапии [8] наряду с применением симптоматического лечения, речь о котором пойдет ниже.
— продукции опухолью биологически активных веществ (по этому признаку НЭО делятся на гормональноактивные и неактивные),
— снижения уровня существующих веществ, что приводит к возникновению патологических симптомов,
— ответа организма пациента на наличие опухолевого процесса.
В табл. 4 представлены некоторые из указанных симптомов [2, 8], ассоциированных с НЭО, и их лечение. Основной терапией для всех указанных состояний является лечение первичной опухоли, которое позволяет успешно контролировать симптомы заболевания.
Обобщая вышесказанное, необходимо отметить следующее
1. НЭО являются гетерогенной группой опухолей, характеризующихся как местным воздействием объема опухоли, так и отдаленным воздействием её на организм.
2. В лечении высокодифференцированных опухолей и смешанных экзо-эндокринных опухолей ведущая роль принадлежит локальным методам лечения. Биотерапия с применением аналогов соматостатина и интерферона позволяет контролировать симптомы большинства гормонально-активных НЭО и является стандартом лечения этой группы опухолей.
3. Химиотерапия с препаратами платины является стандартом при лечении низкодифференцированных и недифференцированных НЭО.
Поступила в редакцию 14.11.2005 г.