Гентамицин и цефтриаксон в чем разница
Гентамицин или Цефтриаксон — какое из средств лучше
Инфекционно-воспалительные заболевания могут начаться в любой момент. Особенно они тяжело протекают в детском и пожилом возрасте. Для лечения инфекций прописывают антибактериальные средства. К этой группе медикаментов относятся Гентамицин и Цефтриаксон. До начала антибиотикотерапии нужно узнать, что общего и чем отличаются между собой эти средства.
Гентамицин
Гентамицин относится к аминогликозидам. Препарат отличается широким спектром действия.
Антибиотик вызывает гибель следующих микроорганизмов:
Гентамицин прописывают при инфекциях, которые вызваны чувствительными к нему бактериями.
В инъекциях препарат назначают при следующих заболеваниях:
Мазь применяется при кожных инфекциях бактериальной этиологии. Глазные капли применяются при блефарите, кератите, конъюнктивите, мейбомите.
Цефтриаксон
Цефтриаксон — полусинтетический цефалоспориновый антибиотик 3-го поколения. Он характеризуется широким спектром действия.
К нему чувствительны следующие микроорганизмы:
Антибиотик помогает при болезни Лайма, также его прописывают с целью профилактики инфекционных осложнений после хирургического вмешательства.
Общие характеристики
Гентамицин и Цефтриаксон имеют следующие сходства:
Отличия
Между Гентамицином и Цефтриаксоном имеются следующие отличия:
| Гентамицин | Цефтриаксон | |
| Форма выпуска | Антибиотик в продаже бывает в растворе для введения в мышцу и в вену, в глазных каплях и мази. Также он выпускается в порошке из которого при разведении получается инъекционный раствор. | Противомикробное средство в продаже бывает в порошке из которого готовится раствор для введения в мышцу и в вену. |
| Применение при беременности | В уколах препарат противопоказан женщинам в положении. Можно ли использовать мазь и глазные капли беременным пациенткам нужно уточнять в аннотации, так как в зависимости от производителя рекомендации будут разные. К примеру, глазные капли, которые выпускает ФГУП «Московский эндокринный завод» можно применять в период беременности с осторожностью, а препарат, производящейся в Польше запрещено. | Антибиотик женщинам в положении можно прописывать с осторожностью. |
| Применение в период лактации | Уколы противопоказаны в период лактации. Можно ли применять мазь и глазные капли надо уточнять в официальной инструкции, так как в зависимости от производителя рекомендации будут разными. Например, польские глазные капли во время лактации запрещены, а которые выпускаются Московским эндокринным заводом можно использовать с осторожностью. | На время антибиотикотерапии надо прервать грудное вскармливание. |
| Противопоказания | Лекарственное средство противопоказано при непереносимости аминогликозидов, тяжелой дисфункции почек, уремии, неврите слухового нерва. С осторожностью антибиотик нужно прописывать при миастении, дрожательном параличе, ботулизме. | Противомикробное средство запрещено при аллергии на антибиотики цефалоспоринового ряда. Препарат с осторожностью надо назначать людям, которые страдают заболеваниями печени, неспецифическим язвенным колитом, энтероколитом, который спровоцирован антибиотикотерапией. |
| Нежелательные реакции | Лечение препаратом может стать причиной повышения уровня билирубина в крови, появления белка и крови в урине, олигурии, почечной недостаточности, головной боли, сонливости, ослабления слуха, необратимой тугоухости, вестибулярных расстройств, нарушения нервно-мышечной проводимости, понижения уровня магния, калия и кальция в крови. Глазные капли могут стать причиной слезотечения, покраснения конъюнктивы, фотофобии, болевых ощущений и жжения в глазах. | Антибиотик может стать причиной расстройства желудка, воспаления печени, холестатической желтухи, псевдомембранозного колита, флебита, болевых ощущений в месте введения препарата, молочницы, интерстициального нефрита. |
Что выбрать?
Подбирать антибиотик должен врач в зависимости от диагноза и чувствительности возбудителя инфекции. Также нужно учитывать наличие у пациента противопоказаний к началу терапии и ее переносимости.
Антибиотики нового поколения: за и против
Антибиотики – это вещества биологического или полусинтетического происхождения. Применяются в лечебной практике для борьбы с болезнетворными микробами, вирусами. До появления этих медпрепаратов статус неизлечимых болезней был у брюшного тифа, дизентерии, пневмонии, туберкулеза. Сегодня лечение заболеваний инфекционного характера возможно с применением 1-6 поколения антибиотиков.
На этот момент фармакологическая индустрия выпускает более 2000 разновидностей лекарственных средств подобного типа. Медики описали действие около 600 позиций, а во врачебной практике используются порядка 120-160 препаратов.
Важно! При любом заболевании принимать антибиотики рекомендуется после консультации с врачом. В противном случае может развиться антибиотикорезистентность (снижение чувствительности патогенных микроорганизмов к антибактериальным средствам).
Классификация антибиотиков
Все антибактериальные средства можно разделить на 5 категорий по характеристикам и спектру применения. Рассмотрим эту классификацию подробнее:
Спектр действия
Различают антибактериальные средства:
По составу
Антибактериальные препараты делят на 6 групп:
Поколения препаратов. У передовых антимикробных препаратов насчитывается уже шесть генераций. Например, пенициллин был первым средством природного происхождения, тогда как третья или шестая генерация – это уже улучшенная версия, которая включает в состав сильнейшие ингибиторы. Зависимость прямая: чем новее генерация, тем эффективнее воздействие препаратов на патогенную микрофлору.
По способу приема. Пероральные – принимают через рот. Это различные сиропы, таблетки, растворимые капсулы, суспензии. Парентеральные – вводятся внутривенно или внутримышечно. Они быстрее дают эффект, чем пероральные лекарства. Ректальные препараты вводятся в прямую кишку.
Важно! Принимать антибиотики допускается только после консультации с врачом, иначе разовьется антибиотикорезистентность.
Антибактериальные средства нового поколения
Отличие последних генераций антибиотиков от их ранних версий в более совершенной формуле действующего вещества. Активные компоненты точечно устраняют только патологические реакции в клетке. Например, кишечные антибиотики нового поколения не нарушают микрофлору ЖКТ. При этом они борются с целой «армией» возбудителей инфекций.
Новейшие антибактериальные препараты делятся на пять групп:
Рассмотрим несколько известных противомикробных средств импортного и российского производства.
Амоксициллин – импортный противомикробный препарат из группы пенициллинов. Используется во врачебной практике для лечения бактериальной инфекции. Эффективен при кишечных инфекциях, гайморите, ангине, болезни Лайма, дизентерии, сепсисе.
Авелокс – медпрепарат последней генерации из группы фторхинолонов. Отличается сильнейшим воздействием на бактериальные и атипичные возбудители. Не вредит почкам и ЖКТ. Используется при острых, хронических заболеваниях.
Цефалоспорины – антибиотики третьего поколения. К этой группе относят Цефтибутен, Цефтриаксон и другие. Используются для лечения пиелонефрита, пневмонии. В целом это безопасные средства с малым количеством побочных действий. Однако их нужно принимать только после консультации с врачом. Медпрепаратов много, а какой именно выбрать – порекомендует специалист.
Дорипрекс – импортный противомикробный препарат синтетического происхождения. Показал хорошие результаты при лечении пневмонии, запущенных интраабдоминальных инфекций, пиелонефритах.
Инваз – антибактериальное средство из группы карбапенемов. Выпускается в ампулах для парентерального способа применения. Показывает быстрый эффект при лечении бактериальных расстройств кожи, мягких тканей, инфекциях мочевыводящих путей, пневмонии, септицемиях.
Аугметин – полусинтетический пенициллин третьей генерации с добавлением усиливающих ингибиторов. Педиатрами признается лучшим комплексным медпрепаратом для лечения детских гайморита, бронхита, тонзиллита и других инфекций дыхательных путей.
Цефамандол – антибактериальное средство российского производства. Относится к группе цефалоспоринов третьего поколения. Используется для лечения кишечных инфекций, возбудителей инфекций половых органов. Как противомикробное средство обширного диапазона воздействия применяется при простудных заболеваниях.
Лучшие антибактериальные препараты широкого диапазона действия
Противомикробные средства новой генерации обычно синтезируют из природного сырья и стабилизируют в лабораториях. Это помогает усилить эффект лекарства на патогенную микрофлору.
Какие препараты самые сильные? Врачи относят к таким антибактериальные средства широкого спектра воздействия. Приведем ниже краткий список препаратов по названиям:
Резюме
Мы рассмотрели российские и импортные антибиотики широкого спектра действия, кратко описали классификацию препаратов. Ответим на вопрос: какие антибактериальные средства выбрать?
Важно понимать, противомикробные лекарства для обширного применения обладают токсичностью, поэтому негативно влияют на микрофлору. Кроме того, бактерии мутируют, а значит препараты теряют свою эффективность. Поэтому антибактериальные средства с новейшей структурой будут в приоритете, чем их ранние аналоги.
Самолечение антибиотиками опасно для здоровья. При инфекционном заболевании первым делом нужно обратиться к врачу. Специалист установит причину болезни и назначит эффективные антибактериальные средства. Самолечение «наугад» приводит к развитию антибиотикорезистентности.
Ошибки в антибактериальной терапии инфекций дыхательных путей в амбулаторной практике
Опубликовано в журнале:
Лечащий врач, 2003, №8 Л. И. Дворецкий, доктор медицинских наук, профессор
С. В. Яковлев, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва
При выборе способа антибактериальной терапии в амбулаторной практике необходимо учитывать и решать как тактические, так и стратегические задачи. К тактическим задачам антибиотикотерапии относится рациональный выбор антибактериального препарата, обладающего наибольшим терапевтическим и наименьшим токсическим воздействием.
Стратегическая задача антибиотикотерапии в амбулаторной практике может быть сформулирована как уменьшение селекции и распространения резистентных штаммов микроорганизмов в популяции.
В соответствии с этими положениями следует выделять тактические и стратегические ошибки при проведении антибактериальной терапии инфекций дыхательных путей в амбулаторной практике (см. таблицу 1).
Таблица 1. Ошибки антибактериальной терапии в амбулаторной практике.
Тактические ошибки антибактериальной терапии
1. Необоснованное назначение антибактериальных средств
Особую категорию ошибок представляет неоправданное применение антибактериальных препаратов (АП) в тех ситуациях, когда их назначение не показано.
Показанием для назначения антибактериального препарата является диагностированная или предполагаемая бактериальная инфекция.
При всех трудностях принятия решения в подобных ситуациях необходимо отдавать себе отчет в том, что антибактериальные препараты не оказывают влияния на течение вирусной инфекции и, следовательно, их назначение при ОРВИ не оправдано (см. таблицу 2). В то же время предполагаемая возможность предотвращения бактериальных осложнений вирусных инфекций с помощью назначения антибактериальных препаратов не находит себе подтверждения в клинической практике. Кроме того, очевидно, что широкое неоправданное применение антибактериальных препаратов при ОРВИ чревато формированием лекарственной устойчивости и повышением риска возникновения нежелательных реакций у пациента.
Таблица 2. Инфекционные заболевания дыхательных путей преимущественно вирусной этиологии
и не требующие антибактериальной терапии.
Часто врач назначает нистатин или другой антимикотик в случае обнаружения в полости рта или в моче грибов рода Candida. При этом он ориентируется лишь на данные микробиологического исследования и не учитывает наличие или отсутствие симптомов кандидоза, а также факторов риска развития грибковой инфекции (тяжелый иммунодефицит и др.).
Выделение грибов рода Candida из полости рта или мочевых путей пациентов в большинстве случаев служит свидетельством бессимптомной колонизации, не требующей коррегирующей противогрибковой терапии.
II. Ошибки в выборе антибактериального препарата
Пожалуй, наибольшее число ошибок, возникающих в амбулаторной практике, связано с выбором антибактериального средства. Выбор антибиотика должен производиться с учетом следующих основных критериев:
Антибиотики XXI века
Поделиться:
В первой части статьи мы рассказали про основные мифы связанные с антибиотиками и подробно описали пенициллиновую группу, а сейчас перейдем к антибиотикам следующего поколения.
ЦЕФАЛОСПОРИНЫ
Микробы часто поступают если не разумно, то вполне логично.
Если им угрожают антибиотики пенициллинового ряда, микробы начинают разрушать пенициллины (вот бы нам так — нам что-то мешает, а мы это раз! — и стерли с лица земли).
Слабое звено пенициллинов — это так называемое бета-лактамное кольцо (вы не раз встретите в описании препаратов этот термин, поэтому его лучше запомнить). Вот это бета-лактамное кольцо микробы и научились разрывать. А инструментом для разрыва служат специальные ферменты, бета-лактамазы.
Так что, если говорить коротко, то антибиотики цефалоспориновой группы — все те же пенициллины, которые работают точно так же, но вот бета-лактамаз они не боятся. И значит, могут расправиться с микробами, с которыми не справляется все тот же ампициллин или даже амоксициллин с клавулановой кислотой.
«Гонка вооружений» между микробами и фармацевтами со временем породила второе, третье, а потом и четвертое поколение цефалоспориновых антибиотиков (при произнесении некоторых названий этих лекарств пугаются даже врачи, сразу представляющие, против какой флоры эти антибиотики предназначены).
КОГДА ВРАЧИ НАЗНАЧАЮТ ЦЕФАЛОСПОРИНЫ
При аллергии на обычные пенициллины.
Конечно, химическая структура пенициллинов и цефалоспоринов похожа, но шанс, что пациент не выдаст аллергической реакции на цефалоспорины, все же очень высок; Если пенициллиновые антибиотики не справляются с инфекцией. Такое часто бывает, если пациент заражается каким-нибудь стафилококком или стрептококком уже в больнице: микробы там травлены уже чем угодно, а потому особенно стойкие к таблеткам из обычной аптеки.
Микробы, к сожалению, быстро учатся и быстро эволюционируют. Оно и понятно: для смены поколений им нужно всего-то 20 минут.
И все же врачам всегда рекомендуют начинать лечение с антибиотиков из группы пенициллинов, чтобы не плодить антибиотикоустойчивую флору.
АНТИБИОТИКИ ГРУППЫ МАКРОЛИДОВ
Что оставалось делать ученым? Только разрабатывать новые антибиотики.
Пенициллин начал массово применяться в 1943 году (в США и СССР, и почти одновременно). А уже в 1949 году Альберто Агилар на Филиппинах нашел новый (после зеленой плесени, из которой был выделен пенициллин) особый грибок, подавляющий рост бактерий.
В США год спустя другой ученый, МакГуир, выделил из него новый антибиотик — эритромицин (в Википедии почему-то упорно пишут, что его выделил Элай Лилли, но это не так — просто МакГуир на него работал).
Эритромицин работает до сих пор: оказалось, что к нему бактерии умеют приспосабливаться намного хуже, чем к пенициллину.
ЧТО УМЕЮТ МАКРОЛИДЫ?
Во-первых, бактерии действительно приспосабливаются к макролидам намного медленнее, чем к пенициллинам.
Но тоже приспосабливаются. Именно поэтому эритромицин сейчас оброс огромным семейством из «младших братьев» — полусинтетических макролидов и азалидов, которые некоторые фармацевты выделяют еще в одну отдельную группу — четвертую и последнюю группу антибиотиков, применяющихся в педиатрии.
Во-вторых, макролиды не убивают бактерий — они лишают их способности размножаться, в результате чего бактериальные клетки, не принося вреда человеку, очень быстро помирают своей смертью или становятся жертвами иммунной системы.
В-третьих, макролиды могут проникать внутрь клеток и настигать бактерий, которые так любят там селиться, — хламидий и микоплазм.
КОГДА ВРАЧИ НАЗНАЧАЮТ МАКРОЛИДЫ?
— у пациента есть аллергия на пенициллины;
Читайте также:
Русская рулетка, или Самолечение антибиотиками
— имеются веские основания полагать, что мы имеем дело с хламидийной инфекцией или микоплазменной пневмонией — пенициллины тут будут бессильны.
ВАЖНО! Пенициллины убивают микробов в момент их размножения. Макролиды лишают микробов способности размножаться. Значит, если врач одновременно назначит, скажем, пенициллин и эритромицин (а пусть, мол, они всю флору одновременно и накроют), эти два антибиотика на самом деле будут… защищать микробов друг от друга.
КОГДА МОЖНО И НУЖНО ПРИНИМАТЬ АНТИБИОТИКИ
— при высокой температуре, длящейся более 3 дней;
— при начале «второй волны» инфекции: лечили-лечили ребенка от вируса, он вроде бы уже и поправляться стал, а тут вдруг снова высокая температура, вялый, да еще вдобавок какой-нибудь кашель присоединился;
— если присутствует четко локализованное инфекционное поражение, например при остром среднем отите, гайморите с гнойными выделениями, бронхите;
— при изменениях в общем анализе крови, характерных для бактериальной инфекции и активного воспаления: высокая СОЭ и большое общее количество лейкоцитов на фоне преобладания в лейкоцитарной формуле нейтрофилов над лимфоцитами.
И конечно, антибиотики нужно принимать только по назначению врача.
Мнение автора может не совпадать с мнением редакции
Аминогликозиды с позиций современной практики лечения инфекций дыхательных путей
Появление аминогликозидных антибиотиков ведет свое начало с открытия исследовательской группой Зельмана Ваксмана в 1943 году стрептомицина — первого препарата, активного в отношении Mycobacterium tuberculosis [1].
Появление аминогликозидных антибиотиков ведет свое начало с открытия исследовательской группой Зельмана Ваксмана в 1943 году стрептомицина — первого препарата, активного в отношении Mycobacterium tuberculosis [1]. За столь выдающееся открытие Ваксман в 1952 году был удостоен Нобелевской премии, при вручении которой было отмечено, что «в отличие от открытия пенициллина профессором Александером Флемингом, которое было в значительной степени обусловлено случаем, получение стрептомицина было результатом длительного, систематического и неутомимого труда большой группы ученых».
Впоследствии на основе природных структур, продуцируемых различными представителями актиномицетов (природные антибиотики), и в ряду их полусинтетических производных была разработана большая группа антибактериальных препаратов, которые составили класс аминогликозидов. В настоящее время выделяют три поколения аминогликозидов (табл. 1). К первому поколению относят стрептомицин, неомицин, канамицин и мономицин, применение которых на современном этапе ограничено вследствие их токсичности. Второе поколение составляют гентамицин, тобрамицин, сизомицин и нетилмицин. Амикацин и исепамицин входят в третье поколение аминогликозидов.
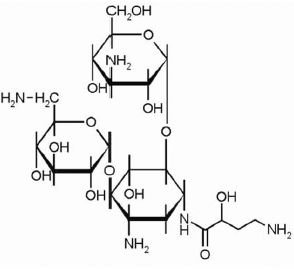
Название данной группы антибиотиков обусловлено молекулярной структурой, в основе которой присутствуют аминосахара, связанные гликозидной связью с агликоновой частью молекулы (рис. 1).
Механизм действия аминогликозидов связан с необратимым угнетением синтеза белка на уровне рибосом у чувствительных к ним микроорганизмов. В отличие от других ингибиторов синтеза белка аминогликозидные антибиотики оказывают не бактериостатическое, а именно бактерицидное действие. Аминогликозиды II и III поколений обладают широким спектром антимикробного действия, в первую очередь, в отношении большинства грамотрицательных микроорганизмов семейства Enterobacteriaceae (Escherichia coli, Proteus spp., Klebsiella spp., Enterobacter spp., Serratia spp. и др.), а также неферментирующих грамотрицательных палочек (Pseudomonas aeruginosa, Acinetobacter spp.) [2, 3, 4]. Аминогликозиды также проявляют свою активность в отношении Staphylococcus aureus, кроме метициллинрезистентных штаммов (MR). Отдельные представители класса различаются между собой по активности и спектру действия. В частности, аминогликозиды I поколения (стрептомицин, канамицин) проявляют наибольшую активность в отношении M. tuberculosis, мономицин обладает эффективностью против некоторых простейших. Все аминогликозиды II и III поколения активны в отношении P. aeruginosa, при этом тобрамицин проявляет наивысшую активность. Сизомицин характеризуется большей активностью, чем гентамицин в отношении Proteus spp., Klebsiella spp., Enterobacter spp. (табл. 2).
Одним из наиболее эффективных аминогликозидов является амикацин, что связано с устойчивостью к действию ферментов, инактивирующих другие аминогликозиды, поэтому антибиотик может оставаться активным в отношении штаммов P. aeruginosa, устойчивых к тобрамицину, гентамицину и нетилмицину [2, 5, 12]. Другой представитель III поколения — изепамицин дополнительно активен в отношении Aeromonas spp., Citrobacter spp., Listeria spp. и Nocardia spp.
Все представители класса аминогликозидов неактивны в отношении S. pneumoniae, S. maltophilia, B. cepacia и анаэробов (Bacteroides spp., Clostridium spp. и др.). Более того, следует помнить, что резистентность S. pneumoniae, S. maltophilia и B. cepacia к аминогликозидам используется при идентификации этих микроорганизмов. Аминогликозиды in vitro активны в отношении шигелл, сальмонелл, легионелл, однако их назначение при данных инфекциях недопустимо, так как они клинически неэффективны в отношении возбудителей, локализованных внутриклеточно [2].
В ряде случаев аминогликозиды оказывают постантибиотический эффект, который зависит от штамма микроорганизма и концентрации препарата в очаге инфекции.
Все аминогликозиды характеризуются практически одинаковой фармакокинетикой (табл. 3). Молекулы антибиотиков являются высокополярными соединениями, в связи с чем плохо растворяются в липидах и при приеме внутрь практически не всасываются из желудочно-кишечного тракта (в системный кровоток поступает менее 2%). Вследствие этого основной путь введения аминогликозидов парентеральный (кроме неомицина). Связывание аминогликозидов с белками крови низкое и колеблется для разных антибиотиков от 0 до 30% (например, тобрамицин практически не связывается с белками). Время достижения Cmax при в/м введении составляет 1–1,5 ч. Аминогликозиды практически не подвергаются биотрансформации, выводятся почками путем клубочковой фильтрации в неизмененном виде, создавая высокие концентрации в моче. Скорость экскреции зависит от возраста, функции почек и сопутствующей патологии пациента (например, при лихорадке она увеличивается, с большой скоростью препарат элиминируется у наркоманов, с меньшей — у беременных, при понижении функции почек скорость экскреции значительно замедляется). Период полувыведения всех аминогликозидов у взрослых с нормальной функцией почек составляет 2–4 ч, при почечной недостаточности период может возрастать до 70 ч и более. Пиковые концентрации аминогликозидов варьируют у различных пациентов и зависят от массы тела, объема жидкости и жировой ткани, состояния пациента. Например, у пациентов с обширными ожогами, асцитом объем распределения аминогликозидов повышен. Наоборот, при дегидратации или мышечной дистрофии он уменьшается.
Аминогликозиды способны создавать высокие концентрации в органах с хорошим кровоснабжением: печени, легких, почках, напротив, низкие концентрации отмечаются в мокроте, бронхиальном секрете, желчи, грудном молоке. Аминогликозиды плохо проходят через гематоэнцефалический барьер, однако при воспалении мозговых оболочек их проницаемость увеличивается.
Учитывая особенности фармакокинетики аминогликозидов, а также потенциальную специфическую токсичность данного класса антибиотиков, необходимо правильно рассчитывать дозу применяемых препаратов. Доза аминогликозидов (не только у детей, но и у взрослых!) должна рассчитываться исходя из массы тела с обязательным учетом индивидуальных особенностей пациента (возраст, функция почек, локализация инфекции).
Факторами, определяющими дозу аминогликозидов, являются [2]:
Дозы у взрослых и детей старше 1 месяца: стрептомицин, канамицин, амикацин по 15–20 мг/кг/сутки в 1–2 введения; гентамицин, тобрамицин — 3–5 мг/кг/сутки в 1–2 введения; нетилмицин — 4–6,5 мг/кг/сутки в 1–2 введения.
Современная практика применения аминогликозидов предусматривает введение препарата 1 раз в сутки, что оправдано как с микробиологической точки зрения (дозозависимый, быстро наступающий бактерицидный эффект; длительный постантибиотический эффект), так и с клинической (меньшая токсичность аминогликозидов при однократном введении при аналогичной эффективности терапии) [2, 3]. В настоящее время однократное в сутки введение аминогликозидов применяется при большинстве показаний (исключение составляют эндокардит и менингит). При однократном введении аминогликозиды лучше всего вводить внутривенно капельно в течение 15–20 мин.
Чрезвычайно важно, что аминогликозиды характеризуются вариабельностью фармакокинетических показателей. При введении одинаковой дозы потенциально токсические уровни в крови (10–14 мкг/мл) для природных аминогликозидов могут быть обнаружены в среднем у 10% больных, концентрации ниже необходимых для адекватной терапии выявляются у 25% больных и более [3]. В этой связи наиболее предпочтительными являются полусинтетические препараты — амикацин и нетилмицин, обладающие наименьшей вариабельностью показателей. Кроме того, данной группе препаратов свойствен узкий коридор безопасности, т. е. незначительный разрыв между эффективным и токсическим уровнем концентраций в крови. В этой связи единственным средством оптимизации лечения аминогликозидами является постоянный фармакокинетический мониторинг, который позволяет исключать создание токсических или субтерапевтических уровней препарата в крови (табл. 4).
При проведении терапевтического мониторинга определяют: 1) пиковую концентрацию аминогликозидов в сыворотке крови — через 60 мин после внутримышечного введения препарата или через 15 мин после окончания внутривенного введения; 2) остаточную концентрацию — перед введением очередной дозы. Установление пиковой концентрации не ниже порогового значения свидетельствует о достаточности используемой дозы аминогликозида, при этом ее высокие уровни не представляют опасности для пациента. Величина остаточной концентрации, превышающая терапевтический уровень, свидетельствует о кумуляции препарата и об опасности развития токсических эффектов. В этом случае снижают суточную дозу или удлиняют интервал между разовыми дозами. При однократном введении всей суточной дозы достаточно определять только остаточную концентрацию [2].
Аминогликозиды относятся к препаратам с низким уровнем общей токсичности. Однако для них характерны специфические нежелательные реакции, а именно ото- и нефротоксичность. Частота развития этих реакций варьирует в зависимости от препарата. В клинических исследованиях было показано, что частота развития нефротоксических явлений при применении нетилмицина составляет 2,8%, амикацина — 8,5%, гентамицина — 11,1% и тобрамицина — 11,5% [9]. Ототоксические реакции наблюдаются у 2,3% пациентов, получавших нетилмицин, у 7,7%, получавших гентамицин, 9,7% — тобрамицин и 13,8% — амикацин [9]. Ототоксичность проявляется как в виде вестибулярных нарушений (чаще при применении стрептомицина, гентамицина, тобрамицина), так и в виде нарушения слуха (амикацин, нетилмицин). Нарушение слуха и поражение преддверно-улиткового нерва могут оказаться необратимыми, вероятность данных реакций возрастает с повышением дозы препарата, при длительных курсах лечения, у больных пожилого возраста и пациентов с исходными нарушениями функции слухового аппарата. Нарушения функции почек при применении аминогликозидов, напротив, чаще всего обратимы. Высокой нефротоксичностью обладает гентамицин, наиболее безопасными препаратами являются амикацин и нетилмицин. В ряде случаев применение аминогликозидов сопровождается нарушением нервно-мышечной проводимости, развитием парестезий, периферических нейропатий.
С точки зрения профилактики развития побочных реакций наибольшее значение имеет отмеченный ранее контроль основных фармакокинетических параметров, которые должны быть ограничены заданными пределами (табл. 3 и 4). Одновременное применение аминогликозидов с другими лекарственными препаратами, выводящимися из организма путем почечной экскреции, также относится к числу факторов риска, влияющих на частоту или степень проявления нежелательных реакций. Аминогликозиды не рекомендуется применять вместе с амфотерицином В, цисплатином, миорелаксантами и ванкомицином.
На протяжении длительного времени аминогликозиды относятся к широко применяемым антибактериальным препаратам и входят в стандарты лечения инфекций различной локализации (табл. 5). На современном этапе практическое значение данной группы антибиотиков, в первую очередь, связано с лечением нозокомиальных инфекций, вызываемых преимущественно грамотрицательными микроорганизмами. Основными показаниями к применению аминогликозидов II и III поколения являются тяжелые инфекции: сепсис, септический эндокардит, остеомиелит, инфекции кожи и мягких тканей, нозокомиальная пневмония, генерализованные формы раневой и ожоговой инфекции, перитонит, послеоперационные гнойные осложнения, инфекции почек и мочеполовых путей и др. В большинстве случаев аминогликозиды назначаются в комбинации с бета-лактамными и антианаэробными антибиотиками. Следует отметить, что в качестве средства эмпирической терапии может служить только амикацин, поскольку к нему сохраняют высокую чувствительность более 70% штаммов грамотрицательных бактерий. Назначение других аминогликозидов рекомендовано после подтверждения чувствительности к гентамицину или конкретному антибиотику выделяемых возбудителей.
Резистентность микроорганизмов к аминогликозидам
К сожалению, более чем полувековое использование аминогликозидов, в том числе по необоснованным показаниям (внебольничные инфекции дыхательных путей и пр.), привело к возникновению и распространению устойчивых к ним штаммов микроорганизмов [10]. В частности, в России уровень резистентности к аминогликозидам, прежде всего к гентамицину, превышает таковой в большинстве других стран [11].
Формирование устойчивости к аминогликозидам обусловлено в первую очередь ферментативной инактивацией антибиотиков путем модификации [11, 12]. Модифицированные молекулы теряют способность связываться с рибосомами и подавлять синтез белка микроорганизмов. Известны три группы аминогликозидмодифицирующих ферментов (АМФ): ацетилтрансферазы (ААС), присоединяющие молекулу уксусной кислоты, фосфортрансферазы (АРН), присоединяющие молекулу фосфорной кислоты, нуклеотидил- или аденилилтрансферазы (ANT), присоединяющие молекулу нуклеотида аденина (табл. 6). В целом именно гентамицин является субстратом для значительно большего количества АМФ, чем другие аминогликозиды II и III поколения, что определяет высокий уровень резистентности к данному антибиотику. Напротив, возможность модифицирования амикацина обуславливает наименьшее среди аминогликозидов количество АМФ, поэтому к нему сохраняют чувствительность ряд бактерий, резистентных к гентамицину, нетилмицину и другим препаратам этой группы.
Согласно данным по антибиотикорезистентности в России за период 2002–2004 гг., чрезвычайно высокая резистентность нозокомиальных штаммов P. aeruginosa и Klebsiella pneumoniae наблюдалась к гентамицину, составляя 74,9% и 76,5% соответственно — рис. 2, рис. 3 [13]. Наиболее активен в отношении данных возбудителей амикацин, к которому нечувствительны до 35,8% штаммов K. pneumoniae и 42,9% P. aeruginosa.
В другом же исследовании (Micromax), проведенном в стационарах Москвы, Смоленска и Екатеринбурга частота выделения нечувствительных к амикацину штаммов P. aeruginosa и K. pneumoniae составила 11% и 10,8% соответственно [14]. В этой связи чрезвычайно важно руководствоваться именно локальными данными по антибиотикорезистентности возбудителей.
Применение аминогликозидов в лечении инфекций дыхательных путей
В связи с тем, что аминогликозиды не обладают активностью в отношении основного возбудителя внебольничных инфекций дыхательных путей — S. pneumoniae, их нельзя использовать для лечения внебольничной пневмонии (как в амбулаторной, так и стационарной практике) и других внебольничных инфекций верхних и нижних отделов респираторного тракта. Пожалуй, единственной клинической ситуацией, оправдывающей назначение аминогликозидов, является тяжелая внебольничная пневмония, вызванная P. aeruginosa. В данном случае применяются цефтазидим, цефепим, цефоперазон/сульбактам, тикарциллин/клавуланат, пиперациллин/тазобактам, карбапенемы (меропенем, имипенем) или ципрофлоксацин либо в режиме монотерапии или комбинации с аминогликозидами II–III поколения (предпочтительным является применение амикацина) [15].
Абсцесс легкого и эмпиема плевры
Потенциальными возбудителями абсцесса легкого являются анаэробные микроорганизмы — Fusobacterium nucleatum, Peptostreptococcus spp., Bacteroides spp. либо ассоциации анаэробных и аэробных бактерий (в первую очередь, представители семейства Enterobacteriacea — K. pneumoniae и K. оxytoca) [16]. Российские эксперты в качестве препаратов выбора рекомендуют применение ингибиторозащищенных аминопенициллинов (амоксициллин/клавуланат, ампициллин/сульбактам) либо цефоперазон/сульбактама. При отсутствии этих антибиотиков либо их неэффективности могут использоваться карбапенемы, ингибиторозащищенные пенициллины (тикарциллин/клавуланат, пиперациллин/тазобактам) либо комбинации клиндамицина с аминогликозидами II и III поколения [17].
В этиологии эмпиемы плевры ведущую роль занимают грамотрицательные бактерии (15–32%) и анаэробы (5–19%). На долю S. aureus приходится от 7 до 15% случаев, S. pneumoniae выделяется у 5–7% больных, еще реже встречается H. influenzae. В 20–25% случаев обнаруживают микробные ассоциации, прежде всего, анаэробов и аэробов, представленных грамотрицательными бактериями [18]. Антибактериальная терапия должна, по возможности, проводится целенаправленно, т. е. с учетом данных микробиологического исследования содержимого плевральной полости. При острой постпневмонической эмпиеме плевры, вызванной S. pneumoniae и S. pyogenes, в качестве препаратов выбора используются цефалоспорины ІІ–ІV поколений в режиме монотерапии. Альтернативой им являются линкосамиды или ванкомицин. При стафилококковой острой постпневмонической эмпиеме применяют оксациллин либо цефазолин, в качестве альтернативы рассматриваются линкосамиды, фузидиевая кислота, ванкомицин и линезолид. В случае острой постпневмонической эмпиемы плевры, вызванной Haemophilus influenzae, препаратами выбора являются цефалоспорины III или IV поколения. Альтернативой им являются «защищенные» аминопенициллины (амоксициллин/клавуланат, ампициллин/сульбактам) или фторхинолоны.
В этиологии подострой и хронической эмпиемы плевры ведущую роль занимают анаэробные стрептококки, бактероиды, часто в ассоциации с микроорганизмами семейства Enterobacteriaceae. Препаратами первой линии в данном случае являются «защищенные» аминопенициллины — амоксициллин/клавуланат или ампициллин/сульбактам. В качестве препаратов альтернативы рекомендуются линкосамид в сочетании с аминогликозидом II или III поколения, либо цефалоспорины II–IV генерации, либо карбапенемы (имипенем, меропенем), либо тикарциллин/клавуланат или пиперациллин/тазобактам [17]. При эмпиеме плевры, как правило, без хирургического вмешательства невозможно добиться излечения пациента, и в большинстве случаев требуется торакотомическое дренирование, реже применяется торакоскопия и декортикация.
Нозокомиальная пневмония
Нозокомиальная пневмония (НП) занимает второе место среди всех нозокомиальных инфекций (13–18%) и является самой частой инфекцией (≥ 45%) в отделениях реанимации и интенсивной терапии (ОРИТ) [19, 23]. НП развивается в среднем у 0,5–1% всех госпитализированных больных и у 10–20% госпитализированных в ОРИТ. Особая категория НП у пациентов, находящихся на искусственной вентиляции легких (вентиляторассоциированная пневмония — ВАП), развивается у 9–27% от общего числа интубированных. По показателю смертности НП лидирует среди нозокомиальных инфекций, вызывая летальные исходы в среднем от 30 до 70% пациентов [20, 21].
НП наиболее часто вызывается аэробными грамотрицательными микроорганизмами — P. aeruginosa, E. coli, K. pneumoniae и Acinetobacter spp. (рис. 4). В последнее время отмечается увеличение частоты обнаружения S. aureus, в том числе МR (MRSA) [21]. Большинство случаев НП имеет полимикробную этиологию [22]. Частота встречаемости полирезистентных возбудителей зависит от популяции пациентов (чаще всего у больных с тяжелыми хроническими заболеваниями, факторами риска развития пневмонии и поздним развитием пневмонии > 5 дней), стационара и типа отделения, что свидетельствует о крайней необходимости получения локальных данных.
При выборе антибиотиков для эмпирической антибактериальной терапии НП необходимо ориентироваться в первую очередь на локальные данные по антибиотикорезистентности возбудителей. Необходимо помнить, что эти данные нуждаются в периодическом обновлении, так как устойчивость бактерий может изменяться с течением времени в зависимости от структуры и частоты использования антибиотиков.
В настоящее время рекомендован подход к антибиотикотерапии НП в зависимости от сроков развития заболевания. При ранней НП (≤ 5 дней), развившейся у пациентов без факторов риска, применяют цефалоспорины III и IV поколения, амоксициллин/клавуланат, левофлоксацин, моксифлоксацин, ципрофлоксацин и эртапенем в режиме монотерапии.
Напротив, у пациентов с поздней (> 5 дней) НП или при наличии факторов риска полирезистентных возбудителей рекомендована комбинированная терапия — антисинегнойный цефалоспорин или карбапенем или цефоперазон/сульбактам в сочетании с амикацином или фторхинолоном с синегнойной активностью.
Аминогликозиды также применяются в комбинации с карбапенемом при НП установленной этиологии, в частности, вызванной E. coli, K. pneumoniae, другими грамотрицательными микро-
организмами (Enterobacter spp., Morganella spp., Serratia spp.), P. aeruginosa или Acinetobacer spp. (табл. 7).
Традиционная длительность терапии НП составляет 14–21 день, однако современная тактика ведения пациентов с ВП предусматривает сокращение длительности антибиотикотерапии до 7 дней в случае эффективной начальной эмпирической терапии [21]. При использовании аминогликозидов для комбинированной эмпирической терапии, их применение может быть прекращено через 5–7 дней у пациентов с клинической эффективностью лечения.
В заключение необходимо еще раз отметить, что применение аминогликозидов для лечения внебольничных инфекций дыхательных путей недопустимо, при внутрибольничных инфекциях аминогликозиды (нетилмицин, амикацин) должны использоваться только лишь в определенных клинических ситуациях и только в комбинации с другими антибактериальными препаратами.





 Читайте также:
Читайте также: