Гипоксия головного мозга что это такое
Хроническая гипоксия: причины, симптомы и способы лечения
Без кислорода жизнь невозможна. Его дефицит отрицательно влияет на все органы, особенно на головной мозг. Если с током плазмы О2 поступает не в полной мере, надвигается кислородный голод или по-другому гипоксия. Объясняется это просто: для полноценной работы мозга требуется более 20% минутного объема кровотока, а это солидное количество.
Наступление гипоксии губительно для мозга. При наступлении острой стадии он способен работать не более 4-5 секунд. По истечению 10-13 секунд наступает бессознательное состояние, а через 30-35 секунд – коматозное. Если патология сохраняется 5-6 минут, наступает гибель клеток, к тому же необратимая.
Причины появления
В основе классификации кислородного голодания лежат причины возникновения болезни.
Чаще всего у взрослых гипоксии развиваются на базе:
Кроме того, такая реакция может развиваться на алкоголь, на аллергены, что приводят к отеку гортани, и в результате болезней нервной системы.
Симптомы
У взрослых кислородное голодание выражается стандартной клинической картиной.
Способы лечения
Схема лечения для взрослых разрабатывается исходя из точной первопричины, которая диагностируется посредством современных технологий. Если больной детально сформулирует те факторы, что спровоцировали гипоксию, врачу будет легче назначить терапевтические мероприятия.
Они могут проходить дома, а также в стационаре. Как правило, рекомендуются средства, которые стабилизируют правильную работу организма. Больной принимает лекарства для восстановления полного кровоснабжения, а значит и полноценной работы тканей мозга.
Бывает, что взрослому человеку с легкой стадией нехватки кислорода достаточно дольше бывать на воздухе. Если же причина в нарушении или в болезни пациента, тогда ему в частности потребуются:
Последствия, если не лечить
Мгновенная и острая стадия может послужить причиной смертельного исхода. Остальные же случаи чреваты головокружениями, расстройством зрения и речи. Конечно, реабилитация поможет восстановить выполнение утраченных обязанностей, но остаточные отклонения могут сохраняться.
Хроническая гипоксия вызывает одышку и гипертонию, образование тромбов и повышенное число митохондрий. Длительное течение кислородного голодания постепенно приводит к нарушению функций и декомпенсации.
Как справляться с ХГ при помощи концентраторов кислорода? И можно ли это делать?
Это делать нужно, как для лечения, так и для предотвращения подобных болезней. Такая терапия насыщает организм кислородом, к тому же высокой концентрации. По эффективности такое лечение стоит рядом с СИПАП-терапией.
Современные концентраторы отделяют чистый кислород из окружающего воздуха посредством фильтров. Очищенный, он попадает в редуктор, увлажняется парами и немного нагревается.
Лечение проводится при каждом заболевании индивидуально. Кислород же применяется разной концентрации.
Кислородное голодание
Кислородное голодание может возникнуть как при недостаточном содержании кислорода в окружающей атмосфере, так и при некоторых патологических состояниях.
Гипоксия головного мозга наблюдается при нарушениях мозгового кровообращения, шоковых состояниях, острой сердечно-сосудистой недостаточности, полной поперечной блокаде сердца, отравлении окисью углерода и при асфиксии различного происхождения. Гипоксия головного мозга может возникать как осложнение при операциях на сердце и магистральных сосудах, а также в раннем послеоперационном периоде. При этом развиваются разнообразные неврологические синдромы и психические сдвиги, причем преобладают общемозговые симптомы, диффузное расстройство функций ЦНС.
Патогенез (что происходит?) во время Кислородного голодания:
Микроскопически может наблюдаться отек головного мозга. Ранним признаком гипоксии является нарушение микроциркуляторного русла – стазы, плазматическое пропитывание и некробиотические изменения сосудистых стенок с нарушением их проницаемости, выходом плазмы в перикапиллярное пространство. При тяжелой форме острой гипоксии рано выявляются различной степени поражения нейроцитов вплоть до необратимых. В клетках головного мозга обнаруживают вакуолизацию, хроматолиз, гиперхроматоз, кристаллические включения, пикноз, острое набухание, ишемическое и гомогенизирующее состояние нейронов, клетки-тени. Отмечаются грубые нарушения ультраструктуры ядра, его мембраны, деструкция митохондрий, осмиофилия части нервных клеток.
Выраженность изменений клеток зависит от тяжести гипоксии. В случаях тяжелой гипоксии может происходить углубление патологии клетки после устранения причины, вызвавшей гипоксию; в клетках, не имеющих признаков серьезных повреждений в течение нескольких часов, спустя 1-3 сут и позже можно обнаружить структурные изменения различной тяжести. В дальнейшем такие клетки подвергаются распаду и фагоцитозу, что приводит к образованию очагов размягчения; однако возможно и постепенное восстановление нормальной структуры клеток.
При хронической гипоксии морфологические изменения нервных клеток обычно менее выражены; глиальные клетки ЦНС при хронической гипоксии активизируются и усиленно пролиферируют.
Симптомы Кислородного голодания:
При возникновении острой кислородной недостаточности часто развивается возбуждение нервной системы, сменяющееся торможением и нарастающим угнетением ее функций. Возбуждение сопровождается двигательным беспокойством, эйфорией, учащением сердцебиения и дыхания, бледностью кожных покровов, появлением холодного пота на лице и конечностях. Вслед за более или менее длительным периодом возбуждения (а нередко и без него) развиваются явления угнетения с возникновением потемнения в глазах (после предшествовавшего «мелькания» перед глазами), головокружения, сонливости, общей заторможенности, оглушенности, с постепенным угнетением сознания.
Растормаживание и индукционное усиление деятельности подкорковых образований сопровождаются беспорядочной двигательной активностью, судорожными сокращениями мышц, общими тоническими и клоническими судорогами. Этот период обычно бывает кратковременным. Дальнейшее распространение торможения сопровождается изменением безусловных рефлексов: выпадают сначала кожные рефлексы (брюшные, подошвенные, кремастерные), затем надкостничные (запястно-лучевые, надбровные) и, наконец, сухожильные, которые вначале резко усиливаются, а потом угасают, обычно сначала на верхних, а затем на нижних конечностях. Далее выпадают зрачковые и корнеальные рефлексы. Однако последовательность исчезновения рефлексов не всегда бывает одинаковой; отмечаются случаи длительного сохранения отдельных рефлексов при отсутствии остальных. Двигательные расстройства характеризуются развитием спастического паралича с повышением тонуса мышц, рефлексов, появлением патологических и защитных рефлексов, а затем тонус мышц снижается, рефлексы угасают. При быстром развитии глубокого кислородного голодания уже через несколько десятков секунд происходит потеря сознания, а спустя 1-2 мин развивается кома. Вследствие гипоксии мозга могут развиваться следующие неврологические синдромы.
• Коматозные состояния (в зависимости от распространенности угнетения функций мозга
и уровня регуляции сохранившихся функций):
а) состояние декортикации (подкорковая кома); б) переднестволовая (диэнцефально-мезэнцефальная), или «гиперактивная», кома;
в) заднестволовая, или «вялая», кома; г) терминальная (запредельная) кома.
• Состояния частичного нарушения сознания: а) сопор; б) оглушение; в) сомноленция.
• Синдромы диффузного органического поражения: а) тяжелая постгипоксическая
энцефалопатия (с мнестическими, зрительными, мозжечковыми, стриарными расстройствами);
б) умеренно выраженная постгипоксическая энцефалопатия.
• Астенические состояния (постгипоксическая астения с явлениями гипо- и гиперстении).
Перечисленные синдромы могут быть фазами проявления последствий гипоксии мозга.
В основе наиболее тяжелой степени коматозного состояния (запредельная кома) лежит угнетение функций центральной нервной системы, клинически проявляющееся арефлексией, гипотонией мышц, отсутствием электрической активности мозга («молчание»), расстройствами дыхания. Сохраняются деятельность сердца, автоматическая деятельность других органов за счет периферической вегетативной регуляции.
С частичным восстановлением функций подкорковых узлов связаны особенности подкорковой комы, или состояния декортикации. Клиническая картина ее характеризуется выраженными симптомами орального автоматизма (иногда сосательными и жевательными движениями), усилением деятельности подкорковых рефлекторных уровней – стволовых, спинальных, периферических, вегетативных. Сухожильные рефлексы повышены, кожные – угнетены, вызываются стопные и кистев ые патологические рефлексы. Явления раздражения проявляются хореиформными и атетоидными гиперкинезами, миоклоническими подергиваниями в отдельных мышечных группах. На ЭЭГ определяются диффузные медленные волны.
По мере восстановления сознания у больных возникает состояние оглушения. Более глубокое оглушение определяется как сопор, легкие степени оглушения постепенно сменяются сомноленцией, что соответствует восстановлению функций коры головного мозга. При этом признаки восстановления сочетаются с симптомами выпадения и раздражения. Особенности клиники в большей степени определяются состоянием лимбико-ретикулярного комплекса.
При сопорозных состояниях имеются лишь самые элементарные реакции на внешние раздражения. На ЭЭГ обычно доминируют медленные волны. Оглушение сопровождается затруднением понимания больным сложных фраз, ограничением способности произвольных движений, затруднением запоминания. Больные обычно лежат неподвижно. На фоне оглушения иногда возникают сноподобные (онейроидные) состояния. При сомнолентных состояниях больных можно легко вывести из дремотного состояния, они адекватно отвечают на вопросы, но крайне быстро устают. На фоне состояния оглушения выявляются мнестические, гностические, праксические нарушения, симптомы поражения мозжечка и экстрапирамидной системы, а также другие органические симптомы. Такие нарушения определяются как постгипоксическая энцефалопатия, которая характериз уется преи мущественно выраженными расстройствами сознания, памяти, агнозиями, апраксиями, речевыми нарушениями (в форме афазий, дизартрии или мутизма), мозжечковыми симптомами, стриарными гиперкинезами, диффузными очаговыми органическими симптомами. В дальнейшем при восстановлении функций (иногда далеко не полном) долго сохраняются неврастеноподобные симптомы, характерные для постгипоксической астении. В основе этих состояний лежит ослабление тормозного процесса с развитием раздражительной слабости, повышенной возбудимости, бессонницы, снижением внимания и памяти (гиперстеническая форма) либо ослабление и тормозного, и возбудительного процессов, сопровождающееся вялостью, сонливостью, обшей заторможенностью (гипостеническая форма).
Лечение Кислородного голодания:
Противогипоксические средства весьма перспективны, но пока применяются главным образом в эксперименте. Большого внимания заслуживают попытки создания новых хинонов (на основе ортобензохинона). Защитными свойствами обладают препараты типа гутимина, оксибутирата натрия, а также средства из группы ноотропов.
К каким докторам следует обращаться если у Вас Кислородное голодание:
Кислородное голодание мозга: симптомы и лечение
Предугадать появление гипоксии весьма сложно. Заболевание может развиться не только в весьма преклонном возрасте, но и в процессе внутриутробного созревания плода. Состав крови во время болезни сильно изменяется, из-за чего к тканям головного мозга она поступать прекращает. Человеку с патологией необходима квалифицированная помощь врачей, иначе он может впасть в состояние комы, а иногда даже погибнуть. Поэтому важно проконсультироваться с врачом при первом подозрении на появление гипоксии. В быту для профилактики и лечения патологического состояния можно использовать кислородный концентратор.
Общая симптоматика
Выявить болезнь можно по таким признакам, как:
Чем дольше человек болеет, тем больше проявлений болезни на каждой из стадий возникает:
Гипоксический тип
Может развиваться если недостаточное питание кислородом было в течение весьма долгого промежутка времени. Чаще всего заболевание проявляется у людей, регулярно бывающих на горных склонах и вершинах, летающих самолетами, а также длительно находящихся в помещениях закрытого типа, где практически нет доступа к свежему воздуху (к примеру подлодки, бункеры и пр.). Уровень гемоглобина при этом значительно снижается. Нередко у больного возникают проблемы с водно-солевым балансом, а также тонусом кровеносных сосудов. Также возникает гипервентиляция легких из-за повышения возбудимости дыхательных центров.
Характерными признаками гипоксической формы заболевания являются:
Если вовремя не приступить к лечению, то на последних стадиях появляются приступы непроизвольного мочеиспускания. Человек нередко теряет сознание и, в итоге, впадает в кому.
Коматозный тип
Спустя примерно 50-60 сек после того, как кислород прекращает поступать к тканям, наступает коматозное состояние. Заболевание развивается постепенно, в несколько стадий, и сопровождается определенными симптомами:
Уже спустя пять минут после перехода больного в состояние комы мозг человека может погибнуть. На четвертой стадии возникает большой риск летального исхода (90%).
Лечение медикаментами
Гипоксию лечат, применяя лекарства различных групп:
Физиотерапевтические процедуры
Помимо этого пациенту могут назначить УВЧ, лечебные массажи, а также магнитную терапию. Часто обращаются и к восточной медицине, где применяются иглоукалывание, лекарства природного происхождения и чаи на основе лекарственных трав, а также специальные комплексы физических упражнений. Оптимальные способы лечения больному должен назначать только лечащий врач. Однако в любой ситуации желательно купить кислородный концентратор, чтобы восстанавливать здоровье не только в стенах медицинского учреждения, но и дома.
Гомеопатия
Людям с гипоксией можно принимать:
Народные методы
Больным рекомендуется выполнять гимнастические упражнения. Атеросклероз можно лечить смесью из имбиря, меда и оливкового масла. Если больного мучают спазмы, то нужно употреблять чесночную настойку. Чтобы быстро повысить уровень гемоглобина, многие советуют употреблять много гречневой крупы, смешанной с грецким орехом, имбирем и медом,
Гипоксию также часто лечат при помощи травяных отваров и настоев. Чаще всего для них используют пустырник, ромашку, валериану, боярышник и зверобой. Восстановить функционирование органов дыхания можно корнем солодки, бузиной, подорожником, мать-и-мачехой и почками сосны. А при помощи тысячелистника, полыни либо одуванчика обыкновенного нормализуют концентрацию гемоглобина в крови.
Гипоксия, негипоксическая гипоксия и иммунитет
Автор
Редактор
Статья на конкурс «био/мол/текст»: За миллионы лет с момента появления кислорода на Земле Природа-матушка наэволюционировала весьма сложный и красивый механизм чувствительности к сниженному содержанию кислорода — гипоксии. Механизм этот регулировал массу разнообразных процессов, и было бы очень жаль (а может быть и лень) упускать возможность сделать его не только кислород-чувствительным. Так появилась так называемая негипоксическая гипоксия или гипоксия без гипоксии, проявления которой ученые в настоящее время находят в самых разнообразных органах и тканях. Не обделена была и иммунная система, для которой функционирование кислород-чувствительных систем является зачастую очень критичным моментом. В статье предпринята попытка осветить некоторые современные аспекты этой области и рассмотреть наиболее интригующие механизмы.
Обратите внимание!
Эта работа опубликована в номинации «лучшая статья по иммунологии» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
«Опять гипоксия! Слышали уже много раз!» — возразит читатель, который, должно быть, уже приготовился услышать томный пересказ глав учебника по патофизиологии про то, что гипоксия бывает экзогенной, респираторной, гемической и много еще какой; возможно, читатель приготовился к рассказам об альпинистах или жизни людей в барокамерах. Позвольте рассказать о другом. О негипоксической гипоксии, например. Как не слышали? Тогда приятного чтения!
История открытия
Рисунок 1. Первооткрыватель HIF, профессор Грегг Семенза.
Как и многие истории, всё началось с пивных баров и, увы, весьма печально. В середине 1960-х годах по США, Бельгии и ряду других стран среди отчаянных любителей пива прокатилась необычная хворь — кардиомиопатия, имеющая по всем характеристикам признаки токсической, обусловленной накоплением неизвестного тяжелого металла. Довольно быстро виновник был найден: им оказался хлорид кобальта (II) — популярный среди ряда крупных пивоварен эффективный пеногаситель. Интересно, что помимо кардиомиопатии у бедняг-пьяниц наблюдался высокий уровень гемоглобина, который коррелировал с высоким уровнем эритропоэтина [1]. Да-да, именно того самого эритропоэтина, на выработку которого так уповают спортсмены, тренируясь в условиях высокогорной гипоксии. Означало ли это, что гипоксию можно заменить приемом двухвалентого пива кобальта? Похоже, что так!
Успокою взволнованных любителей пива и замечу, что чтобы получить кобальтовую кардиомиопатию, потреблять пива необходимо было неимоверно много — около 4 литров в сутки, а всем остальным, возможно, пиво дарило даже некоторое «окрыление» на фоне повышенного гемоглобина. Так или иначе, добавку запретили, разрешив ее ограниченно применять в скотоводстве.
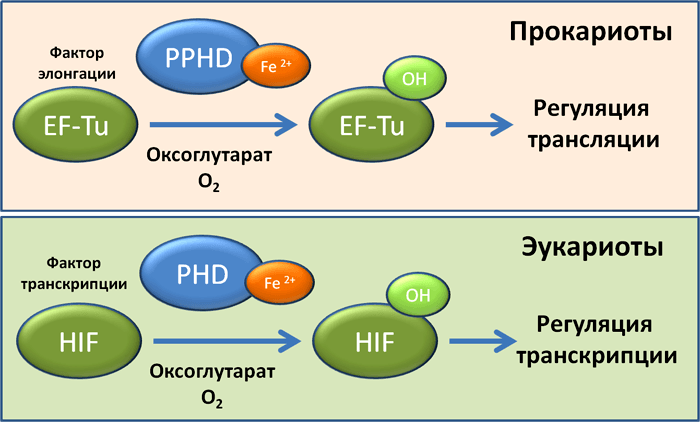
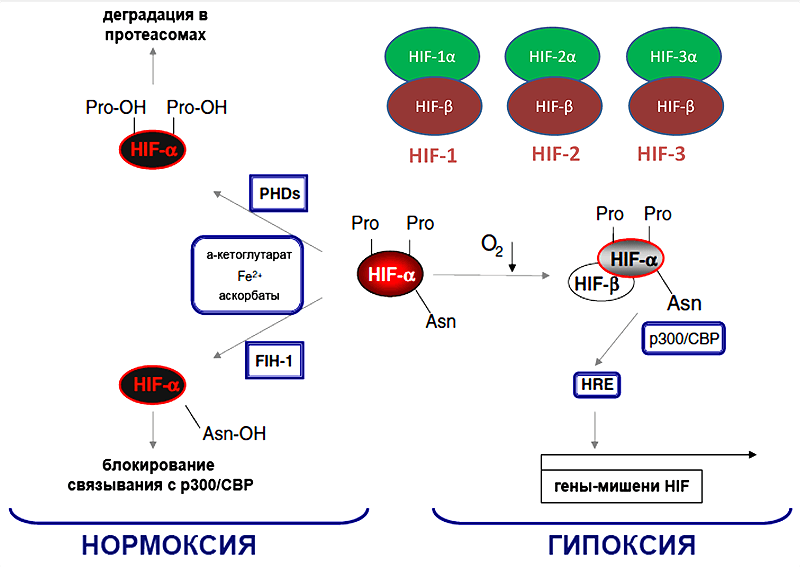
Неизвестно, был ли знаком с этой историей молодой врач-педиатр Грегг Семенза из госпиталя Джонса Хопксинса (рис. 1). Задача постдока Грегга состояла в поиске фактора, регулирующего активность промотора гена эритропоэтина в условиях гипоксии. Постепенно, шаг за шагом, в 1992 году был найден фактор, в 1995 году стало ясно, что фактор представляет собой гетеродимер, в котором одна из субъединиц является кислород-зависимой, в 2001 году был определен механизм, благодаря которому происходит регуляция стабильности кислород-зависимой субъединицы — гидроксилирование с помощью пролилгидроксилаз. Фактору дали красноречивое название — hypoxia-induced factor, или, сокращенно, HIF [2].
Следует отметить, что во всех клеточных экспериментах Семензы гипоксия могла быть заменена добавлением хлорида двухвалентного кобальта. И это уже не просто совпадение, это научный факт.
Некоторые современные сведения о факторах HIF
Далее дорогой читатель будет вынужден простить мне несколько справочный раздел, суммирующий часть современных сведений о факторе HIF.
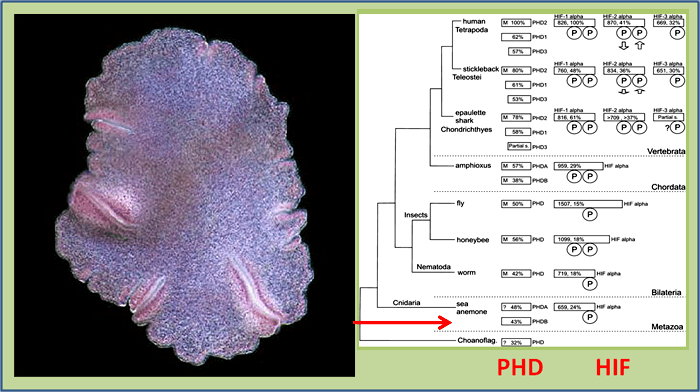
Рисунок 3. Простейшее многоклеточное животное Trichoplax adhaerens (слева) и его положение в истории эволюции PHD-HIF системы у животных (справа). Фото трихоплакса с сайта geneticarchaeology.com.
Рисунок 4. Факторы транскрипции HIF 1-3 и классический кислород-зависимый путь регуляции их активности.
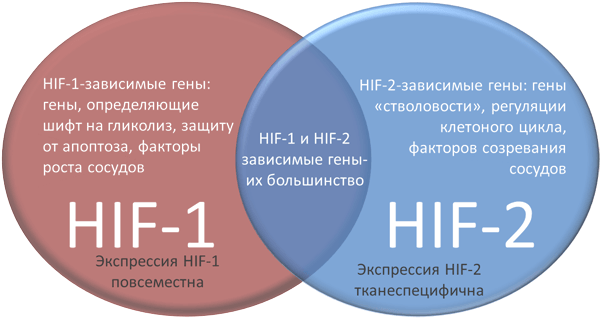
Рисунок 5. Различия HIF-1 и HIF-2.
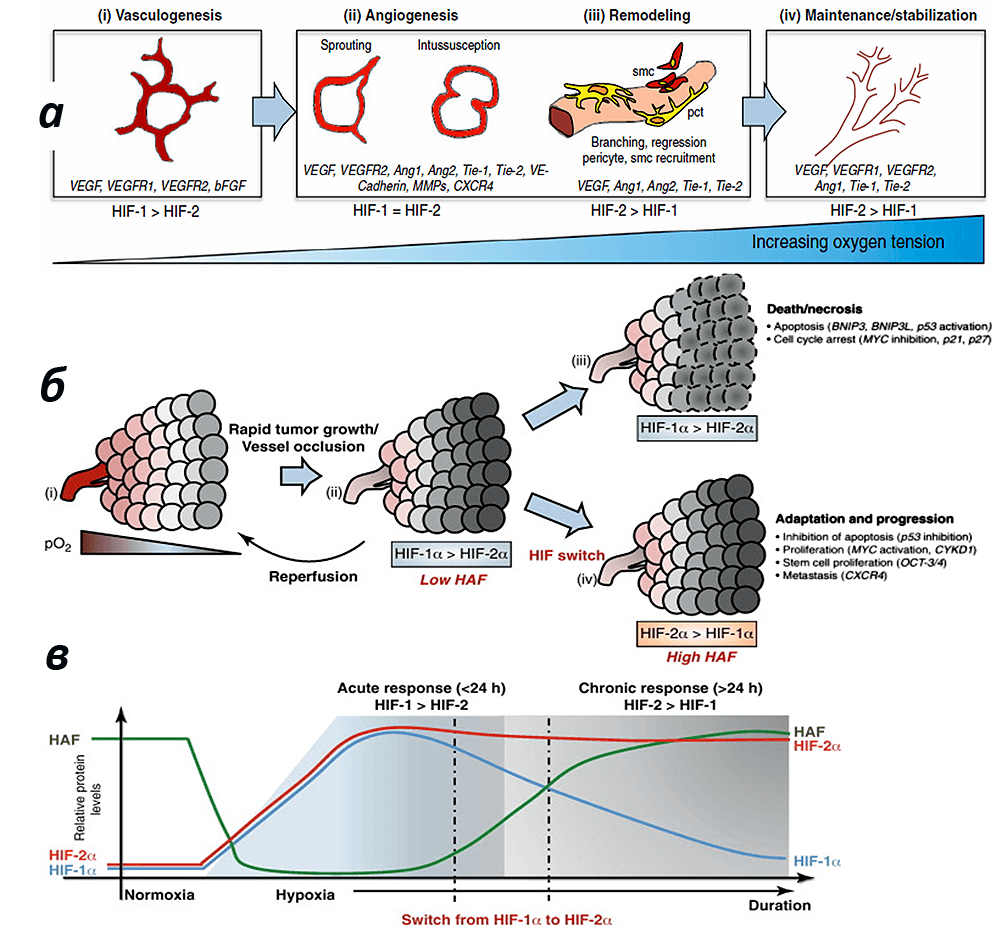
Рисунок 6. Понятие переключения изоформ HIF-1 → HIF-2. По мере роста сосуда (а) опухолевой ткани (б) в след за изменением степени гипоксии от острой до умеренной происходит переключение с HIF-1 изоформы на HIF-2 (в) c экспрессией различного спектра факторов. Рисунок из [12] с изменениями.
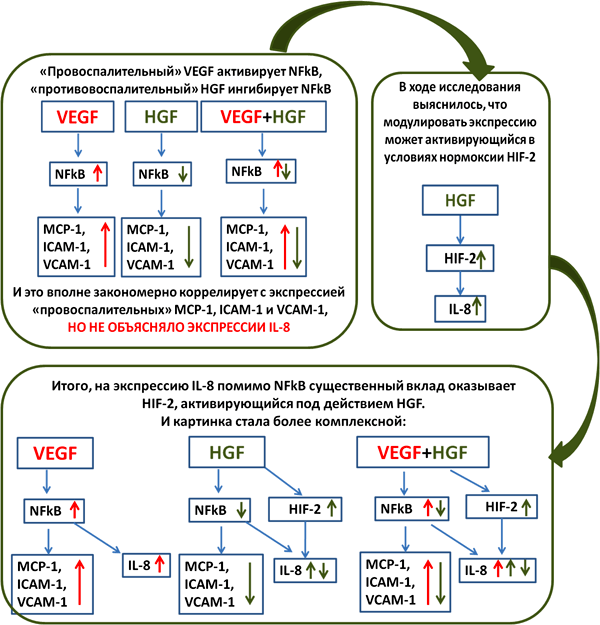
Рисунок 7. Этапы моей дипломной работы, иллюстрирующие то, как негипоксическая активация HIF-2 может вносить свои коррективы в экспрессию хемокинов.
Итак, дорогой читатель, я надеюсь, что вы не сильно утомились ознакомлением первой части рассказа. Скорее перейдем к его иммунологическому разделу!
Роль факторов HIFs в иммунных клетках
И для начала несколько соображений общего характера [16, 17]:
Тема неимоверно интересная и обширная, поэтому я ограничусь парой историй.
История 1: Treg-лимфоциты vs. Th17-лимфоциты
Наивные CD4+ T клетки в зависимости от микроокружения способны дифференцироваться в различные субпопуляции с весьма отличающимися друг от друга функциями: Th1, Th2, Tfh, Th17 и iTreg. Огромное внимание в вопросах аутоиммунных заболеваний и противоопухолевого иммунитета обращено к двум не так давно открытым популяциям T лимфоцитов — Th17 и iTreg [17].
Th17-клетки дифференцируются из наивных CD4+ лимфоцитов под действием TGF-β и IL-6; критичным является активация транскрипционных факторов STAT3 и RORgt. Th17-лимфоциты обладают мощным бактерицидным и фунгицидным действием за счет секреции IL-17 и IL-22. Однако вследствие своего избыточного воспалительного потенциала, Th17 печально известны как участники многих аутоиммунных заболеваний.
Индуцированные iTreg дифференцируются из наивных CD4+ лимфоцитов под действием TGF-β и IL-2; критичным является активация транскрипционного фактора Foxp3. Treg вырабатывают IL-10, TGFβ, экспрессируют на своей поверхности много интересных молекул (типа рецептора к IL-2 СD25, ингибиторного корецептора CTLA-4), за счет которых проявляют свои иммуносупрессивные свойства.
Итого, мы имеем две субпопуляции лимфоцитов, обладающих диаметрально противоположными свойствами, не способными перепрограммироваться друг в друга и происходящие из единого предшественника — наивных CD4+ лимфоцитов. Часто говорят о балансе Treg и Th17, сдвиге баланса либо в иммуносупрессивную, либо в провоспалительную сторону при разных заболеваниях, и подчеркивают первостепенную важность механизмов, определяющих дифференцировку по одному из двух путей. Кратко рассмотрим механизмы и попытаемся понять, в чем соль.
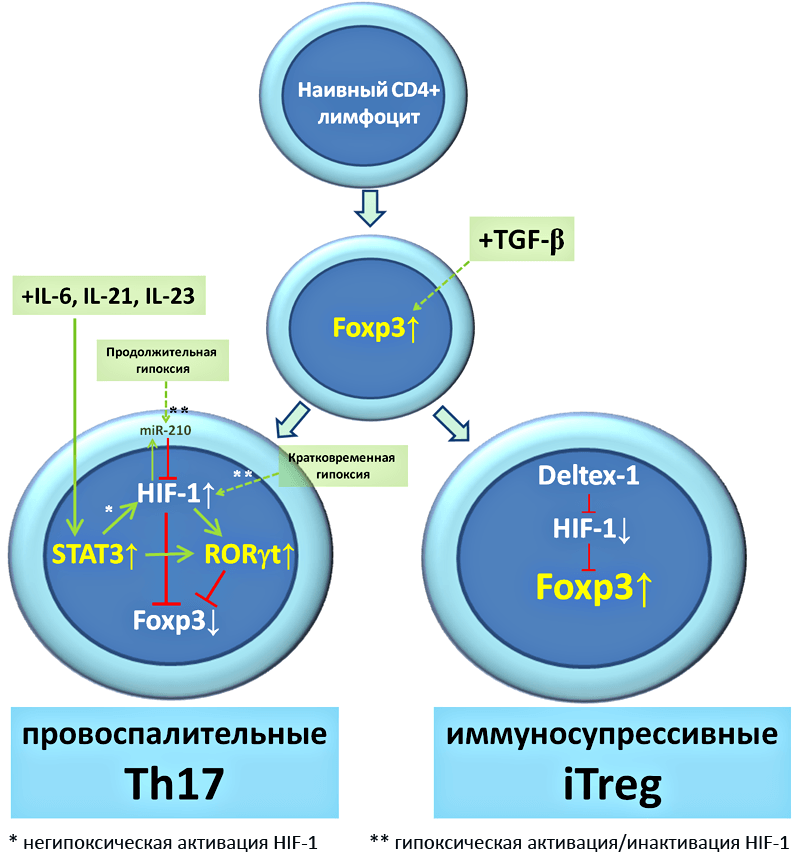
Первое, на что внимательный читатель обратит внимание, это общий для двух субпопуляций индуктор TGFβ. Известно, что сами по себе высокие концентрации TGFβ способны поддерживать активацию Foxp3 и коммитировать образование iTreg. Однако для Th17 также характерна активация Foxp3, которая в обязательном порядке должна быть подавлена. Подавляется она за счет активации фактора STAT3 (под действием IL-6, IL-21 или IL-23), что, в свою очередь, активирует RORgt, который активно подавляет активность Foxp3 и определяет экспрессию Th17-специфичных хемокинов.
Теперь о роли HIF-1. Для немиелоидных клеток показано, что активация STAT3 может приводить к негипоксической активации HIF-1. HIF-1, в свою очередь, способен ингибировать Foxp3, причем, вероятно, за счет механизма активации полиубиквитинирования с последующей протеасомной деградацией, т.е. механизма по которому HIF-1 разрушается сам. Ингибируя Foxp3, HIF-1 способствует дифференцировке CD4+ наивных лимфоцитов в Th17 направлении. Что интересно, данную STAT3-зависимую негипоксическую активацию HIF-1 с последующим ингибированием Foxp3 можно заменить циклами периодической гипоксии-нормоксии, которая приводит к стабилизации и накоплению HIF-1 (рис. 8).
Рисунок 8. Роль HIF-1 в дифференцировке CD4+ наивных лимфоцитов в Treg и Th17.
Любопытно, что то же самое не случается в условиях длительной гипоксии. И виной здесь отрицательная обратная связь — длительная гипоксия повышает экспрессию HIF-зависимой микроРНК-210, которая способна подавлять трансляцию HIF-1α.
Приведенную выше концепцию особой роли HIF-1 в активации фактора RORgt (критичного для Th17) и ингибирования Foxp3 (критичного для Treg) подтверждает недавняя замечательная статья о роли фактора Deltex1 в поддержании стабильности Foxp3 за счет ингибирования его негативного регулятора HIF-1 [18].
Не так давно была открыта новая субпопуляция лимфоцитов — Tr1, обладающих иммуносупрессивными свойствами, при этом не экспрессирующих Foxp3 (маркер регуляторных T-лимфоцитов). Tr1 играют особую роль в супрессии воспаления в нервной системы и кишечнике [19].
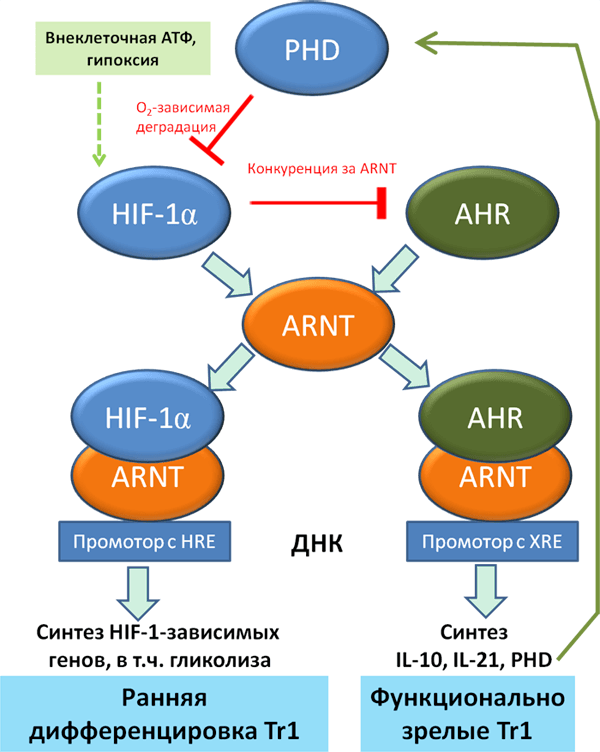
Интересно, что гипоксия и повышенная концентрация внеклеточного АТФ — частые атрибуты воспаления — способны угнетать дифференцировку Tr1-лимфоцитов. Весьма красивым оказался механизм: критичным фактором для дифференцировки в Tr1 лимфоциты является фактор AHR, который при взаимодействии со своим ядерным переносчиком ARNT, переносится в ядро и активирует экспрессию IL-10, IL-21 и прочих факторов, определяющих иммуносупрессивные свойства Tr1-лимфоцитов. Однако ARNT хорошо известен нам как HIF-1β, кислород независимая субъединица, с которой димеризуется HIF-1α. Между HIF-1α и AHR в указанных условиях происходит конкуренция за ARNT и HIF-1α в этой конкуренции побеждает. Впрочем, если условия позволяют, и в схватке побеждает ARNT, ему есть чем ответить — активируясь, он способствует деградации HIF-1α, предположительно за счет повышения экспрессии пролилгидроксилаз PHDs по кислород-зависимому механизму (рис. 9).
Рисунок 9. Роль HIF-1 в дифференцировке иммуносупрессивных Tr1-лимфоцитов.
Хочется отметить также, что угнетающая роль HIF-1α на дифференцировку Tr1-лимфоцитов оказалась не столь уж однозначной — исследователи отмечают то, что активность HIF-1α важна на ранних стадиях дифференцировки, главным образом, за счет своей способности переключать метаболизм на гликолитический тип.
История 2: Врожденный иммунитет и макрофаги
В марте 2015 года в Кембридже прошла любопытнейшая конференция по теме, которая может показаться на первый взгляд очень провокационной — формированию парадигмы памяти врожденного иммунитета. Но не пугайтесь громкого названия; ознакомившись с материалами конференции [20], очень скоро понимаешь, что главной темой было понятие «тренированного» (trained) иммунитета, ставшее уже своего рода классикой.
Суть явления проста: моноцит (или неполяризованный макрофаг М0) после встречи с антигеном через активацию рецепторов врожденного иммунитета (dectin-1, TLRs и др.) способен программироваться метаболически (переходя на гликолитический тип метаболизма) и эпигенетически, становясь таким образом «тренированным» и обеспечивая при повторной инфекции активный ответ. Несложно заметить, что «тренированные» макрофаги есть ни что иное как «классически активируемые» макрофаги, или M1 макрофаги (рис. 10).
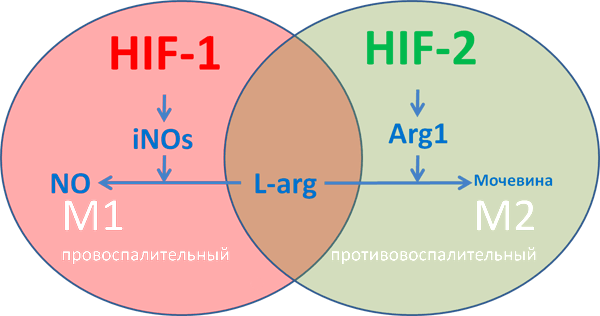
Рисунок 10. М1-макрофаги характеризуются «провоспалительным» фенотипом, преимущественно гликолитическим типом метаболизма, синтезом провоспалительных хемокинов типа IL-1β, экспрессией индуцибельной NO-синтазы iNOs. М2 макрофаги характеризуются «противовоспалительным» фенотипом, преимущественно окислительным фосфорилированием, синтезом аргиназы ARG1 и противовоспалительных хемокинов типа IL-10. У iNOs и ARG1 имеется единый субстрат — L-аргинин, содержание которого в межклеточной среде ограничено.
Про макрофаги, в том числе роль их в противоопухолевом иммунитете, очень здорово и находчиво написано в статье «Одураченные макрофаги, или несколько слов о том, как злокачественные опухоли обманывают иммунитет» [21]. Добавлю — сейчас не вызывает сомнений факт, что важнейшим условием для поляризации в М1-макрофаги является активация HIF-1, а поляризации в M2-макрофаги — активация HIF-2. Активируясь, HIF-1 и HIF-2 контролируют экспрессию соотвествующих генов.
Как в случае с провоспалительными Th17 и супрессорными Treg, между провоспалительными M1 и противоспалительными M2 в тканях наблюдается баланс, нарушение которого может приводить к различным заболеваниям. Так, например, сдвиг в сторону M1-макрофагов в жировой ткани патогенетически связан с развитием метаболического синдрома за счет постоянного хронического воспаления в жировой ткани, ее инсулинрезистентностью, секрецией в кровь провоспалительных хемокинов и адипокинов [22].
Вместо заключения
В настоящее время разработаны/разрабатываются методы селективного ингибирования HIF-1 и HIF-2; селективного ингибирования различных изоформ пролилгидроксилаз PHDs, за счет чего возможно активировать HIF-1 и HIF-2, причем также селективно; можно ингибировать фермент FIH-1и прочие участники пути регуляции кислород-зависимого пути деградации. При желании и достаточной фантазии можно пробовать воздействовать на кислород-независимые пути.
Все это, несомненно, должно найти и, я уверен, найдет применение в практической медицине. Но это потребует крайней обдуманности, многостадийного контроля и досконального изучения. Чем далеко ходить, лучше приведу пример.
Не так давно, в начале-середине 2000-х годов, наблюдался некоторый бум: для многих типов онкологических заболеваний была показана сверхэкспрессия HIF-1α, что вполне соответствовало понятиям об опухолевой биологии: быстрорастущая опухолевая масса в условиях жесткой гипоксии переходит на гликолитический анаэробный тип метаболизма [23], при этом активно секретируя вокруг себя многочисленные факторы роста сосудов, факторы инвазии и т.д. Что делать? Подавим экспрессию HIF-1α и дело в шляпе! Не тут-то было — реальность оказалась сложнее и запутанней.
Так, например, при применении siRNA против HIF-1α на культуре пигментного эпителия сетчатки и эндотелия сосудов, наблюдалось вполне закономерное снижение секреции таких ангиогенных факторов как VEGF, TGF-β (это очень хорошо), но росла секреция IL-8, мощного хемокина с ярко выраженными ангиогенными свойствами (это очень плохо) [24]. Позднее, группой профессора Лобода был раскрыт механизм — дело в том, что HIF-1 подавляет экспрессию IL-8, а HIF-2 — активирует. Подавляя HIF-1 в клетках, исследователи добивались реципрокной активации HIF-2 и экспрессии IL-8 [25]. Такая неоднозначная выходила терапия.
Также нужно быть аккуратными с иммунной системой. Системное подавление HIF-1 при аутоиммунных заболеваниях, возможно, и приведет к снижению популяции Th17 и росту числа Treg, что теоретически способно облегчить течение заболевания, но также способно привести к искусственному комбинированному иммунодефициту за счет дисфункции M1-макрофагов, нейтрофилов, Th1, Th2, Th17 и СD8+ T лимфоцитов.