Гликогенез что это простыми словами
Гликогеноз
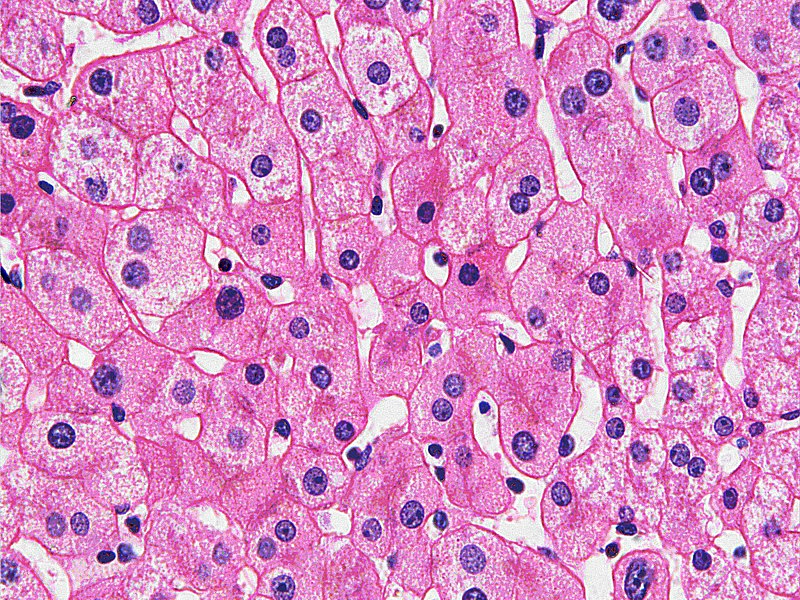
Организм человека имеет энергетический резерв. Одним из соединений, исполняющих данную роль, является гликоген, который способен быстро распадаться на простейшую глюкозу, питая при этом организм энергией. Печень расщепляет гликоген и трансформирует с помощью определенных ферментов. При недостатке этих специфических ферментов гликоген накапливается в печеночной паренхиме и мышечной ткани. Эта патология называется гликогенозом. Заболевание носит наследственный по рецессивному типу характер и развивается по причине генетической мутации.
Печеночная форма гликогеноза
Данная форма заболевания характеризуется локализацией патологического процесса в соответствующем депонирующем органе.
Течение болезни. Заболевание начинает себя проявлять с 8–9-го месяца жизни. До этого времени ребенок развивается нормально или немного замедленно. Первые признаки характеризуются непроизвольным сокращением мышц конечностей, временной потерей сознания. Приступы гипогликемии наблюдаются в основном утром или в большом промежутке времени между приемами пищи. Их появление можно предотвратить приемом сладкой воды. Осложнить течение гликогеноза могут интеркуррентные заболевания (инфекционные процессы). Первые пять лет считаются наиболее опасными для жизни. С возрастом состояние больного улучшается за счет развития компенсаторных механизмов и реакций приспособления. На умственные способности гликогенозы негативного воздействия не оказывают.
Симптомы. Симптоматические патологии проявляются в различной степени тяжести и зависят от ряда факторов, в том числе от вида недостающего фермента, участвующего в обмене глюкозы. Наиболее характерными считаются следующие симптомы: увеличение печени, селезенки, потеря аппетита, аномалии мышечного тонуса, замедленное физическое развитие, воспаление суставов, высокая утомляемость, образование камней в почках, множественные поражения центральной нервной системы, ощущение затруднения дыхания, увеличение размеров сердца и другие.
Диагностика. При физикальном осмотре врач уделяет особое внимание размеру печени. Если констатируется факт ее увеличения, необходимо сдать кровь и мочу на анализы, чтобы комплексно исследовать липидный обмен, уровень глюкозы. Обязательно проводятся гематологическое и молекулярно-генетическое исследования, позволяющие проанализировать активность ферментов и выявить наличие гликогена в тканях. ДНК-диагностика выявляет мутированные гены.
Лечение. Лечение может быть назначено только врачом. Оно обычно состоит из соблюдения диеты и заместительной терапии. Рацион должен включать до 8 приемов пищи в день (включая ночное время). Метод заместительной терапии направлен на восполнение недостающих компонентов в организме для его нормальной жизнедеятельности.
Фосфоглив* —
1. Настоящая информация основана на исследованиях, проводимых ООО «Ипсос Комкон», и действительна по состоянию на декабрь 2016 года
2. Распоряжение правительства РФ от 28 декабря 2016 г. № 2885-р «Об утверждении перечней жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2017 год»
3. Ивашкин В.Т., Бакулин И.Г., Богомолов П.О., Мациевич М.В. и др., 2017 г.
4. Бакулин И.Г., Бохан Н.А., Богомолов П.О., Гейвандова Н.И. и др., 2017 г.
5. Буеверов А.О., 2014 г.
6. Филимонкова Н.Н., Воробьева Ю.В., Топычканова Е.П., 2013 г.
7. Новикова Т.И., Новиков В.С., 2011 г.
8. Приказ МЗ РФ от 10.11.2011 г. № 1340н «Об утверждении Перечня лекарственных средств, отпускаемых по рецептам врача (фельдшера) при оказании дополнительной бесплатной медицинской помощи отдельным категориям граждан, имеющим право на получение государственной социальной помощи»
9. Приказ Минздрава РФ от 09.11.2012 N 772н «Об утверждении стандарта специализированной медицинской помощи при других заболеваниях печени»
10. Инструкция по медицинскому применению
11. И.Г. Никитин, И.Е. Байкова, В.М. Волынкина и соавторы, 2009г.
Гликогенез что это простыми словами
Факторы, определяющие выживаемость у пациентов с протоковой аденокарциномой поджелудочной железы
Как повысить частоту обнаружения аденом правых отделов толстой кишки?
Сравнение различных методов дренирования желчного пузыря при остром холецистите
Частота неполной резекции колоректальных полипов. Результаты систематического обзора и мета-анализа
Плюсы и минусы экстренного эндоскопического исследования у пациентов с острым кровотечением из верхних отделов ЖКТ
Подагра
Подагра– заболевание, обусловленное гиперурикемией, приводящей к накоплению в тканях кристаллов уратов, что клинически проявляется подагрическим артритом и разнообразными внесуставными проявлениями.
Следует различать первичную подагру (врожденные дефекты пуринового обмена), вторичную подагру и бессимптомную гиперурикемию (отсутствует суставной синдром, но не исключаются другие клинические проявления).
Распространенность болезни достигает 0,7% в странах Европы, при чем соотношение мужчин и женщин составляет 19:1.
Для подагры характерно интермиттирующее течение. Принято отсчитывать начало заболевания с первого приступа подагрического артрита – в 50-65% случаев речь идет об остром моноартрите I плюсне-фалангового сустава. Клиника классической подагрической атаки весьма выразительна: внезапное начало, высокая интенсивность боли, быстрое нарастание отека и гиперемии в области сустава, спотанное обратное развитие симптомов через 3-7 дней. Продолжительность интермиттирующей подагры обычно не превышает 5-6лет.
Хроническая подагра характеризуется развитием хронического артрита и внесуставных составляющих: тофусы и уратная нефропатия. Поражение почек определяет прогноз течения подагры у многих больных.
В лечении подагры можно выделить несколько главных направлений:
Всероссийская Образовательная Интернет-Сессия
Информация и материалы, представленные на настоящем сайте, носят научный, справочно-информационный и аналитический характер, предназначены исключительно для специалистов здравоохранения, не направлены на продвижение товаров на рынке и не могут быть использованы в качестве советов или рекомендаций пациенту к применению лекарственных средств и методов лечения без консультации с лечащим врачом.
Лекарственные препараты, информация о которых содержится на настоящем сайте, имеют противопоказания, перед их применением необходимо ознакомиться с инструкцией и проконсультироваться со специалистом.
Мнение Администрации может не совпадать с мнением авторов и лекторов. Администрация не дает каких-либо гарантий в отношении cайта и его cодержимого, в том числе, без ограничения, в отношении научной ценности, актуальности, точности, полноты, достоверности научных данных представляемых лекторами или соответствия содержимого международным стандартам надлежащей клинической практики и/или медицины основанной на доказательствах. Сайт не несет никакой ответственности за любые рекомендации или мнения, которые могут содержаться, ни за применимость материалов сайта к конкретным клиническим ситуациям. Вся научная информация предоставляется в исходном виде, без гарантий полноты или своевременности. Администрация прикладывает все усилия, чтобы обеспечить пользователей точной и достоверной информацией, но в то же время не исключает возможности возникновения ошибок.
Гликогенозы – наследственные болезни, в основе которых лежит генетический дефект производства ферментов, принимающих участие в метаболизме углеводов. Характерный общий признак – чрезмерное отложение гликогена в миоцитах, гепатоцитах и других клетках организма. Гликогенозы проявляются симптомами гипогликемии, гепатомегалии, мышечной слабости, печеночной, сердечной, дыхательной и почечной недостаточности. Диагностика включает биохимический анализ крови, морфологическое исследование биопсийного материала мышц и печени, определение активности ферментов, молекулярно-генетические тесты. Лечение основано на лечебном питании, медикаментозной коррекции метаболических расстройств, в ряде случаев требуются операции.
МКБ-10
Общие сведения
Исследование гликогенозов ведется с 1910 года. В 1928-29 годах была описана симптоматика гликогеноза I типа – «болезни накопления гликогена». Лишь в 1952 году удалось выявить ферментный дефект и установить его связь с развитием симптомов. Патогенетические механизмы и способы лечения до сих пор остаются не до конца изученными. К настоящему времени выделено 12 типов гликогенозов, наиболее полно исследовано 9. Распространенность низкая, в среднем составляет 1 случай на 40-68 тысяч населения. Эпидемиологические показатели одинаковы среди представителей обоих полов, но при X-рецессивном наследовании мужчины болеют чаще. Симптомы проявляются в период новорожденности или в раннем детстве, течение чаще непрерывно прогрессирующее.
Причины гликогенозов
Единственным фактором, провоцирующим развитие гликогеновых болезней, является генетический дефект, в результате которого возникает недостаточность определенного фермента, участвующего в обмене глюкозы. Все гликогенозы за исключением IX типа наследуются по аутосомно-рецессивному принципу. Это означает, что мутационный ген расположен на хромосоме, не сцепленной с полом, проявление заболевания возможно только при наследовании мутаций от каждого из родителей – при наличии двух рецессивных измененных генов в аллели. Если дефектным является один ген из пары, то другой – доминантный, нормальный – обеспечивает организм достаточным количеством фермента. Человек при этом становится носителем гликогеноза, но не болеет. В парах, где оба партнера – носители, вероятность рождения больного ребенка составляет 25%. При гликогенозе типа IX патологический ген локализован в половой X-хромосоме. Гемизиготные мужчины имеют пару XY, всегда больны гликогенозом, передают дефект всем своим дочерям. Вероятность передачи мутации от женщины-носительницы детям обоих полов составляет 50%.
Патогенез
Патогенетическая основа всех гликогенозов – невозможность процесса синтеза и распада гликогена, его накопление в тканях. Гликоген является единственным резервным полисахаридом организма, своеобразным энергетическим «депо» – после приема пищи излишек глюкозы превращается в гликоген печени и мышц, затем постепенно расщепляется обратно до глюкозы. Благодаря этому механизму поддерживается стабильный уровень сахара в плазме крови, клетки и ткани организма непрерывно обеспечиваются энергией. При агликогенозе (0 тип) – отсутствует фермент гликогенсинтетаза, ответственная за производство гликогена. Пациенты страдают от тяжелой гипогликемии.
При гликогеновых болезнях типов 1-11 возникает генетически обусловленная недостаточность какого-либо фермента, катализирующего цепочку глюкоза-гликоген-глюкоза. 1 тип характеризуется дефектом глюкозо-6-фосфатазы и глюкозо-6-фосфаттранслоказы, 2 тип – альфа-1,4-глюкозидазы, 3 тип – амило-1,6-глюкозидазы, 4 тип – D-1,4-глюкано-α-глюкозилтрансферазы, 5 тип – гликогенфосфорилазы миоцитов, 6 тип – крахмалфосфорилазы гепатоцитов, 7 тип – фосфоглюкомутазы, 8 тип – фосфофруктомутазы, 9 тип – киназы фосфорилазы гепатоцитов. Из-за сниженной активности или полного отсутствия фермента гликоген накапливается в мышцах, печени, редко – в других тканях. Изменяется структура и функциональность органов, развиваются различные формы органной недостаточности.
Классификация
С учетом ферментативного дефекта и особенностей клинических проявлений выделяют 12 вариантов гликогенозов, от 0 до XI. Кроме того, описаны случаи комбинированных типов, когда определяется дефицит двух ферментов, а также случаи неидентифицируемых типов, при которых выделить ферментный дефект не удается. Согласно ведущему патогенетическому механизму гликогеновые болезни подразделяются на три больших группы:
Симптомы гликогенозов
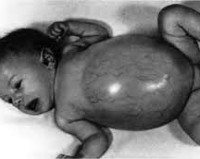
Агликогеноз развивается в периоде новорожденности либо раннего детства. Низкое содержание гликогена в печени проявляется резко выраженной гипогликемией натощак. Наблюдается заторможенность, глубокий сон, потеря сознания, бледность кожи, тошнота, рвота, судороги ночью и в утренние часы. Внешне пациенты низкорослые, имеют пониженную плотность костной ткани, повышенный риск переломов. При болезни Гирке (I тип) симптомы дебютируют в первые 4 месяца жизни. Характерен плохой аппетит, приступы рвоты, недостаток веса, увеличение печени, диспропорциональность строения тела – круглое лицо, большой живот, тонкие конечности.
Клинические признаки болезни Помпе (II тип) определяются в течение нескольких недель после рождения. Дети вялые, малоподвижные, с ослабленным сосательным рефлексом, сниженным аппетитом. Гепатомегалия изменяет пропорции тела – живот увеличивается, руки и ноги остаются тонкими. Поражается сердце, легкие, нервная система. Высок риск сердечной и легочной недостаточности. У пациентов с болезнью Форбса (III тип) симптомы слабой и умеренной выраженности. На первый план выходит гипогликемия постабсорбционного периода, гепатомегалия, накопление подкожного жира в области туловища. Ведущие симптомы болезни Андерсена (IV тип)– мышечная слабость, плохая переносимость физической нагрузки, судороги.
Течение болезни Таруи (VII тип) включает непереносимость физической нагрузки, сопровождающуюся тошнотой и рвотой, болезненными спазмами мышц. Поступление глюкозы не повышает способность совершать физические действия. После употребления пищи симптомы обостряются. Наиболее мягкое течение свойственно болезни Хага (IX тип). У больных детей увеличивается печень, задерживается моторное развитие и рост, формируется мышечная гипотония. С возрастом симптомы самостоятельно редуцируются. Гликогеноз X типа крайне редок, характеризуется гепатомегалией, при длительном течении снижается переносимость физических нагрузок. Гликогеноз XI типа сопровождается значительным увеличением печени, задержкой роста и физического развития, рахитом. У подростков нередко наблюдается сокращение объема печени, ускорение роста.
Осложнения
При разновидностях гликогенозов, сопровождающихся гипогликемией, существует риск развития гипогликемической комы. Как правило, выраженное снижение уровня глюкозы в крови происходит при пропуске приемов пищи, особенно после ночного сна (пропуск завтрака). Пациенты испытывают головокружение и судороги, теряют сознание. Тяжелые формы мышечных гликогенозов при продолжительном течении и отсутствии терапии приводят к дистрофии скелетных мышц, сердечной недостаточности. Осложнением некоторых печеночных гликогенозов является цирроз печени.
Диагностика
При подозрении на гликогеноз ребенку рекомендуется консультация врача-генетика, педиатра, гастроэнтеролога, гепатолога. В первую очередь специалист собирает анамнез, проводит клинический опрос и осмотр. Поскольку заболевание передается аутосомно-рецессивным способом, семейные случаи выявляют редко. Распространены жалобы на слабость, апатичность ребенка, бледность и желтушность кожи, отказ от еды или повышенный аппетит, трудности пробуждения утром, тремор, судороги. При осмотре врач отмечает увеличение размера печени, выпирание живота, задержку роста, мышечную гипотрофию, специфическое отложение подкожной жировой клетчатки, ксантомы. Лабораторные и инструментальные методы позволяют подтвердить диагноз гликогеноза, исключить врожденный сифилис, токсоплазмоз, цитомегалию, патологии печени, болезнь Гоше, миотонию, прогрессирующую мышечную дистрофию, амиотрофии. К обязательным методам исследований относят:
Комплекс диагностических исследований подбирается индивидуально в зависимости от возраста пациента и предполагаемого типа гликогеновой болезни. Может потребоваться молекулярно-генетическая диагностика (секвенирование генов с целью выявления мутации), электромиография, ЭХО-КГ, ОАК, коагулограмма.
Лечение гликогенозов
Специфические методы терапии не разработаны. Патогенетическое лечение проводится консервативно, направлено на устранение гипогликемии, метаболического ацидоза, кетоза, гиперлипидемии, коррекцию дисфункции гепатобилиарного комплекса и желудочно-кишечного тракта. При развитии осложнений (серьезном поражении внутренних органов) выполняются хирургические операции. Медицинская помощь пациентам включает следующие направления:
Прогноз и профилактика
Эффективность терапии, вероятность осложнений и летального исхода зависят от типа патологии. Одни гликогенозы незначительно ухудшают качество жизни больных, компенсируются по мере взросления, другие – не поддаются лечению и неизбежно завершаются смертью. Для снижения риска рождения ребенка с гликогенозом супружеским парам из группы риска – имеющим семейный отягощенный анамнез, детей с подтвержденным диагнозом – требуется медико-генетическое консультирование, пренатальная диагностика.
Синтез гликогена (гликогенез)
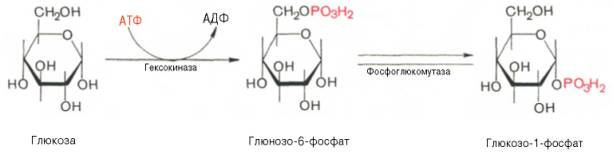
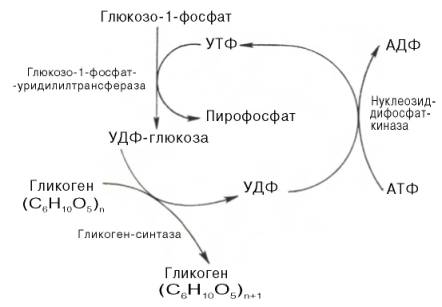
Прежде всего глюкоза подвергается фосфорилированию при участии фермента гексокиназы, а в печени – и глюкокиназы. Далее глюкозо-6-фосфат под влиянием фермента фосфоглюкомутазы переходит в глюкозо-1-фос-фат:
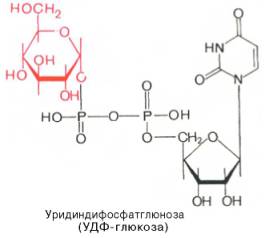
Образовавшийся глюкозо-1-фосфат уже непосредственно вовлекается в синтез гликогена. На первой стадии синтеза глюкозо-1-фосфат вступает во взаимодействие с УТФ (уридинтрифосфат), образуя уридиндифосфатглюкозу (УДФ-глюкоза) и пирофосфат. Данная реакция катализируется ферментом глюкозо-1-фосфат-уридилилтрансферазой (УДФГ-пирофосфорилаза):
Глюкозо-1-фосфат + УТФ УДФ-глюкоза + Пирофосфат.
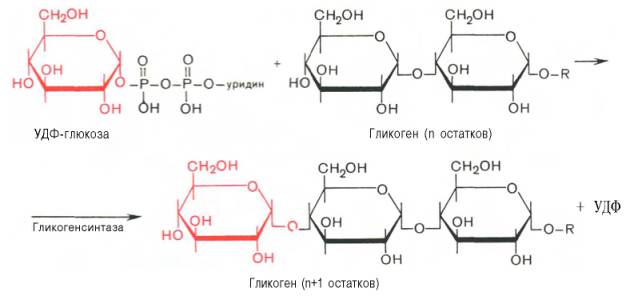
На второй стадии – стадии образования гликогена – происходит перенос глюкозного остатка, входящего в состав УДФ-глюкозы, на глюкозидную цепь гликогена («затравочное» количество). При этом образуется α-(1–>4)-связь между первым атомом углерода добавляемого остатка глюкозы и 4-гидроксильной группой остатка глюкозы цепи. Эта реакция катализируется ферментом гликогенсинтазой. Необходимо еще раз подчеркнуть, что реакция, катализируемая гликогенсинтазой, возможна только при условии, что полисахаридная цепь уже содержит более 4 остатков D-глю-козы.
Образующийся УДФ затем вновь фосфорилируется в УТФ за счет АТФ, и таким образом весь цикл превращений глюкозо-1-фосфата начинается сначала.
В целом образование α-1,4-глюкозидной ветви («амилозной» ветви) гликогена можно представить в виде следующей схемы:
Установлено, что гликогенсинтаза неспособна катализировать образование α-(1–>6)-связи, имеющейся в точках ветвления гликогена. Этот процесс катализирует специальный фермент, получивший название гли-когенветвящего фермента, или амило-(1–>4)–>(1–>6)-трансглюкозидазы. Последний катализирует перенос концевого олигосахаридного фрагмента, состоящего из 6 или 7 остатков глюкозы, с нередуцирующего конца одной из боковых цепей, насчитывающей не менее 11 остатков, на 6-гидроксиль-ную группу остатка глюкозы той же или другой цепи гликогена. В результате образуется новая боковая цепь.
Ветвление повышает растворимость гликогена. Кроме того, благодаря ветвлению создается большое количество невосстанавливающих концевых остатков, которые являются местами действия гликогенфосфорилазы и гликогенсинтазы.
Таким образом, ветвление увеличивает скорость синтеза и расщепления гликогена.
Благодаря способности к отложению гликогена (главным образом в печени и мышцах и в меньшей степени в других органах и тканях) создаются условия для накопления в норме некоторого резерва углеводов. При повышении энерготрат в организме в результате возбуждения ЦНС обычно происходят усиление распада гликогена и образование глюкозы.
Помимо непосредственной передачи нервных импульсов к эффекторным органам и тканям, при возбуждении ЦНС повышаются функции ряда желез внутренней секреции (мозговое вещество надпочечников, щитовидная железа, гипофиз и др.), гормоны которых активируют распад гликогена, прежде всего в печени и мышцах (см. главу 8).
Как отмечалось, эффект катехоламинов в значительной мере опосредован действием цАМФ, который активирует протеинкиназы тканей. При участии последних происходит фосфорилирование ряда белков, в том числе гликогенсинтазы и фосфорилазы b – ферментов, участвующих в обмене углеводов. Фосфорилированный фермент гликогенсинтаза сам по себе малоактивен или полностью неактивен, но в значительной мере активируется положительным модулятором глюкозо-6-фосфатом, который увеличивает Vmaxфермента. Эта форма гликогенсинтазы называется D-формой, или зависимой (dependent) формой, поскольку ее активность зависит от глюкозо-6-фосфата. Дефосфорилированная форма гликоген-синтазы, называемая также I-формой, или независимой (independent) формой, активна и в отсутствие глюкозо-6-фосфата.
Таким образом, адреналин оказывает двойное действие на обмен углеводов: ингибирует синтез гликогена из УДФ-глюкозы, поскольку для проявления максимальной активности D-формы гликогенсинтазы нужны очень высокие концентрации глюкозо-6-фосфата, и ускоряет распад гликогена, так как способствует образованию активной фосфорилазы а. В целом суммарный результат действия адреналина состоит в ускорении превращения гликогена в глюкозу.
Основные закономерности метаболических процессов в организме человека. Часть 2.
Рассматривая обмен веществ в условиях нормального функционирования организма, следует остановиться на безусловно взаимосвязанных, но в то же время достаточно специфичных составляющих метаболизма, а именно на углеводном, белковом, липидном и водно-электролитном обмене.
Очевидно, что основная роль углеводов в метаболизме определяется их энергетической функцией. Именно глюкоза крови вследствие наличия простого и быстрого пути гликолитической диссимиляции и последующего окисления в цикле трикарбоновых кислот, а также возможности максимально быстрого извлечения ее из депо гликогена, обеспечивающей экстренную мобилизацию энергетических ресурсов, является наиболее востребованным источником энергии в организме. Использование циркулирующей в плазме глюкозы разными органами неодинаково: мозг задерживает 12% глюкозы, кишечник— 9%, мышцы — 7%, почки — 5%. При этом уровень глюкозы плазмы крови является одной из важнейших гомеостатических констант организма, составляя 3, 3—5, 5 ммоль/л. Как известно снижение уровня глюкозы ниже допустимого передела имеет своим незамедлительным следствием дискоординацию деятельности ЦНС, проявляющуюся соответствующей клинической симптоматикой: головной мозг содержит небольшие резервы углеводов и нуждается в постоянном поступлении глюкозы, поскольку энергетические расходы мозга покрываются исключительно за счет углеводов. Глюкоза в тканях мозга преимущественно окисляется, а небольшая часть ее превращается в молочную кислоту.
При полном отсутствии углеводов в пище они образуются в организме из продуктов трансформации жиров и белков. В печени возможно новообразование углеводов как из собственных продуктов их распада (пировиноградной или молочной кислоты), так и из продуктов диссимиляции жиров и белков (кетокислот и аминокислот), что обозначается как глюконеогенез. В результате трансформации аминокислот образуется пировиноградная кислота, при окислении жирных кислот — ацетилкоэнзим А, который может превращаться в пировиноградную кислоту — предшественник глюкозы. Это наиболее важный общий путь биосинтеза углеводов. Между двумя основными источниками энергии — углеводами и жирами — существует тесная физиологическая взаимосвязь. Повышение содержания глюкозы в крови увеличивает биосинтез триглицеридов и уменьшает распад жиров в жировой ткани. Поступление в кровь свободных жирных кислот уменьшается. В случае возникновения гипогликемии процесс синтеза триглицеридов тормозится, ускоряется распад жиров и в кровь в большом количестве поступают свободные жирные кислоты. Гликогенез, гликогенолиз и глюконеогенез являются тесно взаимосвязанными процессами, обеспечивающими оптимальный уровень глюкозы крови сообразно степени функционального напряжения организма.
Центральным звеном регуляции углеводного и других видов обмена и местом формирования сигналов, управляющих уровнем глюкозы, является гипоталамус. Отсюда регулирующие влияния реализуются вегетативными нервами и гуморальным путем, включающим эндокринные железы. Единственным гормоном, снижающим уровень гликемии, является инсулин — гормон, вырабатываемый β-клетками островков Ланхгерганса. Снижение гликемии происходит за счет усиления инсулином синтеза гликогена в печени и мышцах и повышения потребления глюкозы тканями организма. Увеличение уровня глюкозы в крови возникает при действии нескольких гормонов. Это глюкагон, продуцируемый α-клетками островков Ланхгерганса, адреналин — гормон мозгового слоя надпочечников, глюкокортикоиды — гормоны коркового слоя надпочечников, соматотропный гормон гипофиза, тироксин и трийодтиронин — гормоны щитовидной железы. Данные гормоны в связи с однонаправленностью их влияния на углеводный обмен и функциональным антагонизмом по отношению к эффектам инсулина часто объединяют понятием «контринсулярные гормоны».
Таким образом биологическая роль углеводов для организма человека определяется прежде всего их энергетической функцией. Обладая энергетической ценностью в 16, 7 кДж (4, 0 ккал) на 1 грамм вещества, углеводы являются основным источником энергии для всех клеток организма, при этом выполняя еще пластическую и опорную функции. Суточная потребность взрослого человека в углеводах составляет около 500 г.
— пластическая (структурная) функция заключается в том, что белки являются главной составной частью всех клеточных и межклеточных структур тканей;
— ферментная (каталитическая, энзимная) функция состоит в обеспечении всех химических реакций, протекающих в ходе обмена веществ в организме (дыхание, пищеварение, выделение), деятельностью ферментов, являющихся по своей структуре белками;
— транспортная функция белков заключается в их способности к соединению с целым рядом метаболитов и переносе последних в связанном состоянии в межтканевой жидкости и плазме крови к области их утилизации;
— защитная функция белков проявляется реализацией иммунного ответа образованием иммуноглобулинов (антител) и системы комплемента при поступлении в организм чужеродного белка, а также способностью к непосредственному связыванию экзогенных токсинов; белки системы гемостаза обеспечивают свертывание крови и остановку кровотечения при повреждении кровеносных сосудов;
— регуляторная функция, направленная на сохранение гомеостаза с поддержанием биологических констатнт организма, реализуется буферными свойствами молекулы протеинов, белковой структурой клеточных рецепторов, активируемых в свою очередь регуляторными полипептидами и гормонами, также имеющими белковую структуру;
— двигательная функция, обеспечивается взаимодействием сократительных белков мышечной ткани актина и миозина;
— энергетическая роль белков состоит в обеспечении организма энергией, образующейся при диссимиляции белковых молекул; при окислении 1 г белка в среднем освобождается энергия, равная 16, 7 кДж (4, 0 ккал).
При катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогеназы, в результате чего получаются а-кетоглутарат и аммиак. При необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты. В случае использования белков в качестве источника энергии большинство аминокислот окисляются в конечном счёте через цикл лимонной кислоты до углекислого газа и воды. Прежде, чем эти вещества вовлекаются в заключительный этап катаболизма, их углеродный скелет превращается в двухуглеродный фрагмент в форме ацетил-КоА. Именно в этой форме большая часть молекул аминокислот включается в цикл лимонной кислоты.
Таблица 1. 1. Аминокислоты, входящие в состав белков человека.
1. Незаменимые
2. Частично заменимые
3. Условно заменимые
4. Заменимые
Таблица 1. 2. Классификация липидов организма человека.
1. Гликолипиды.
Содержат углеводный компонент.
2. Жиры.
3. Минорные липиды.
4. Стероиды.
А. Стерины (спирты).
Наиболее важен холестерин.
В. Стериды.
Эфиры стеринов и высших жирных кислот. Наиболее распространены эфиры холестерина.
5. Фосфолипипы.
Одним из продуктов катаболизма жиров, имеющем важное значения для метаболизма в целом являются кетоновые тела. Кетоновые тела — группа органических соединений, являющихся промежуточными продуктами жирового, углеводного и белкового обменов. К кетоновым телам относят β-оксимасляную и ацетоуксусную кислоты и ацетон, имеющие сходное строение и способные к взаимопревращениям. Главным путем синтеза кетоновых тел, происходящего в основном в печени, считается реакция конденсации между двумя молекулами ацетил-КоА, образовавшегося при β-окислении жирных кислот или при окислительном декарбоксилировании пирувата (пировиноградной кислоты) в процессе обмена глюкозы и ряда аминокислот. Данный путь синтеза кетоновых тел более других зависит от характера питания и в большей степени страдает при патологических нарушениях обмена веществ. Из печени кетоновые тела поступают в кровь и с нею во все остальные органы и ткани, где они включаются в универсальный энергообразующий цикл — цикл трикарбоновых кислот, в котором окисляются до углекислоты и воды. Кетоновые тела используются также для синтеза холестерина, высших жирных кислот, фосфолипидов и заменимых аминокислот. При голодании, однообразном безуглеводистом питании и при недостаточной секреции инсулина использование ацетил-КоА в цикле трикарбоновых кислот подавляется, так как все метаболически доступные ресурсы организма превращаются в глюкозу крови. В этих условиях увеличивается синтез кетоновых тел. Следует подчеркнуть важную роль кетоновых тел в поддержании энергетического баланса. Кетоновые тела – поставщики «топлива» для мышц, почек и действуют, возможно, как часть регуляторного механизма с обратной связью, предотвращая чрезвычайную мобилизацию жирных кислот из жировых депо. Печень в этом смысле является исключением, она не использует кетоновые тела в качестве энергетического материала.
Процесс образования, отложения и мобилизации из депо жира регулируется нервной и эндокринной системами, а также тканевыми механизмами и тесно связаны с углеводным обменом. Так, повышение концентрации глюкозы в крови уменьшает распад триглицеридов и активизирует их синтез. Понижение концентрации глюкозы в крови, наоборот, тормозит синтез триглицеридов и усиливает их расщепление. Таким образом, взаимосвязь жирового и углеводного обменов направлена на обеспечение энергетических потребностей организма. При избытке углеводов в пище триглицериды депонируются в жировой ткани, при нехватке углеводов происходит расщепление триглицеридов с образованием неэтерифицнрованных жирных кислот, служащих источником энергии. В обмене жиров одна из важнейших ролей принадлежит печени. Печень — основной орган, в котором происходит образование кетоновых тел (бета-оксимасляная, ацетоуксусная кислоты, ацетон), используемых как альтернативный глюкозе источник энергии.
Как указывалось выше метаболизм жиров контролируется нервной и эндокринной системами. Мобилизация жиров из депо происходит под влиянием гормонов мозгового слоя надпочечников — адреналина и норадреналина. Соматотропный гормон гипофиза также обладает жиромобилизирующим действием. Аналогично действует тироксин — гормон щитовидной железы. Тормозят мобилизацию жира глюкокортикоиды — гормоны коркового слоя надпочечника, вероятно, вследствие того, что они несколько повышают уровень глюкозы в крови. Действие инсулина связано с повышением активности внутриклеточной фосфодиэстеразы, что приводит к снижению концентрации цАМФ и угнетению липолиза. Таким образом, инсулин усиливает синтез жира и уменьшает скорость его мобилизации. Имеются данные, свидетельствующие о возможности прямых нервных влияний на обмен жиров. Симпатические влияния тормозят синтез триглицеридов и усиливают их распад. Парасимпатические влияния, напротив, способствуют отложению жира в депо.
Статья добавлена 31 мая 2016 г.